天然麝香ATR-FTIR红外指纹图谱的比较1)
2018-03-07敖艳霖刘闯金煜
敖艳霖 刘闯 金煜
(东北林业大学,哈尔滨,150040)
麝香(musk)为鹿科(Cervidae)动物林麝(M.berezovskiiFlerov)、马麝(M.chrysogasterHodgson)或原麝(M.moschiferusLinnaeus)成熟雄体香囊中的干燥分泌物[1]。源动物在我国的地理分布,涉及西南、西北、东北多个省份,食物构成多样,在物种、季节及地区间有明显差异[2-6]。目前,以人工养殖为主[7]。麝香是重要的中药材,其化学成分比较复杂,主要含有大环酮化合物(主要为麝香酮)、G9雄甾类成分以及氨基酸、多肽和蛋白质,还有尿囊素、胆兹醇以及酯类、无机成分等[8]。
傅里叶红外光谱法(FTIR)是一种无需对被检测物进行单一化学成分提取,可获取物质整体化学信息的方法。获得的红外指纹图谱中,包含物质的结构及含量变化、分子间相互作用等信息,其在中药材鉴别、质量检测及评价等方面发挥的作用已得到广泛认可[9-10]。衰减全反射(ATR)技术的应用,使FTIR的适用范围更加广泛,ATR-FTIR法已成为一种重要实验手段[10]。本文采用衰减全反射红外光谱(ATR-FTIR),结合双指标序列法[11-13],对来自不同产地、不同生活状态的3个物种的22份天然麝香样本进行了检测,分析了样本的红外原始图谱及其共有峰率、变异峰率等,旨在为日后麝香的快速鉴定提供参考。
1 材料与方法
样本共采集了3个物种的天然麝香样本22份(见表1),其中原麝麝香样本直接来自野外,其余样本均来自国内主要的麝人工养殖基地。
仪器设备:美国Thermo Fisher Scientific的Nicolet 6700 FT-IR傅里叶变换红外光谱仪。DTGS中红外检测器;光谱范围为4 000~650 cm-1,分辨率为4 cm-1。
全部样本在30 ℃(不超过30 ℃)条件下烘至绝干,研成细粉,密封备用。
处理好的样本粉末置于金刚石ATR附件上。调节压力塔至合适的位置,设置仪器扫描次数为32次,扣除大气背景的干扰。获得的红外光谱导入ominc 8.0,进行13点平滑,基线校正,纵坐标归一化等处理。
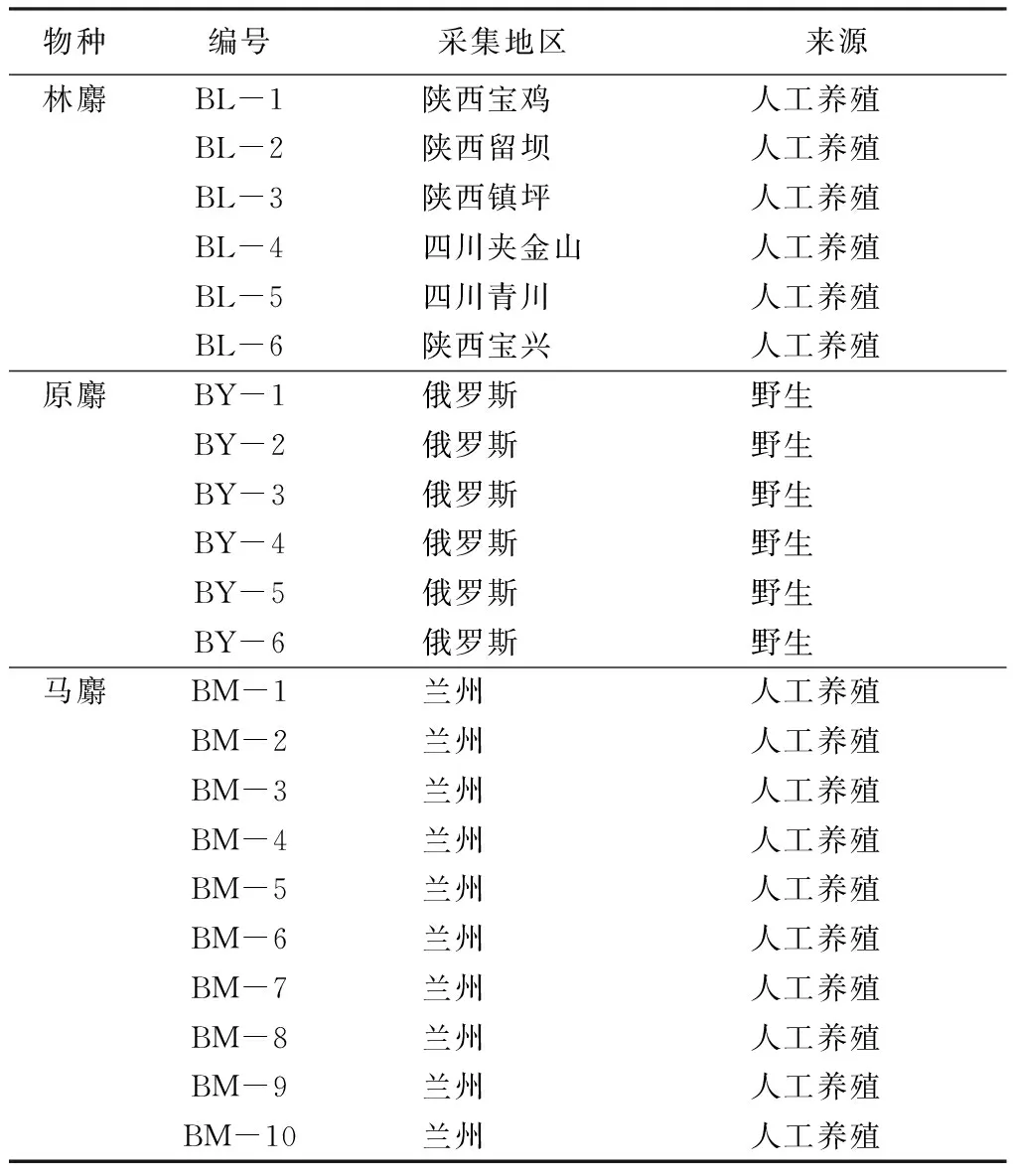
表1 天然麝香样本及来源
注:林麝样本均采于同一年份,为各养殖场的混合样;原麝样本来自不同个体;马麝样本均来自同一养殖基地,但采收年份不同。
共有峰率和变异峰率双指标序列鉴别指标[14]:
共有峰率(P)=(共有峰数(Ng)/两个红外图谱中的独立峰数(Nd))×100%。共有峰数(Ng)为比较的两个红外图谱中都会出现的吸收峰的个数;独立峰为a、b两个图谱中相对于共有峰的非共有峰数(na、nb),独立峰数(Nd)为相互比较的两个红外图谱中的独立峰的总个数(Nd=Ng+na+nb)。
变异峰率(Pv),指红外图谱中相对于共有峰的变异峰数与共有峰的比值。指纹图谱a的变异峰率(Pva)=(na/Ng)×100%;指纹图谱b的变异峰率(Pvb)=(nb/Ng)×100%。
指纹图谱中a的总峰数(Na)=Ng+na;指纹图谱中b的总峰数(Nb)=Ng+nb。
全部数据利用Excel软件进行分析处理。
2 结果与分析
2.1 天然麝香图谱基本特征
由图1、表2可见:22份受检样本的ATR-FTIR红外指纹图谱,峰位、峰形和峰强均存在明显差异,表明不同物种、不同地区、不同采收时间以及同一物种不同个体获取的麝香样本,在成分构成上均存在差异。
林麝麝香样本差异:在1 800~1 700 cm-1之间,BL-3在1 740 cm-1附近的吸收峰强度明显低于其余样本;在1 700~1 500 cm-1之间,BL-1、BL-2的峰强比I(1 644 cm-1)/I(1 596 cm-1)<1,BL-3的I(1 625 cm-1)/I(1 596 cm-1)<1,BL-4、BL-5、BL-6、BL-7均为I(1 644 cm-1)/I(1 596 cm-1)>1;在1 200~1 100 cm-1之间,BL-2样本的I(1 173 cm-1)/I(1 153 cm-1)>1,其余样本相反,且BL-2在1 173 cm-1附近的吸收峰峰形较其它样本相对尖锐;在1 100~1 000 cm-1之间,BL-1、BL-2样本的峰强I(1 076 cm-1)/I(1 034 cm-1)>1,其余样本或无1 076 cm-1附近的吸收峰,或1 076 cm-1吸收峰强度不及1 034 cm-1附近,且峰形与BL-1、BL-2样本不相同。
原麝麝香样本差异:在1 700~1 600 cm-1之间,BY-6样本在1 625 cm-1附近的峰强比其余样本都小,峰形比其余样本宽,其余样本在此处的吸收峰相对较为尖锐,说明该样本组成较为复杂,出现了峰的重叠现象;在1 100~1 000 cm-1之间,样本的强峰峰位在1 043.74~1 006.61 cm-1之间变化,BY-1、BY-2、BY-4样本在强峰的左边出现一小的肩峰,其余均无此肩峰,且各样本在此强峰的峰强大小均不同。
马麝麝香样本差异:在1 700~1 600 cm-1之间,BM-4、BM-7样本的峰强I(1 644 cm-1)/I(1 540 cm-1)>1,其余样本均小于1;在1 550~1 350 cm-1之间,存在2个相邻峰,除BM-7样本I(1 454 cm-1)/I(1 402 cm-1)<1外,其余样本的2个相邻峰比值均大于1;在1 100~1 000 cm-1之间,BM-4、BM-7样本在1 040.87~1 006.61 cm-1附近的吸收强峰无左边的肩峰,其余均存在肩峰;BM-4在720~650 cm-1之间的峰强比其余都小,且峰形与其余样本存在差异。

图1 天然麝香样本的ATR-FTIR红外指纹图谱
2.2 共有峰
若一组吸收峰的组内吸收峰波数最大差异,显著小于相邻组之间的平均波数差,则可确定该组峰为一组共有峰[14]。光谱的共有峰一般为某一波长范围内的峰[15],由表2数据可以总结出麝香共有峰区段(见表3)。
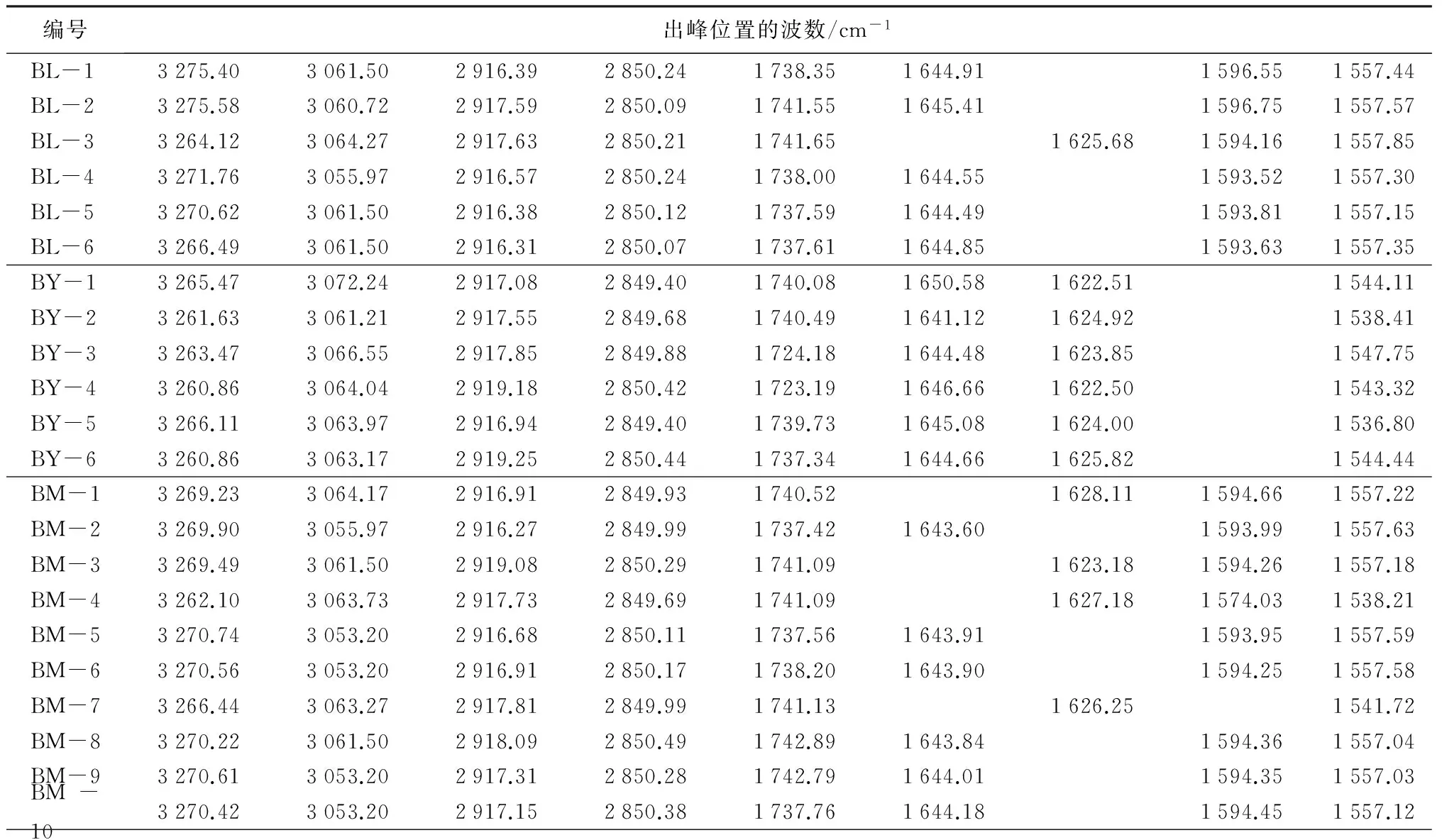
表2 22份天然麝香红外指纹图谱出峰位置

编号出峰位置的波数/cm-1BL-11436.311392.311310.411279.231267.331244.59BL-21435.361411.191308.861279.021238.57BL-31438.831401.991314.401242.92BL-41434.541401.891317.171279.651265.751244.82BL-51434.041402.331314.401279.521266.021244.90BL-61434.831392.021314.401279.621266.021245.05BY-11462.661454.211378.421235.42BY-21461.151454.621383.571311.471272.871236.10BY-31445.741408.241376.431238.07BY-41446.521384.361306.101232.24BY-51463.351453.651383.051306.701235.49BY-61445.401375.951317.171233.74BM-11437.021401.941317.171242.53BM-21435.991402.451308.861278.411264.561245.17BM-31435.681402.701315.401242.85BM-41454.511402.321379.481321.071238.51BM-51435.921413.811402.701314.961281.181264.561244.37BM-61435.801414.171403.031314.571281.181267.331243.59BM-71454.601402.721321.871240.63BM-81434.521402.721314.401279.351266.051243.95BM-91434.541403.091317.171278.411264.561244.22BM-101434.811402.601316.401279.401265.801244.49
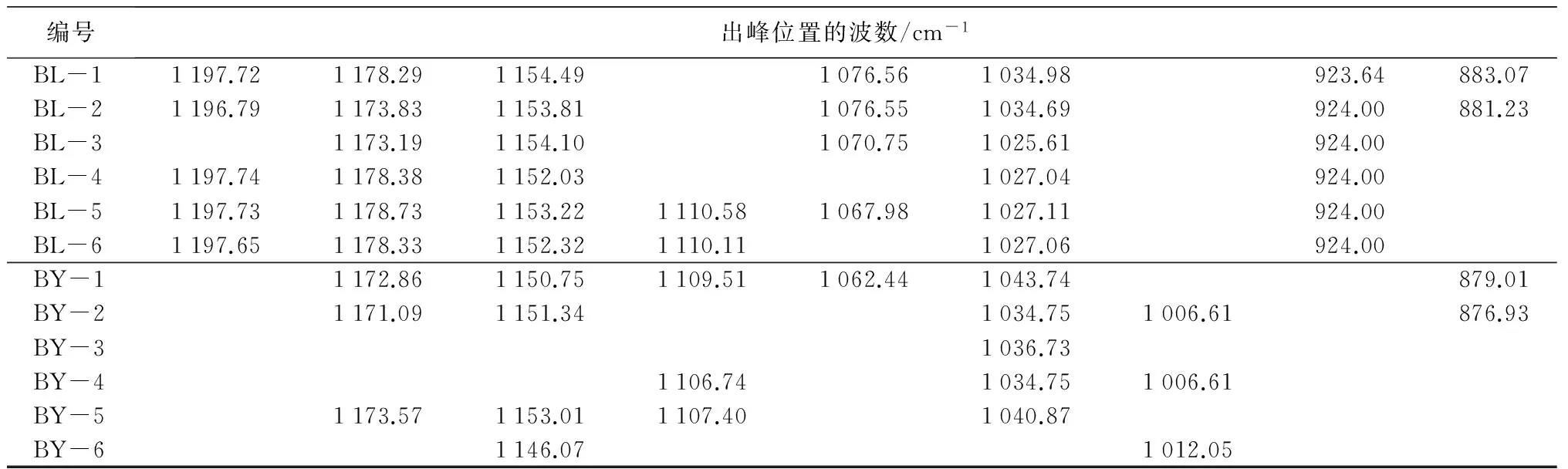
编号出峰位置的波数/cm-1BL-11197.721178.291154.491076.561034.98923.64883.07BL-21196.791173.831153.811076.551034.69924.00881.23BL-31173.191154.101070.751025.61924.00BL-41197.741178.381152.031027.04924.00BL-51197.731178.731153.221110.581067.981027.11924.00BL-61197.651178.331152.321110.111027.06924.00BY-11172.861150.751109.511062.441043.74879.01BY-21171.091151.341034.751006.61876.93BY-31036.73BY-41106.741034.751006.61BY-51173.571153.011107.401040.87BY-61146.071012.05

续(表2)
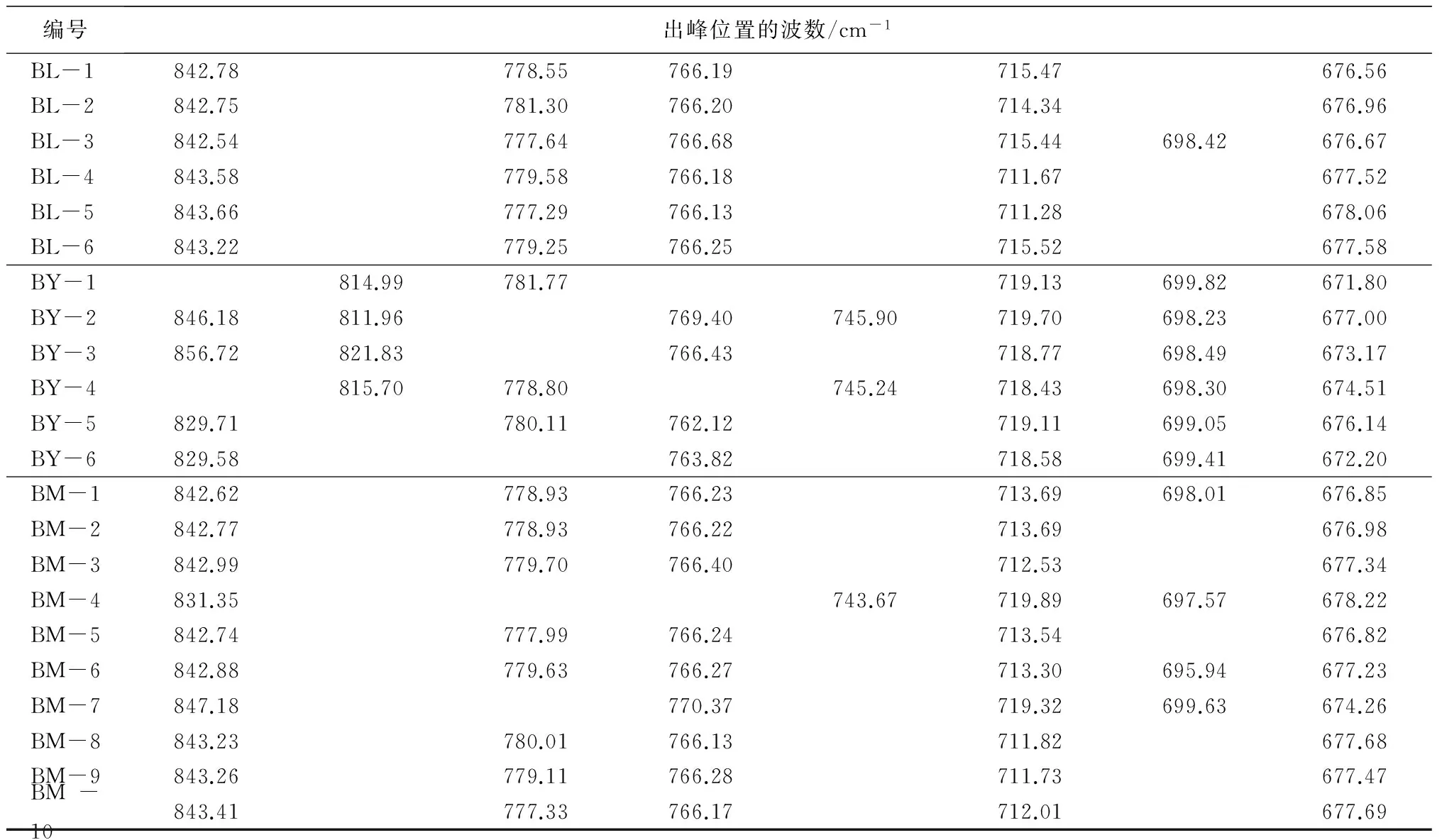
编号出峰位置的波数/cm-1BL-1842.78778.55766.19715.47676.56BL-2842.75781.30766.20714.34676.96BL-3842.54777.64766.68715.44698.42676.67BL-4843.58779.58766.18711.67677.52BL-5843.66777.29766.13711.28678.06BL-6843.22779.25766.25715.52677.58BY-1814.99781.77719.13699.82671.80BY-2846.18811.96769.40745.90719.70698.23677.00BY-3856.72821.83766.43718.77698.49673.17BY-4815.70778.80745.24718.43698.30674.51BY-5829.71780.11762.12719.11699.05676.14BY-6829.58763.82718.58699.41672.20BM-1842.62778.93766.23713.69698.01676.85BM-2842.77778.93766.22713.69676.98BM-3842.99779.70766.40712.53677.34BM-4831.35743.67719.89697.57678.22BM-5842.74777.99766.24713.54676.82BM-6842.88779.63766.27713.30695.94677.23BM-7847.18770.37719.32699.63674.26BM-8843.23780.01766.13711.82677.68BM-9843.26779.11766.28711.73677.47BM-10843.41777.33766.17712.01677.69

表3 麝香共有峰区段
2.3 双指标序列
表4为22份天然麝香的共有峰率表,表5为22份天然麝香的变异峰率表,两者组合为天然麝香的双指标序列表。
由表4、表5可见:林麝麝香共有峰率为71.4%~96.2%,变异峰率在4.0%~25.0%之间,区别不大,相似度较高。这是由于这些样本均来自陕西和四川等麝香的传统产区,地理位置临近,气候、生长环境十分相似,且样本采收时间比较接近。BL-4、BL-5、BL-6样本出于同一公司,养殖手段相似,其共有峰率较高,相互之间达到90%以上;推测,麝香成分构成除受地理位置、气候和生长环境等因素影响,也受养殖方式、养殖条件的影响,相同养殖方式下产生的麝香化学成分更为相似。
原麝麝香共有峰率在55.6%~76.9%之间,变异峰率在5.6%~44.4%之间。其中:仅BY-5与BY-1、BY-2之间,BY-6与BY-2、BY-3、BY-4、BY-5之间,共有峰率达到70%以上,相似度相对较高,化学性质相对接近。其余样本相互之间的共有峰率多在61.5~69.0%之间,BY-1与BY-6的共有峰率甚至低于60%,说明对于原麝麝香而言,个体因素对红外指纹图谱影响比较大。又因这批样本来自野生原麝,每个个体具有客观不确定因素,所以推测,样本共有峰率较低也与其个体生活环境、摄食成分以及样本保存方式、保存时间等一系列因素有关。
马麝麝香共有峰率在48.4%~100%之间,变异峰率在3.7%~68.8%之间。其中:BM-2、BM-9和BM-10相互之间共有峰率达到100%,变异峰率为0;BM-2、BM-5、BM-8、BM-9和BM-10样本相互之间,BM-6与BM-9、BM-10之间的共有峰率在90%以上;除BM-4、BM-7之外,其余样本共有峰率均在80%以上,变异峰率极低,化学成分相似;说明同场产出的同种麝香,在相同保存方式下,只要保存得当,一定时间内麝香的成分不会发生较大的变化。而BM-4、BM-7与其余样本的共有峰率在48.4%~58.6%之间,全部低于60%;变异峰率在29.4%~68.8%之间。BM-4、BM-7样本相对于其余样本峰位较少,缺失了诸如1 270~1 070 cm-1、780 cm-1附近的吸收峰,说明麝香中存在一些保存时间过长或保存不当便易挥发或变质的物质。麝香的采集存放时间,对麝香的成分存在一定影响,但并非决定性因素,成分变化的差异也与麝香样本本身性质有关。
针对不同种类的麝香,林麝与原麝麝香之间的共有峰率在42.4%~70.4%之间,变异峰率在18.8%~85.7%之间,变异峰主要集中在1 625~924 cm-1;而原麝与马麝麝香之间的共有峰率在45.2%~66.7%之间,变异峰率在15.0%~85.7%,变异峰主要集中在1 595~924 cm-1;林麝与马麝麝香之间的共有峰率在43.8%~100%之间,变异峰率在3.8%~78.6%之间,变异峰主要集中在1 625、1 281~1 264、1 109 cm-1。不同种类麝香共有峰率普遍比同种麝香的共有峰率低,且出现变异的峰也有差异,显示不同种麝香在多肽及蛋白质、大环酮类物质和酯类物质等物质组成中存在差异,说明麝种类对麝香化学成分有较大的影响,使用天然麝香时需注意区分不同种类的麝香。
综合上述分析,麝香的种类、产地、个体、采收时间等因素会对麝香化学成分有一定影响,天然麝香的红外指纹图谱基本不会出现完全相同的情况。而共有峰率、变异峰率的双指标序列的分析,显示了麝香样本之间的相似程度,从中容易找到最相似和差异最大的样本,直观展示了不同因素的影响程度。
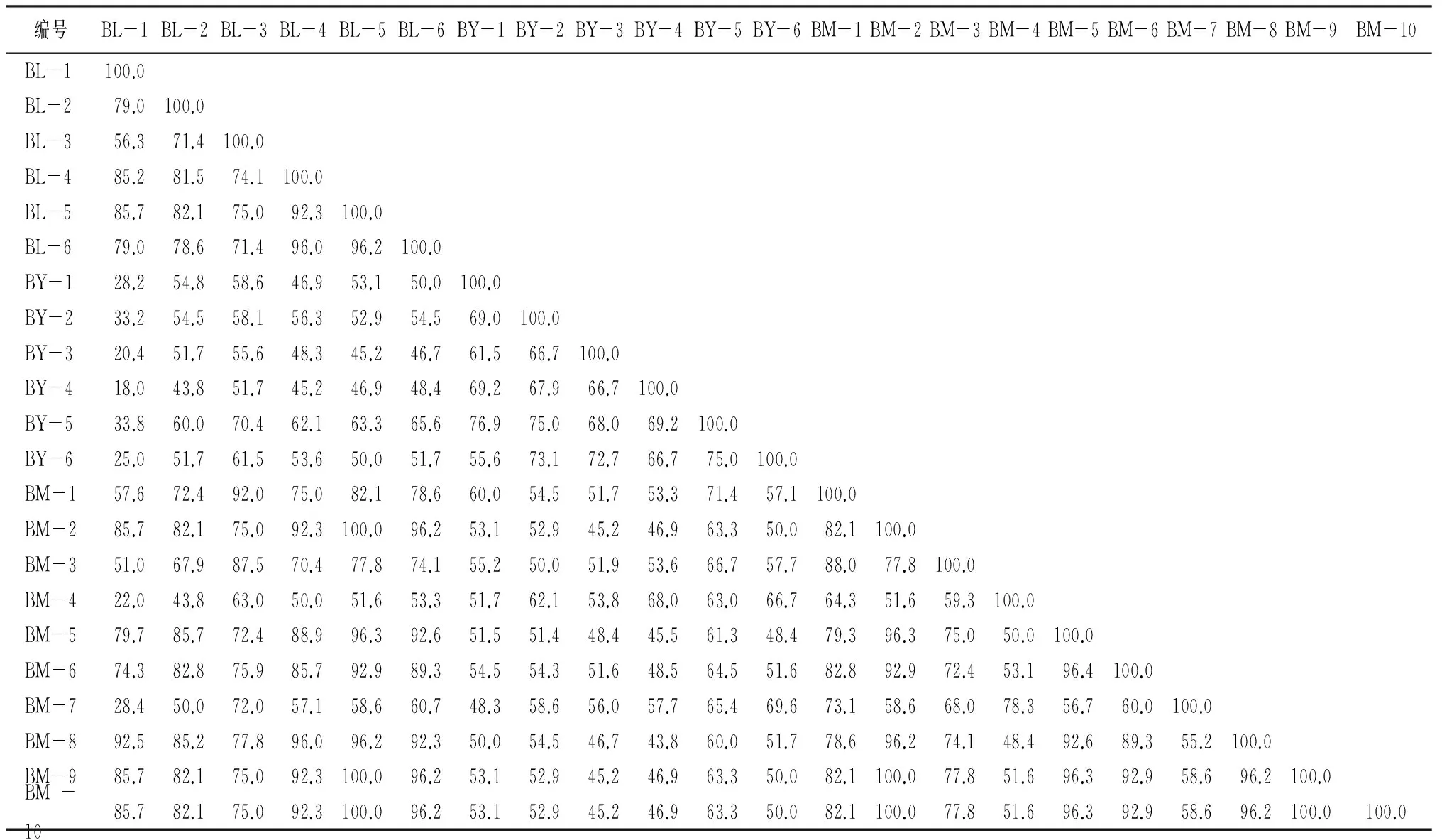
表4 22份天然麝香共有峰率 %
2.4 特征峰
根据构成麝香的主要化学成分的相关基团,从22个受检样本中的共有峰中筛选出天然麝香固定存在的特征吸收峰(见表6)。参照文献[16]~[18]分析,2 919.25~2 916.27、2 850.49~2 849.40、1 645.41~1 622.50 cm-1代表麝香中如麝香酮一类的大环酮类物质;3 275.58~3 260.86、1 645.41~1 622.50、1 557.85~1 536.80 cm-1代表天然麝香中含有大量的多肽以及蛋白质类物质成分;3 072.55~3 053.20、1 454.62~1 434.04、1 040.87~1 006.61、843.66~695.64 cm-1代表麝香中的吡啶类物质;1 742.89~1 724.18、1 245.17~1 104.08、1 043.74~1 006.61 cm-1表明麝香中存在酯类物质;3 275.58~3 260.86、2 919.25~2 916.27、2 850.49~2 849.40、678.22~666.71 cm-1表明天然麝香中存在甾体类物质。

表5 天然麝香变异峰率 %
注:某一行中的数据表示某个样本与其余样本比较时其自身的变异峰率;某一列中的数据表示某个样本与其余样本比较时另一样本的变异峰率。例如:BL-1行与BL-2列的值为BL-1的变异峰率;BL-3列与BL-4行的值为BL-4的变异峰率。

表6 天然麝香特征峰
3 结论与讨论
天然麝香红外指纹图谱较为复杂,其共同的特征峰范围为:3 275.58~3 260.86、3 072.55~3 053.20、2 919.25~2 916.27、2 850.49~2 849.40、1 742.89~1 724.18、1 645.41~1 622.50、1 557.85~1 536.80、1 454.62~1 434.04、1 411.19~1 375.95、1 245.17~1 232.24、1 178.79~1 171.18、1 155.57~1 104.08、1 043.74~1 006.61、843.66~695.64、678.22~666.71 cm-1。
原始图谱可直接观察到不同因素影响下天然麝香之间峰位、峰强以及峰形的差异。通过双指标序列法,可准确判定样本之间的相似程度。林麝麝香样本,共有峰率在71.4%~96.2%之间,变异峰率在4.0%~25.0%之间;原麝麝香样本共有峰率在55.6%~76.9%之间,变异峰率在5.6%~44.4%之间;马麝麝香样本,共有峰率在48.4%~100%之间,变异峰率在3.7%~68.8%之间。当麝香品种不同时,林麝与原麝麝香之间的共有峰率在42.4~70.4%之间,变异峰率在18.8%~85.7%之间;原麝与马麝麝香之间的共有峰率在45.2%~66.7%之间,变异峰率在15.0%~85.7%;林麝与马麝麝香之间的共有峰率在43.8%~100%之间,变异峰率在3.8%~78.6%之间。这种方法可以快速找出样本中最为相似和差异度最大的麝香,对于麝香鉴别以及质量评价具有重要意义。
利用红外指纹图谱的方法鉴别天然麝香,需要建立红外标准图谱。红外标准图谱的建立,需充分考虑各种差异的影响,比如麝香的养殖方式、产地、个体、不同采集时间以及种类等因素。应尽量扩大样本量,充分考虑各种因素影响,通过分析天然麝香样本的共有特性,进行麝香标准图谱的建立。也需要了解不同因素会对麝香指纹图谱产生的影响,以便日后鉴定时,能相对准确判别麝香是受何因素影响以及麝香化学成分的变化情况。这对于其余物质,如灵芝、犀牛角和羚羊角等已有红外指纹图谱相关研究的动物产品[19-21],后续标准红外图谱的建立具有借鉴意义。
[1] 国家药典委员会.中国药典:Ⅰ部[M].北京:中国医药科技出版社,2015:384.
[2] 李林海.我国麝类动物养殖产业现状及对策研究[D].北京:北京林业大学,2012.
[3] 李林海,胡德夫,梦梦.麝类动物的主食植物研究进展[J].安徽农业科学,2012,40(19):10184-10186.
[4] 孟秀祥,潘世秀,栾晓峰,等.兴隆山自然保护区马麝春季生境选择[J].生态学报,2010,30(20):5509-5517.
[5] 穆文靖.食物对原麝采食生境选择的影响研究[D].哈尔滨:东北林业大学,2016.
[6] 王文霞.林麝食源植物的营养学特征及食物选择主导因子的研究[D].北京:北京林业大学,2016.
[7] 李林海,黄祥云,刘刚,等.我国麝养殖种群现状及其养殖业发展的分析[J].四川动物,2012,31(3):492-496.
[8] 徐国钧.中药辞海:第4卷[M].北京:中国医药科技出版社,1998.
[9] 黄巧文.红外光谱技术对中药鉴别的研究进展[J].海峡药学,2008,20(12):151-153.
[10] 黄红英,尹齐和.傅里叶变换衰减全反射红外光谱法(ATR-FTIR)的原理与应用进展[J].中山大学研究生学刊(自然科学、医学版),2011,32(1):20-31.
[11] 陈勇,魏后超,韦韬,等.磨盘草药材红外指纹图谱共有峰率和变异峰率双指标序列分析法[J].中华中医药杂志,2015,30(3):709-712.
[12] 蔡皓,秦昆明,刘晓,等.用共有峰率和变异峰率双指标序列分析法分析百合的红外指纹图谱[J].红外,2010,31(11):38-43.
[13] 孟凡会,吴霞.农作物秸秆红外指纹图谱双指标序列分析[J].分析科学学报,2012,28(2):233-236.
[14] 邹华彬,袁久荣,杜爱琴,等.甘草水提物红外指纹图谱共有峰率和变异峰率双指标序列分析法[J].中成药,2004,26(10):779-783.
[15] 邹华彬,袁久荣,王伟.中药指纹图谱共有峰的理论识别:W检验判别方法[J].世界科学技术-中医药现代化,2004,6(2):50-56.
[16] 周健,金城,罗云,等.应用红外光谱技术鉴别中药麝香的真伪[J].光谱学与光谱分析,2010,30(9):2368-2371.
[17] 孙素琴.中药红外光谱分析与鉴定[M].北京:化学工业出版社,2010.
[18] 邢莹莹.衰减全反射红外光谱技术(ATR-FTIR)在琥珀检测与研究中的应用[J].光谱学与光谱分析,2016,36(7):2066-2070.
[19] 何晋浙,邵平,孙培龙.灵芝红外光谱的特征峰研究[J].光谱学与光谱分析,2010,30(5):1202-1205.
[20] 李圣清,祖恩东,孙一丹,等.犀牛角及其替代品的红外光谱分析[J].光谱实验室,2011,28(6):3186-3189.
[21] 刘炎,张贵君,孙素琴.羚羊角及其角塞的傅里叶红外光谱快速识别研究[J].光谱学与光谱分析,2010,30(1):42-44.
