微生物控制对实验动物培育的研究
2018-03-07黄治朝
黄治朝
(中国医学科学院血液病医院(血液学研究所),天津 300020)
0 引言
近年来随着生物医学的快速发展,实验动物培养及模型动物的建立成为了医学研究必需的材料,其中SPF级实验动物的选择及饲养中各种控制性因素是影响医学实验结果的重要原因,因此良好的管理制度和规范化的饲养流程是保障高质量实验动物的前提[1-2]。在SPF级实验动物饲养管理中,影响动物生长发育的重要指标在于实验动物及其周围物料的微生物控制,有效的微生物控制措施,不仅可以保障实验的顺利进行,同时可以保障实验动物健康培育[3]。为有效验证微生物控制对实验动物的影响,本文从微生物控制角度分析微生物控制对实验动物培育的相关性。
1 材料与方法
1.1 试验动物
80只40日龄,体重在30g左右的SPF级KM小鼠作为研究对象(均由北京维通利华实验动物中心提供),将上述实验小鼠随机分为观察组和对照组,各40只,每组共20对,按照雌雄1:1长期合笼随机交配方式进行饲养繁殖。
1.2 饲养管理
两组实验动物均饲养在SPF级屏障设施内,饲养间均采用程序化自动设置控制室温、光照、湿度及噪音在合理范围内。对照组实验动物的饲料、饮水及垫料等均按照普通实验动物屏障环境饲养标准流程操作,普通饮水和普通全价颗粒饲料经真空高压灭菌(0.2mPa 、121℃、30min);观察组均接受SPF体系化处理,包括饲料双层小包装并经Co60灭菌全价颗粒料、饮水为酸化处理结合预真空高压灭菌处理、垫料(真空压缩包装联合Co60灭菌的刨花)。两组实验动物饲养人员及笼具等均严格按照相同高压真空灭菌流程,且饲喂饲料营养均符合《GB 14924.3-2010实验动物配合饲料营养成分》规定。所有实验动物的繁殖均在相同饲养间,准确记录各组实验动物的产仔数及窝重、离乳仔数。
1.3 微生物检测
在相同条件下,实施不同的微生物防控措施,依照《GB14922.2-2011实验动物微生物学等级及监测》程序,对不同环境下灭菌后0h及使用12h、24h、36h期间屏障环境、物料的菌落数进行对比。随机抽取两组实验动物及其第1代、第2代及第3代20日龄小鼠各20只进行无菌解剖分离培养,经PCR检测两组气管分泌物、肠内容物及脏器中沙门氏菌、鼠棒状杆菌阳性率。
1.4 评定指标
繁殖性能指标(第1胎-第3胎20日龄、60日龄、离乳小鼠体重变化;第1胎-第3胎出生体重、离乳活健仔数、离乳率及胎次间隔);实验动物感染沙门氏菌及鼠棒状杆菌阳性率。
1.5 统计学分析
试验结果采用SPSS(17.0)进行t检验及χ2检验,统计分析差异性变化,P<0.05差异显著。
2 结果
2.1 两组实验动物微生物感染阳性率对比分析

表1 两组所用垫料及饮水中菌落总数含量对比分析(CFU/皿,n=20)
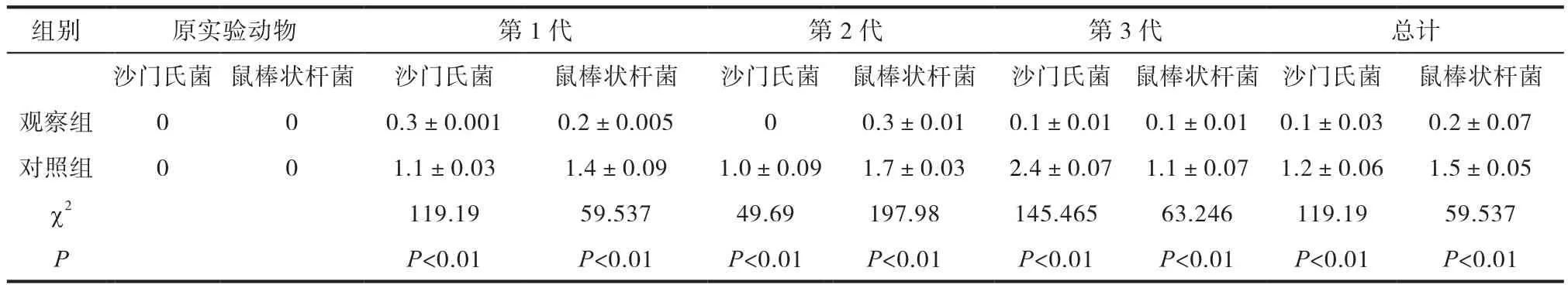
表2 两组20日龄各代实验动物中微生物菌落含量对比分析(CFU/皿,n=20)
由表1可知,两组实验动物所使用的物料,经不同时间段微生物菌落总数含量分离培养对比分析可知,0h进入的垫料和饮用的水中均符合无菌要求;放置12h、24h、36h后,发现对照组中的垫料和饮水中菌落总数含量显著高于观察组,差异显著(P<0.05)。由表2可知,两组实验动物原代均无沙门氏菌和鼠棒状杆菌感染;经过对其第1-第3代小鼠组织脏器无菌条件下培养发现,对照组第1-第3代小鼠中沙门氏菌和鼠棒状杆菌培养菌落含量均极显著高于观察组,差异显著(P<0.05)。
2.2 两组实验动物繁殖性能对比分析
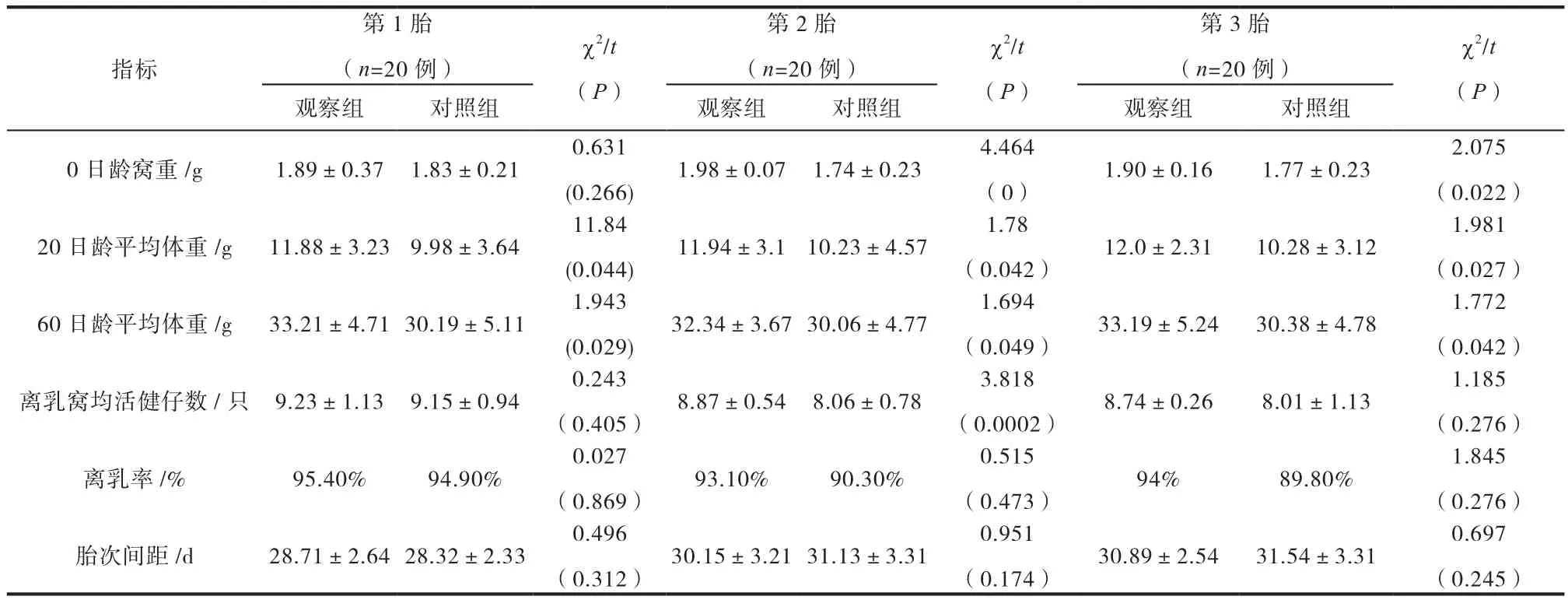
表3 两组实验动物繁殖性能对比分析
由表3可知,两组的第1代实验动物,除20日龄体重和60日龄体重方面,观察组显著高于对照组差异显著(P<0.05),其余各指标均差异不显著(P>0.05);两组第2代实验动物,在0日龄窝重、20日龄平均体重、60日龄平均体重及离乳窝均活健仔数方面,观察组均显著优于对照组(P<0.05);两组第3代实验动物,在0日龄窝重、20日龄平均体重及60日龄平均体重方面,观察组显著优于对照组(P<0.05)。同时,两组第1-第3胎次的离乳率及胎次间距差异不显著(P<0.05)。
3 讨论
随着医学动物模型的不断深入研究,动物模型所用实验动物的标准化管理成为近年来社会关注的焦点。有效的标准化管理,不仅要保障实验动物的生存环境条件、日粮营养水平,同时还应该对环境及物料中微观生物进行有效的控制[4-5]。为有效保障实验动物的合格化生产,国家出台了相关的实验动物微生物检测相关标准《GB14922.2-2011实验动物微生物学等级及监测》,通过这项标准可以有效检测实验动物在SPF级环境条件下是否符合SPF级实验动物。尽管近年来有关实验动物的检测标准得到有效优化,SPF环境及SPF实验动物的培养得到稳步进行,但是对SPF级实验动物的繁育方面却未得到有效重视,其中有关微生物影响SPF级实验动物培育的研究报道较少[6]。
本研究通过对80只SPF级KM实验小鼠在不同环境下的微生物监控结果可知,有效的微生物监控不仅可以保障实验动物的健康生长,同时可以降低其子代的发病率及提高子代繁殖性能,因此优化微生物控制对实验动物的培育具有重要意义。
[1] 白冰,张海,毛峰峰,等.大小鼠微生物检测质量控制探讨[J].中国比较医学杂志,2012,7(22):69-71.
[2] 赵继勋.实验动物的微生物及寄生虫净化[J].实验动物科学 ,2011,4(28):67-69.
[3] 邢进,冯玉芳,高正琴,等.北京地区动物实验设施动物饮水无菌检测及绿脓杆菌污染菌株鉴定[J].实验动物科学,2012,1(29):30-33.
[4] 任倩,周洁,何远清.浅谈实验动物小鼠微生物学质量控制的过程管理[J].生物技术世界,2017,2(14):337-339.
[5] 冯洁,谢建云,冯丽萍,等. 培养法和PCR法用于实验大、小鼠细菌检测的比较分析[J].中国比较医学杂志,2015(8):23-26.
[6] 王刚,张志,钟志勇,等.垫料对NIH小鼠生长发育及繁殖性能的影响[J].实验动物与比较医学,2008,28(3):180-182.
