基于线粒体细胞色素b基因的崇明岛白山羊系统进化研究
2018-03-07吕玉华戴建军张德福易建中刘成倩孙凤萍
高 骏,吕玉华,戴建军,张德福,易建中,李 红,刘成倩,孙凤萍
(上海市农业科学院畜牧兽医研究所,上海201106)
山羊在动物分类学上属于哺乳动物纲Mammalia、偶蹄目Cetartiodactyla、反刍亚目Ruminantia、牛科Bovoidea、绵阳山羊亚科Caprinae、山羊属Capra,除了家山羊Capra hircus外,山羊属余下的种多为野生种,如羱羊Capra ibex、捻角山羊Capra falconeri、高加索羱羊Capra caucasica等[1]。我国山羊品种丰富,据统计现有山羊品种62个,但由于外来品种的引入,许多品种已濒临灭绝[1-2]。崇明岛白山羊,毛洁白而富有弹性,羊肉味道鲜美,营养丰富,是冬令御寒助暖抗病延年的滋补佳品。崇明岛白山羊是特定水土条件下孕育而成的地方特有良种和传统特产之一,是上海市首批获得国家工商总局注册的“地理标志特色农产品”。但是对于崇明岛白山羊的分子遗传、系统进化等相关研究鲜有报道。
动物线粒体基因组由于分子量小、结构简单、母系遗传和进化速率快等优点,常常作为研究物种起源、亚种分化、分子遗传学的重要手段之一[3]。对于崇明岛白山羊群体在没有参考基因组信息的前提下,通过对其线粒体基因组的测序和比较分析,可以从分子生物学的角度提供重要的分子基因序列参考;通过系统进化、群体遗传学分析,可以了解崇明岛白山羊目前的遗传多样性现状。比较不同地理区域来源的白山羊样本,可以发现一定数量的分子遗传标记,为今后崇明岛白山羊的种群鉴定、来源检测以及种群繁育的多样性维持提供重要的基础数据。
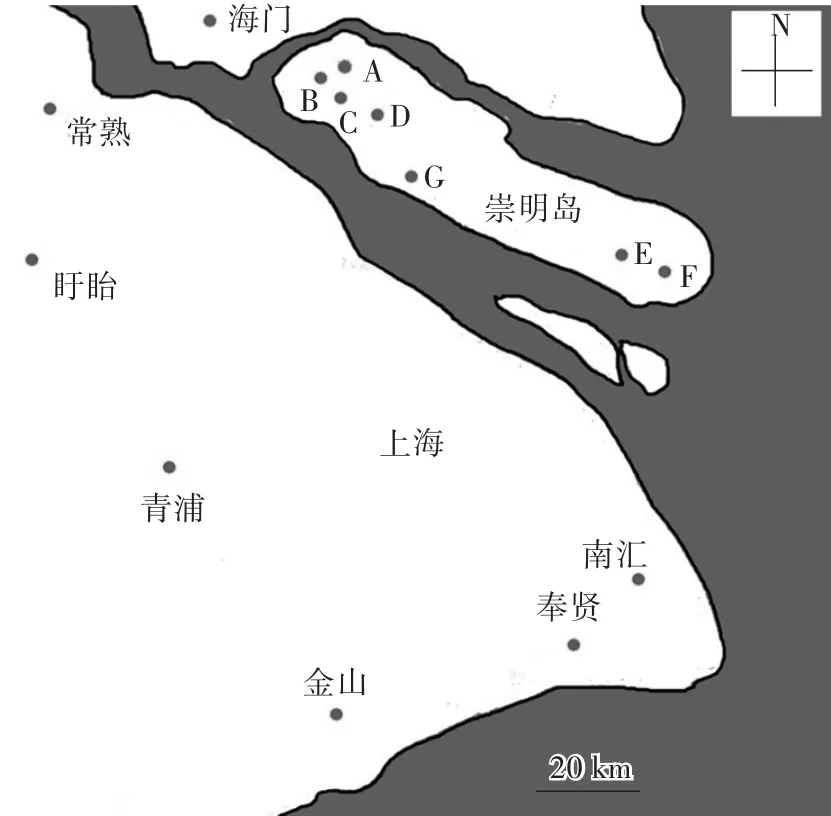
图1 72只白山羊样本的采样地点图示Fig.1 Sketch map of sampling locations(black dots)of 72 white goat individuals
1 材料与方法
1.1 样品来源和总DNA提取
在2015年7—9月,本研究采集了上海及周边长三角地区共14个点的72只白山羊样本。其中,崇明岛上5家羊场(CM_1—CM_5)和2家农户(CM_6、CM_7)共采集了36个样本,上海郊区(除崇明岛外)及周边的江苏地区共7个点也采集了36只白山羊样本,采样信息见图1、表1。每个样本,利用耳标打孔器采集少量耳组织样本,并编号记录,放入无水乙醇低温保存。利用SDS/蛋白酶K裂解,酚氯仿提取总DNA[4],琼脂糖凝胶电泳检测提取的DNA质量。

表1 白山羊样本采样信息Table 1 Sampling points and quantities of white goats
1.2 PCR扩增及测序
根据GenBank上已报道的山羊线粒体基因组全长序列(NC_005044),设计2对PCR引物(CF1/CF2,MA1/MA2),对长三角地区的72只白山羊样本的线粒体细胞色素b基因进行测序,引物序列及PCR反应条件如下。线粒体细胞色素 b(cyt b)基因的 PCR扩增引物:上游引物(CF1):5’-ATGACCAACATCCGAAAGAC-3’,下游引物(CF2):5’-TCTTCATTTTAGAAGGTTG-3’,上游引物(MA1):5’-TCGGAAGTCTCTTCACAGGA-3’,下游引物(MA2):5’-TGCTGTTATTGTGTCGGATGT-3’。
PCR反应体系为:10×PCR Buffer(Mg2+free)2μL,MgCL2(25 mmol/L)0.6μL,dNTP Mix(2.5 mmol/L)1.6μL,上下游引物(10 pmol/μL)各1μL,DNA模板2μL,rTaq酶0.3μL,用纯水调整体积至20μL/管。PCR反应条件:95℃变性3 min;94℃变性20 s,58℃退火30 s,72℃延伸1.5 min,35个循环;72℃10 min。PCR产物经1%琼脂糖电泳后,检测有无目的条带。并将PCR产物-20℃保存,送深圳华大基因科技有限公司进行PCR产物的测序。
1.3 崇明岛白山羊线粒体细胞色素b基因的测序及系统进化树的构建
测序获得的原始序列利用SeqmanTMⅡ(DNASTAR Inc.)和Chromas2.0进行序列检查,并与已报道的山羊线粒体细胞色素b基因进行BLAST比对和校正。
利用MEGA 5.0软件[5]对72只白山羊的cytb序列(表1)以及11条山羊属动物细胞色素b基因的序列(表2)进行碱基替换模型检验。并利用最最大似然法(Maximum likelihood,ML)和邻接法(Neighbor joining,NJ)分别构建系统进化树,系统进化树各分支的置信度由Bootstrap法检验,其中ML法的重复抽样次数为200次,NJ法的重复抽样次数为1 000次。

表2 系统进化分析中其他11条山羊属动物细胞色素b基因的序列信息Table 2 Sequences information of Capra genus’other cyt b genes used for phylogenetic analysis
1.4 群体遗传多样性检测
根据系统进化树获得的样本群体分组信息,利用DnaSP v5[6]软件统计72只白山羊样本不同群体内的单倍型(Haplotype)数量、单倍型杂合度(Hd)以及核苷酸多样性(π)。利用 Arlequin version 3.5[7]进行群体内以及群体间的分子变异方差分析。并对各群体的序列进行两种方法的中性检验(Tajima’s D and Fu’s Fs)和错配分布(Mismatch distribution)检验,判断各群体数量是否处于稳定状态还是经历过快速的种群扩张事件。
2 结果与分析
2.1 白山羊样本线粒体细胞色素b(cyt b)基因的全长及碱基组成
本研究中72只白山羊线粒体细胞色素b基因全长序列长度为1 140 bp,平均的碱基组成为:A含量29.6%,G含量19.8%,C含量21.5%,T含量29%。
2.2 白山羊群体系统进化树分析及多态性位点分析
MEGA序列检测得到最佳碱基替换模型为GTR+G+I,通过最大简约法(ML)和邻接法(NJ)构建的系统进化树得到相同的分组拓扑结构(图2—3)表明,本研究的72只白山羊样本,共可分为2个大的分支。其中有40个样本与江苏、南京的长江三角洲白山羊样本聚为一支(取名为YRD),且具有较高置信度(自检举置信度Bootstrap=81%),在这40个样本中有20个样本来自于崇明岛(CM),而另外20个样本来自于上海周边(除崇明岛)地区,该长江三角洲白山羊的40条细胞色素b全长序列已登录至Genbank(登录号:KY348291—KY348330)。而另一支中来自崇明岛(16个样本)以及来自上海周边地区(16个样本)与波尔山羊等聚为一支(取名BOR),具有极高的置信度(自检举置信度Bootstrap=99%)。值得注意的是在YRD支中有6个样本CM_F1、CM_F4以及CM_G1—G4单独地聚为一分支(取名CM),该CM分支中仅包含6个来自于崇明岛的白山羊样本,未出现其他上海周边地区的白山羊样本,提示该6个来自于崇明岛的白山羊样本的母系遗传来源可能是崇明本地土种白山羊。通过与其他34个YRD支中的长江三角洲白山羊细胞色素b基因的BLAST比对,共发现有8个特异的SNP位点(表3)。
2.3 白山羊样本的群体遗传学分析
系统进化树分析表明,崇明岛白山羊以及上海及周边的长三角地区白山羊从母系线粒体基因组角度共可分为2个大的群体:1)长江三角洲白山羊(YRD)群体,2)波尔山羊(BOR)群体,还有在YRD群体中,包含有一个小的崇明岛群体(CM)。对该3个群体进行遗传多样性参数的检测,发现3个群体的单倍型杂合度(Hd=0.600—0.956)均较高,表明3个群体都具有较高的遗传多样性(表4)。核苷酸多样性(π=0.001—0.003)普遍较低,说明线粒体cyt b基因在各自种群内的多样性较低。群体间遗传差异的分子方差分析(表5)表明,绝大多数的遗传差异来自于群体间(98.98%),而来自于群体内的差异很小(1.02%)。中性检验(Neutrality test)中虽然YRD和BOR群体都呈现负值,但由于中性检验P>0.05,均不显著,所以不支持群体在历史上经历过群体扩张事件(表6)。

图2 基于最大似然法(M L)构建的72个白山羊线粒体细胞色素b基因系统进化树Fig.2 Phylogenetic tree of 72 white goat individuals’m itochondrial cyt b genes constructed by maximum likelihood
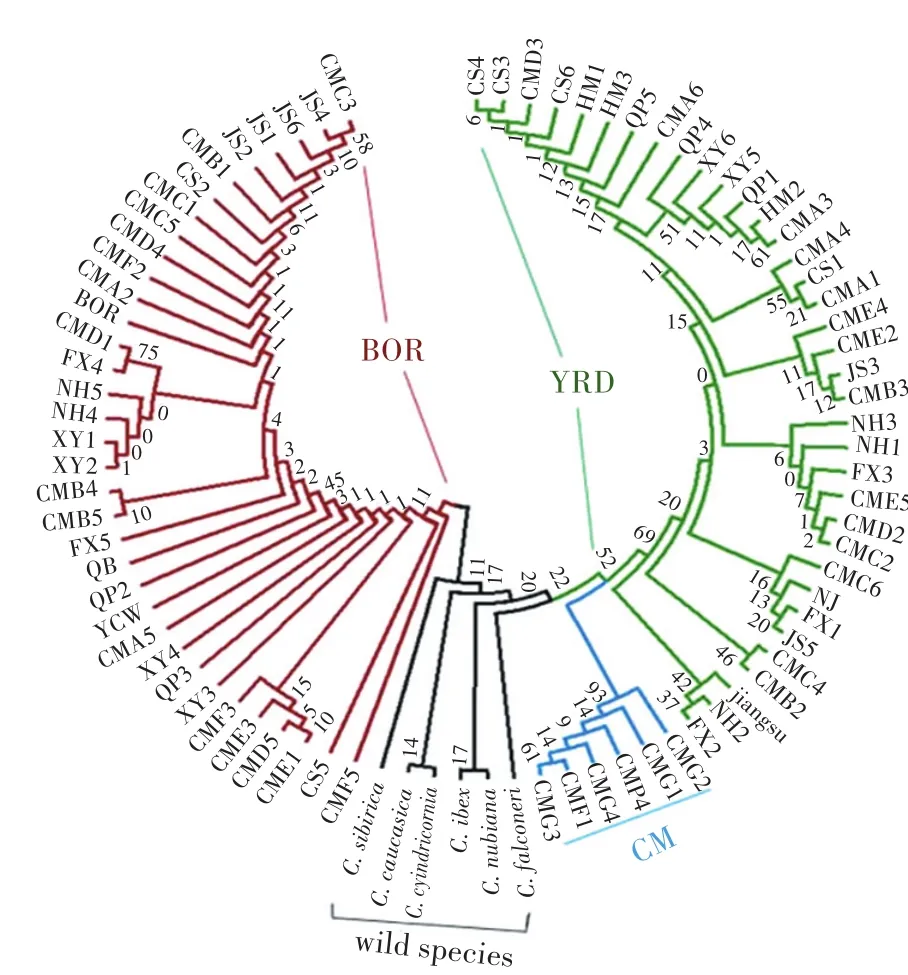
图3 基于邻接法(NJ)构建的72只白山羊线粒体细胞色素b基因系统进化树Fig.3 Phylogenetic tree of 72 white goat individuals’m itochondrial cyt b genes constructed by neighbor joining

表3 崇明岛白山羊群体(CM)线粒体细胞色素b基因特异性SNP统计Table 3 Statistic ofm itochondrial cyt b gene’s single nucleotide polymorphism(SNP)of Chongm ing Island’s white goat population

表4 白山羊群体的遗传多样性参数分析Table 4 Genetic diversity parameters of white goat populations

表5 群体间遗传差异的分子方差分析Table5 Molecular variance analysis of genetic difference between populations

表6 白山羊群体的中性检验及核酸错配分布检验Table 6 Neutrality and m ismatching distribution tests for white goat populations
3 讨论
长江三角洲白山羊(原称海门山羊)是分布在东海之滨的一种优质的毛、肉兼用的家养山羊品种,具有悠久的历史。目前,对山羊的品种研究,主要从形态学水平进行鉴定,如高腾云等[8]选用体高、体长、胸围等8个指标,应用系统聚类的方法对我国19个山羊品种进行了分析。而对于各山羊品种,通过分子生物学基因遗传角度的研究则相对较少。
目前,主要以微卫星标记、随机扩增多态(RAPD)[9]、限制性片段长度多态性(RFLP)[10]等手段进行山羊品种的遗传多态性研究。近年来,通过线粒体DNA的母系遗传结构研究,为解析山羊的系统进化以及各山羊品种的遗传进化关系研究提供了重要手段。Luikart等[11]通过对88个山羊品种的线粒体D-loop高变区测序分析,发现山羊至少有3个主要的母系起源。Saeid等[12]通过构建来自于不同国家的2 430条山羊线粒体序列,在家养山羊中发现了7个主要的支系。
崇明岛白山羊从分类上属于长江三角洲白山羊,但关于该群体的分子生物学研究很少。陈士超等[13]通过12个ISSR分子标记研究了崇明岛3个群体和1个徐淮山羊群体的遗传分化,结果发现群体间的遗传分化水平很低,而遗传变异主要来自于群体内部,不同山羊群体的遗传分化不符合地理隔离距离模式。
本研究对崇明岛的7个点以及上海及周边地区7个点的共计72个白山羊样本的母系遗传结构研究发现,在崇明岛的36个样本中,仅有20个样本的线粒体细胞色素b基因序列符合长江三角洲样本序列特征,而其余16个与波尔山羊的细胞色素b基因具有较高的同源性。这种情况在上海及周边地区的白山羊样本中也是如此,所以将72个样本根据线粒体cyt b分组后发现,符合长江三角白山羊样本(YRD)的共40个样本,其余32个为波尔山羊群体(BOR),这表明,目前长江三角洲地区的白山羊存在大量的外源山羊品种的杂交情况,人类活动(羊只的贸易、引种)等对崇明岛本身的山羊群体遗传结构造成了重要的影响。大量的外来山羊品种基因渗入到原来的本地山羊群体中,而仅通过形态学来判断山羊品种的遗传背景已变得非常困难和不准确。在本研究的长江三角白山羊(YRD)群体中,还发现了有6个样本(CM群体)与其他崇明岛外的长江三角洲白山羊样本(YRD)群体在线粒体细胞色素b基因上存在8个SNP位点。且该6个样本来源于崇明岛上2个农户自繁自养的白山羊样本,提示该6个样本可能为崇明岛本地山羊品种,而存在较小的与外来山羊杂交情况。研究认为,该8个位点需要在更大的群体样本中进行验证,有望成为今后崇明岛白山羊种群遗传鉴定等方面的重要分子遗传标记,建议对该两个采样点上的崇明岛白山羊进行种源保护和进一步的研究。
[1]武艳平.中国部分山羊品种多样性及系统进化分析[D].北京:中国农业科学院,2008.
[2]马月辉,吴常信.畜禽遗传资源受威胁程度评价[J].家畜生态,2001,22(2):8-13.
[3]张方,米志勇.动物线粒体DNA的分子生物学研究进展[J].生物工程进展,1998,18(3):25-31.
[4]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning:a laboratory manual[M].Cold Spring Harbor:Cold Spring Harbor Laboratory Press,1989.
[5]TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimonymethods[J].Mol Phylogenet Evol,2011,28:2731-2739.
[6]LIBRADO P,ROZAS J.DnaSP v5:software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25:1451-1452.
[7]EXCOFFIER L,LISCHER H E.Arlequin suite ver 3.5:a new series of programs to perform population genetics analyses under Linux and Windows[J].Mol Ecol Res,2010,10:564-567.
[8]高腾云,孔庆友.中国山羊品种定量分类研究[J].家畜生态,2000,21(2):20-24.
[9]李样龙,田庆义,马国强,等.波尔山羊杂交后代及其亲本DNA随机扩增多态研究遗传[J].遗传,2000,22(2):75-77.
[10]LEROUX C,MARTIN P,MAHEM F,et al.Restriction fragment length polymorphism identification of goat alpha s1-casein alleles:a potential tool in selection of individuals carrying alleles associated with a high level protein synthesis[J].Animal Genetics,1990,21(4):341-351.
[11]LUIKART G,GIELLLY L,EXCOFFIER L,et al.Multiple maternal origins and weak phylogeographic structure in domestic goats[C].The Proceedings of the National Academy of Sciences(US),2001,98(10):5927-5932.
[12]SAEID N,HAMID REZA K,et al.Large scalemitochondrial DNA analysis of the domestic goat reveals six haplogroupswith high diversity[J].PLoSONE,2007,10(1012):1-12.
[13]陈士超,郑佩培,罗倩倩,等.崇明白山羊群体问的遗传分化[J].中国畜牧杂志,2010,46(19):7-9.
