动脉化疗栓塞联合射频消融与手术切除对早期HCC患者生存率影响的Meta分析
2018-03-06郭伟昌李昭辉黄智勇高磊
郭伟昌,彭 翼,李昭辉,黄智勇,高磊,黄 强,阮 强
(四川省宜宾市第一人民医院血管外科 644000)
在世界范围内,肝细胞性肝癌(hepatocellular carcinoma,HCC)已上升为肿瘤性致死因素中的第5位[1]。目前,手术切除(surgical resection,SR)和肝移植是仅有的治愈性疗法[2]。对肝功能尚可(Child-Pugh A级或B级)且肿瘤较小(≤3.0 cm)或中等大小(3.1~5.0 cm)的早期HCC患者,动脉栓塞化疗(transarterial chemoembolization,TACE)联合射频消融(radiofrequency,RFA)和SR均为可供选择的方案[3-4]。RFA是一种相对新颖的治疗方案,对肿瘤较小(≤2.0 cm)的早期HCC有着安全、有效的优势[5],但因病变范围和热柜效应所导致的消融不全,其局部复发风险较高[6-7],尤其当肿瘤大于3.0 cm时复发风险明显升高[8]。TACE是一种常用于非可切除性HCC、旨在延缓病情进展、缓解症状及改善生存质量的保守疗法[9]。TACE可减少、甚至阻断局部血流,有助于减少RFA的热量损失。因此,TACE联合RFA(TACE-RFA)具有辅助增强的作用。最近的两篇Meta分析显示,TACE-RFA较单一疗法有着更高的总体生存率(OS)及无复发生存率(RFS)[10-11]。
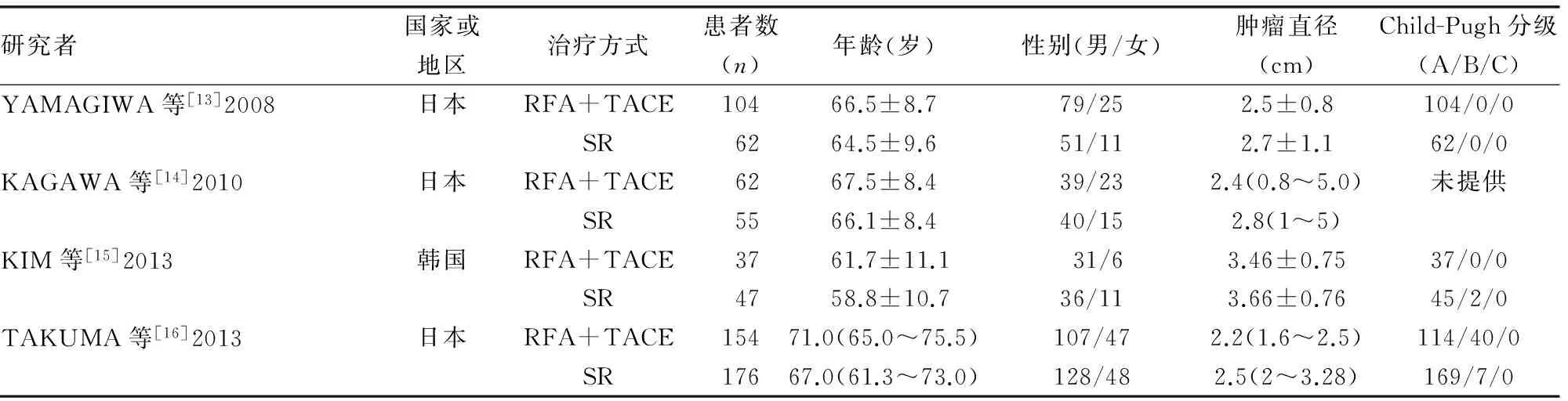
表1 纳入文献的基本特征

图1 TACE-RFA组与SR组1年OS比较
因此,这种联合疗法有望替代外科手术成为治疗瘤体较小的早期HCC的首选疗法。TACE-RFA有着微创、低并发症发生率。不过,该疗法是否能获得与外科手术相似的生存率尚不明确。本研究旨在汇总已有的研究结果以评估、对比二者对治疗瘤体较小、可切除的早期HCC患者的生存结果与严重并发症情况。
1 资料与方法
1.1 文献检索策略 计算机检索:PubMed、Medline、Embase、中国生物医学数据库、万方数据库、维普数据库和中国期刊全文数据库数据库。中文检索词包括:早期肝细胞性肝癌、动脉化疗栓塞、射频消融、手术切除、生存率。英文检索词包括:“radiofrequency ablation” OR “radio frequency ablation” OR “RFA”“transarterial chemoembolization” OR “TACE”“liver resection” OR “hepatectomy” OR “surgical resection”“hepatocellular carcinoma” OR “liver cancer” OR “HCC”。搜索范围为2000年1月至2016年3月出版的文献,语种不限。文献中列出的参考文献、综述、Meta分析皆再次通过手工检索以收集适合纳入者。
1.2 方法
1.2.1 文献纳入标准 (1)评估TACE-RFA与外科手术对早期HCC治疗效果的前瞻性或回顾性研究;(2)包含存在影响OS或RFS风险的病例数记录或有术后至少3年OS或RFS曲线记录的研究。
1.2.2 文献排除标准 (1)研究纳入了非早期的HCC患者;(2)随访少于3年;(3)首次治疗后3年内再次接受其他任何治疗者;(4)RFA实施于TACE术前者。
1.2.3 文献质量评价及数据提取 数据提取由两位研究员分别独立执行,由第3名研究员进行横向检测。意见分歧由组内讨论解决。提取的数据包括第一作者姓名、发表时间、患者数、男女性别数、平均年龄、平均肿瘤大小及Child-Pugh各分级内患者数。存在风险的患者数以评估治疗效果,提取两组发生严重并发症的患者数以评估安全性。严重并发症的定义为:导致严重疾患、残疾、再次住院、需高级生命支持或住院时间延长的事件。
1.3 统计学处理 使用RevMan5.3对原始数据进行汇总和分析。OS、RFS及严重并发症率均为非连续型数据。根据异质性水平,用固定性效应或随机性效应模型分析比值和相应的95%CI。用I2statistic和χ2检验评估各研究间异质性。P<0.1或I2>50%表示存在明显异质性[12],此时使用随机效应模型;否则使用固定性效应模型。对汇总的数据进行Z检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 文献检索结果 本Meta分析最终纳入4个回顾性研究[13-16],共纳入697例患者,其中357例接受TACE-RFA治疗,340例接受SR治疗。其中3个研究所选患者的肿瘤直径小于5.0 cm[13-14,16],另1个研究肿瘤直径为2.0~5.0 cm[15]。纳入文献的基本特征见表1。
2.2 两组患者的OS比较 TACE-RFA组患者的1、3年总体生存率为94.40%(337/357)、59.94%(214/357),SR组患者为92.35%(314/340)、68.24%(232/340),两组比较差异无统计学意义(OR=1.43,95%CI:0.79~2.60,P=0.24,I2=0%;OR=0.77,95%CI:0.56~1.07,P=0.12,I2=45%),见图1、2。两组对比异质性较小,提示与原研究结果高度一致。此外,除去任意一组研究不能改变二者的总体对比趋势,提示研究结果高度稳定。
2.3 两组患者的RFS比较 TACE-RFA组与SR组患者的1年RFS分别为81.51%(291/357)、80.29%(273/340),两组比较差异无统计学意义(OR=1.07,95%CI:0.73~1.57,P=0.74,I2=0%);但TACE-RFA组3年PFS[29.97%(107/357)]明显低于SR组[44.41%(151/340)],两组比较差异有统计学意义(OR=0.56,95%CI:0.40~0.77,P=0.000 5,I2=0%) ,见图3、4。两次对比同质性均较小,提示与原始研究结论高度一致。此外,两次对比中除去任意一组研究均不能改变总体趋势,提示研究结果高度稳定。

图2 TACE-RFA组与SR组3年OS比较

图3 TACE-RFA组与SR组1年RFS比较

图4 TACE-RFA组与SR组3年RFS比较

图5 TACE-RFA组与SR组严重并发症发生率比较
2.4 两组患者的严重并发症发生率比较 TACE-RFA组TACE-RFA的严重并发症发生率为明显低于SR组(1.43%vs.5.07%),两组比较差异有统计学意义(OR=0.23, 95%CI:0.10~0.54,P=0.000 7,I2=10%),见图5。
3 讨 论
对于非可切除性HCC,TACE被推荐为一线保守疗法,该术式通过注入栓塞剂和化疗药物达到使肿瘤缺血坏死的治疗目的。RFA则通过施加RFA能量使肿瘤发生热融性凝固从而达到治疗目的。这种疗法被认为是外科手术的有效替代方案,尤其是对于已有肝功能损害的患者。不过,RFA也常因消融不完全而更易发生局部肿瘤恶化[17]。所以,该项技术的改进重点应在于减少局部恶化的发生。
尽管RFA和TACE都不能达到对病情的完全控制,二者联合应用却显示出比单一疗法更有潜力的协同效应。其协同效应的优势之一就是能通过减少局部血流和减少热量流失达到阻止局部肿瘤恶化的效果[18-19]。联合疗法可能机制如下:(1)TACE阻断血流,减少了热量流失,间接扩大了消融范围,能帮助杀灭肿瘤周围的微小转移灶[19];(2)单纯TACE对主病灶旁的卫星病灶有着良好的治疗效果,理论上可以用于阻止局部病灶恶化进展。新近的几篇Meta分析指出,TACE-RFA相比单纯RFA有着更低的局部肿瘤恶化率[10,20]。对于早期HCC,这种联合疗法显然更具潜力;而对比外科手术,其是否能获得相似的生存结果却尚不明确。
本研究中纳入了4篇回顾性研究。通过对原始研究结果的汇总,本研究发现,TACE-RFA联合疗法的OS与外科手术相似,但远期复发率较高,而严重并发症发生率则较低。本课题组认为,该联合疗法在并发症方面的优势得益于其微创性,但远期复发率的不足仍与其非去除性、易残留性相关,属不可避免的自身缺陷。所以,只要患者可以耐受手术,外科手术仍然是治疗HCC的首选。但在制订治疗计划时,手术并发症仍需予以重视,尤其对于肝功能受损的患者。
本研究存在以下局限:(1)所纳入的研究均为非随机对照试验,故原始数据存在一定的选择偏倚,对研究结果有一定影响;所幸灵敏度分析提示研究结果均为高度稳定,提示可能存在的偏倚影响并不大。(2)各研究所纳入的患者数相对较少,使得最终结论的统计学论证力偏弱,未来仍需大型随机对照试验加以证实。
[1]SIEGEL R,MA J,ZOU Z,et al.Cancer statistics[J].CA Cancer J Clin,2014,64(1):9-29.
[2]MORIMOTO M,NUMATA K,KONDOU M,et al.Midterm outcomes in patients with intermediate-sized hepatocellular carcinoma:a randomized controlled trial for determining the efficacy of radiofrequency ablation combined with transcatheter arterial chemoembolization[J].Cancer,2010,116(23):5452-5460.
[3]CHO Y K,KIM J K,KIM M Y,et al.Systematic review of randomized trials for hepatocellular carcinoma treated with percutaneous ablation therapies[J].Hepatology,2009,49(2):453-459.
[4]RHIM H,LIM H K.Radiofrequency ablation of hepatocellular carcinoma:pros and cons[J].Gut Liver,2010,4 Suppl 1:S113-118.
[5]LIVRAGHI T,MELONI F,DI STASI M.et al.Sustained complete response and complications rates after radiofrequency ablation of very early hepatocellular carcinoma in cirrhosis:is resection still the treatment of choice?[J].Hepatology,2008,47(1):82-89.
[6]WHITE R R,AVITAL I,SOFOCLEOUS C T,et al.Rates and patterns of recurrence for percutaneous radiofrequency ablation and open wedge resection for solitary colorectal liver metastasis[J].J Gastrointest Surg,2007,11(3):256-263.
[7]REUTER N P,WOODALL C E,SCOGGINS C R,et al.Radiofrequency ablationvs. resection for hepatic colorectal metastasis:therapeutically equivalent?[J].J Gastrointest Surg,2009,13(3):486-491.
[8]ALOIA T A,VAUTHEY J N,LOYER E M,et al.Solitary colorectal liver metastasis-Resection determines outcome[J].Arch Surg,2006,141(5):460-466.
[9]TAKAYASU K,ARII S,IKAI I,et al.Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients[J].Gastroenterology,2006,131(2):461-469.
[10]LIU Z,GAO F,YANG G,et al.Combination of radiofrequency ablation with transarterial chemoembolization for hepatocellular carcinoma:an up-to-date meta-analysis[J].Tumor Biology,2014,35(8):7407-7413.
[11]DONG W,ZHANG T,WANG Z G,et al.Clinical outcome of small hepatocellular carcinoma after different treatments:a meta-analysis[J].World J Gastroenterol,2014,20(29):10174-10182.
[12]HIGGINS J P,THOMPSON S G,DEEKS J J,et al.Measuring inconsistency in meta-analyses[J].BMJ,2003,327(7414):557-560.
[13]YAMAGIWA K,SHIRAKI K,YAMAKADO K A,et al.Survival rates according to the Cancer of the Liver Italian Program scores of 345 hepatocellular carcinoma patients after multimodality treatments during a 10-year period in a retrospective study[J].J Gastroenterol Hepatol,2008,23(3):482-490.
[14] KAGAWA T,KOIZUMI J,KOJIMA S,et al.Transcatheter arterial chemoembolization plus radiofrequency ablation therapy for early stage hepatocellular carcinoma:comparison with surgical resection[J].Cancer,2010,116(15):3638-3644.
[15] KIM J W,SHIN S S,KIM J K,et al.Radiofrequency ablation combined with transcatheter arterial chemoembolization for the treatment of single hepatocellular carcinoma of 2 to 5 cm in diameter:comparison with surgical resection[J].Korean J Radiol,2013,14(4):626-635.
[16]TAKUMA Y,TAKABATAKE H,MORIMOTO Y A,et al.Comparison of combined transcatheter arterial chemoembolization and radiofrequency ablation with surgical resection by using propensity score matching in patients with hepatocellular carcinoma within Milan criteria[J].Radiology,2013,269(3):927-937.
[17]LAM V W,NG K K,CHOK K S,et al.Incomplete ablation after radiofrequency ablation of hepatocellular carcinoma:analysis of risk factors and prognositic factors[J].Ann Surg Oncol,2008,15(3):782-790.
[18]YAMAKADO K,NAKATSUKA A,AKEBOSHI M,et al.Combination therapy with radiofrequency ablation and transcatheter chemoembolization for the treatment of hepatocellular carcinoma:short-term recurrences and survival[J].Oncol Rep,2004,11(1):105-109.
[19]YAMAKADO K,NAKATSUKA A,OHMORI S,et al.Radiofrequency ablation combined with chemoembolization in hepatocellular carcinoma:treatment response based on tumor size and morphology[J].J Vasc Interv Radiol,2002,13(12):1225-1232.
[20]GU L L,LIU H L,FAN L L,et al.Treatment outcomes of transcatheter arterial chemoembolization combined with local ablative therapy versus monotherapy in hepatocellular carcinoma:a meta-analysis[J].J Cancer Res Clin Oncol,2014,140(2):199-210.
