RBP4对糖尿病肾病无症状脑梗死神经认知功能的影响
2018-03-06陈丹燕黄晓龙邓华聪杜晓刚王成剑黄荣曦张冰寒
陈丹燕,黄晓龙,卢 松,邓华聪,甘 华,杜晓刚,王成剑,黄荣曦,张冰寒
(1.重庆市人民医院中山院区内分泌肾内科,重庆 400013;2.解放军第三二四医院神经外科,重庆 400028;3.重庆医科大学附属第一医院内分泌科,重庆 400016;4.重庆医科大学附属第一医院肾内科,重庆 400016)
无症状脑梗死(silent cerebral infarction,SCI)发病率逐年增高,SCI一般病灶直径为2~15 mm,以腔隙性脑梗死型最常见,最主要病理基础是微小血管病变的基底膜增厚、内皮细胞增生和小粥样斑块形成,因梗死灶的破坏范围小或受累的脑组织远离功能区而无明显症状和体征,但可以通过CT或MRI等神经影像学检测验证[1]。若患者反复多次发作SCI可导致认知功能减退、假性球麻痹、血管性帕金森综合征、有症状性脑梗死等[2]。
视黄醇结合蛋白(retinol binding protein,RBP)是新近发现的一种与糖尿病相关的脂肪因子,由181个氨基酸残基组成,属于RBP家族中分泌型RBP。RBP4由肝脏合成并释放入血,通过与视黄醇、甲状腺素转运蛋白及细胞表面受体相互作用,参与代谢综合征、动脉粥样硬化等疾病的发生、发展。RBP4表达水平增高可诱发糖尿病大血管病变[3-4],然而,RBP4是否与糖尿病肾病(diabetic nephropathies,DN)患者SCI功能障碍有关,及其可能发生机制的研究国内外尚少见报道。
1 资料与方法
1.1 一般资料 选取2016年2-10月重庆市人民医院60例新诊断DN患者和30例健康志愿者(CON组)为研究对象,根据影像学结果将60例DN患者分成并发SCI组(SCI组)和未并发SCI组(NSCI组),每组30例。SCI的诊断符合以下条件[5-6]:(1)无神经系统症状和体征;(2)MRI T1加权像存在低信号,T2加权像存在高信号,病灶直径范围大于3 mm,MRI 弥散加权成像无高信号。患者入组标准:(1)患者日常生活和社会活动未受明显影响;(2)头颅MRI证实存在SCI病灶;(3)患者均为右利手。排除标准:(1)脑梗死和痴呆病史;(2)其他中枢神经系统疾病史如感染;(3)严重躯体疾病;(4)精神心理疾病病史;(5)乙醇或毒品依赖者;(6)病情严重或因残障而无法完成认知功能量表评定者;(7)有活动性出血或出血倾向者;(8)服用非甾体类消炎药、糖皮质激素、甲状腺素片等药物者;(9)肝疾病患者。所有研究对象均签署知情同意书,该研究通过本院伦理委员会审批。
1.2 方法
1.2.1 观察及检测指标 临床资料包括性别、年龄、吸烟史、高脂血症、心房纤颤史等;检测指标包括收缩压、舒张压、踝臂指数、颈内动脉内膜中层厚度(intima-media thickness,IMT),纤维蛋白原(fibrinogen,FIB)、糖化血红蛋白(HbA1c)、胰岛素抵抗指数(homeostasis model assessment insulin resistame,HOMA-IR)、胰岛素β细胞功能指数(homeostasis model assessment for beta cell function,HOMA-β)及体内脂肪水平,计算公式如下:
HOMA-IR=空腹血糖×空腹胰岛素/22.5
(1)
HOMA-β=20×空腹胰岛素/(空腹血糖-3.5)
(2)
体内脂肪水平(男)=1.2×BMI+0.23×年龄-16.2
(3)
体内脂肪水平(女)=1.2×BMI+0.23×年龄-15.4
(4)
1.2.2 颈动脉超声检查 超声检查由两名严格培训的专业医师操作,所有研究对象均采用多普勒超声诊断仪,探头3~9 MHz,扫描双侧颈动脉,平卧位、前方和侧面做纵向扫描。观察颈总动脉分叉处和颈内、颈外动脉,每个方向纵切测量3个点的IMT,交叉点最厚处为一个点,另外两个点分别位于交叉部向下1 cm和向下2 cm处,计算平均颈IMT。判断标准:若IMT<1.0 mm,颈动脉内膜光滑者则为正常;若IMT≥1.0~1.2 mm则为颈动脉内膜增厚,IMT>1.2 mm则为颈动脉斑块形成。根据斑块形态临床意义将低回声斑块和溃疡性混合斑块归为不稳定性斑块,强回声斑与扁平斑归为稳定性斑块。管腔狭窄30%~50%为轻度,>50%~<70%为中度,≥70%~90%为重度。颈动脉狭窄程度计算公式如下:
颈动脉狭窄程度=1-残留血管截面积/血管截面积
(5)
1.2.3 评估神经认知功能缺损情况 (1)评估神经功能缺损程度:由两名医师按国立卫生研究院卒中量表(national institutes of health stroke scale,NIHSS)神经功能缺损程度评分标准评定,0~1分为正常;>1~4分为轻度;>4~15分为中度;>15~20分为中-重度;>20~42分为重度。(2) 蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA):从视空间/执行功能、注意力与集中、记忆力、语言能力、抽象思维、命名、计算和定向力8个领域进行评估,10 min内完成量表,总分30分,≥26分为认知正常;若受教育年限小于或等于12年则加1分。
1.2.4 ELISA检测外周血血清RBP4水平 禁食10 h后次日晨空腹采集肘静脉血2 mL,分离血清,-20 ℃保存待检。ELISA检测血清RBP4水平,ELISA试剂的批内分析和批间分析变异系数均小于10%,所有样本设3个复孔。
1.2.5 Western blot检测脂蛋白相关磷脂酶A2(lipoprotein-associated phospholipase A2,Lp-PLA2)和趋化因子受体4(C-X-C chemokine receptor type 4,CXCR4)表达 提取总蛋白用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。每孔上样50 μg,加等体积2×加样缓冲液,100 ℃变性5 min,60 V电泳至样品进入分离胶,120 V电泳2 h,取出凝胶。将蛋白转移至硝酸纤维膜,3%脱脂奶粉稀释后的一抗4 ℃孵育过夜,0.05%Tris缓冲盐-Tween溶液室温漂洗后与3%脱脂奶粉稀释后的二抗37 ℃摇动孵育2 h,充分洗涤后5-溴-4-氯-3-吲哚-磷酸盐/四唑硝基蓝染色试剂盒显示蛋白印迹条带。Quantity One图像分析系统检测蛋白表达水平。
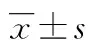
2 结 果
2.1 各组对象临床检测指标比较 SCI和NSCI组患者的年龄、性别、病程时间、危险因素(吸烟史、高脂血症、心房纤颤史、收缩压和舒张压)比较,差异无统计学意义(P>0.05)。CON组HOMA-IR、HOMA-β和HbA1c明显低于DN患者(P<0.05);在DN患者中SCI组HOMA-IR、HOMA-β和HbA1c与NSCI组比较,差异有统计学意义(P<0.05)。NSCI组患者IMT、FIB和体内脂肪水平均低于SCI组,而高于CON组,组间比较差异有统计学意义(P<0.05)。NSCI组患者踝背指数高于SCI组,而低于CON组,组间比较均差异有统计学意义(P<0.05),见表1。
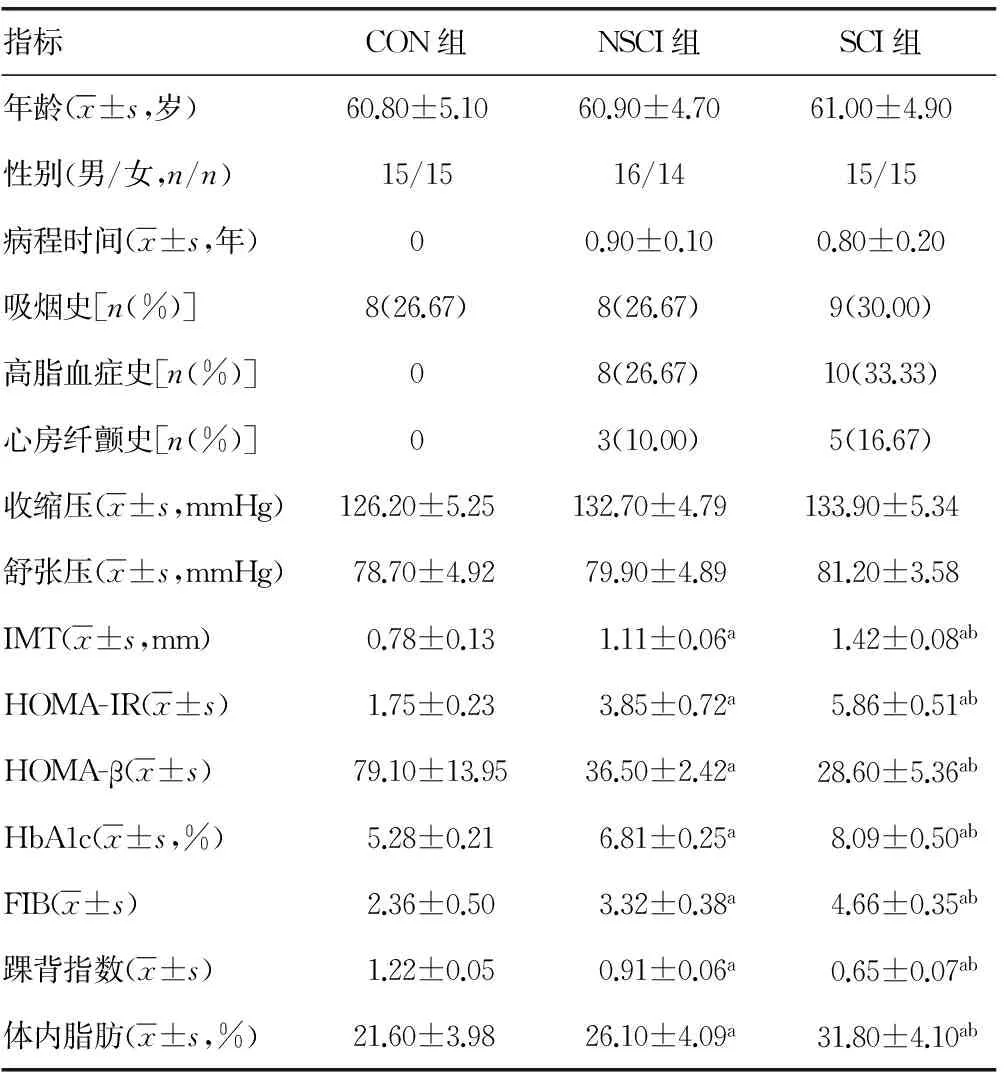
表1 各组对象临床检测指标比较(n=30)
a:P<0.05,与CON 组比较;b:P<0.05,与NSCI组比较
2.2 SCI患者MRI图像特征和临床表现 SCI患者梗死灶大小不一,多呈圆形、类圆形,其中腔隙性脑梗死18例;单发病灶者10例,2个及以上病灶者20例。梗死灶位于基底节区10例、内囊7例、脑室2例、放射冠3例、颞叶3例、丘脑6例、桥脑3例和小脑2例。SCI患者非特异性症状包括头痛8例、头晕10例、乏力9例、主观感觉肢体麻木12例、反应迟钝10例、健忘15例。
2.3 颈动脉粥样硬化程度比较 30例SCI患者中,20例有颈动脉粥样硬化斑块形成,颈动脉粥样硬化斑块检出率明显高于NSCI组,其中SCI组不稳定斑块例数和狭窄程度均明显高于NSCI组(P<0.05),见表2,图1。

表2 SCI组与NSCI组颈动脉粥样硬化斑块及狭窄程度比较[n(%),n=30]
a:P<0.05,与SCI 组比较

A:正常颈动脉内膜;B:颈动脉内膜增厚;C:颈动脉软斑;D:颈动脉混合斑;E:颈动脉硬斑
图1 颈动脉内膜厚度和斑块超声检图像
2.4 SCI组与NSCI组患者神经功能缺损程度评分和MoCA评分比较 与NSCI组患者相比,SCI组NIHSS评分增高(4.43±1.12vs. 8.48±3.69,P<0.05);而视空间/执行能力、注意力与集中、计算、抽象思维、记忆力、定向力和MoCA综合评分均降低,组间比较差异有统计学意义(P<0.05)。SCI组命名和语言能力评分虽较NSCI组低,但组间比较差异无统计学意义(P>0.05),见表3。

表3 SCI组与NSCI组患者MoCA评分比较
a:P<0.01,b:P<0.05,与NSCI组比较
2.5 血清RBP4水平及其与神经认知功能损害相关性 与NSCI组比较,SCI组血清RBP4水平明显增高(17.02±1.83vs. 28.59±2.16,P<0.05)。SCI组血清RBP4水平与神经功能缺损NIHSS评分和MoCA综合评分均呈正相关(r=0.72、0.80,P<0.05)。
2.6 Logistic回归分析 以DN患者是否并发SCI为因变量,将IMT、踝背指数、体内脂肪水平和RBP4作为自变量引入单因素Logistic回归分析,按α=0.05标准,最终ITM、踝背指数和RBP4纳入回归模型。进一步多元Logistic回归分析,发现ITM和RBP4与DN患者并发SCI存在回归关系,见表4。
2.7 Lp-PLA2和CXCR4表达 与CON组比较,SCI组和NSCI组患者Lp-PLA2和CXCR4表达水平均明显增高,其中SCI组Lp-PLA2和CXCR4表达水平明显高于NSCI组,组间比较均差异有统计学意义(P<0.05),见表5。
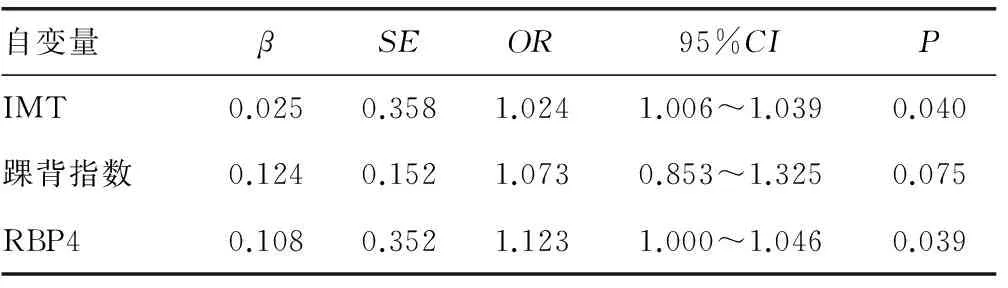
表4 DN并发SCI的影响因素Logistic回归分析

表5 各组研究对象Lp-PLA2和CXCR4表达 水平比较
a:P<0.05,与CON 组比较;b:P<0.05,与NSCI组比较
3 讨 论
DN患者微血管基底膜增厚,肾小球内血流动力学异常,激发慢性炎症反应,促进血小板聚集并释放活性物质,形成微血栓,神经细胞凋亡增多,缺血性坏死组织形成腔隙状态,临床上表现为SCI和反复发作的短暂性脑缺血发作。本研究结果提示,DN并发SCI患者神经功能缺损程度较NSCI患者重,结合MoCA量表评估结果发现,SCI患者的视空间/执行能力、注意力与集中、计算、抽象思维、记忆力、定向力和综合评分均明显低于NSCI组,而命名、语言能力评分虽较NSCI组低,但差异无统计学意义(P>0.05),表明早期SCI患者较少出现语言功能障碍。
动脉粥样硬化是缺血性脑血管疾病的重要病理、生理基础。颈动脉硬化及狭窄程度越重,狭窄处血流越快,越易导致斑块破裂形成新血栓。本文颈动脉超声结果表明所有DN患者均存在不同程度IMT变化。SCI组颈动脉斑块检出率达63.33%,而NSCI 组检出率为30.00%,其中SCI组颈动脉狭窄程度高于NSCI组,提示颈动脉狭窄粥样硬化斑块形成与DN患者并发SCI密切相关。XIAO等[7]发现,血清RBP4水平与IMT呈正相关。校正心血管疾病危险因素后,ROH/RBP4比值与IMT高度相关,提示游离RBP4可能在动脉粥样硬化发生中起特殊作用[8-9]。RBP4可自由经肾小球滤过,几乎全部被近曲小管重吸收,其是提示DN早期肾损害的重要因子,亦是随访DN病情的重要指标[10-11],尿中RBP4水平与糖尿病患者血糖控制情况和HbA1c水平有关[12]。本研究结果发现,SCI组患者血清RBP4水平明显高于NSCI组,提示血清RBP4可作为DN并发SCI的预测因子,且SCI患者血清RBP4水平与神经功能缺损NIHSS评分和MoCA综合评分均呈正相关。
机体在持续性炎症刺激下,Lp-PLA2促进炎症因子级联反应,使胰岛素受体信号负反馈环路受阻,加速DN的发生、发展。近期研究发现,Lp-PLA2在受损或破裂粥样斑块的坏死中心或周围的巨噬细胞中表达明显增高[13-14]。机体内80%Lp-PLA2与低密度脂蛋白胆固醇(LDL-C)结合,通过水解氧化低密度脂蛋白(ox-LDL)中氧化修饰的磷脂产生溶血磷脂酰胆碱和氧化型游离脂肪酸,后二者具有强致炎性,可通过诱导内皮细胞生成细胞黏附分子和细胞因子,促进单核细胞聚集并移行入血管内膜,并进一步分化为巨噬泡沫细胞,促进动脉粥样硬化形成[15],是缺血性脑血管疾病发病的独立危险因子。
本研究还发现,SCI患者Lp-PLA2和CXCR4表达水平高于NSCI组。推测Lp-PLA2引起DN患者并发SCI的可能机制是:(1)DN患者氧化应激系统被激活,内皮细胞损伤和炎性介质释放增多,Lp-PLA2生成增多活性增强,诱发和(或)加剧炎症反应,促进动脉粥样硬化斑块形成,斑块释放CXCR4增多,斑块易破裂,导致血栓形成和脑血管事件发生;(2)Lp-PLA2生成增多,循环系统中血液黏稠度增高,促进粥样斑块形成和稳定性减弱,诱发心脑血管疾病;(3)溶血卵磷脂破坏血管内皮完整性,导致平滑肌细胞过度增殖并向内膜迁移,促进粥样硬化斑块形成。
综上所述,SCI患者的病情评估和管理很大程度上影响患者预后,DN并发SCI患者尤其是伴有吸烟、高血压、血脂紊乱、颈动脉狭窄的糖尿病患者,无论是否伴有SCI均应定期随访,以减轻家庭和社会负担。本研究发现,RBP4水平与SCI患者神经认知功能损害程度呈正相关,其可作为该病的预测因子,Lp-PLA2/CXCR4通路活化可能是发病机制之一,但该研究尚存在样本量小,未比较RBP4对不同DN分期SCI患者神经认知功能缺损的影响等不足,后续研究将就以上不足继续深入探讨,为临床防治DN并发SCI提供更科学的理论数据。
[1]HASHIMOTO M,TAKASHIMA Y,UCHINO A,et al.Dual task walking reveals cognitive dysfunction in community-dwelling elderly subjects:the Sefuri brain MRI study[J].J Stroke Cerebrovasc Dis,2014,23(7):1770-1775.
[2]JACQUIN A,BINQUET C,ROUAUD O,et al.Post-stroke cognitive impairment:high prevalence and determining factors in a cohort of mild stroke[J].J Alzheimers Dis,2014,40(4):1029-1038.
[3]INGELSSON E,SUNDSTRÖM J,MELHUS H,et al.Circulating retinol-binding protein 4,cardiovascular risk factors and prevalent cardiovascular disease in elderly[J].Atherosclerosis,2009,206(1):239-244.
[4]LIAO Y,CASTELLO A,FISCHER B,et al.The cardiomyocyte RNA-Binding proteome:links to intermediary metabolism and heart disease[J].Cell Rep,2016,16(5):1456-1469.
[5]ZHU Y C,DUFOUIL C,TZOURIO C,et al.Silent brain infarcts:a review of MRI diagnostic criteria[J].Stroke,2011,42(4):1140-1145.
[6]AURIEL E,WESTOVER M B,BIANCHI M T,et al.Estimating total cerebral microinfarct burden from Diffusion-Weighted imaging[J].Stroke,2015,46(8):2129-2135.
[7]XIAO Y,XU A,HUI X Y,et al.Circulating lipocalin-2 and retinol-binding protein 4 are associated with intima-media thickness and subclinical atherosclerosis in patients with type 2 diabetes[J].PLoS One,2013,8(6):e66607.
[8]KADOGLOU N P,LAMBADIARI V,GASTOUNIOTI A,et al.The relationship of novel adipokines,RBP4 and omentin-1,with carotid atherosclerosis severity and vulnerability[J].Atherosclerosis,2014,235(2):606-612.
[9]FENG S Y,ZHU Y,YAN C F,et al.Retinol binding protein 4 correlates with and is an early predictor of carotid atherosclerosis in type 2 diabetes mellitus patients[J].J Biomed Res,2015,29(6):451-455.
[10]TITAN S M,VIEIRA J M,DOMINGUEZ W V,et al.Urinary MCP-1 and RBP:Independent predictors of renal outcome in macroalbuminuric diabetic nephropathy[J].J Diabetes Complications,2012,26(6):546-553.
[11] ZAHRA N,JAVAD M A,ABOALFAZL N,et al.Detection of early stage renal disease by elevation of certain low molecular Weight proteins in urine of diabetes patients[J].Int J Biol Sci Appl,2014,1(1):15-18.
[12]NOVERY E,SUSANAH S,RACHMADI D,et al.The correlation of urine retinol binding protein-4 and serum HbA1c with glomerular filtration rate in type 1(insulin-dependent) diabetic children:a perspective on the duration of diabetes[J].Open J Pediatr,2015,5(2):134-140.
[13]SONG J X,REN J Y,CHEN H.Simvastatin reduces lipoprotein-associated phospholipase A2 in lipopolysaccharide-stimulated human monocyte-derived macrophages through inhibition of the mevalonate-geranylgeranyl pyrophosphate-RhoA-p38 mitogen-activated protein kinase pathway[J].J Cardiovasc Pharmacol,2011,57(2):213-222.
[14]FORTUNATO J,BLHA V,BIS J,et al.Lipoprotein-associated phospholipase A2 mass level is increased in elderly subjects with type 2 diabetes mellitus[J].J Diabetes Res,2014,2014(1):278063.
[15]ZHENG H D,CUI D J,QUAN X J,et al.Lp-PLA2 silencing protects against ox-LDL-induced oxidative stress and cell apoptosis via Akt/mTOR signaling pathway in human THP1 macrophages[J].Biochem Biophys Res Commun,2016,477(4):1017-1023.
