鸭圆环病毒的PCR鉴定及分子特点分析
2018-03-06刘新勃山东畜牧兽医职业学院山东潍坊261061孙嘉吴少鹏鞠孜敬山东农业大学山东泰安唐德宏山东省泰安市动物疫病预防控制中心
刘新勃 (山东畜牧兽医职业学院 山东 潍坊 261061)孙嘉 吴少鹏 鞠孜敬 (山东农业大学 山东 泰安)唐德宏 (山东省泰安市动物疫病预防控制中心)
鸭圆环病毒的PCR鉴定及分子特点分析
刘新勃 (山东畜牧兽医职业学院 山东 潍坊 261061)孙嘉 吴少鹏 鞠孜敬 (山东农业大学 山东 泰安)唐德宏*(山东省泰安市动物疫病预防控制中心)
本研究采用2对针对鸭圆环病毒(DuCV)的特异性引物,对57份病死鸭病料进行PCR检测,探究了DuCV在病死鸭的感染情况;同时,随机选择2个DuCV阳性的样品进行克隆、序列测定。结果显示,病死鸭中DuCV阳性率为7.0%;同源性分析显示,2株DuCV的核苷酸序列与广西参考株(KC460535)的同源性最高,分别为97.7%、96%。基因进化树分析显示,2株DuCV与德国参考株(AY228555)和广西参考株(KC460532、KC460535)属于同一群,为基因1型。本研究对病死鸭DuCV感染情况的初步调查,补充了其流行病学资料,对肉鸭疫病防控具有一定的参考意义。
鸭圆环病毒(DuCV) PCR鉴定 分子特点
圆环病毒是一种目前在哺乳动物和禽类中发现和鉴定的最小的DNA病毒[1],其在鸡、鸭、鸽、鹅、猪等动物体内普遍存在[2-5]。圆环病毒有2个属:圆环病毒属和环病毒属。鸡传染性贫血病毒归于环病毒属,猪圆环病毒、鹦鹉喙羽病、鸭圆环病、鹅圆环病等大部分病毒归于圆环病毒属。目前,对动物的圆环病的研究主要集中在猪圆环病、鸡传染性贫血、鹦鹉喙羽病方面。
鸭圆环病毒最早于2003年由德国学者Hattermann通过PCR和电镜从番鸭的法氏囊组织中发现[6]。2004年Soike等[7]研究发现,感染圆环病毒42日龄的半番鸭临床上表现为羽毛紊乱、生长迟缓、体况消瘦,组织病理学检测显示,鸭法氏囊内淋巴细胞减少、法氏囊出现坏死、组织细胞增多,这与其他动物圆环病毒引起的病毒诱导性淋巴组织损伤类似,由此推测该病毒可能具有免疫抑制作用。傅光华等[8]于2008年成功克隆了鸭圆环病毒的全基因序列。根据鸭圆环病毒的Cap蛋白,可将鸭圆环病毒分为两个基因型:1型DuCV(Duck Circovirus Type 1, DuCV-1)和2型DuCV(Duck Circovirus Type 2, DuCV-2)。DuCV-1基因组大小一般大于1988bp,为1991bp,1995bp大小不等的基因组。两个基因型的DuCV Cap蛋白基因在某些区域差异较大,是现行的DuCV分型方法。
近几年来,对鸭、鹅等水禽仅呈隐形感染的疾病也可导致水禽死亡,一些曾经免疫过禽流感疫苗的鸭也爆发流感,对此,很多研究者认为是水禽感染了某种或某几种能够产生免疫抑制的病原,导致其机体免疫力下降,导致禽流感等病原体的继发感染,其中圆环病毒是最重要的病原之一。鸭圆环病在临床上主要表现为羽毛凌乱、生长发育缓慢、严重病例有时会出现零星死亡。但是由于发病症状不明显,未得到相应重视。尽管DuCV感染不具有明显病征,但有研究证明,DuCV侵害鸭的免疫器官,引起潜在的免疫抑制和生长异常[6, 7],从而使鸭对疫苗的免疫应答能力和其它病原的抵抗力下降,导致免疫失败和继发感染,增加疾病防治的难度,加重病情,对养殖业的经济产生严重影响,因此,对DuCV进行相关研究具有十分重要的意义。
山东地区是我国养殖较集中的地区,山东泰安地区水禽养殖业发展较为迅速,为此,对山东泰安地区DuCV的感染情况进行了初步调查,补充了其流行病学资料,并对毒株的核苷酸分子特点进行分析,确定了山东泰安地区流行毒株的基因型,对肉鸭疫病防控具有一定的参考意义。
1 材料和方法
1.1 样品 样品来自山东地区的病死樱桃谷鸭肝脏、脾脏共计57份,樱桃谷肉种鸭场的死胚48份。
1.2 主要试剂 Tris 平衡酚购自Solarbio,琼脂粉购自Biowest,2×Taq Master Mix(含Taq DNA Polymerase,dNTP,优化的缓冲体系)购自诺唯赞生物科技有限公司,pUMD19-T载体购自Thermo Fisher Scientific,Trans 5α感受态细胞购自Takara,其它试剂均为国产分析纯。
1.3 引物信息 根据已发表的DuCV基因序列及文献报道,选取两对引物,由上海生工生物工程有限公司合成。DuCV1:5’--TTACCGGCGCTTGTACTC--3’;5’--TACTTGTTTTCGGCGGGA--3’,预计扩增目的片段长度为605 bp。DuCV2:5’--CATTACGCCATGGGCATG--3’;5’--CCAATAAACTACTGAGAC--3’,预计扩增目的片段长度为1002 bp。
1.4 病毒基因组DNA提取 采用传统苯酚氯仿法提取DuCV的基因组DNA。
1.5 PCR体系及条件 PCR反应体系为25µl,2×Taq Master Mix 12.5µl,上下游引物各0.5µl,ddH2O 10.5µl。PCR反应程序为95℃预变性5min;94℃变性45s,54℃退火45s,72℃延伸45s,30个循环;72℃延伸10min。

表1 DuCV参考株信息
1.6 PCR产物的鉴定 取7µl PCR扩增产物进行电泳,根据扩增产物的大小进行初步鉴定,琼脂糖凝胶浓度为1%。利用凝胶回收试剂盒回收与目的片段大小相符的特异性片段,将基因片段连接至pUMD19-T载体,连接体系为:T4 DNA Ligase 1µl,pUMD19-T Simple Vector 1µl,10×Ligase Buffer 1µl,回收的PCR产物7µl。16℃过夜连接后转化入Trans 5α感受态细胞。挑取单个转化菌落于LB培养液(Amp+)过夜培养,PCR鉴定阳性克隆送至铂尚生物技术有限公司进行测序。
1.7 DuCV部分核苷酸序列分析 将测得的基因片段序列与DuCV参考株基因组序列比对,进行同源性比较和基因进化树分析。用于核酸序列分析所用的DuCV各毒株名称、GenBank登录号、登录时间、分离地区见表1。
2 结果与分析
2.1 PCR检测结果 提取病毒DNA,PCR扩增后经1%琼脂糖凝胶电泳后,在紫外凝胶成像仪下可观察到DuCV1引物扩增出约605 bp左右的条带(图1A),DuCV2引物条带大小约为1002bp左右(图1B)。PCR检测结果显示,病料中DuCV阳性率为7.0%(4/57),未从鸭死胚中检测出DuCV感染。

图1 DuCV部分PCR检测结果
A:DuCV 1引物,1-5为样品,6为CEF阴性对照,7为DuCV阳性对照,M为DNA Maker 2000。B:DuCV 2引物,1-5为样品,6为CEF空白对照,7为DuCV阳性对照,M为DNA Maker 2000。
2.2 DuCV部分基因序列同源性分析 随机选择PCR阳性样品进行克隆测序。序列分析发现,DuCV-A、DuCV-B的部分基因片段(605bp、607bp)同源性为98.3%。DuCV-A、DuCV-B的部分基因片段均与基因1型参考株(广西,KC460535)的同源性最高,分别为97.7%、96%,与其它参考株的同源性分别在87.3%~97.7%、85.6%~95.9%之间(图2)。由此可见,该试验检测到的两株DuCV与GeneBank中已发表的国内外其它参考株的同源性较高,可确诊为鸭圆环病毒。
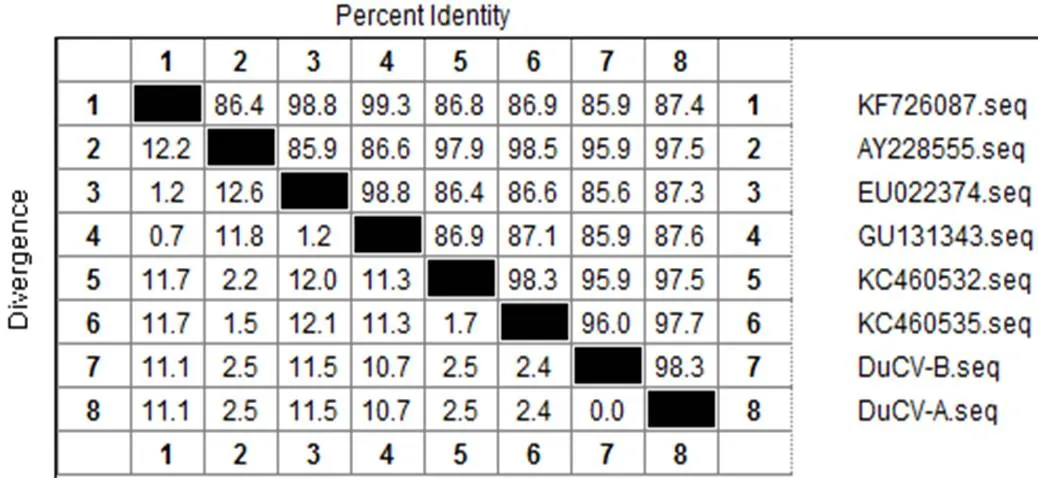
图2 DuCV部分基因片段同源性分析图
2.3 DuCV部分基因片段系统基因进化树 基因进化树显示,DuCV-A与DuCV-B位于基因进化树同一分支上,亲缘关系极近。两株DuCV与基因1型参考株(德国,AY22 8555;广西,KC460532、KC460535)属于同一群(图3)。
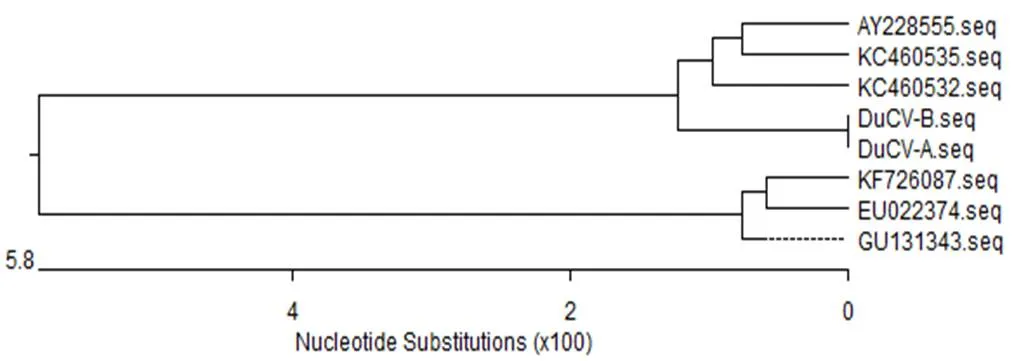
图3 DuCV系统进化树
3 讨论
(1)DuCV最早在2003年由Hattermann从患病番鸭的法氏囊中检测分离到,并进行了全基因组测序[6],随后在福建、辽宁、中国台湾、韩国、美国、匈牙利等地区也发现或报道该病毒[2, 8~10]。(2)DuCV感染主要引起羽毛发育不良,但是某些细菌、真菌以及多瘤病毒等其它病原感染引起的毛囊炎,代谢失衡、内分泌病以及一些营养性疾病均能造成禽类羽毛发育不良,同DuCV感染的临床表现相似。另外,由于DuCV感染鸭后很容易引起继发感染,因此,在对DuCV进行诊断时就要采用多种方法进行鉴别诊断,也要考虑其它传染性病原共感染的可能性。(3)现有的病毒增殖体系难以增殖DuCV,目前不能进行病毒的分离,因此,DuCV的研究主要局限在检测和基因组序列分析方面,各种蛋白分子生物学研究也难以找到合适的细胞系进行。PCR在诊断DuCV方面的特异性和灵敏性已得到验证[7]。有研究报道,基于SYBR染料的荧光定量方法可用于法氏囊中DuCV的检测[8]。除常规PCR和荧光定量PCR外,多重PCR、套式PCR、等温环介导PCR在DuCV的检测中也有相关应用。另外,通过制备探针,利用ISH对福尔马林固定石蜡包埋的样本进行病理组织学检测,间接ELISA和斑点杂交均是有效的检测方法[2]。(4)本研究对2017年自泰安地区采集的病死鸭病料进行DuCV的分离鉴定,发现DuCV在泰安地区鸭群有流行,但是大群健康鸭带毒不发病。同时,也根据剖检症状检测了其它常见具有传染性的病原体,包括禽腺病毒(Fowl adenovirus,FAdV)、H5、H7、H9亚型禽流感病毒(Avian influenza virus, AIV)等病原进行检测,其它病原有阳性结果,但未检测到DuCV与其它病毒同时感染的情况。另外,我们对PCR扩增的片段测序后进行序列比对和同源性分析,根据现行的DuCV分型方法分型发现,检测到的DuCV主要为基因1型,确定了用于PCR扩增的引物的准确性和特异性。(5)李志国和刘少宁的检测结果表明,DuCV在鸭中的感染存在不同的组织嗜性,雏鸭肝脏中的检出率,胸腺和法氏囊的检出率也较高,但脾脏检出率存在争议,可能与脾脏的发育程度有关[2,12]。Wan 等在2011年建立了检测DuCV的荧光定量PCR方法,在进行种蛋和死胚中的DuCV检测时并未检测到DuCV[13],但李志国在某种鸭厂跟踪检测的过程中,在种蛋、死胚、和刚出壳的雏鸡中均检测到DuCV。(6)DuCV常以隐性感染的方式存在,养殖过程中通常不会对DuCV进行检测,这为DuCV的水平传播创造了条件,DuCV会侵害鸭的免疫系统,导致鸭群更容易发生其它病原导致的疫情,造成严重的经济损失。在对病死鸭进行DuCV检测的同时,也进行了沙门氏菌的分离工作,结合临床剖检,发现感染DuCV的鸭更易发生细菌性继发感染,引起病情的加重。随着山东地区鸭饲养业的不断发展,应足够重视DuCV的感染,避免DuCV感染加重疫情,减少损失,而针对DuCV的疫苗研制工作也急需进行。
[1] Todd, D. , M. S. McNulty, B. M. Adair, G. M. Allan. Animal circoviruses[J]. Advances in virus Research. 2001, 57:1-70.
[2] 刘少宁, 杨金宝, 张兴晓等. 我国自然发病鸭圆环病毒的流行病学调查[J]. 中国兽医学报, 2009, 29(11): 1402-1405.
[3] Todd, D. L. , H. Westen, D. Soike, J. A. Smyth. Genme sequence determinations and analyses of novel circoviruses from goose and pigeon[J]. Virology. 2001, 286:354-362.
[4] Smyth, J. A. , D. Soike, D. Moffett, J. H. Weston, D. Todd. Circovirus infected geese studied by in situhybrididization. Avian Pathology. 2005, 34: 227- 232.
[5] 施德兰, 周辉, 杨锁柱. 规模化猪场猪圆环病毒2型感染的血清流行病学调查[J]. 中国畜牧兽医, 2009, 36 (10): 156-158.
[6] Hattermann, K., C. Schmitt, D. Soike, A. Mankertz. Cloning and sequencing of duck circovirus (DuCV)[J]. Archives of Virology. 2003, 148: 2471-2480.
[7] Soike D, Albrcehtk, Hattermann K, eta1. Novel circovirus in Mulard ducks with developmental and feathering disorders[J]. VetRes, 2004, 154: 792-793.
[8] 傅光华, 程龙飞, 施少华等. 鸭圆环病毒全基因组克隆与序列分析[J]. 病毒学报, 2008, 24(2): 138- 143.
[9] Fringuelli E, Scoott A N, Beckett A, et al. Diagnosis of duck circovirus infections by conventional and real time polymer rase chain reaction tests[J]. Avian Pathol. 2005, 34(6): 495-500.
[10] Banda A, Galloway-Haskins R I, Sandhu T S, et al. Genetic analysis of a duck circovirus detected in commercial pekin ducks in New York[J]. Avian Disease. 2007, 51: 90–95.
[11] Chen C L, Wang P X, Lee M S, et al. Development of a polymerase chain reaction procedure for detection and differentiation of duck and goose circovirus[J]. Avian Disease. 2006, 50(1): 92-95.
[12] 李志国. 检测两型鸭圆环病毒双重PCR方法的建立和分子流行病学调查[D]. 泰安: 山东农业大学, 2015: 43.
[13] Wang D, Xie X, Zhang D, et al. Detection of duck circovirus in China: Aproposal on genotype classification[J]. Vet Microbiol. 2011, 147(3-4): 410-415.
(2017–09–01)
S852.65+9.2
A
1007-1733(2018)02-0005-03
