进水pH值对CASS工艺处理低浓度生活污水中氧化亚氮排放的影响
2018-03-06毛念佳嵇鸿民任洪强李颖瑜
毛念佳,嵇鸿民,许 柯,任洪强,李颖瑜
(南京大学环境学院,污染控制与资源化研究国家重点实验室,江苏南京 210046)
氧化亚氮(N2O)是大气中含量仅次于CO2和CH4的温室气体,其在污水生物处理过程中的排放日益受到关注[1]。美国环保署报告称,污水处理过程中释放的N2O占总释放量的3%[2]。IPCC报告中指出,污水处理厂污水处理过程中大约0.05%~25%的氮被转化成N2O形式释放,约占全球N2O总排放量的1.2%[3]。因此,深入了解污水处理过程中N2O的产生机理和减量控制具有重要意义。
周期循环活性污泥法(cyclic activated sludge system,CASS)是基于SBR工艺的一种新型污水处理技术,因其系统组成简单、操作运行灵活多变、基建费用低和可靠性好等特点,在国内外得到了广泛的应用[4-5],当前关于污水生物脱氮过程中N2O释放特征的研究主要以SBR、AAO、氧化沟等工艺为主[6-7],而对于CASS工艺脱氮过程中N2O的排放及机理研究较少。
pH作为CASS工艺运行中的实时控制参数,对微生物的代谢活动具有重要影响,同时对生物脱氮过程中某些物质(如游离氨、HNO2等)的存在及浓度产生影响,是控制生物脱氮过程正常进行和影响N2O产生量的重要条件。本研究考察了进水pH对CASS工艺过程中N2O排放的影响,并从微生物群落结构、功能基因层面分析N2O产生机理,旨在为实际工艺运行中N2O的减排提供指导。
1 材料与方法
1.1 试验装置与运行条件
试验所用CASS反应器由有机玻璃制成,如图1所示。反应器长43 cm、宽11 cm、高15 cm,水面超高5 cm,有效容积为4.66 L。生物选择区、缺氧区和主反应区容积分别为0.25、0.33 L和4.08 L。模拟污水经由蠕动泵进入反应器,通过电磁阀控制出水。

图1 CASS反应器示意图Fig.1 Schematic Diagram of CASS Reactor
本试验采用间歇进水,一个周期包括了进水、曝气、沉淀、排水这四个阶段,运行时间分别为0.8、2、1、1 h,共4.8 h。装置由电子计时器控制开关,可实现周期式自动连续运行。每周期进水1.86 L,出水后剩余体积2.80 L,排水比40%。接种污泥取自南京江心洲污水处理厂,污泥浓度在3 000 mg/L左右;反应器末端设有污泥回流管,污泥经回流泵进入生物选择区,污泥回流率为20%。
1.2 模拟污水
本试验采用模拟污水,组分为:一水合葡萄糖,51 mg/L;蛋白胨,100 mg/L;氯化铵,80 mg/L;磷酸二氢钾,13 mg/L;七水合硫酸镁,25 mg/L;二水合氯化钙,11 mg/L;微量元素浓缩液,0.6 mL /L。微量元素浓缩液组分为:FeCl3·6H2O,1.50 mg/L;KI,0.18 mg/L;ZnSO4· 7H2O, 0.12 mg/L;H3BO3,0.15 mg/L;MnCl2· 4H2O,0.12 mg/L;CoCl2·6H2O,0.15 mg/L;CuSO4· 5H2O, 0.03 mg/L;Na2MoO4·2H2O,0.06 mg/L;EDTA,10 mg/L。主要营养物质浓度为:COD150mg/L,NH+4_N 21 mg/L,
TN 36 mg/L,TP 3 mg/L,五个反应器进水 pH 值分别调节为 6.6、7.2、7.8、8.4、9.0。
1.3 分析方法
1.4 实时荧光定量PCR分析
试验采用SYBR Green染料法,对污泥中反硝化功能基因nirS(编码的血红素cd1型亚硝酸还原酶)、nirK(编码铜型亚硝酸还原酶)、nosZ(N2O还原酶催化中心)进行定量分析[9]。以大肠杆菌感受态细胞制备质粒标准品,建立标准曲线(R2>0.999),扩增程序实时荧光定量 PCR仪 AB7500(Life Technologies,美国)进行,热循环过程为:95℃ 3 min,40个循环的95℃ 20 s,退火 30 s,72℃延伸 40 s。反应体 系为 25 μL,含 12.5 μL 2 ×SYBR®Green PCR Master Mix(Vazyme,中国),2 μL模板 DNA (20 ng/μL),正反向引物各 0.5 μL(20 μmol/L),9.5 μL 无菌超纯水,每个样品做三个平行样。以标准品拷贝数的对数为横坐标,Ct值为纵坐标,做标准曲线,对待测功能基因或细菌定量,计算其拷贝数,如表1所示。

表1 目标基因的引物序列及退火温度Tab.1 Primer Sequences for Target Genes and Corresponding Annealing Temperature
1.5 16S rRNA高通量测序
以FastDNA Spin Kit for soil试剂盒提取污泥DNA,稀释至20 ng/μL后用于16S rRNA基因V1-V2区域PCR扩增,每个样品做四个平行样。PCR扩增 中 用 到 的 正 向 引 物 序 列 (5′-3′)为AGAGTTTGATYMTGGCTCAG,反向引物序列(5′-3′)为 TGCTGCCTCCCGTAGGAGTCR。扩增体系为50 μL,包含 2 × EasyTaq©PCR SuperMix 25 μL,正向和 反 向 引 物 (10 μmol/L)各 1 μL,DNA 模 板2 μL,超纯水21 μL。PCR 扩增过程为:首先 98℃预热5 min,再经过扩增程序,其中98℃变性30 s,50℃退火30 s,72℃延伸40 s,此扩增程序循环20次,最终72℃延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测。然后将平行样合并,用E.Z.N.A.TM Cycle-Pure试剂盒(Omega Bio-tek Inc.,USA)对扩增产物纯化,再用超微量分光光度仪测定纯化样品浓度和纯度。
纯化产物送至江苏中宜金大分析检测公司进行Miseq高通量测序,所得的结果通过 Sickle软件,Mothur软件对样品数据进行降噪处理,获得序列结果,进行多样本深度归一化处理后,通过R语言程序(R version 3.1.1)绘制热图。
2 结果与讨论
2.1 不同进水pH条件下氮的转化过程
本研究考察了稳定运行20 d(2倍污泥龄)后,各反应器在不同进水pH下一周期内浓度变化,结果如图2所示。由图 2可知,进水 pH 值为 6.6、7.2、7.8、8.4、9.0时去除率分别为39.5%、65.1%、82.4%、98.0%、99.7%,TN去除率分别为 37.5%、37.1%、40.3%、42.6%、45.7%。随着进水pH的增加,和TN去除率都上升,pH对去除效果影响更大。当进水pH值高于8.4时,N可基本完全去除。为保证较好的脱氮效果,CASS工艺进水pH值最好维持在7.8以上。
由于硝化反应的进行消耗碱度,pH的提高会促进好氧段硝化反应的进行。进水pH值为9.0时,曝气90 min后几乎所有被完全氧化。当进水pH值从6.6增加到9.0时,更多的被硝化菌氧化为最大浓度从9.66 mg/L 增加到 19.70 mg/L。浓度的增多也提高了活性污泥沉淀时缺氧反硝化速率。因此,TN去除率也随进水pH的提高而有所增加。
2.2 不同进水pH条件下N2O的释放特征
本研究考察了不同进水pH下CASS反应器曝气阶段N2O排放速率及一周期溶解性N2O浓度变化,结果如图3所示。进水pH值为6.6~8.4时,N2O排放速率在曝气开始时出现峰值(0.03~0.09 mg N/min),随后逐渐降低,并保持在较低水平(约0.01 mg N/min)。而当进水pH值增加到9.0时,曝气开始时N2O排放速率仅为0.01 mg N/min,在曝气过程中稍有上升,曝气30 min后N2O排放速率(0.02 mg N/min)高于其他反应器。进水pH值为9.0的反应器溶解性N2O浓度在整个周期都低于0.1 mg/L。
不同进水pH下CASS反应器N2O的释放量、转化率及在沉淀出水阶段的产生量如图4所示。随着进水pH值从6.6提高到9.0,每周期N2O排放量从0.32 mg N/L增加到0.52 mg N/L。不同进水pH下N2O转化率差别较小,为6.02%~7.92%,进水pH值为6.6时N2O转化率最低,而进水pH值为9.0时最高。沉淀出水阶段的N2O产生量在pH值为6.6~7.8时随pH的提高从1.28 mg N增加到7.02 mg N,但随着进水pH的继续增加,N2O产生量迅速减少,在进水pH值为9.0时完全没有N2O产生。
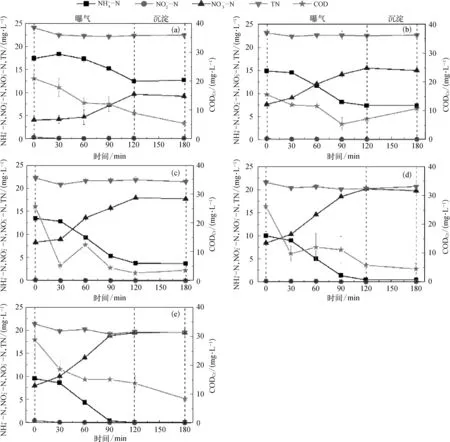
图2 不同进水pH值下反应器中污染物浓度变化 (a)6.6;(b)7.2;(c)7.8;(d)8.4;(e)9.0Fig.2 Variation of Pollutant Concentration under Different Influent pH Value(a)6.6;(b)7.2;(c)7.8;(d)8.4;(e)9.0

图3 不同进水pH下曝气阶段N2O排放速率及一周期溶解性N2O浓度变化Fig.3 N2O Emission Rate during Aeration Period and Dissolved N2O Concentration in a Typical Cycle under Different Influent pH Value

图4 不同进水pH下N2O排放特征Fig.4 N2O Emission Characteristics under Different Influent pH Value
当前关于污水处理过程进水pH与N2O排放特征关系的研究不多。Kampschreur等[12]认为与其他影响因素相比,pH的影响较小。然而,本试验中pH对CASS工艺脱氮过程中N2O释放特征的影响不可忽视。pH最高的反应器在硝化过程N2O排放速率高于其他反应器。Law等[13]的研究表明,在富集氨氧化细菌的活性污泥反应器中,随着pH值从6.0增加到8.0,硝化过程N2O产生量逐渐增加,原因与较高的氨氧化速率相关。Hynes等[14]研究Nitrosomonas europeae硝化过程中N2O的产生规律时发现,与pH较低的条件相比,在pH值为8.5的有氧条件下,氨氧化细菌达到最大的NO及N2O产生速率,此时N2O产生的最主要来源是NOH的分解作用。刘越等[15]对短程硝化过程的研究表明,低DO水平下氨氧化速率的提高会引起N2O产生速率的增加,N2O的产生以羟胺氧化途径为主。本试验中NO-2浓度极低,较高的氨氧化速率促进氨氧化菌反硝化途径产生N2O的可能性较小,因此进水pH的提高促进羟胺氧化途径产生N2O。
2.3 反硝化功能基因丰度分析
不同进水pH条件下反硝化功能基因丰度如图5所示。由图5可知,进水pH值为8.4时nosZ和nirS基因丰度最高,分别为 3.54×108copies/mL和3.33×108copies/mL。进水 pH值为9.0的反应器nirK 基因丰度(2.12×107copies/mL)远高于其他反应器(4.91×106~ 6.97×106copies/mL),而 nirS 基因丰度(1.55×108copies/mL)也较高,仅低于进水pH值为8.4的反应器。反硝化菌在高pH条件下数量增加,可能是这两个反应器的TN去除率高于低pH反应器的原因之一。然而,进水pH值为9.0的反应器nosZ基因丰度并非最高,但在沉淀出水阶段却没有N2O产生,可能的原因是pH值为9.0的条件没有促进含有nosZ基因的反硝化菌增长,但增强了N2O还原酶的活性。Shu等[19]研究发现,在进水pH值为4.3~7.8的污水处理厂中,nosZ基因丰度与pH呈负相关关系,与本试验中进水pH值为6.6时nosZ基因丰度高于进水pH值为7.2和7.8的结果接近。

图5 不同进水pH下反硝化功能基因丰度Fig.5 Abundances of Denitrification Functional Genes under Different Influent pH Value
2.4 微生物群落结构分析
本试验利用高通量测序Miseq分析了微生物群落结构,结果如图6所示。pH对变形菌丰度影响较小,不同进水pH条件下的反应器变形菌含量分别为19.23%~23.93%,如图6(a)所示。有研究认为在亚硝化系统中N2O的产生主要来自为Nitrosomonas的反硝化作用[20]。不同进水pH条件下,CASS工艺活性污泥中氨氧化菌(ammoniaoxidizing bacteria,AOB)主要是 Nitrosomonadales,而亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)主要是Nitrospira。随着进水pH的增加,氨氧化菌含量在0.43%~0.63%波动,而亚硝酸盐氧化菌含量则从2.58%增加至3.42%。Shu等[21]采用荧光定量PCR测定6个污水处理厂活性污泥硝酸盐氧化菌(Nitrobacter和Nitrospira)的16S rRNA丰度时,发现硝酸盐氧化菌含量也与pH呈正相关关系,与进水COD浓度呈负相关关系,pH对硝酸盐氧化菌细胞增殖起重要作用。
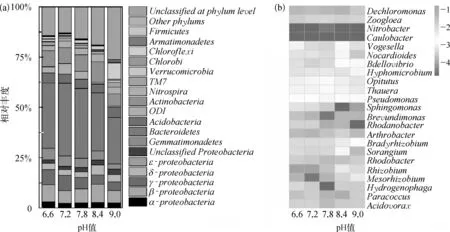
图6 不同进水pH条件下微生物群落结构(a)门水平及变形菌纲分布;(b)反硝化菌相对丰度(>0.1%)Fig.6 Microbial Community Structure under Different Influent pH Value (a)Distribution in Phylum and Proteobacteria in Class Level;(b)Relative Abundances of Potential Denitrifying Bacteria
不同pH条件下的CASS反应器中反硝化菌相对丰度如图6(b)所示。试验活性污泥样品中共检测到59个反硝化菌属,图6(b)列举了其中相对丰度最高的23个反硝化菌属(相对丰度 >0.1%)。由图6(b)可知,进水 pH 值为 6.6、7.2、7.8、8.4、9.0 的反应器总反硝化菌含量分别为 5.77%、4.16%、4.76%、6.59%、3.89%。优势反硝化菌为 Dechloromonas(1.36%~4.25%)和 Zoogloea(0.75%~1.26%)。不同pH的反应器中Dechloromonas丰度变化较大。在进水pH值为7.2~8.4时,反硝化菌丰度随pH的增加而增加。进水pH值为9.0的反应器反硝化菌丰度最低,因此其在沉淀出水阶段没有N2O累积的原因并不是较多完全反硝化的微生物,而是N2O还原酶在高pH条件下活性更高,反硝化过程N2O还原速率高于产生速率。由于本试验的反应器几乎没有亚硝酸盐产生,即使在进水pH值为6.6的反应器中对应的游离亚硝酸浓度也极低,反硝化菌的生长繁殖没有受到较大的抑制,pH对反硝化菌含量的影响较小。
3 结论
(2)进水pH值为6.6~8.4时,N2O排放在曝气开始出现峰值,随后逐渐降低,并保持较低水平(约0.01 mg N/min);而进水pH值增加到9.0,曝气开始时N2O排放速率较小,而后在曝气过程中稍有提升。随着进水pH值从6.6提高到9.0,每周期N2O排放量从0.32 mg N/L增加到0.52 mg N/L。
(3)进水pH值为8.4的反应器中nosZ和nirS基因丰度最高,而进水pH值为9.0的反应器nirK基因丰度最高。高pH条件下反硝化菌的数量增加,提高了TN去除率。
(4)不同进水pH下,污泥中氨氧化菌(AOB)主要是Nitrosomonadales,亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)主要是Nitrospira。随着进水pH的增加,氨氧化菌含量变化不大,而亚硝酸盐氧化菌含量则从2.58%增加至3.42%。反硝化优势菌种为Dechloromonas(1.36%~4.25%)和 Zoogloea(0.75%~1.26%),Dechloromonas丰度随进水pH变化较大。
[1]张静蓉,王淑莹,尚会来,等.污水短程硝化反硝化和同步硝化反硝化生物脱氮中N2O释放量及控制策略[J].环境科学,2009,30(12):3624-3629.
[2]Agency U S E P.Global anthropogenic non-CO2greenhouse gas emissions:1990 to 2020[R].Washington DC:US-EPA,2006.
[3]IPCC.Climate change 2007:The physical science basis[R].Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change,2007.
[4]李刚.循环式活性污泥法在城市污水处理中的应用与研究[J].科技促进发展,2012(7):119-121.
[5]君珊.基于CASS工艺的城市污水处理研究综述[J].北方环境,2012,28(6):56-60.
[6]Hu,Z,Zhang J,Xie H,et al.Identifying sources of nitrous oxide emission in anoxic/aerobic sequencing batch reactors(A/O SBRs)acclimated in different aeration rates [J].Enzyme and Microbial Technology,2011.49(2):237-245.
[7]Rodriguez-Caballero A,Aymerich I,Marques R,et al.Minimizing N2O emissions and carbon footprint on a full-scale activated sludge sequencing batch reactor[J].Water Research,2015,49(24):1-10.
[8]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[9]郭丽芸,时飞,杨柳燕.反硝化菌功能基因及其分子生态学研究进展[J].微生物学通报,2011,38(4):583-590.
[10]Zhou Z F,Zheng Y M,Shen J P,et al.Response of denitrification genes nirS,nirK,and nosZ to irrigation water quality in a Chinese agricultural soil[J]. Environmental Science and Pollution Research International,2011,18(9):1644-1652.
[11]Henry S,Bru D,Stres B,et al.Quantitative detection of the nosZ gene,encoding nitrous oxide reductase,and comparison of the abundances of 16S rRNA,narG,nirK,and nosZ genes in soils[J].Applied and Environmental Microbiology,2006,72(8):5181-5189.
[12]Kampschreur M J,Temmink H,Kleerebezem R,et al.Nitrous oxide emission during wastewater treatment[J].Water Research,2009,43(17):4093-4103.
[13]Law Y,Lant P,Yuan Z.The effect of pH on N2O production under aerobic conditions in a partial nitritation system [J].Water Research,2011,45(18):5934-5944.
[14]Hynes R K, KnowlesR. Production ofnitrousoxide by nitrosomonas europaea:Effects of acetylene,pH,and oxygen [J].Canadian Journal of Microbiology,1984,30(11):1397-1404.
[15]刘越,彭轶,李鹏章,等.短程硝化过程中 NO-2对 NH+4及NH2OH氧化产生 N2O 的影响[J].化工学报,2015,66(3):1133-1141.
[16]李鹏章,王淑莹,彭永臻,等.COD/N与pH值对短程硝化反硝化过程中 N2O产生的影响[J].中国环境科学,2014,34(8):2003-2009.
[17]Zhou Y ,P M,Zeng R J,et al.Free nitrous acid inhibition on nitrous oxidereduction bya denitrifying-enhanced biological phosphorus removal sludge [J]. Environmental Science &Technology,2008,42(22):8260-8265.
[18]Richardson D,Felgate H,Watmough N,et al.Mitigating release of the potent greenhouse gas N2O from the nitrogen cycle-could enzymic regulation hold the key?[J].Trends Biotechnol,2009,27(7):388-397.
[19]Shu D,He Y,Yue H,et al.Metagenomic and quantitative insights into microbial communities and functional genes of nitrogen and iron cycling in twelve wastewater treatment systems [J].Chemical Engineering Journal,2016,21(8):21-30.
[20]Kong Q,Liang S,Zhang J,et al.N2O emission in a partial nitrification system:Dynamic emission characteristics and the ammonium-oxidizing bacteria community [J]. Bioresource Technology,2013,23(1):400-406.
[21]Shu D,He Y,Yue H,et al.Microbial structures and community functions of anaerobic sludge in six full-scale wastewater treatment plants as revealed by 454 high-throughput pyrosequencing [J].Bioresource Technology,2015,25(3):163-172.
