单过硫酸氢钾复合粉降解水中甲氧苄啶的效能与机理
2018-03-06古振川高乃云陈菊香
古振川,高乃云,陈菊香,安 娜
(1.同济大学环境科学与工程学院,污染控制与资源化研究国家重点试验室,上海 200092;2.新疆大学建筑工程学院,新疆乌鲁木齐 830046)
甲氧苄啶(trimethoprim,TMP)作为磺胺增效剂普遍应用于医药领域。TMP摄入人体后代谢大约22.5%,而残留的TMP和代谢产物通过排泄进入水环境中[1]。常规水处理工艺并不能有效地去除TMP[2-3]。有研究发现TMP能抑制淡水微藻的生长,对水生生物具有生态毒理作用[4]。所以开发低成本的环保处理工艺以消除TMP的相关风险至关重要。
氯消毒是目前水厂中最常见的消毒处理技术。有研究表明,氯消毒过程中产生的副产物会对人类健康和生态安全造成威胁,这使得氯消毒的安全性受到了广泛关注[5]。近年来人们先后研究了臭氧和紫外线等替代消毒技术[6],然而这些消毒技术都存在局限性,例如不具备持久的杀菌能力、需要额外的能耗以及对水中难降解有机物去除能力不强等。因此,研究更能保障饮用水安全的新型消毒剂成为了近些年的研究热点。
基于硫酸根自由基的高级氧化技术自提出以来就受到了广泛的关注。本研究中所使用的氧化剂(单过硫酸氢钾复合粉,Oxone)就是应用之一。单过硫酸氢钾复合粉是一种粉末状无机过氧化物,其中的主要成分是单过硫酸氢钾(peroxymonosulfate,PMS),是Oxone活性成分和氧化势能的来源;氯化钠作为消毒助剂,另外辅以其他的络合剂、表面活性剂和稳定剂[7]。近年来,单过硫酸氢钾复合粉受到了广泛关注,并且已经作为消毒剂应用于我国10多个省市、近300家水厂。
本文首次对新型消毒剂Oxone去除难降解有机物的效能和机理进行研究,并对降解反应中的主要活性物种进行鉴定,从而分析Oxone的作用机理,考察了Oxone浓度、初始pH、温度对TMP降解效果的影响,对降解反应过程中的消毒副产物进行分析测定。
1 材料与方法
1.1 试验材料
甲氧苄啶(优级纯,99%),购自阿拉丁试剂(Aladdin)有限公司;单过硫酸氢钾复合粉(Oxone),购自成都润兴消毒药业有限公司;单过氧硫酸氢钾制剂(PMS),购自阿拉丁试剂(Aladdin)有限公司;乙腈(色谱纯级),购自上海麦克林生化科技有限公司;乙醇(EtOH),叔丁醇(TBA),硫代硫酸钠(Na2S2O3),氯化钠(NaCl),磷酸二氢钾(KH2PO4)等其他试剂均为分析纯级,购自国药集团化学试剂有限公司;试验用水为 Milli-Q纯水(TOC<0.2 mg/L,电阻率>18.2 MΩ)。
1.2 试验方法与装置
试验前配制质量浓度为50 mg/L的TMP储备液,使用时根据需要进行稀释。使用0.01 mmol/L的NaOH和H2SO4调节溶液初始pH。在反应前30 min制备100 mg/L的Oxone溶液。反应开始时同时将平行样按比例加入Oxone溶液,分别在0、5、10、15、20、25、30 min 时取样。所有反应都在100 mL棕色试剂瓶内进行,并且使用水浴摇床(SHZ-B型)控制所需试验温度,并通过快速振荡确保溶液处于完全混合状态。在不同的反应时间取样1 mL至液相小瓶中,小瓶预先加有20 μL的硫代硫酸钠溶液确保反应的淬灭终止,之后利用高效液相色谱仪对样品中的TMP浓度进行测定。
1.3 分析方法
TMP浓度的检测采用高效液相色谱仪(岛津LC-2010AHT),配备UV/Vis紫外可见光检测器,色谱柱为 C18柱(250 nm×4.6 mm×5 μm,岛津)。TMP的检测波长为 235 nm,流动相为乙腈和0.02 mol/L的磷酸二氢钾溶液,体积比为20∶80,流速为1 mL/min,柱温为35℃,进样量为20 μL。
消毒副产物的分析根据USEPA524.2方法,利用吹扫捕集-气相色谱/质谱法(GC/MS)进行分析。配备吹扫捕集样品浓缩仪(美国OI-Eclipse4660)和气相色谱/质谱联用仪(岛津QP2010),配备电子轰击离子源(EI)和4551-A自动进样器,色谱柱为Rtx-5MS(30 m×0.25 nm×0.25 μm,岛津)。吹扫捕集条件:吹扫气流量为31 mL/min;吹扫温度为100℃;预热时间为5.0 min;吹扫时间为11 min;烘焙温度为240℃;烘焙时间为20 min。气相色谱条件:进样口温度为110℃,分流进样,分流比为23∶1;载气为高纯氦气(99.999%),恒压模式;流速为1.29 mL/min;升温程序为初始温度35℃,以7℃/min的升温速率升至72℃,保持1 min,以40℃/min的升温速率上升至200℃,保持1 min。质谱条件:电子轰击离子源(EI);离子源温度为200℃;接口温度为250℃;Scan扫描模式,扫描范围为45~270 m/z。
溶液pH通过梅特勒-托利多(Mettler Toledo)pH计测定。
2 结果与分析
2.1 Oxone对TMP的降解效果
Oxone对TMP降解效果的试验条件:TMP的初 始 浓 度 为 17、34、51 mol/L;氧 化 剂 投 加 量(Oxone投加 100 mg/L,PMS 投加 100 mg/L);试验温度为25℃;初始pH值为6.3。去除率计算如式(1)。
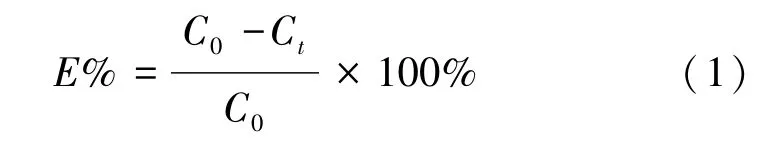
其中:C0—TMP 初始浓度,μmol/L;
Ct—t时刻 TMP 浓度,μmol/L。
E值越高,表示此工艺的去除效率越高。
TMP的去除率如图1所示。由图1可知,采用单独PMS,仅有极少部分的TMP被降解,30 min内去除率仅为2.5%。单独使用Oxone时出现较好的降解效果,30 min内TMP的去除率为99.5%。试验结果表明,PMS在不激活的条件下,几乎没有氧化能力,无法降解有机污染物。而Oxone的主要成分是PMS[7],Oxone溶于水后,其中具有活化作用的成分与PMS通过一系列反应,生成了具有氧化能力的活性物种,使得TMP被快速降解。

图1 Oxone和PMS对TMP的去除率Fig.1 TMP Removal Rate by Oxone and PMS
2.2 活性物种的鉴定和反应动力学
为了探究Oxone降解TMP过程中的活性物种,本研究使用乙醇(EtOH)和叔丁醇(TBA)作为自由基清除剂,对体系中的·SO-4和·OH进行鉴定。有研究[8]报道乙醇与·SO-4和·OH的二级反应速率常数为(1.2~2.8)×109L /(mol·s)和(1.6~7.7)×107L /(mol·s)。叔丁醇与·SO-4和·OH的二级反应速率常数为(4.0~9.1)×105L /(mol·s)和(3.8~7.6)×108L /(mol·s)。乙醇和叔丁醇可以选择性淬灭·SO-4和·OH,从而抑制降解反应。系统中投加EtOH和TBA的浓度为162.68 mmol/L,是Oxone投加量的1 000倍,确保了自由基反应淬灭。
试验结果如图2所示,TMP去除率分别为95.22%和94.58%;在不投加自由基清除剂的条件下,TMP去除率为96.33%。无论EtOH或者TBA对TMP的降解均无明显的抑制作用,表明无激活条件下Oxone溶于水后不生成·SO-4和·OH。故可间接证明该条件下Oxone降解TMP的活性物种并非是·SO-4和·OH。
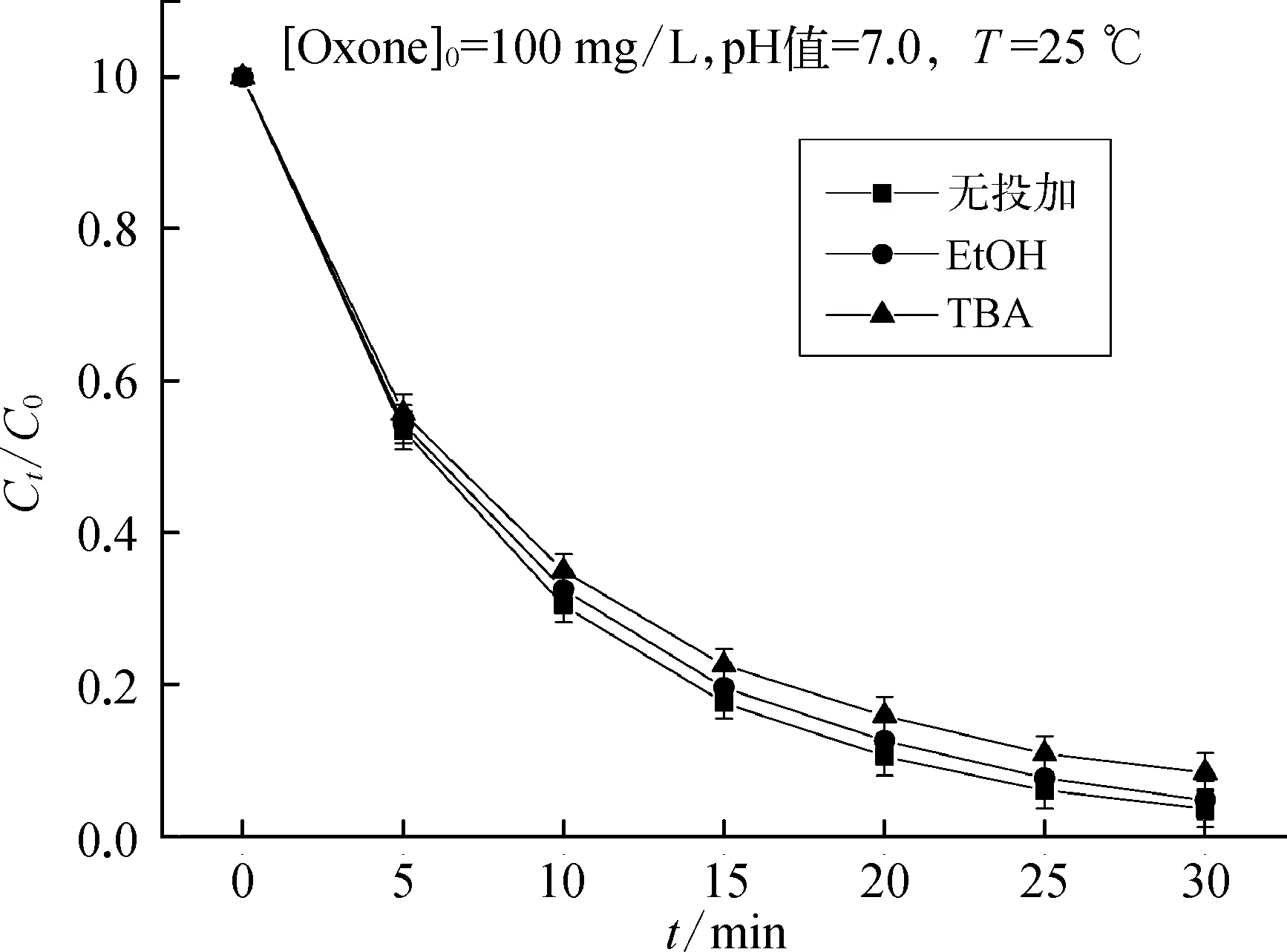
图2 乙醇和叔丁醇对TMP去除率的影响Fig.2 Effect of EtOH and TBA on TMP Removal Rate
Oxone的主要成分是单过硫酸氢钾(PMS),另外含有5%的NaCl作为消毒助剂[7]。故推测 Cl-在常温条件下可以活化PMS产生具有氧化性的活性物质,从而氧化降解TMP。设计验证试验中,PMS投加量为 1.627 mmol/L,TMP 初始浓度为17 μmol/L。如图 3 所示,体系中含有 Cl-浓度为1、3、5、7 mmol/L,60 min 时 TMP 去除率相应为18.90%、51.39%、84.12%、99.21%。结果表明,Cl-在常温条件下可以活化PMS氧化降解TMP,且在其他条件一定时,Cl-浓度越高,TMP的去除率越高。徐蕾等[9]也有类似的研究发现,PMS与Cl-可以自发地发生反应生成活性氯从而有效降解2,4,6-三氯苯酚。
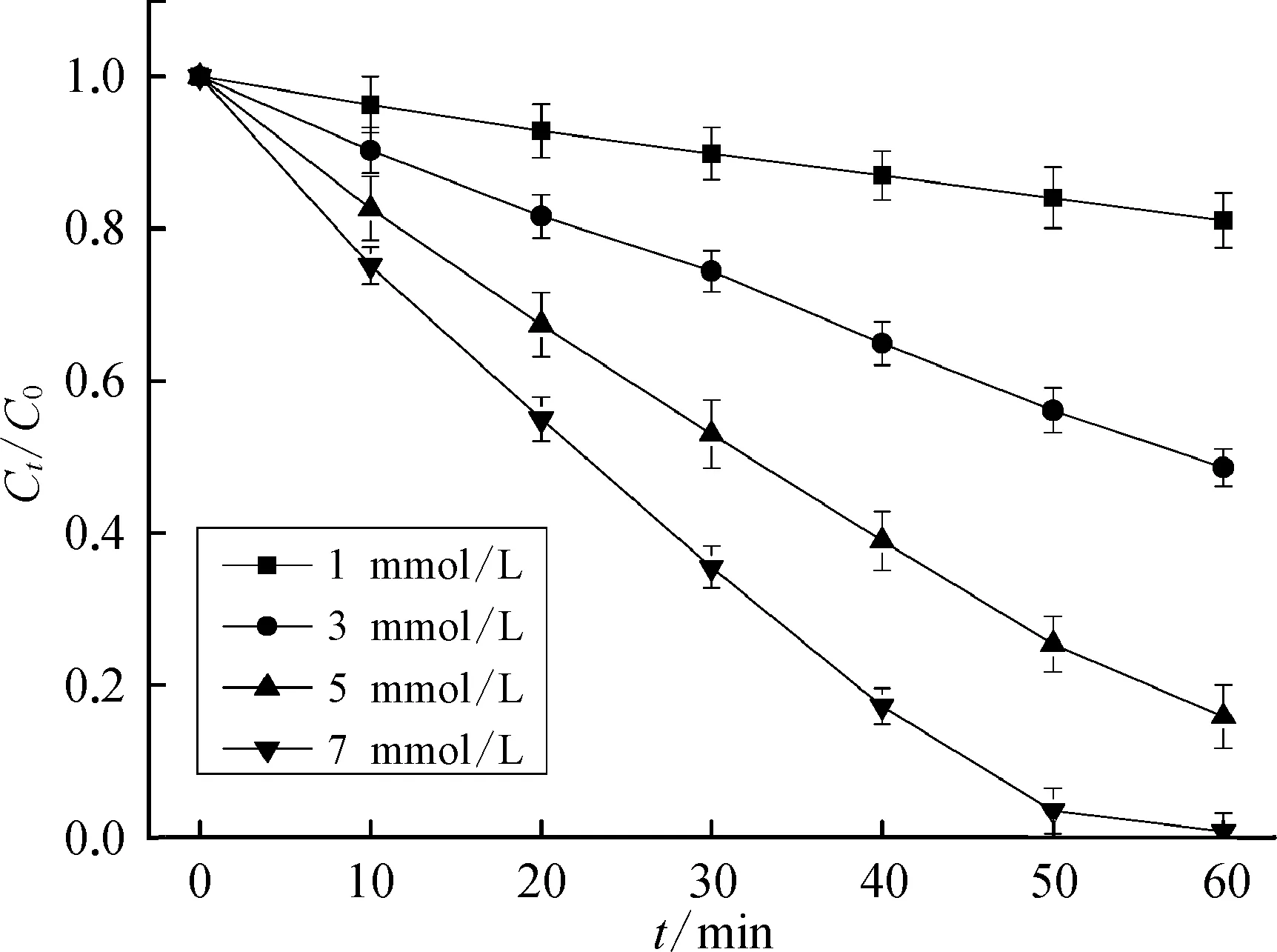
图3 氯离子活化PMS降解TMP的去除率Fig.3 Degradation Efficiency of TMP by PMS/Cl-
在常温条件下,PMS可以与Cl-发生非自由基反应生成活性氯(Cl2和HOCl),具体反应如式(2)、式(3)。

体系中产生的Cl2和HOCl都是具有氧化能力的活性物种,能够迅速直接地与溶液中的TMP发生反应,Wang 等[10]考察 Cl-对 Co2+/PMS 体系降解橙II的研究中,发现较高浓度的Cl-可以活化PMS生成的活性氯与橙II反应。因此,可以推测活性氯是常温条件下Oxone降解TMP的主要活性物质。
本文采用拟一级反应动力学表观速率常数kobs来描述反应的表观速率。拟一级反应动力学模型可表示为式(4),将式(4)定积分得到式(5)。
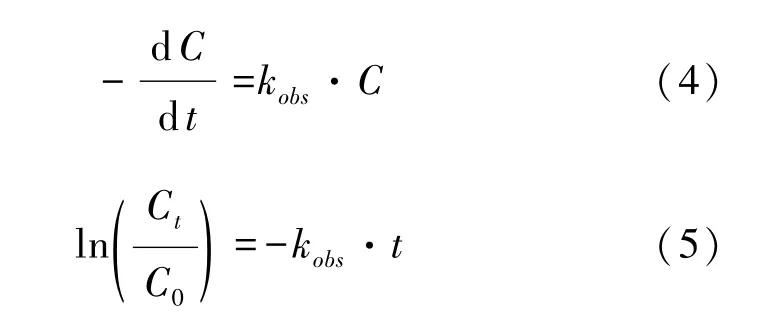
其中:C0—TMP 初始浓度,μmol/L;
Ct—t时刻 TMP 浓度,μmol/L;
t—反应时间,min。
2.3 Oxone投加量的影响
在本试验中,Oxone作为提供氧化活性物质的载体,其投加量是一个很重要的参数。在试验中固定TMP的初始浓度为 17 μmol/L,改变 Oxone的投加量,考察其对 TMP降解效果的影响。不同的Oxone投加量降解TMP反应符合拟一级反应动力学模型,如表1所示。随着Oxone的初始浓度由50 mg/L 增 加 到 300 mg/L,30 min 内 kobs由0.050 5 min-1增加到 0.463 6 min-1,表明其他条件一定时,在一定范围之内,增加Oxone的投加量可以提高TMP的反应速率。
如表1所示,在25℃条件下,TMP初始浓度为17 μmol/L;Oxone 投加量为 100 mg/L,由试验结果计算得出的 kobs为 9.15×10-2min-1(R2>0.99)。

表1 不同Oxone投加量下TMP的一级动力学常数Tab.1 First-Order Kinetics Parameters of TMP Degradation under Different Oxone Dosage
由图4可知,在Oxone的投加量为50、100、150、200、300 mg/L,反应时间为 5 min 时,对应的 TMP 去除率分别为 37.87%、54.09%、67.54%、79.53%、92.22%。表明Oxone投加量与TMP的去除率呈正相关,这是由于其他条件相同、TMP初始浓度一定时,Oxone投加量越大,系统中生成的活性氯越多,从而促进了体系中TMP的降解。

图4 Oxone投加量对TMP去除率的影响Fig.4 Effect of Oxone Dosage on TMP Degradation Efficiency
2.4 pH的影响
通过控制反应的初始pH,考察不同pH对TMP降解效果的影响。试验中固定Oxone的投加量为100 mg/L,TMP 的 初 始 浓 度 为 17 μmol/L,使 用NaOH和H2SO4调节溶液初始pH,研究其对去除率的影响。
图5为在不同pH条件下,TMP去除率与反应时间的关系。由图5可知,随着pH值从9.2逐渐减小至 5.1,系统中去除率分别为 77.1%、68.8%、62.4%、78.0%和86.7%。15 min内TMP的去除率均在60%以上,表明在不同pH下Oxone对TMP降解效果都较好。

图5 初始pH对TMP去除率的影响Fig.5 Effect of Initial pH Value on TMP Removal Rate
TMP去除率变化呈现先减小后增加的趋势,这可能是由于活性氯物种的存在形式与pH密切相关。在酸性条件,活性氯主要以HOCl的形态存在,其氧化降解效果较中性条件强,且系统中的H+促进非自由基反应生成更多的活性氯,如式(2),进而有利于TMP的去除。随着pH逐渐增大,中性条件下活性氯物种主要以 ClO-的形式存在,相比而言,ClO-(E0= 0.94)氧化电位低于 HOCl(E0=1.49)[11],所以中性条件下TMP去除率有所减少。在碱性条件,PMS存在碱活化作用,OH-能够使PMS处于激发态,从而更有利于Cl-与PMS触发反应,反应以式(3)为主,溶液中产生的活性氯浓度增大,使得TMP的去除率提高。pH值越大,碱活化作用越强,在pH值为9.2时,30 min内TMP的去除率高达98%。类似的结果在 Yuan等[12]的研究中也有报道,在PMS/Cl-体系中,碱性条件下偶氮染料AO7的脱色速率明显提高。
2.5 温度的影响
通过控制试验的反应温度,考察不同温度对TMP降解效果的影响。TMP的初始浓度为17 μmol/L,Oxone 的投加量为 100 mg/L,溶液的初始 pH 值为 6.3,考察了 15、25、35、45、55 ℃下,不同温度对TMP降解效果的影响。反应30 min后,拟合各时间点ln(Ct/C0)随时间t的变化关系如图6所示。反应符合拟一级反应动力学(R2>0.99),拟合结果如表2所示。系统温度由15℃升至55℃,反应速率常数由 0.064 3 min-1增至 0.345 7 min-1。当温度升高至55℃时,PMS在热激活作用下生成·SO-4和 ·OH[13],如式(6)。有 研 究[14-15]表 明,·SO-4和·OH具有极强的氧化能力,它们对TMP的二级反应动力学常数分别为7.71×109L/(mol·s)和 8.34×109L /(mol·s),所以该条件下 Oxone 降解TMP是活性氯和自由基共同作用的结果,并且温度越高,自由基作用越强,从而使得kobs显著提高。


图6 不同温度对TMP降解的拟一级反应拟合曲线Fig.6 First-Order Kinetics Fitting Linear of TMP Degradation under Different Temperature

表2 不同温度下TMP的一级动力学常数Tab.2 First-Order Kinetics Parameters of TMP Degradation under Different Temperature
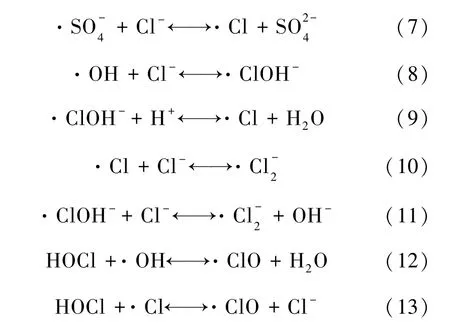
Oxone中含有 5%的 NaCl作为消毒助剂[7],其溶于水后体系中Cl-可消耗·SO-4和·OH,从而抑制降解反应的进行[16]。而试验结果表明反应速率有增无减,其原因可能是Cl-与·SO-4和·OH通过双电子转移发生自由基反应生成氯自由基(·Cl-2、·Cl、·ClOH-和 ·ClO)如式(7)~ 式(13)[17]。氯自由基能与富含电子的目标物充分反应。TMP结构式中含有两个氨基,是典型的供电子集团,所以其与氯自由基的反应速率较高。Wu等[18]得出类似的结果,研究表明 UV/Cl工艺降解TMP的效率比UV/H2O2高,就是由于所产生的氯自由基起到了重要作用。
根据化学反应速率常数在一定温度下满足阿伦尼乌斯定律,得出反应表观速率常数与温度的关系如式(14)[19]。
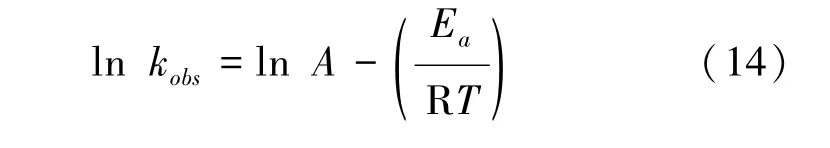
其中:kobs—反应速率常数,min-1;
Ea—反应的表观活化能,kJ/mol;
A—前置因子;
R—摩尔气体常数 8.314,J/(mol·K);
T—反应的绝对温度,K。
在不同温度下,Oxone与TMP反应的阿伦尼乌斯公式拟合模型如图7所示,呈现良好的线性关系(R2>0.98)。
由图7可知,不同温度下的TMP反应速率常数较好地符合阿伦尼乌斯方程,根据方程计算得到TMP的反应活化能Ea为34.12 kJ/mol。类似的研究中,Ji等[20]在热激活过硫酸盐降解TMP的研究中,得出的反应活化能Ea为177.8 kJ/mol。

图7 阿伦尼乌斯拟合方程Fig.7 Plot of Activation Energy (Ea)Calculation by Using the Arrhenius Equation
2.6 消毒副产物
Oxone作为一种新型消毒剂,在氧化降解TMP的过程中Cl2和HOCl为主要的活性物质。因此,评价反应过程中消毒副产物(DBPs)的生成特性十分必要。在试验中,TMP 的初始浓度为 17 μmol/L,Oxone 投加量分别为100 mg/L 和50 mg/L,初始pH 值为6.3,对反应过程中60 min内的DBPs生成量进行检测。
三卤甲烷(THMs)和卤乙酸(HAAs)是消毒过程中产生的两类主要的DBPs,是评价致癌风险的重要指标。试验结果表明,反应体系中无HAAs类消毒副产物生成,而生成的THMs主要是三氯甲烷(CHCl3)。Oxone 投 加 量 分 别 为 50 mg/L 和100 mg/L,体系中CHCl3的生成如图8所示。反应时间为 5 min,CHCl3的生成量分别为 62.88 μg/L和26.53 μg/L,随着反应时间逐渐减少,60 min 时减少至 10.88 μg/L 和 1.88 μg/L。有研究表明,Oxone投加量为2.0 mg/L时处理实际原水和滤后出水,生成的THMs和HAAs均少于氯消毒工艺[21]。

图8 不同Oxone投加量生成的THMsFig.8 THMs Generation under Different Oxone Dosage
3 结论
(1)在常温条件下,Oxone降解TMP的反应机理:Oxone溶于水后,含有的PMS与Cl-发生非自由基反应生成活性氯(Cl2和HOCl),活性氯作为主要活性物质进一步与TMP反应。
(2)Oxone可以高效地降解TMP,在30 min内去除率高达98%。降解过程符合拟一级反应动力学,反应动力学常数为 9.15×10-2min-1。
(3)TMP的去除率及速率常数随着Oxone投加量增大而增大,不同投加量与其对应的反应速率常数拟合呈线性关系。
(4)初始pH值在5.1~9.2,随着初始pH的增大,TMP的去除率先减小后增加,呈现出酸性和碱性条件下比中性条件下去除率高的趋势,但即使是中性条件下仍呈现出较好的去除效果。
(5)温度在15~55℃条件下,温度越高,反应速率常数越大,提高反应温度,可以显著加快反应速率。根据阿伦尼乌斯方程,得到TMP的反应活化能Ea为 34.12 kJ/mol。
(6)Oxone降解TMP过程中产生的DBPs主要是CHCl3,反应刚开始时生成量最高并随着时间逐渐减小;Oxone投加量越大,CHCl3的生成量越多。
[1]Klaus Kümmerer.Antibiotics in the aquatic environment— A review — Part II[J].Chemosphere,2009,75(4):435-441.
[2]Göbel A,Thomsen A,Mcardell C S,et al.Occurrence and sorption behavior of sulfonamides,macrolides,and trimethoprim in activated sludgetreatment[J]. EnvironmentalScience &Technology,2005,39(11):3981-3989.
[3]Lindberg R H,Olofsson U,Rendahl P,et al.Behavior of fluoroquinolones and trimethoprim during mechanical,chemical,and active sludge treatment of sewage water and digestion of sludge [J].Environmental Science & Technology,2006,40(3):1043-1048.
[4]De L M,Di L V,Dalla B M,Merlanti R,et al.Sublethal effects of trimethoprim on four freshwater organisms[J].Ecotoxicology &Environmental Safety,2012,82(4):114-121.
[5]常洋洋,陈庆欣,李宁,等.饮用水消毒技术发展趋势的文献计量学分析[J].环境科学学报,2016,36(2):413-419.
[6]陈国光,朱慧峰,钱静汝,等.消毒方式及消毒副产物控制研究[J].给水排水,2014,40(10):9-13.
[7]余京儒,李菠,李忠良,等.消毒粉及其制备方法:中国,101049107A[P].2007-10-10.
[8]Anipsitakis G P,Dionysiou D D.Radical generation by the interaction of transition metals with common oxidants [J].Environmental Science & Technology,2004,38(13):3705-3712.
[9]徐蕾,袁瑞霞,郭耀广,等.氯离子对钴/单过氧硫酸盐体系降解2,4,6-三氯苯酚的影响[J].武汉大学学报(理学版),2013,59(1):51-56.
[10]Wang Z H,Yuan R X,Guo Y G,et al.Effects of chloride ions on bleaching of azo dyes by Co2+/oxone regent:Kinetic analysis [J].Journal of Hazardous Materials,2011,190(1-3):1083-1087.
[11]Wang P,He Y L,Huang C H,et al.Reactions of tetracycline antibiotics with chlorine dioxide and free chlorine [J].Water Research,2011,45(4):1838-1846.
[12]Yuan R,Ramjaun S N,Wang Z,et al.Photocatalytic degradation and chlorination of azo dye in saline wastewater:Kinetics and AOX formation [J].Chemical Engineering Journal,2012,17(11):171-178.
[13]Lou X,Wu L,Guo Y,et al.Peroxymonosulfate activation by phosphate anion for organics degradation in water [J].Chemosphere,2014,117:582-585.
[14]Zhang R,Sun P,Boyer T H,et al.Degradation of pharmaceuticals and metabolite in synthetic human urine by UV,UV/H2O2,and UV/PDS [J].Environmental Science & Technology,2015,49(5):3056.
[15]Luo X,Zheng Z,Greaves J,et al.Trimethoprim:Kinetic and mechanistic considerations in photochemical environmental fate and AOP treatment[J].Water Research,2012,46(4):1327-1336.
[16]郭佑罗,关晓红,高乃云,等.紫外过硫酸紫外/过硫酸盐工艺降解水中氯贝酸的研究[J].中国环境科学,2016,36(7):2014-2019.
[17]Yang Y,Pignatello Joseph J,Ma J,et al.Comparison of halide impacts on the efficiency of contaminant degradation by sulfate and hydroxyl radical-based advanced oxidation processes (AOPs)[J].Environmental Science& Technology,2014,48 (4):2344-2351.
[18]Wu Z H,Fang J Y,Xiang Y Y,et al.Roles of reactive chlorine species in trimethoprim degradation in the UV/chlorine process:Kinetics and transformation pathways[J].Water Research,2016,50(21):272-282.
[19]Lou X Y,Guo Y G,Xiao D X,et al.Rapid dye degradation with reactive oxidants generated by chloride-induced peroxymono-sulfate activation [J].Environmental Science and Pollution Research,2013,20(9):6317-6323.
[20]Ji Y F,Xie W P,Fan Y,et al.Degradation of trimethoprim by thermo-activated persulfate oxidation:Reaction kinetics and transformation mechanisms [J].Chemical Engineering Journal,2016,21(4):16-24.
[21]敖秀玮,李豪杰,刘文君,等.单过硫酸氢钾复合粉在饮用水消毒过程中的副产物生成特性及遗传毒性[J].环境科学,2016,37(11):4241-4246.
【专家点评】文章研究了单过硫酸氢钾复合粉降解水中甲氧苄啶的效果、影响因素,对降解过程中的活性物种进行鉴定,分析其作用机理,并对反应过程中的消毒副产物进行了分析测定。研究结果为单过硫酸氢钾复合粉在水处理中的应用提供了参考。研究目标明确、试验数据翔实,理论分析合理,表述清晰。
