高温胁迫下高山杜鹃的生理生化响应
2018-03-06李小玲雒玲玲华智锐
李小玲,雒玲玲,华智锐
(商洛学院 生物医药与食品工程学院,陕西商洛 726000)
植物在生长发育过程中会受到各种非生物因子的胁迫,其中温度是影响植物生理过程的重要生态因子之一。近年来,由于人类活动而急剧产生的温室气体,导致全球气候越来越暖,如全球气温在近100年内约上升了0.3~0.6 ℃,并呈现出逐年上升的总趋势。全球变暖同时也容易引发局部地区频繁发生严重干旱和异常高温等恶劣气候。这些恶劣气候导致本地区植物的生理生态过程受到严重影响,对植物正常生长发育造成高温热害,严重影响植物的分布、生长和生产力[1]。
杜鹃花是杜鹃花科杜鹃花属(RhododendronLinn)植物,它与龙胆、报春并称为世界三大高山花卉,同时属于中国十大名花之一,其园林观赏及应用价值极高[2]。中国属于世界杜鹃花属植物的分布中心和起源地,野生杜鹃花资源丰富,其中以西南高海拔地区野生资源分布最多[3],该属植物耐热性相对较差,而喜湿润和冷凉环境,所以高温热害严重影响了其迁地保育及园林应用。秦岭野生杜鹃花树枝优美,花繁色艳,观赏价值极高,而且有些植物果实能食用,枝叶可入药,极具开发利用价值;同时,该属植物通常植株矮小、枝条密集、根系发达,常丛生成密不可分的灌木林,既不怕压、又耐极恶劣的高山气候,对保持高山土壤、防止雨水冲刷和砾石滚落等能起到固定作用,是优良的山地水土保持植物[2]。秦岭野生高山杜鹃多生长在海拔2 500~4 000 m的山地阴坡冷杉林(或杂林)中和林缘草坡上,喜冷凉的环境,不适宜高温环境,温度高低直接影响到杜鹃花芽的形成和花蕾的发育[3]。随着全球生态环境的日趋恶化,高温对植物的影响日趋显著,杜鹃花赖生存的生境受到前所未有的破坏。因此,开展杜鹃花高温胁迫机理的研究能为杜鹃的引种栽培提供理论依据。
本研究通过对不同温度胁迫后高山杜鹃热害指数及各项生理指标的测定,旨在阐明杜鹃花耐热性的生理响应机理,揭示其主要生理生化指标——超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性、丙二醛(MDA)质量摩尔浓度、叶绿素质量分数与高温胁迫之间的关系及生理指标之间的相关性。进而探讨高山杜鹃在高温胁迫逆境条件下的生理生态响应机制和生理指标变化规律,并通过对高温胁迫下生理生化指标响应的研究及主因子的分析,为杜鹃花抗热性早期鉴定和人工引种栽培提供理论依据。
1 材料与方法
1.1 试验材料
供试材料高山杜鹃幼苗采自商洛镇安木王国家森林公园海拔2 500 m左右的茨沟杜鹃花景区。
1.2 试验方法
1.2.1 高山杜鹃幼苗的预培养与高温胁迫 预培养:2016年3月中旬选取大小一致、生长健壮的高山杜鹃幼苗栽植于直径15 cm的花盆中,每盆3株,栽培基质为根源土∶河沙∶腐叶土=1∶1∶1(体积比)[4-5],处理期间每天傍晚喷施质量分数为0.1% 硫酸亚铁水溶液以保持土壤湿润,改变水质,促进植物生长,使叶色浓绿[4]。材料于温室中培养1个月后选取生长一致的幼苗用于试验。
高温胁迫:试验于人工气候箱中进行,采用22 ℃(昼/夜) 为对照、30 ℃(昼/夜)为轻度高温胁迫、38 ℃(昼/夜)为重度高温胁迫3个温度梯度处理,人工培养箱空气相对湿度75%、光照时间12 h·d-1,光照度为1 200 lx。盆底设有托盘(水深2 cm)补充基质水分以防止高温引发的水分胁迫伤害,每处理设3次重复,每重复3株,1周后取高山杜鹃叶片测定相关生理生化指标。
1.2.2 热害指数的计算 高山杜鹃温度处理期间,对其进行生长状况的观察,并对杜鹃幼苗的高温伤害程度进行分级记录。高温伤害程度分为5个级别,其中0级指无热伤害症状;1级指1~2片叶子开始变黄变枯;2级指2~4片叶子变黄,1片枯死;3级指2片叶枯死;4级指2片叶以上枯死;5级指整株枯死。热害指数=(∑热害级数×相应株数)/(最高级数×总株数)
1.2.3 生理生化指标测定 叶绿素质量分数测定参考丙酮法[6], MDA质量摩尔浓度测定参考硫代巴比妥酸(TBA)检测法[6],SOD活性测定参考氮蓝四唑(NBT)光化还原法[6],POD活性的测定参考愈创木酚法[6], CAT活性的测定参考紫外吸收法[7]。
1.3 数据处理与分析
试验指标测定重复3次,试验数据取3次测定数据平均值。采用Excel 2003和SPSS 17.0软件进行数据处理和分析。
2 结果与分析
2.1 高温胁迫对高山杜鹃热害指数的影响
22 ℃(对照)处理下的高山杜鹃植株正常生长,未发生形态变化,即热害指数为零。由图1得出,2个不同温度处理条件下的植物的热害指数呈上升趋势,其中30 ℃处理植株1、3、5、7 d时热害指数分别为0.022、0.044、0.222、0.356,由显著性分析可知,处理1 d和3 d时,30 ℃处理下植株的热害指数与对照差异不显著(P>0.05),从第5天开始,差异极显著(P<0.01);形态表现为3 d时植株形态出现微小变化,叶片轻度下垂而反卷;5 d时叶片反卷且下垂程度加重,叶片枯死;7 d时叶片枯死严重,老叶脱落。而38 ℃处理下3 d时热害指数即达到0.111,7 d时达到0.578,上升幅度达80.8 %,且由显著性分析可知,38 ℃处理下3 d时的热害指数和对照相比差异已表现出极显著水平;形态表现为第3天时叶片严重反卷而下垂,并开始萎蔫;第5天时植株表现为叶片萎蔫和轻度的失水,老叶卷曲且褐化并出现少数脱落,新叶叶尖和叶缘有黄色坏死斑;7 d时,部分植株大多数叶片枯死脱落。
将不同温度处理后的植株重新置于室温下培养后发现,30 ℃处理后的大多数高山杜鹃植株能恢复正常生长,但长势较对照处理弱;38 ℃处理后的杜鹃植株茎部表现出失水而皱缩,叶片出现黄化或褐变且逐渐脱落,重新萌发新叶植株少,植株陆续死亡现象严重。

不同大小写字母分别表示同期处理间在0.01和0.05水平差异显著,下同 The different capital and lowercase letters indicate significant difference between different temperatures at the same treatment time at 0.01 and 0.05 level,respectively,the same below.
图1高温胁迫下高山杜鹃热害指数
Fig.1EffectofhightemperaturestressontheThermaldamageindexofRhododendronlapponicum
2.2 高温胁迫对高山杜鹃耐热生理生化指标的影响
2.2.1 MDA质量摩尔浓度 丙二醛是植物细胞遇逆境后膜脂过氧化作用的产物之一,其质量摩尔浓度高低通常被作为细胞膜脂过氧化作用程度的重要指标[8]。从图2可看出,30 ℃高温胁迫条件下高山杜鹃幼苗的MDA质量摩尔浓度随着胁迫时间的增加呈上升趋势,其中从对照开始,将后一天与前一天MDA质量摩尔浓度相比增幅在第3、5、7天分别为12.92%、26.12%和1.19%,随着30 ℃高温处理天数的增加,MDA质量摩尔浓度先快速上升后上升减缓。同理,由38 ℃处理下的MDA质量摩尔浓度变化可知,随着胁迫时间的增加,其质量摩尔浓度后一天与前一天相比变化幅度分别为4.19%、26.53%、-0.35%,可知38 ℃处理下的植株的MDA质量摩尔浓度呈先增加后下降的趋势。再由显著性分析可知,本试验中, 22 ℃(对照)处理下的MDA质量摩尔浓度分别与30 ℃处理下高山杜鹃幼苗叶片的MDA质量摩尔浓度和38 ℃处理条件下的MDA质量摩尔浓度相比,差异均呈现极显著差异(P<0.01),说明2种温度对植株的影响均很大;其中第1天时,30 ℃和38 ℃ 2种温度处理下的植株的MDA质量摩尔浓度相比差异极显著,而3 d后30 ℃和38 ℃处理下的植株的MDA质量摩尔浓度相比差异均不显著。说明胁迫初期不同温度对高山杜鹃MDA的产生影响差异很大,随着处理时间的延长,植株MDA的产生对温度变化的反应迟钝。
2.2.2 叶绿素质量分数 叶绿素是与光合作用 密切相关的最重要色素,植物叶片中叶绿素质量分数的变化是表征叶片生理活性的重要指标之一。由图3~图5得出,随着时间的增加,对照处理下的叶绿素质量分数随时间增加变化不大,但在高温处理下,随着处理时间的延长,高山杜鹃幼苗叶片叶绿素的质量分数积累受到严重影响,其中叶绿素b的质量分数变化波动不定,但叶绿素a和总叶绿素的质量分数都呈现下降的趋势,且下降幅度不同。其中30 ℃处理下叶绿素a的质量分数后一天与前一天相比在第3、5、7天分别下降15.26%、19.46%、88.82%,总叶绿素的质量分数分别下降了12.81%、23.04%、53.9%;38 ℃处理下叶绿素a的质量分数分别下降了53.55%、52.75%、15.64%,总叶绿素的质量分数分别下降50.81%、5.65%、33.92%。可见,30 ℃处理下叶绿素质量分数呈现初期下降幅度较小,后期下降幅度较大的趋势,而38 ℃处理下叶绿素的质量分数大体呈现初期下降幅度较大,后期下降幅度较 小的趋势。Downton等[9]研究认为引起植物光合速率降低的主要原因是由于叶绿素质量分数降低所导致。由差异显著性分析可知,与对照处理下的叶绿素质量分数相比,30、38 ℃处理下杜鹃幼苗叶片的总叶绿素质量分数、叶绿素a的质量分数和叶绿素b的质量分数均显著(P<0.05)且极显著(P<0.01)降低,这一结果说明高温胁迫对植物的光合器官造成了严重伤害。
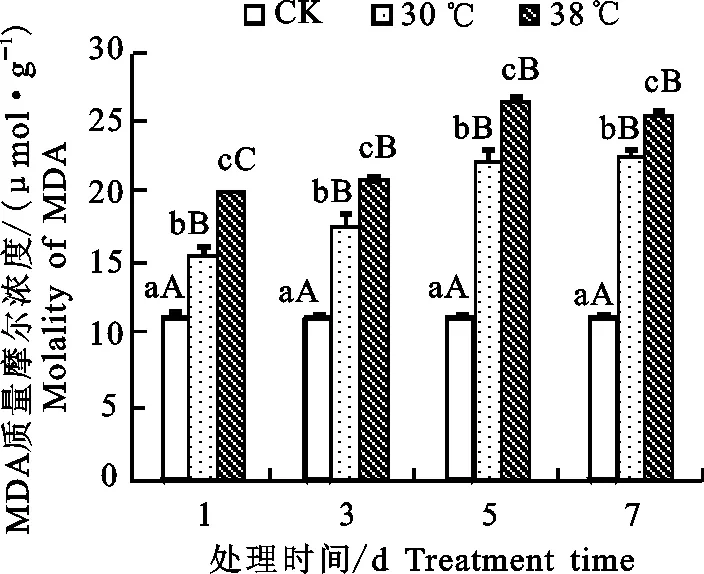
图2 高温胁迫下高山杜鹃幼苗MDA质量摩尔浓度Fig.2 Effect of high temperature stress on MDA molality of Rhododendron lapponicum seedling

图3 高温胁迫下高山杜鹃幼苗叶片总叶绿素质量分数Fig.3 Effect of high temperature stress on total chlorophyllmass fraction of Rhododendron lapponicum
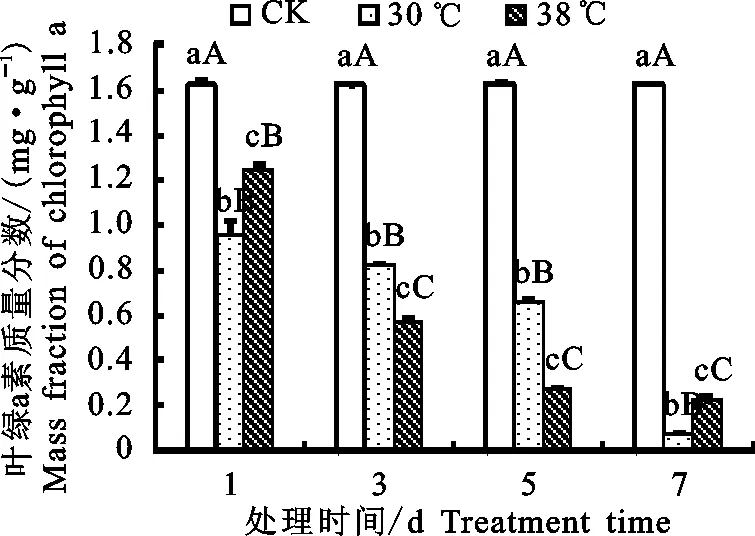
图4 高温胁迫下高山杜鹃幼苗叶片叶绿素a质量分数Fig.4 Effect of high temperature stress on chlorophyll a mass fraction of Rhododendron lapponicum seedling leaves
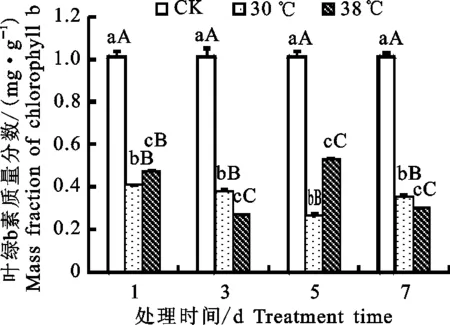
图5 高温胁迫下高山杜鹃幼苗叶片叶绿素b质量分数Fig.5 Effect of high temperature stress on chlorophyll bmass fraction of Rhododendron lapponicum
2.2.3 保护酶活性 由图6、图7和图8可知,与22 ℃(对照)处理相比,高温胁迫下高山杜鹃3种保护酶活性均有所上升。根据数据分析得出,随着高温胁迫时间的延长,温度胁迫处理后一天与前一天相比抗氧化酶SOD的活性上升幅度在第3、5、7天分别为29.74%、-5.78%、-12.72%,可知SOD活性在第3天时达到最大以后逐渐下降。同理,经分析可知POD及CAT的活性均在第5天达到最大随后降低。显著性分析表明,与对照处理下的植株相比,30 ℃和38 ℃处理下的高山杜鹃的POD活性和SOD活性均呈极显著差异(P<0.01),而与对照相比,30、38 ℃高温处理下高山杜鹃叶片的CAT活性除第1天差异显著(P<0.05)外,3、5、7 d的差异也均为极显著(P<0.01)。此结果说明高山杜鹃幼苗对高温胁迫的反应比较明显。
3 讨 论
3.1 高温胁迫对高山杜鹃热害指数的影响
在逆境条件下植物自身形态特征的变化能直接有效评价和反映对逆境抗性强弱及受伤害的程度[10]。大部分杜鹃花属植物喜冷凉而湿润的气候环境,且这些地区即使在最热夏季的极端最高气温也不会超过28 ℃。秦岭高山杜鹃也性喜空气湿润、通风凉爽和半阴环境,忌强光暴晒和天气炎热。

图6 高温胁迫下高山杜鹃幼苗SOD活性变化Fig.6 Effect of high temperature stress on SODactivity of Rhododendron lapponicum
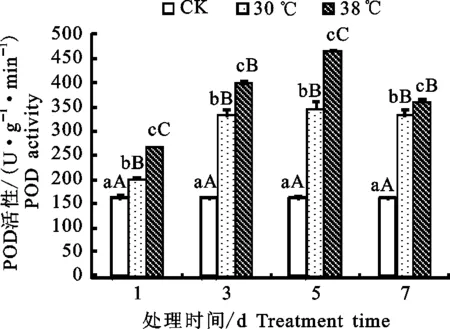
图7 高温胁迫下高山杜鹃幼苗POD活性变化Fig.7 Effect of high temperature stress on PODactivity of Rhododendron lapponicum
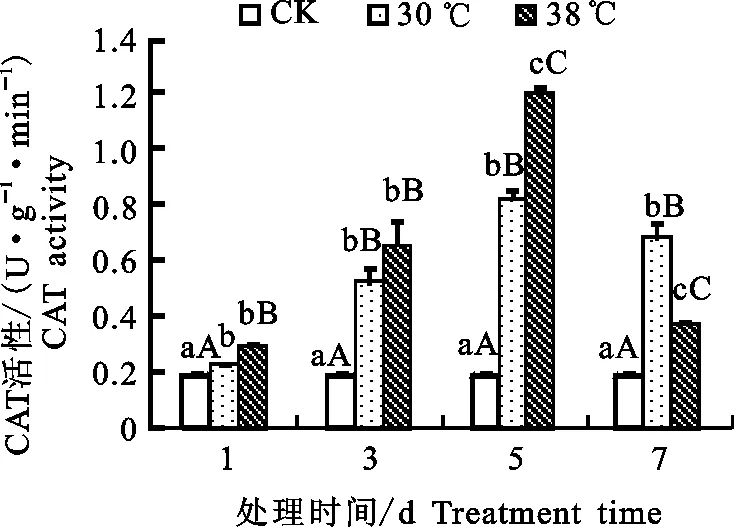
图8 高温胁迫下高山杜鹃幼苗CAT活性变化Fig.8 Effect of high temperature stress onCAT activity of Rhododendron lapponicum
由热害指数和形态观测结果可知,本试验在30 ℃和38 ℃高温条件胁迫下,植株均遭受到不同程度伤害,这与高山杜鹃表现出高温适应性不良特性相一致。从高山杜鹃植株生长形态和各个指标来看,22 ℃(对照)是高山杜鹃生长的较适温度,这与赵冰等[4]的研究结果一致;30 ℃已对植株造成轻度伤害,但植株仍能耐受该温度胁迫并恢复正常生长;而38 ℃高温对高山杜鹃植株造成严重伤害,这与周广等[11]对井冈山杜鹃的相关研究结果相似,且与胁迫条件下植株的生理响应规律相一致。
3.2 高温胁迫对高山杜鹃耐热生理生化指标的影响
细胞膜是联系植物细胞与外界环境的媒介,其组成及性质与细胞所处环境紧密相关,而外界环境首先在膜系统中对植物造成胁迫危害,其中主要的危害表现在膜脂过氧化[1]。丙二醛(MDA)是膜脂过氧化作用的最终分解产物,故植物在受到逆境胁迫后叶片中的丙二醛(MDA)质量摩尔浓度高低可有效反映细胞膜脂质过氧化的程度[12-13]。本试验中,对照处理下的MDA质量摩尔浓度相对稳定,而不同高温胁迫下高山杜鹃幼苗的MDA质量摩尔浓度与其对照相比则极显著增加,且其质量摩尔浓度大体上表现出随高温胁迫时间的延长而增加的趋势(图2),这与相杜鹃花属植物的其他研究结果相一致[11,14-15]。
叶绿素的质量分数与光合机能的大小具有密切关系。张庆峰等[16]在对高温胁迫下高羊茅生理生化特性的研究中发现,高羊茅在高温胁迫下叶片的叶绿素质量分数呈现出先升后降趋势,其原因可能是在短期高温胁迫下的光照加强促进了草坪草的光合作用进一步加强;在本试验中,随着胁迫温度的升高,叶绿素a和总叶绿素的质量分数均呈现出下降趋势,而叶绿素b的质量分数变化波动不定,所以叶绿素的质量分数变化是否能成为衡量高山杜鹃热胁迫的有效指标仍需进一步的研究积累。叶绿素a质量分数变化表现为前期小幅度下降、后期大幅度下降趋势,分析其可能原因主要表现在两方面:一方面,高温胁迫抑制了高山杜鹃植物叶绿素的生物合成,从而降低了叶绿素的生成量;另一方面,可能是杜鹃植物在受到高温胁迫后,其体内急剧累积上升的活性氧的氧化作用加速了叶绿素的破坏[9]。
当植物遭受逆境胁迫时,细胞内超氧自由基、单线态氧、过氧化物自由基和羟基自由基等活性氧大量累积而使活性氧产生和清除的动态平衡被打破[17-19]。而处于逆境的植物体并不只是被动承受伤害,而会出现主动的适应和调节。植物为缓解高温逆境造成的伤害,会激活体内保护酶活性的提高,以减轻细胞膜膜脂过氧化作用程度,从而提高细胞膜的稳定性。SOD、POD和CAT是植物体内清除活性氧的主要保护酶类,它们会协同作用对抗逆境对植物造成的伤害[20]。本试验中,SOD、POD、CAT的活性呈先升高后下降的趋势,说明尽管SOD可清除自由基,减轻膜脂过氧化作用对细胞的伤害,但也只能起到有限的保护作用;一旦高温胁迫加重,植物遭受的胁迫压力超过所能承受的极限时,高温将通过抑制酶的表达或破坏酶的结构,促使保护酶活性下降。
本研究发现对照下的3种酶的活性比较稳定,而与对照处理相比,30、38 ℃处理下杜鹃幼苗叶片3种酶的活性虽有所波动但整体表现为活性上升趋势;同样是在38 ℃高温胁迫条件下,王凯红等[15]在对另5种杜鹃幼苗的类似研究中却发现SOD活性呈现出下降趋势。这可能与不同研究中材料、方法或处理时间的不同或不同类型杜鹃对高温胁迫的反应不同有关,具体原因还有待深究。
综上所述,秦岭高山杜鹃幼苗适宜生长温度在22 ℃左右,30 ℃时植株生长会受到抑制,但具有一定耐热性;秦岭高山杜鹃幼苗在38 ℃高温环境下生长受到严重影响,不利于植株正常生长。因此,将高山杜鹃引种栽培到夏季最高温度不超过25~28 ℃的地区是可行的,但随着近年来夏季温度的不断上升,通过什么手段让杜鹃在炎热的城市引种成功还需要进一步研究。
Reference:
[1] 商侃侃,张德顺,王 铖.高温胁迫下植物抗性生理研究进展[J].园林科技,2008(1):11-25.
SHANG K K,ZHANG D SH,WANG CH.Research progress of plant resistance physiology under high temperature stress [J].ScienceandTechnologyofGarden,2008(1):11-25.
[2] 李璟琦,苏 真,张晓静.秦岭杜鹃花属植物资源及其利用研究[J].中国农学通报,2012,28(22):304-307.
LI J Q,SU ZH,ZHANG X J.The study of plant resources and their utilization on Qinling rhododendron [J].ChineseAgricultureBulletin,2012,28(22):304-307.
[3] WU Z Y,RAVEN P H.Flora of China:Vol.14 [M].Beijing:Science Press,2005:260-455.
[4] 赵 冰,丁惠惠,付玉梅,等.秦岭高山杜鹃的引种栽培管理技术[J].林业实用技术,2010(8):52-53.
ZHAO B,DING H H,FU Y M,etal.Techniques of introduction and cultivation management ofAlpinerhododendronin Qinling[J].PracticalForestryTechnology,2010(8):52-53.
[5] 赵 冰,付玉梅,丁惠惠,等.Ca2+处理对秦岭高山杜鹃耐热性的影响[J].西北林学院学报,2010,25(6):29-32.
ZHAO B,FU Y M,DING H H,etal.The influence of Ca2+treatment on the heat resistance of the rhododendron in Qinling mountain[J].NorthwestForestryJournal,2010,25(6):29-32.
[6] 张志良,翟伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2009:207-208.
ZHANG ZH L,ZHAI W J,LI X F.Experimental Instruction of Plant Physiology[M].Beijing:High Education Press,2009:207-208.
[7] 张以顺,黄 霞,陈云凤.植物生理实验教程[M].北京:高等教育出版社,2009:139-140.
ZHANG Y SH,HUANG X,CHEN Y F.Physiological Experiments in Plants[M].Beijing:High Education Press,2009:139-140.
[8] 屠小菊,汪启明,饶力群.高温胁迫对植物生理生化的影响[J].湖南农业科学,2013(13):28-30.
TU X J,WANG Q M,RAO L Q.Effects of high temperature stress on physiology and biochemistry of plant [J].HunanAgriculturalScience,2013(13):28-30.
[9] DOWNTONW J S,GRANT W J,ROBINSON S P.Stomatal closure fully accounts for the inhibition of photosynthesis by abscisic acid [J].PlantPhysiology,1985(77):85-88.
[10] 郑 宇,何天友,陈凌艳,等.高温胁迫下西洋杜鹃的生理响应及耐热性[J].福建林学院学报,2012,32(4):332-333.
ZHENG Y,HE T Y,CHEN L Y,etal.Physiological response and heat resistance of western rhododendron under high temperature stress [J].FujianForestryCollegeJournal,2012,32(4):332-333.
[11] 周 广,孙宝腾,张乐华,等.井冈山杜鹃叶片抗氧化系统对高温胁迫的响应[J].西北植物学报,2010,30(6):1149-1156.
ZHOU G,SUN B T,ZHANG L H,etal.High temperature stress response of the Jinggang mountains rhododendron leaf antioxidant system [J].NorthwestPlantsJournal,2010,30(6):1149-1156.
[12] 张燕红,吴永波,刘 璇,等.高温和干旱胁迫对杨树幼苗光合性能和抗氧化酶系统的影响[J].东北林业大学学报,2017(11):32-38.
ZHANG Y H,WU Y B,LIU X,etal.The effects of high temperature and drought stress on photosynthesis and antioxidant enzyme system of poplar seedlings [J].JournalofNortheastForestryUniversity,2017(11):32-38.
[13] 李 黎,宋帅杰,方小梅,等.高温干旱及复水对毛竹实生苗保护酶和脂质过氧化的影响[J].浙江农林大学学报,2017,30(2):268-275.
LI L,SONG SH J,FANG X M,etal.The effects of high temperature drought and complex water on the protective enzyme and lipid peroxidation of bamboo seedlings [J].JournalofZhejiangAgriculturalandForestryUniversity,2017,30(2):268-275.
[14] 申惠翡,赵 冰,徐静静,等.外源水杨酸对西洋杜鹃耐热性的影响[J].东北林业大学学报,2016,20(7):40-45,50.
SHEN H C,ZHAO B,XU J J,etal.Effects of exogenous salicylic acid on heat resistance of Cuckoo[J].JournalofNortheastForestryUniversity,2016,20(7):40-45,50.
[15] 王凯红,刘向平,张乐华,等.5种杜鹃幼苗对高温胁迫的生理生化响应及耐热性综合评价[J].植物资源与环境学报,2011,20(3):29-35.
WANG K H,LIU X P,ZHANG L H,etal.Physiological and biochemical response of 5 kinds of rhododendron seedling to heat stress and heat resistance comprehensive evaluation [J].PlantResourcesandEnvironmentJournal,2011,20(3):29-35.
[16] 张庆峰,徐 胜,李建龙.高温胁迫下高羊茅生理生化特性研究[J].草业科学,2006,23(4):26-27.
ZHANG Q F,XU SH,LI J L.Research on physiological and biochemical characteristics of high fescue under high temperature stress [J].GrassIndustryScience,2006,23(4):26-27.
[17] GULEN H,ERIS A.Effect of heat stress on peroxidase activity and total protein content in strawberry plants[J].PlantScience,2004(166):739-744.
[18] SCANLIOS J G.Oxygen stress and superoxide dismutases[J].PlantPhysiology,1993(101):456-459.
[19] 张秋芳,吕春平,贝昭贤,等.野外模拟增温对亚热带杉木叶片膜脂过氧化及保护酶活性的影响[J].植物生态学报,2016,25(12):1230-1237.
ZHANG Q F,LÜ CH P,BEI ZH X,etal.The effects of simulated warming on the lipid peroxidation and protective enzyme activity of subtropical fir leaves[J].PlantEcologyJournal,2016,25(12):1230-1237.
[20] 吴姝漪,孟千万,宋希强,等.高温胁迫对华石斛幼苗的形态和生理参数的影响[J].热带作物学报,2017,31(4):646-651.
WU S Y,MENG Q W,SONG X Q,etal.Effects of high temperature stress on the morphology and physiological parameters of dendrobius seedling[J].TropicalCropsJournal,2017,31(4):646-651.
