腹膜透析相关性腹膜炎患者短期预后不良危险因素的分析
2018-03-06王海云周紫娟刘炳岩李雪梅陈丽萌
马 莹,王 颖,王海云,李 阳,周紫娟,刘炳岩,李雪梅,陈丽萌
中国医学科学院 北京协和医学院 北京协和医院肾内科,北京 100730
腹膜透析是终末期肾脏病患者有效的肾脏替代治疗方式,腹膜透析相关性腹膜炎是腹膜透析治疗常见的严重并发症[1]。澳大利亚和新西兰透析与移植注册中心(Australian and New Zealand Dialysis and Transplant Register,ANZDATA)的数据显示,腹膜透析相关性腹膜炎预后不良可导致20%腹膜透析技术失败;在腹膜透析死亡的患者中,有6%的患者死于腹膜炎,占感染性死因的30%[2- 3]。腹膜炎发生后4周内出现的短期预后不良包括死亡、拔管转血液透析、腹腔持续感染状态或复发[4- 5],是影响腹膜透析能否继续和腹膜透析患者生存的直接原因,但国内关于腹膜炎短期预后的相关研究很少。本研究采用回顾性队列研究,观察了腹膜炎患者的短期预后,分析了其相关的危险因素。
资料和方法
资料及分组2004年1月1日至2017年3月31日在北京协和医院腹膜透析中心开始腹膜透析治疗、发生腹膜透析相关性腹膜炎(≥1次)的终末期肾脏病患者。排除标准:(1)资料不完整;(2)未规律随诊(随诊间期超过2个月)。所有患者均由同一肾脏病科医师行直视手术切开腹膜透析置管术,采用百特公司的乳酸盐腹膜透析液。透析方式主要为连续不卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD),其次为自动化腹膜透析(automated peritoneal dialysis,APD)。随访至2017年4月30日,主要终点事件为死亡,次要终点事件为转血液透析、失访、转外院等。根据首次腹膜炎的结局分为短期预后不良组和预后良好组。本研究方案及实施经北京协和医院伦理审查委员会审查通过(伦理审核编号S-K142)。
收集患者的基线资料包括性别、年龄、原发病、查尔森共病指数(Charlson’s comorbidity index,CCI),根据国际疾病分类(International Classification of Diseases,ICD)10疾病编码:心肌梗死、充血性心力衰竭、外周血管疾病、脑血管疾病、痴呆、慢性阻塞性肺病、结缔组织病、溃疡、轻度肝病、糖尿病各1分;偏瘫、中-重度肾脏病、伴终末器官受累的糖尿病、肿瘤、白血病、淋巴瘤各2分;中-重度肝病3分;转移性实体肿瘤、艾滋病各6分。记录基线(腹膜透析前)及腹膜炎发生前3个月内(无腹膜炎状态下)的实验室检查指标,包括血红蛋白、白蛋白、铁代谢、血白细胞计数及分类、血中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、超敏C反应蛋白(high-sensitivity C-reactive protein,hsCRP)等。记录初始及首次腹膜炎前的透析相关指标如尿素清除指数(urea clearance index,Kt/V)、每周肌酐清除率(creatinine clearance rate,CCr)、残余肾功能(residual glomerular filtration rate,rGFR)、标准蛋白分解率(normalized protein catabolic rate,nPCR)、腹膜转运状态等。收集腹膜炎发生时的透出液细胞计数及分类、血生化指标、病原学培养结果及临床转归。
腹膜透析相关性腹膜炎的诊断标准具备以下3项中的2项或以上可诊断:(1)有腹膜炎的症状和体征,如腹痛、腹水浑浊、伴或不伴发热;(2)透出液白细胞计数>100/μl,中性粒细胞比例>50%(APD患者以后者为主要诊断标准);(3)透出液涂片或培养有病原微生物的生长[3- 4,6- 7]。
腹膜透析相关性腹膜炎的治疗参照国际腹膜透析学会(International Society for Peritoneal Dialysis,ISPD)指南,在留取透出液病原学培养后予以经验性抗感染治疗(腹腔内用抗生素覆盖革兰氏阳性菌和阴性菌),根据临床症状是否改善、病原学培养及药敏结果调整方案。
短期预后根据ISPD指南及参考文献,短期不良事件包括腹膜炎发生后4周以内出现的死亡(败血症、感染性休克、腹膜炎病程4周内的死亡)、拔管转血液透析(临时或长期)、持续性感染(抗感染治疗>3周未获缓解)、复发(治疗结束后4周内再次发生同一菌种腹膜炎)。临床粥样硬化血管疾病包括冠状动脉硬化性心脏病、脑血管疾病和外周血管疾病[4- 5,8]。
统计学处理采用SPSS 20.0统计软件,符合正态分布计量资料以均数±标准差表示,非正态分布计量资料以中位数(25%,75%)表示,计量资料呈正态分布且方差齐两样本均数比较采用t检验,非正态分布、方差不齐数据组间比较采用非参数秩和检验;计数资料以率表示,组间比较采用卡方检验。采用单因素及多因素Logistic回归分析评估各因素对腹膜炎短期不良预后的影响;P<0.05为差异有统计学意义。
结 果
一般情况共有162例患者入选,其中,男79例,女83例,平均年龄(58.5±15.7)岁(25~85岁)。原发病为慢性肾小球肾炎者26例,其中9例具有肾活检,包括8例IgA肾病及1例膜性肾病;糖尿病肾病55例(34.0%),高血压性肾损害39例(24.1%),狼疮性肾炎6例,紫癜性肾炎2例,乙肝病毒相关性肾炎及丙肝病毒相关性肾炎各1例(主要根据病史资料及临床表现诊断);慢性间质性肾炎10例(其中马兜铃酸肾病5例),高尿酸血症肾损害3例,慢性肾盂肾炎3例,多囊肾3例,泌尿系移行细胞癌1例,肾动脉狭窄及缺血性肾病1例,梗阻性肾病1例。
根据首次腹膜炎结局分为短期预后不良组(n=55)和预后良好组(n=107)。55例短期预后不良的患者中,17例(30.9%)为拔管转血液透析治疗,致病菌主要是革兰氏阴性菌;16例(29.1%)在腹膜炎病程中死亡,死因为感染性休克或并发多脏器功能衰竭,革兰氏阴性菌感染者比例最高;首次腹膜炎抗感染治疗后4周内有16例患者(29.1%)发生复发,致病菌以革兰氏阳性菌最多见,明确为葡萄球菌感染者5例,肠球菌感染者2例;经腹腔细胞计数及分类或病原学培养结合临床症状判断,6例(10.9%)患者病程迁延>3周。
透出液病原学培养结果显示,92例(56.8%,92/162)透出液培养阳性,其中,革兰氏阳性菌53例,包括凝固酶阴性葡萄球菌28例、金黄色葡萄球菌3例、链球菌10例、肠球菌6例、微球菌属1例、棒状杆菌2例、不动杆菌1例、未明确的革兰氏阳性杆菌1例、革兰氏阳性球菌1例;革兰氏阴性菌31例,包括大肠埃希菌14例、奈瑟菌属3例,莫拉菌属1例,克雷伯菌2例,其他及未明确的革兰氏阴性菌11例;多种微生物引起的腹膜炎7例,真菌性1例。
两组患者基线资料的比较短期预后不良组患者合并临床粥样硬化性血管疾病的比例显著高于预后良好组(49.1%比 31.8%;χ2=4.639,P=0.031),两组患者在基线血压、CCI、腹膜透析置管类型方面差异均无统计学意义(P均>0.05);两组患者初始腹膜转运状态均以高平均转运为主,其初始Kt/V、CCr和rGFR水平差异无统计学意义(P均>0.05);两组患者的基线血红蛋白,白蛋白,血脂,血清钙磷乘积,甲状旁腺素,血清铁、尿酸等代谢指标,及NLR、hsCRP和铁蛋白等炎症指标差异也均无统计学意义(P均>0.05)(表1)。

表 1 两组患者基线资料的比较Table 1 Comparison of baseline characteristics between two groups
CCI:查尔森共病指数;SBP:收缩压;DBP:舒张压;APD:自动化腹膜透析;Kt/V:尿素清除指数;CCr:总肌酐清除率;rGFR:残余肾小球滤过率;nPCR:标准蛋白分解率;WBC:白细胞;LY:淋巴细胞;NLR:中性粒细胞淋巴细胞比值;HGB:血红蛋白;HCT:血细胞比容;ALB:白蛋白;K:钾;CO2CP:二氧化碳结合力;Ca×P:校正钙与血磷乘积;iPTH:全段甲状旁腺素;TG:三酰甘油;TC:总胆固醇;UA:尿酸;SI:血清铁;SF:铁蛋白;hsCRP:超敏C反应蛋白;CA125:糖类抗原125;1 mmHg=0.133 kPa
CCI:Charlson’s comorbidity index;SBP:systolic blood pressure;DBP:diastolic blood pressure;APD:automated peritoneal dialysis;Kt/V:urea clearance index;CCr:total creatinine clearance rate;rGFR:residual glomerular filtration rate;nPCR:normalized protein catabolic rate;WBC:white blood cell;LY:lymphocyte;NLR:neutrophil to lymphocyte ratio;HGB:hemoglobin;HCT:hematocrit;ALB:albumin;K:potassium;CO2CP:carbon dioxide combining power;Ca×P:calcium-phosphorus product;iPTH:parathyroid hormone;TG:triglyceride;TC:total cholesterol;UA:uric acid;SI:serum iron;SF:serum ferritin;hsCRP:high-sensitivity C-reactive protein;CA125:carbohydrate antigen 125;1 mmHg=0.133 kPa
两组患者腹膜炎前3个月内实验室检测结果的比较预后不良组患者的hsCRP水平[9.3(2.2,16.3)mg/dl比3.6(1.4,9.5)mg/dl;Z=-2.879,P=0.004]和腹膜低转运比例(8.7%比1.0%;Z=4.879,P=0.027)均明显高于预后良好组,CCr水平明显低于预后良好组[56.7(45.7,71.1) ml/(min·w·1.73 m2)比61.4(54.5,76.4) ml/(min·w·1.73 m2);Z=-2.084,P=0.037];两组患者在白蛋白、血红蛋白等营养指标,血白细胞计数及铁蛋白等炎症指标,Kt/V及rGFR等透析相关指标方面差异均无统计学意义(P均>0.05)(表2)。
两组患者腹膜炎相关临床特征的比较两组患者透出液病原学培养阳性率差异无统计学意义(58.2%比56.1%;χ2=0.066,P=0.798)。在病原学培养阳性的患者中,预后不良组患者多种微生物引起的腹膜炎比例显著高于预后良好组(15.6%比3.3%;χ2=4.241,P=0.039),革兰氏阳性菌感染比例显著低于预后良好组(37.5%比68.3%;χ2=4.241,P=0.004)。两组患者随访期内腹膜炎发生率差异无统计学意义(0.5次/患者年比0.4次/患者年;χ2=-1.595,P=0.111)(表3)。
腹膜炎短期预后不良危险因素分析单因素Logistic回归分析结果显示,在性别、发生腹膜炎时的年龄及腹膜透析时间、糖尿病肾病、合并临床粥样硬化性血管疾病、透析方式为APD、腹膜炎前腹膜低转运状态、多种微生物引起的腹膜炎、腹膜炎前hsCRP、血白蛋白等因素中,合并临床粥样硬化性血管疾病(OR=2.070,95%CI:1.062~4.034,P=0.033)和腹膜炎前高hsCRP(OR=1.032,95%CI:1.006~1.059,P=0.015)是发生腹膜炎短期不良预后的危险因素。以性别、发生腹膜炎时的年龄(每增加1岁)、腹膜透析时间(每增加1个月)、糖尿病(以不患糖尿病为参照组)、发生腹膜炎前的血白蛋白(每增加1 mg/dl)校正后显示,腹膜炎前高hsCRP(OR=1.026,95%CI:1.000~1.052,P=0.046)、基线合并临床粥样硬化性血管疾病(OR=2.105,95%CI:1.014~4.367,P=0.046)是腹膜透析患者发生腹膜炎短期不良预后的独立危险因素。
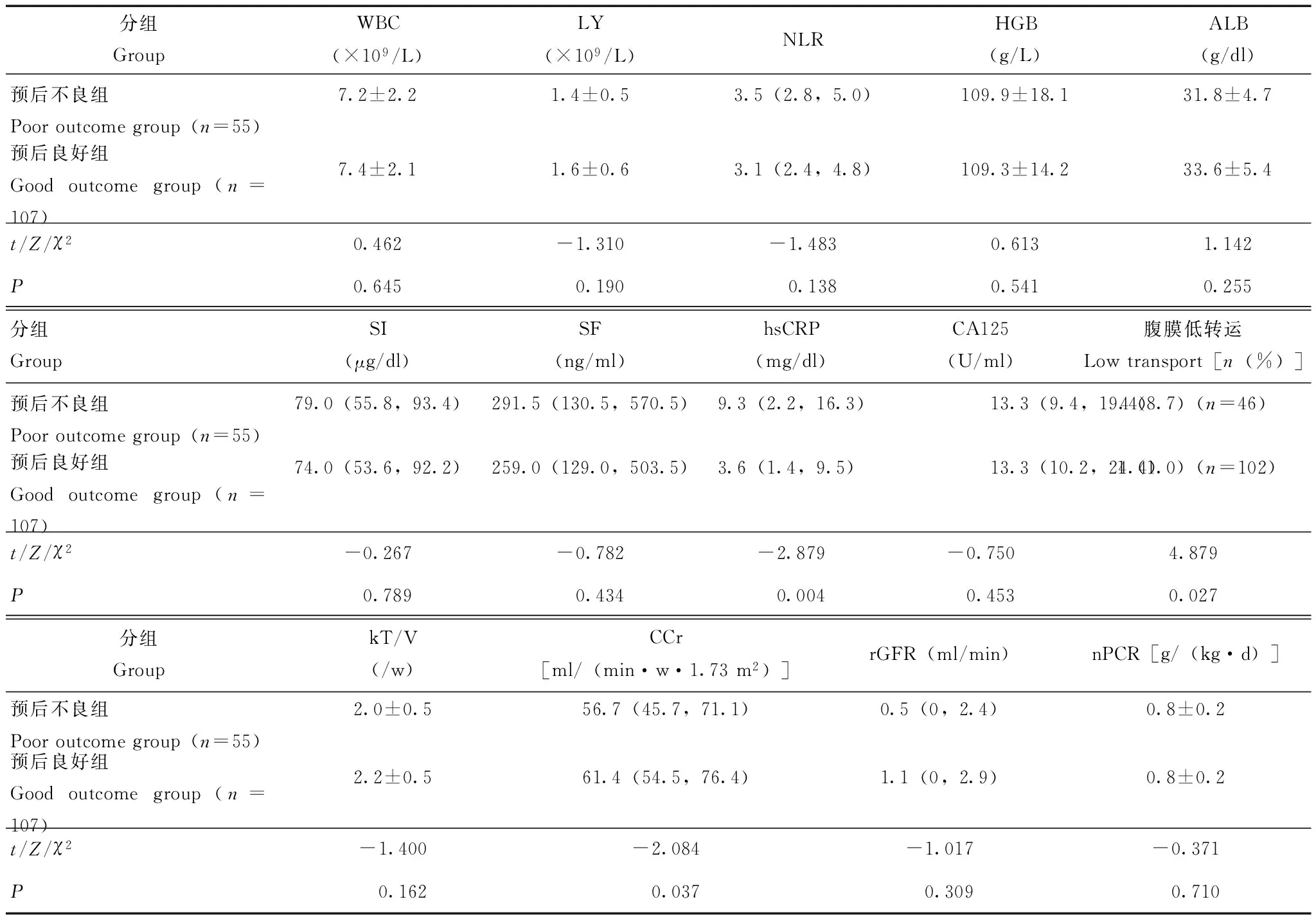
表 2 两组患者腹膜炎前3个月内实验室检测结果的比较Table 2 Comparison of laboratory findings between two groups within 3 months before peritonitis onset

表 3 两组患者腹膜炎相关临床特征的比较Table 3 Comparison of clinical characteristics related to peritonitis of the patients between two groups
讨 论
研究发现,年龄、透析时间和糖尿病患病率可能是腹膜透析患者发生预后不良的原因[9- 10]。本组资料显示,腹膜透析相关腹膜炎患者的短期不良预后发生率为34.0%,与Zalunardo等[5]研究相同,高于Ye等[8]研究的16.3%,推测可能与该研究患者平均年龄更小、发生腹膜炎时的中位腹透龄更低、糖尿病患病率更低有关。此外,不同中心致病菌谱的差异也可能会影响腹膜炎短期预后不良的发生率,本研究观察到腹膜炎死亡患者的主要致病菌为革兰氏阴性菌,复发患者则以革兰氏阳性菌多见,与国外研究相似。
C反应蛋白(C-reactive protein,CRP)是常见的炎症指标,血清CRP水平升高提示机体处于炎症疾病或氧化应激状态[11- 12],CRP自身也可作为促炎因子结合受损的细胞、活化补体[13]。研究发现,30%~50%的腹膜透析患者可出现CRP水平升高[14],除尿毒症毒素外,动脉粥样硬化性疾病、腹膜转运状态、残肾功能等均可影响腹膜透析患者血清CRP水平。多项研究证实,CRP可预测慢性肾脏病及透析患者心肌梗死、卒中等多种心血管疾病的结局及长期预后[13,15]。相比较传统的CRP而言,hsCRP敏感性更高。Wang等[12]对246例CAPD患者的研究发现,基线hsCRP水平高的患者,全因死亡率更高。一项横断面研究也证实,腹膜透析患者基线hsCRP水平是腹膜透析患者技术失败的独立危险因素[16]。然而,以往关于CRP与PD患者腹膜透析相关性腹膜炎预后的研究往往关注的是腹膜炎发生时的CRP为腹膜炎短期预后不良的独立危险因素[5],并未关注发生腹膜炎前、无腹膜炎状态下高hsCRP水平与腹膜炎预后的关系。本研究结果则显示,腹膜炎前无腹膜炎状态下高hsCRP可能是腹膜炎患者短期预后不良的独立危险因素,提示除感染状态下的急性炎症外,高炎症状态亦可影响腹膜炎患者的结局。Tonbul等[17]研究发现,营养不良—炎症—粥样硬化(MIA综合征)是透析患者常见的临床综合征。炎症不仅与营养不良密切相关,同时是全身血管动脉粥样硬化的危险因素[18]。本研究结果显示,基线动脉粥样硬化性血管疾病是腹膜透析相关性腹膜炎患者短期预后不良的独立危险因素,提示炎症与动脉粥样硬化疾病关系密切。在本研究中,短期预后不良患者感染前的hsCRP更高,合并临床粥样硬化性疾病的比例更高,提示动脉粥样硬化参与hsCRP对腹膜透析患者预后的影响。
有研究显示,高龄、合并糖尿病和心血管事件、抑郁、营养不良[9]、吸烟、低钠血症、高腹膜葡萄糖暴露[10]和抗生素治疗后腹膜透析液白细胞仍持续升高[19]等因素是腹膜炎患者预后不良的危险因素,但仅极少数研究对短期和长期预后进行了区分。以往研究对于腹膜透析时间与腹膜炎患者预后关系存在争议:Krishnan等[19]研究认为,腹膜透析时间是预测腹膜炎结局的独立危险因素,推测随着透析时间的延长,腹膜纤维化程度加重,腹腔巨噬细胞表面表达CD15的显著增加,提示长期腹透患者腹腔巨噬细胞成熟度下降[20],上述腹膜结构与功能的改变可能影响局部防御功能从而导致腹膜炎预后不良[21]。而Troidle等[22]则观察到,腹膜透析时间长的患者(>37个月)发生腹膜炎后拔管率显著低于腹膜透析时间短的患者(≤12个月),两者的死亡率则无差异;本研究结果显示,长的腹膜透析时间不是腹膜炎患者短期预后不良的危险因素,与Elsurerd等[23]研究结论类似。研究对象的种族、年龄、各中心致病菌谱及操作方式的差异等可能是导致上述研究结论不一致的原因之一。本研究没有观察到低蛋白血症和腹膜透析方式对预后的影响,最近澳大利亚一项多中心大样本量的注册性研究也证实APD与CAPD患者腹膜炎的短期预后及腹膜炎发生率无差异[24],与本研究结论相似。推测也可能与本队列样本量较小、血白蛋白小于30g/L和APD患者数少(21例,13.0%)有关。
本研究的局限性在于是一项单中心回顾性研究,今后尚需进行大样本量、多中心前瞻性研究来进一步验证感染前高hsCRP与腹膜炎预后的关系。
[1] Mehrotra R,Devuyst O,Davies SJ,et al. The current state of peritoneal dialysis [J]. J Am Soc Nephrol,2016,27(11):3238- 3252.DOI:10.1681/ASN. 2016010112.
[2] Boudville N,Kemp A,Clayton P,et al. Recent peritonitis associates with mortality among patients treated with peritoneal dialysis [J]. J Am Soc Nephrol,2012,23(8):1398- 1405. DOI:10.1681/ASN.2011121135.
[3] Cho Y,Johnson DW. Peritoneal dialysis-related peritonitis:towards improving evidence,practices,and outcomes [J]. Am J Kidney Dis,2014,64(2):278- 289. DOI:10.1053/j.ajkd.2014.02.025.
[4] Li PK,Szeto CC,Piraino B,et al. Peritoneal dialysis-related infections recommendations:2010 update [J]. Int Urol Nephrol,2010,30(4):393- 423. DOI:10.3747/pdi.2010.00049.
[5] Zalunardo NY,Rose CL,Ma IW,et al. Higher serum C-reactive protein predicts short and long-term outcomes in peritoneal dialysis-associated peritonitis [J]. Kidney Int,2007,71(7):687- 692. DOI:10.1038/sj.ki.5002127.
[6] Li PK,Szeto CC,Piraino B,et al. ISPD peritonitis recommendations:2016 update on prevention and treatment [J]. Perit Dial Int,2016,36(5):481- 508. DOI:10.3747/pdi.2016.00078.
[7] Flanigan MJ,Freeman RM,Lim VS. Cellular response to peritonitis among peritoneal dialysis patients [J]. Am J Kidney Dis,1985,6(6):420- 424.
[8] Ye H,Lin X,Qiu Y,et al. Higher alkaline phosphatase was associated with the short-term adverse outcomes of peritoneal dialysis-related peritonitis [J]. Clin Chem Lab Med,2015,53(4):e113-e116. DOI:10.1515/cclm- 2014- 0770.
[9] Perez Fontan M,Rodriguez-Carmona A,Garcia-Naveiro R,et al. Peritonitis-related mortality in patients undergoing chronic peritoneal dialysis [J]. Perit Dial Int,2005,25(3):274- 284.
[10] Jiang N,Zhang Z,Fang W,et al. High peritoneal glucose exposure is associated with increased incidence of relapsing and recurrent bacterial peritonitis in patients undergoing peritoneal dialysis [J]. Blood Purif,2015,40(1):72- 78. DOI:10.1159/000381663.
[11] Windgassen EB,Funtowicz L,Lunsford TN,et al. C-reactive protein and high-sensitivity C-reactive protein:an update for clinicians [J]. Postgrad Med,2011,123(1):114- 119. DOI:10.3810/pgm.2011.01.2252.
[12] Wang AY,Woo J,Lam CW,et al. Is a single time point C-reactive protein predictive of outcome in peritoneal dialysis patients [J]. J Am Soc Nephrol,2003,14(7):1871- 1879.
[13] Torzewski J,Torzewski M,Bowyer DE,et al. C-reactive protein frequently colocalizes with the terminal complement complex in the intima of early atherosclerotic lesions of human coronary arteries [J]. Arterioscler Thromb Vasc Biol,1998,18(9):1386- 1392.
[14] Herzig KA,Purdie DM,Chang W,et al. Is C-reactive protein a useful predictor of outcome in peritoneal dialysis patients [J]. J Am Soc Nephrol,2001,12(4):814- 821.
[15] Chen HY,Chiu YL,Hsu SP,et al. Elevated C-reactive protein level in hemodialysis patients with moderate/severe uremic pruritus:a potential mediator of high overall mortality [J]. QJM,2010,103(11):837- 846. DOI:10.1093/qjmed/hcq036.
[16] Liu SH,Li YJ,Wu HH,et al. High-sensitivity C-reactive protein predicts mortality and technique failure in peritoneal dialysis patients [J]. PLoS One,2014,9(3):e93063. DOI:10.1371/journal.pone.0093063.
[17] Tonbul HZ,Demir M,Altintepe L,et al. Malnutrition-inflammation-atherosclerosis (MIA) syndrome components in hemodialysis and peritoneal dialysis patients [J]. Ren Fail,2006,28(4):287- 294.
[18] Koo HM,Do HM,Kim EJ,et al. Elevated osteoprotegerin is associated with inflammation,malnutrition and new onset cardiovascular events in peritoneal dialysis patients [J]. Atherosclerosis,2011,219(2):925- 930. DOI:10.1016/j.atherosclerosis.2011.09.025.
[19] Krishnan M,Thodis E,Ikonomopoulos D,et al. Predictors of outcome following bacterial peritonitis in peritoneal dialysis [J]. Perit Dial Int,2002,22(5):573- 581.
[20] McGregor SJ,Topley N,Jorres A,et al. Longitudinal evaluation of peritoneal macrophage function and activation during CAPD:maturity,cytokine synthesis and arachidonic acid metabolism [J]. Kidney Int,1996,49(2):525- 533.
[21] Van Esch S,Krediet RT,Struijk DG. Prognostic factors for peritonitis outcome [J]. Contrib Nephrol,2012,178:264- 270. DOI:10.1159/000337889.
[22] Troidle L,Gorban-Brennan N,Kliger AS,et al. Effect of duration of chronic peritoneal dialysis therapy on the development of peritonitis [J]. Perit Dial Int,1999,19(4):376- 379.
[23] Elsurer R,Afsar B,Sezer S,et al. Peritoneal cells at admission:do they have prognostic significance in peritonitis [J]. Ren Fail,2010,32(3):335- 342. DOI:10.3109/08860221003611679.
[24] Lan PG,Johnson DW,McDonald SP,et al. The association between peritoneal dialysis modality and peritonitis [J]. Clin J Am Soc Nephrol,2014,9(6):1091- 1097. DOI:10.2215/CJN.09730913.
