原煤和氧化煤的低温氧化特性
2018-03-05李青蔚王彩萍
邓 军,李青蔚,肖 旸,王彩萍
0 引言
煤自燃灾害在世界主要产煤国家是十分普遍的,在我国新疆尤为严重,部分煤层的燃烧已经持续了几十年,甚至上百年[1]。煤的分子结构十分复杂,导致了煤自燃是一个涉及物理吸附、化学吸附以及化学反应等的复杂过程,并受多种因素的影响。例如,温度每升高10℃,煤的耗氧速率增加一倍,此外,CO,CO2氧化产物也与温度有关[2-3]。氧气作为参与反应的物质之一,也是一个非常重要的影响因素。研究表明,动力学参数随着氧浓度的降低而降低,不同的氧浓度范围导致不同的降低率[4-5]。此外,抑制剂和添加剂对煤自燃特性均有重要影响[6-10]。在矿井实际生产过程中,近距离煤层群开采有可能会引起邻近采空区贯通,使原采空区遗煤在漏风供氧的条件下再次发生氧化,此时的遗煤由于经历了初次氧化,自燃特性发生改变。Grzybek等的研究表明,氧化后煤表面的硫含量由于含硫物质的流动性而升高[11];Geng等通过X射线衍射发现,氧化作用使煤分子结构中形成碳氧化合物,且氧化温度越高,碳氧化合物含量越高,同时含氮元素结构呈现不同形式的变化[12];Xia等验证了Geng等的分析,并指出氧化后 C—C 和 C—H 基团含量降低[13-14]。此外,氧化作用也会对煤的浮选特性产生影响,研究表明,氧化后煤表面的亲水性基团增多而疏水性基团减少,导致氧化煤的亲水性增强,可燃物质的回收率降低[14-16]。马砺等研究了氯盐阻化剂对煤二次氧化过程的阻化作用[17-19];邓军等结合官能团变化,从微观角度分析了煤二次氧化过程中的气体变化[20-21];张辛亥等研究了遗煤二次氧化过程中耗氧和放热特性,并计算了自燃极限参数,发现遗煤二次氧化时的耗氧速率和放热强度在某一温度范围内和原煤发生交叉,而其自燃极限参数表明,遗煤二次氧化时的自燃条件更容易满足[22]。
目前关于氧化煤的研究多集中于宏观气体以及微观基团的变化规律,对于其自由基变化特征的研究较少。文中以潘集矿煤样为研究对象,通过恒温氧化法,人工制备90℃氧化煤。采用程序升温实验和电子自旋共振实验(ESR),对比分析了原煤和90℃氧化煤低温氧化阶段的CO浓度、自由基浓度变化规律,并基于CO浓度分阶段计算了煤低温氧化阶段的表观活化能,从CO浓度、表观活化能、自由基浓度3个不同的角度分析氧化煤自燃特性。
1 实验介绍
1.1 煤样制备
实验煤样采集自淮南矿区潘集矿。进行实验时,需制备原煤和氧化煤。氧化煤自燃是原煤经历过一次氧化自燃后,在满足煤自燃的条件(浮煤厚度、供风量、氧浓度等)时,再次发生的煤自燃现象,即煤的二次氧化过程。张辛亥等认为一次氧化过程中超过其临界温度后的煤样再次氧化升温称为二次氧化[22]。因此,在氧化煤样制备过程中,氧化温度应高于临界温度。此外,由于在实际生产过程中,当煤的温度超过临界温度后,煤的氧化自热加速,在此之前必须进行控制,也就是说大部分采空区遗煤的氧化温度低于临界温度,因此,氧化温度控制在90℃。制备煤样时,首先将煤样去除表面氧化层后进行破碎,筛分出粒径为0.106~0.150 mm(10g)的煤样用于电子自旋共振实验,0~0.9 mm,0.9 ~3 mm,3 ~5 mm,5 ~7 mm,7 ~10 mm(各360 g)的煤样用于程序升温实验。将筛分的煤样均分为2份(编号1和2),其中1#煤样作为原煤,2#煤样在90℃和空气环境中恒温氧化150 min(使煤样的氧化更加充分),之后将煤样自然冷却至室温作为氧化煤样备用。原煤和氧化煤的工业分析结果见表1.
从表1可以看出,在空气干燥基条件下,90℃氧化煤与原煤工业分析结果相差不大。氧化煤中仍含有一定的水分,导致这一现象的原因可能是氧化煤吸附空气中的水蒸气造成的。为了排除水分的影响,分别计算了灰分、挥发分和固定碳在三者总含量中的占比,见表2.

表1 原煤和氧化煤样的工业分析Tab.1 Proximate analysis of raw coal and oxidized coal wt/%

表2 灰分、挥发分和固定碳在三者总含量中的占比Tab.2 Ratio of ash,volatile,and fixed carbon to the total content of the three indices %
从表2可以看出,虽然90℃氧化煤的灰分、挥发分和固定碳占比和原煤相差不大,仍然可以看出,90℃氧化后的煤样挥发分占比略微降低,进而导致了灰分和固定碳占比相对增大。因为在原煤低温氧化过程中,煤中较为稳定的结构(如芳香环)不能活化参与反应,一些易与氧反应的小分子机构与氧反应被消耗,且由于氧化温度较低,氧化强度较弱,导致挥发分含量略微降低,而固定碳和灰分含量相对增大。
1.2 程序升温实验
程序升温系统如图1所示。该系统包括程序升温箱、供气系统、热电偶、炉体和气相色谱仪。炉体直径100 mm,高度220 mm;气体从炉体底部流入,经煤体后由顶部排出;炉体顶、底部设有预留空间,用于气流缓冲。实验时,将0~0.9 mm,0.9~3 mm,3~5 mm,5~7 mm,7~10 mm 5种粒径的煤样各取180 g混合均匀后装入炉体,气体流量恒定为120 mL/min,从30℃升温至170℃.升温过程中由控制面板控制升温速率为0.33℃/min,由热电偶监测煤体温度,每隔10℃设置气体采集温度点,并经气相色谱仪对气样进行分析。

图1 程序升温系统Fig.1 Temperature-programmed system
1.3 电子自旋共振实验(ESR)
电子自旋共振实验采用日本电子生产的JES-FA200型电子自旋共振波谱仪(X波段)。实验时,取0.106~0.150 mm 粒径煤样 5 mg装入试管,扫描温度为50,80,120,150和180 ℃,到达预设温度后恒定5 min,由电子自旋共振波谱仪对样品进行扫描(相关参数见表3),扫描过程中气体流量控制为60 mL/min.

表3 电子自旋共振实验参数Tab.3 Experimental parameters of ESR
2 实验结果及分析
2.1 CO 浓度
CO是重要的指标气体之一,由于其灵敏性较高,常用于预测预报煤自燃的程度。由于在煤样破碎过程中,机械扰动使得煤吸附的CO气体释放,因此认为实验测得的CO气体主要由煤氧复合产生。原煤和氧化煤的CO浓度及随温度的变化规律如图2所示。
从图2可以看出,原煤和氧化煤的CO浓度均随着温度的升高而增大,原煤和氧化煤分别在50℃和60℃以后CO浓度出现明显增加的趋势。这是因为CO是煤氧化的产物,在低温氧化的初始阶段,煤氧复合以吸附作用为主,氧化反应强度较弱,而随着温度的不断升高,煤分子中的结构不断活化并与氧反应,导致初始阶段的CO浓度较低,并随着温度的升高而增大。此外,原煤和氧化煤的CO浓度曲线在50至60℃之间发生交叉,在交叉温度之前氧化煤的CO浓度较高,超过交叉温度,原煤的CO浓度较高。这可能是因为,原煤经过氧化后,分子中的—OH等反应吸热的基团含量降低,使得反应放热量增大,同时初次氧化过程中的物理化学作用使得煤体表面结构发生变化,为煤氧反应提供较大的面积[23],促进煤氧化,而CO作为煤氧化的主要气体产物之一,氧化煤的CO浓度大于原煤。而随着温度的升高,原煤中反应吸热的基团含量由于反应消耗而降低。此外,氧化煤在初次氧化过程中部分易与煤反应的基团数量降低,此时原煤的氧化性高于氧化煤,CO浓度较高。本实验采用的潘集矿煤样交叉温度在50~60℃范围内,而对于不同煤样交叉温度可能会发生变化。

图2 原煤和氧化煤不同温度下的CO浓度Fig.2 CO concentrations of raw coal and oxidized coal at different temperatures
2.2 表观活化能
在低温氧化过程中,煤与氧反应生成CO和CO2以及其他产物,因此煤与氧的反应过程可表示为:煤+O2→m CO+g CO2+其他。仲晓星等利用该表达式推导了基于程序升温过程中CO浓度计算表观活化能的公式[24]
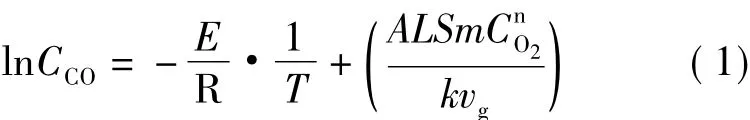
式中 CCO为出口CO浓度,10-6;E为表观活化能,kJ/mol;R 为气体常数,8.314 ×10-3kJ·mol-1·K-1;T为煤体热力学温度,K;A指前因子,s-1;L为煤体高度,m;S为煤体底面积,m2;m为化学反应系数;n为反应级数;k为换算系数,22.4×109;vg为供风量,m3/s;CO2为氧浓度,mol·m-3.
从式(1)可以看出,通过ln CCO和1/T的斜率可求得表观活化能E.原煤和氧化煤ln CCO和1/T的关系如图3所示。从图3可以看出,原煤和氧化煤的ln CCO与1/T的关系以50℃(1/T=0.003 1)为界呈阶段性变化,因此采用式(1)对原煤和氧化煤50℃前后的数据进行了线性拟合,拟合结果见表4,可以看出原煤和氧化煤ln CCO与1/T的线性关系非常明显,拟合度达到0.98以上。因此根据斜率计算了原煤和氧化煤2个阶段的表观活化能。

图3 原煤和氧化煤ln C CO与1/T的关系Fig.3 Relationship between ln C CO and 1/T for raw coal and oxidized coal
煤低温氧化阶段的表观活化能反映了煤氧反应所需的最小能量,表观活化能越小,煤氧反应越容易进行。从表4可以看出,在低温氧化阶段,原煤和氧化煤的表观活化能均随着反应的不断加剧而增大。这是因为煤分子是一种结构十分复杂的大分子,含有多种可与氧反应的基团。根据陆伟等提出的煤自燃逐步自活化理论[25],随着温度的升高,煤中在较低温度下不与氧反应的基团在较高温度下活性增强并参与反应,使得所需的能量增大,表观活化能增大;同时还可以看出,在50℃以下原煤和氧化煤的表观活化能远远小于60℃以上的表观活化能,原煤和氧化煤的表观活化能分别增加了约3倍和4.6倍,这表明在低温氧化的初始阶段,煤与氧的反应强度是相当弱的。

表4 利用式(1)对原煤和氧化煤的线性拟合结果Tab.4 Linear fitting results using equation(1)for raw coal and oxidized coal
此外,在50℃以前,原煤的表观活化能大于氧化煤;60℃以后,原煤的表观活化能小于氧化煤。这与CO浓度的变化规律一致。如2.1部分所述,其原因为氧化煤经过一次氧化后,比表面积的增大和吸热官能团的消耗等有利于煤氧复合的进行,反应需要的能量降低,表观活化能低于原煤;而随着温度的升高,由于一次氧化过程中活性官能团消耗并生成较为稳定的官能团,相同温度条件下,氧化煤反应所需的能量增大,表观活化能高于原煤。
2.3 自由基浓度
自由基浓度与波谱的吸收强度呈正比。在采用电子自旋共振实验分析煤氧化过程中的自由基浓度时,首先测定标准样品(Tempol,自旋数7.250 73 ×1014g-1),然后在实验条件相同的情况下通过式(2)测定待测样品的自由基浓度。煤分子的复杂性和基团种类的多样性决定了自由基种类的多样性,很难通过电子自旋共振扫描得到自由基的种类及浓度,因此测得的自由基浓度是多种自由基的表观值。

式中 Ng,Ns分别为待测样品和标样的自由基浓度,g-1;Ag,As分别为待测样品和标样 ESR波谱的积分面积。原煤和氧化煤的ESR图谱如图4所示,得到不同温度下的自由基浓度如图5所示。
煤氧作用时,氧分子与煤中的活性基团首先发生化学吸附,形成—O—O—,并与甲基、次甲基等反应形成烃类自由基,而烃类自由基可再与氧反应,生成过氧化物自由基,即煤中的自由基不断的产生和消耗,当自由基的产生速率大于消耗速率时,自由基浓度增大,反之则减小[26]。从图5(a)可以看出,在潘集矿原煤的自由基浓度随着温度的上升而逐渐增大,这是因为随着温度的升高,官能团不断活化,煤氧复合作用加强,导致自由基的生成速率大于消耗速率。氧化煤的自由基浓度随着温度的升高先降低后增大,拐点温度在80~100℃之间,而预氧化处理的温度为90℃,处于该温度范围内。因此推断导致氧化煤自由基浓度随温度变化趋势不同的原因为在预氧化处理过程中,大部分90℃以下能与氧反应的官能团被消耗,而只能在90℃以上与氧反应的官能团仍存在于煤中,当氧化煤在低于90℃氧化时,煤氧复合主要是消耗残留的自由基,而新生自由基较少,自由基的消耗速率大于产生速率,当温度超过90℃,仍有大量的官能团与氧反应,自由基的生成速率大于消耗速率,自由基浓度由降低转为升高。

图4 原煤和氧化煤不同温度下的ESR波谱Fig.4 ESR spectrums of raw coal and oxidized coal vs.temperatures
此外,从图5(a)还可以看出,氧化煤的自由基浓度大于原煤,其相对变化率在19.1% ~26.1%范围内。煤的自由基除了与氧反应外,自由基之间也会相互作用。当自由基浓度较大时,自由基之间的平均距离缩小,自由基之间相互作用的几率增大,反而会导致自由基浓度的降低[26]。因此导致原煤自由基浓度较低的原因可能是一方面其氧化过程中产生的自由基数量较多,自由基之间相互作用加强;另一方面大量的自由基与氧反应,使得其表观浓度较低。对比分析自由基浓度和CO浓度,可以看出在50~180℃范围内潘集矿原煤的CO浓度大于氧化煤,而自由基浓度小于氧化。叶敏等认为自由基浓度的大小不能直接用于判断煤的氧化性,并提出了根据自由基浓度增长率进行判断的方法,自由基浓度增长速率越快,煤的氧化性越强[26]。从图5(b)可看出,潘集矿的原煤自由基增长速率大于氧化煤,这与CO浓度的变化规律一致,验证了该观点,其原因为大量自由基与氧反应,产生了大量的CO气体。

图5 不同温度下原煤和氧化煤的自由基浓度及其变化率Fig.5 Free radical concentrations of raw coal and oxidized coal at different temperatures
3 结论
1)原煤和氧化煤的CO浓度随温度的升高而增大,且在初始阶段的CO浓度较低,增加较为缓慢;随着温度的升高,CO浓度逐渐增大,增速加快。氧化煤和原煤的CO浓度在一定温度范围内产生交叉(潘集矿煤样的交叉温度范围在50~60℃),交叉温度以前,氧化煤的CO浓度较大,交叉温度以后,原煤的CO浓度较大;
2)煤低温氧化阶段的表观活化能呈阶段性变化,且随着温度的升高而增大。在交叉温度以前,氧化煤的表观活化能较低,超过交叉温度,原煤的表观活化能较低。表明初始阶段,氧化煤的氧化性较高,而超过交叉温度,原煤的氧化性较高;
3)氧化煤的自由基浓度大于原煤,但自由基浓度的变化速率小于原煤。
[1] Strachera G B,Taylorb T P.Coal fires burning out of control around the world:thermodynamic recipe for environmental catastrophe[J].International Journal of Coal Geology,2004,59(1):7 -17.
[2] Baris K,Kizgut S,Didari V.Low-temperature oxidation of some Turkish coals[J].Fuel,2012,93(1):423-432.
[3] Yuan L,Smith A C.Experimental study on CO and CO2emissions from spontaneous heating of coals at varying temperatures and O2concentrations[J].Journal of Loss Prevention in the Process Industries,2013,26(6):1321-1327.
[4] Qi G,Wang D,Zheng K,et al.Kinetics characteristics of coal low-temperature oxidation in oxygen-depleted air[J].Journal of Loss Prevention in the Process Industries,2015,35:224 -231.
[5] Liu B,Zhang Z,Zhang H,et al.An experimental investigation on the effect of convection on the ignition behaviour of single coal particles under various O2concentrations[J].Fuel,2014,116(6):77 -83.
[6] Clemens A H,Matheson T W.The role of moisture in the self-heating of low-rank coals[J].Fuel,1996,75(7):891-895.
[7] 文 虎,张福勇,金永飞,等.硫对煤自燃特性参数影响的实验研究[J].煤矿安全,2011,42(10):5 -7.WEN Hu,ZHANG Fu-yong,JIN Yong-fei,et al.Experiment research on effect of sulfur on characteristic parameters of coal spontaneous combustion[J].Safety in Coal Mines,2011,42(10):5 -7.
[8] Watanabe W S,Zhang D K.The effect of inherent and added inorganic matter on low-temperature oxidation reaction of coal[J].Fuel Processing Technology,2001,74(3):145-160.
[9] Taraba B,Peter R,Slov k V.Calorimetric investigation of chemical additives affecting oxidation of coal at low temperatures[J].Fuel Processing Technology,2011,92(3):712-715.
[10] Wang D,Dou G,Zhong X,et al.An experimental approach to selecting chemical inhibitors to retard the spontaneous combustion of coal[J].Fuel,2014,117(5):218-223.
[11] Grzybek T,Pietrzak R,Wachowska H.X-ray photoelectron spectroscopy study of oxidized coals with different sulphur content[J].Fuel Processing Technology,2002,S77-78(1):1-7.
[12] Geng W,Kumabe Y,Nakajima T,et al.Analysis of hydrothermally-treated and weathered coals by X-ray photoelectron spectroscopy(XPS)[J].Fuel,2009,88(4):644-649.
[13] Xia W,Yang J.Changes in surface properties of anthracite coal before and after inside/outside weathering processes[J].Applied Surface Science,2014,313(18):320-324.
[14] Xia W,Xie G,Liang C,et al.Flotation behavior of dif-ferent size fractions of fresh and oxidized coals[J].Powder Technology,2014,267:80 -85.
[15] Jena M S,Biswal SK,Rudramuniyappa M V.Study on flotation characteristics of oxidised Indian high ash subbituminous coal[J].International Journal of Mineral Processing,2008,87(1 -2):42 -50.
[16] Xia W,Yang J.Effect of pre-wetting time on oxidized coal flotation[J].Powder Technology,2013,250(12):63-66.
[17] 马 砺,任立峰,艾绍武,等.氯盐阻化剂抑制煤初次和二次氧化特性的实验研究[J].矿业安全与环保,2015,42(1):1 -4.MA Li,REN Li-feng,AI Shao-wu,et al.Experimental study of using chlorate inhibitor for inhibiting initial and secondary coal oxidation[J].Mining Safety and Environmental Protection,2015,42(1):1 -4.
[18] 马 砺,向 崎,任立峰.阻化煤样的初次/二次氧化特性实验研究[J].西安科技大学学报,2015,35(6):702-707.MA Li,XIANG Qi,REN Li-feng.Experimental study on the primary/secondary oxidation characteristics of inhibited coal sample[J].Journal of Xi’an University of Science and Technology,2015,35(6):702 -707.
[19] 段志勇,王 飞.MgCl2对煤一次氧化与二次氧化影响的实验研究[J].煤矿安全,2017,48(6):13-15.DUAN Zhi-yong,WANG Fei.Influence of MgCl2on initial oxidation and secondary oxidation of coal[J].Safety in Coal Mines,2017,48(6):13 -15.
[20] 邓 军,赵婧昱,张嬿妮,等.低变质程度煤二次氧化自燃特性试验[J].煤炭科学技术,2016,44(3):49-54.DENG Jun,ZHAO Jing-yu,ZHANG Yan-ni,et al.Experiment on secondary oxidation spontaneous combustion characteristics of low metamorphic degree coal[J].Coal Science and Technology,2016,44(3):49 -54.
[21] 邓 军,赵婧昱,张嬿妮,等.不同变质程度煤二次氧化自燃的微观特性试验[J].煤炭学报,2016,41(5):1164-1172.DENG Jun,ZHAO Jing-yu,ZHANG Yan-ni,et al.Micro-characteristics of spontaneous combustion of second oxidation with different rank coals[J].Journal of China Coal Society,2016,41(5):1164 -1172.
[22] 张辛亥,李青蔚,肖 旸,等.遗煤二次氧化过程中自燃极限参数变化规律试验[J].安全与环境学报,2016,16(4):101 -106.ZHANG Xin-hai,LI Qing-wei,XIAO Yang,et al.Experiment study on the limit parameters of the forsaken coal spontaneous combustion in the re-oxidation process[J].Journal of Safety and Environment,2016,16(4):101-106.
[23] 邓 军,赵婧昱,张嬿妮,等.陕西侏罗纪煤二次氧化自燃特性试验研究[J].中国安全科学学报,2014,24(1):34-40.DENG Jun,ZHAO Jing-yu,ZHANG Yan-ni,et al.Experimental study on spontaneous combustion characteristics of secondary oxidation Jurassic coal[J].China Safety Science Journal,2014,24(1):34 -40.
[24] 仲晓星,王德明,尹晓丹.基于程序升温的煤自燃临界温度测试方法[J].煤炭学报,2010,35(S1):128-131.ZHONG Xiao-xing,WANG De-ming,YIN Xiao-dan.Test method of critical temperature of coal spontaneous combustion based on temperature programmed experiment[J].Journal of China Coal Society,2010,35(S1):128-131.
[25] 陆 伟,胡千庭,仲晓星,等.煤自燃逐步自活化反应理论[J].中国矿业大学学报,2007,36(1):111-115.LU Wei,HU Qian-ting,ZHONGXiao-xing,et al.Gradual self-activation reaction theory of spontaneous combustion of coal[J].Journal of China University of Mining and Technology,2007,36(1):111 -115.
[26] 叶 敏,戴广龙.低温氧化煤自由基的顺磁共振实验研究[J].洁净煤技术,2006,12(1):53 -55.YE Min,DAI Guang-long.Investigation of the low temperature oxidation coal free radical with the electron paramagnetic resonance[J].Clean Coal Technology,2006,12(1):53 -55.
