喉癌组织中CD3表达的研究
2018-03-05李满意刘济生周慧吴文璎肖根生于亚峰
李满意 刘济生 周慧 吴文璎 肖根生 于亚峰
颈部肿瘤约占全身肿瘤的5%。最常见的喉癌的组织学类型是鳞状细胞癌。不同的研究项目表明T淋巴细胞可能在肿瘤发生中有重要意义[1]。iNKT细胞是一种新的T细胞亚群,对抗肿瘤细胞具有细胞毒活性。iNKT细胞数量占CD3+ T细胞总量的0.005%~0.200%。一般来说,NKT细胞的定义是表达T细胞受体和NK细胞分子在其表面(如CD161)的CD3+ T细胞。 NKT细胞分为I型、II型和NKT样细胞。NKT样细胞是一种具有记忆表型的T细胞亚群。目前癌症TNM分类及组织学亚型,是临床治疗决策和评估预后可用的最可靠的指南。然而,临床经常遇到许多患者TNM分期及组织学亚型相同,治疗方案相同,预后结果可能会不同。肿瘤浸润淋巴细胞(TILs),可能严重影响着癌症患者预后结果。一些研究提出“免疫微环境”,包括免疫细胞类型、密度和免疫细胞的分布,都以有利或有害的方式影响肿瘤患者的预后[2]。特别是肿瘤浸润淋巴细胞(TILs),在人类许多恶性肿瘤中与改善生存预后关系密切[3]。在结直肠癌病灶中,对CD3+的CD8+ TIL T细胞浸润的密度和分布研究,发现用以评估肿瘤患者预后,比传统TNM分期及组织学分类更为精准[3]。本研究的目的是初探CD3+的CD8+ TIL T细胞在喉鳞癌病灶、正常喉黏膜中的分布情况及二者间的关系。
1 材料和方法
1.1 临床资料
本研究选取苏州大学附属第一医院耳鼻咽喉科选择2013年1月1日—2016年12月31日的手术治疗及病理证实50例喉癌为喉癌组,10例正常喉黏膜作为对照组。喉癌组:男性49例,女性1例,年龄42~84岁,平均为(56.0±3.6)岁。术前均未行术前放疗及全身化疗,所有患者术前均签署知情同意书。病理分级:高分化18例,中分化20例,低分化12例,病理检查为鳞癌,淋巴结转移11例,无淋巴结转移39例。TNM分期是根据1987年国际抗癌联盟(UICC)第四版进行的,其中,包括I期17例,II期9例,III期14例,IV期10例;声门上型12例,声门型30例,声门下型8例。
1.2 方法
1.2.1 石蜡切片 先脱蜡,再重新进行使用标准方案水化,通常在10 ml柠檬酸盐缓冲液(pH 6.0)中温育来进行.后用磷酸盐缓冲液(PBS)冲洗3次,再将它们浸入3%过氧化氢溶液中10分钟以阻断内源性过氧化物酶。通过孵育,用5%正常山羊或兔血清20分钟阻断非特异性抗体结合。然后添加CD3抗体(福建迈新生物科技有限公司)在4℃孵育过夜,后载玻片用PBS洗涤,用辣根过氧化物酶(北京中山生物技术有限公司)通过温育检测抗体结合,加二氨基联苯胺溶液一滴,用苏木精复染。
1.2.2 免疫组化方法 本研究采用SP法,严格按照试剂盒说明书进行操作,免疫组化检测设定阳性、阴性和空白对照。
1.2.3 结果标准 在喉癌中,CD3免疫染色得分如下:得分(-):在肿瘤的任何部分都未检测到染色。评分(+):0%~25%的肿瘤细胞呈阳性染色。评分(++):25%~50%的肿瘤细胞呈阳性染色。评分(+++):50%~75%的肿瘤细胞呈阳性染色。评分(++++):75%~100%的肿瘤细胞呈阳性染色。随机观察至少10个高倍视野(10×40)中的每一个的喉鳞状细胞癌和正常组织切片。以上所有由病理学家进行双盲阅读并记录所有切片。
1.3 统计学分析
采用SPSS 17.0软件对数据进行分析处理,计量资料以(均数±标准差)表示;计数资料以(n,%)表示,采用χ2检验,采用Spearman相关分析,以P<0.05表示差异具有统计学意义。
2 结果
CD3在喉癌中的表达:从表1可见,喉癌组CD3的阳性表达率和阴性表达率为84.0%,高于正常对照组(正常喉黏膜)阳性率为20.0%。喉癌组织中CD3的阳性表达率与正常喉黏膜组织的阳性表达率对比,差异有统计学意义(P<0.05)。(图1~3)CD3与局部淋巴结转移、肿瘤分区、性别呈负相关,与年龄分组、T分类、病理分化程度、临床分期无明显相关性(表2)。

表1 CD3在喉癌组织和正常喉部黏膜中的表达 [n(%)]

表2 CD3表达与喉癌临床病理特征的关系(n)

图 1 (SP staining,×200)正常喉黏膜中见极少量CD3表达

图 2(SP staining,×200) 喉癌组织中见较多CD3表达
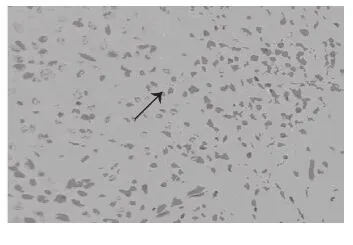
图 3 (SP staining,×200)有淋巴结转移喉癌组织中见少量CD3
3 讨论
研究已证实小鼠和人类的肿瘤病灶内都存在着免疫细胞的浸润。通过对免疫缺陷小鼠的实验证明了适应性免疫应答在癌症免疫监视中的作用。肿瘤细胞可以表达抗原并成为T细胞介导的适应性免疫应答的靶点。在小鼠的实验中发现,免疫细胞似乎在阻止肿瘤的发生并抑制肿瘤的进展[4]。抗肿瘤免疫也同时会引起免疫编辑,这促使肿瘤细胞降低免疫原性从而利于肿瘤的生长.截至目前,人类肿瘤病灶中免疫细胞的作用及相关机制尚不十分清楚。免疫细胞可以释放炎症介质,发挥促血管生成和促肿瘤细胞发生转移的作用[4,6]。黑色素瘤、结直肠癌和卵巢癌中的肿瘤浸润淋巴细胞已被证明具有抑制肿瘤细胞生长功能,并可以一定程度上改善肿瘤患者的预后[5-7]。接受抗原刺激后,小部分抗原特异性记忆T细胞仍存在于病变组织中这些抗原特异性记忆T细胞通过适应性免疫应答在阻止肿瘤复发中起重要作用。结直肠早期肿瘤内高浸润密度的T细胞不仅可以抑制肿瘤细胞向淋巴管和周围神经结构侵犯,而且可以降低肿瘤远处转移率[8]。由此可以猜测在肿瘤早期阶段,其复发时间和总体生存率在一定程度上决定于局部适应性免疫状态。这也就可以解释为什么一些Ⅰ期和Ⅱ期喉癌患者预后较差的原因。有研究报道50例下唇癌患者,肿瘤浸润淋巴细胞的分布密度与肿瘤的侵袭程度呈负相关。本研究结果证实喉鳞状细胞癌中CD3的过表达和正常喉黏膜中CD3的低表达,表明CD3是喉癌组织依赖性表达。喉癌组织中CD3的表达呈正相关(P<0.05)。CD3与局部淋巴结转移呈负相关(r=-0.823,P<0.05)。尽管本研究不能得出CD3+ T细胞和肿瘤侵袭程度的确切关系,但是可以初步确认的是,CD3+ T细胞和肿瘤侵袭程度二者可以互为补充,更为准确的评估肿瘤的复发和生存率。值得注意的是,肿瘤浸润淋巴细胞与肿瘤侵袭程度分期二者任何一个都不能针对所有肿瘤患者作出关于复发及预后的准确评估。故不妨可考虑同时应用二者对肿瘤患者进行分层风险评估。既往许多研究与本研究结果都提示原发肿瘤的浸润深度直接关系着肿瘤的潜在转移率。总之,本研究提示联合应用CD3检测及TNM分期、组织学分级可能对喉鳞癌的复发、预后作出更为准确的评估。
[1]Kardasz-Ziomek M,Scierski W,Namysłowski G,et al.[Long term results of partial laryngectomies in patients suffering from laryngeal cancer][J].Otolaryngol Pol,2012,66(1):46-50.
[2]Galon J,Angell HK,Bedognetti D,et al.The continuum of cancer immunosurveillance: prognostic, predictive, and mechanistic signatures[J].Immunity,2013,39(1):11-26.
[3]Galon J,Costes A,Sanchez-Cabo F,et al.Type, density, and location of immune cells within human colorectal tumors predict clinical outcome[J].Science,2006,313(5795):1960-1964.
[4]袁晓东,刘晓平.记忆T细胞亚群与抗感染和肿瘤免疫[J].岭南现代临床外科,2012,12(4):385-388.
[5]崔京远,马红,马文慧,等.结肠癌组织中Cyr61和HPA-1的表达水平及其在侵袭转移中的作用[J].中国现代普通外科进展,2012,15(6):439-443.
[6]秦彩娟.原发卵巢癌及卵巢之转移性结肠癌组织中CDX-2与CK7和CK20的表达及其临床意义[J].中国医药导报,2012,9(18):26-27.
[7]张妍,崔保霞,马道新,等.Th17细胞联合CD3+CD8-IL-21+T细胞升高与宫颈癌发生发展的关系[J].中国病理生理杂志,2011,27(6):1103-1108.
[8]Yamada S,Yanamoto S,Naruse T,et al.Skp2 Regulates the Expression of MMP-2 and MMP-9, and Enhances the Invasion Potential of Oral Squamous Cell Carcinoma[J].Pathol Oncol Res,2016,22(3):625-632.
