内生假单胞菌对小麦生长及光合特性的影响
2018-03-05庞发虎黄思良赵晨晨
庞发虎,黄思良,赵晨晨
(1.南阳师范学院农业工程学院,河南南阳 473061;2.南水北调中线水源区水安全河南省协调创新中心/河南省南水北调中线水源区生态安全重点实验室,河南南阳 473061)
内生菌是指生活在健康的植物体内,对植物没有引起明显病害症状的微生物。内生菌在长期的适应过程中与宿主植物协同进化,建立了互惠和谐的共生关系,已成为国内外研究的热点[1]。内生菌产生的代谢物质能刺激植物的生长和发育,而植物能为内生菌提供光合产物和矿物质并通过种子帮助其传播[2-3]。有关内生菌影响宿主植物的光合作用已有一些报道,如Richardson等用内生菌处理2种不同基因型的牛毛草后,发现其净光合速率之间确实存在着差异[4];沈德龙等研究发现用内生成团泛菌PantoeaagglomeransYS19接种水稻后可明显提高水稻旗叶乳熟期的光合速率[5]。史应武从甜菜根中分离出1株多黏类芽孢杆菌S7,用该菌接种甜菜后可使叶片的净光合速率提高16.11%[6]。
目前对植物光合作用的研究多集中在非生物因素,而对于生物因子,尤其是植物内生菌对宿主植物光合特征的影响研究较少。Larran等都对小麦的内生菌进行分离鉴定[7-9],但有关小麦内生细菌对小麦的光合特性及产量的影响,国内外还鲜有报道。因此本研究用内生假单胞菌JD204接种不同品种小麦后,分析内生假单胞菌对小麦的生长及光合特性的影响,探讨内生假单胞菌影响光合参数的机制,揭示小麦内生假单胞菌与产量的关系,以期为促进小麦的生长和发育提供参考依据,为防病增产的新型生物有机肥料开发奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 供试品种 供试的14个小麦品种(新源958、豫农416、豫麦130、金丰3号、矮优66、豫麦69、中育12、高优503、偃高006、郑麦9023、开麦20、众连1号、濮麦9号和矮抗吨产王)购自河南省南阳市种子公司。
1.1.2 供试菌株 菌株为小麦分蘖期分离自根部的1株内生恶臭假单胞菌JD204,并对其进行了抗药性标记,获得抗药性突变株JD204M,保存于南阳师范学院植物病理学实验室。
1.1.3 内生假单胞菌悬浮液的制备 将抗药突变株JD204M在NA平板上活化后,挑取2~3个环接种于NB培养基中,在160 r/min、30 ℃摇床上培养24 h,然后调菌体悬浮液浓度为107CFU/mL备用。
1.2 试验方法
1.2.1 试验设计 于2014年10月上旬用抗药性变异株JD204M的菌体悬浮液(107CFU/mL)分别浸泡14个小麦品种种子,1 mL菌体悬浮液浸泡4 g小麦种子,浸泡24 h后分别播种于南阳国家农业科技示范园区试验地(112°27′49″E、32°57′6″N)中,麦地常规深耕碎土,整理平整。施肥量为 750 kg/hm2复合肥(18% N,18% P2O5,9% K2O)。试验采用随机区组设计,共28个处理,每处理重复3次,每处理面积为2 m×2 m(播种量80 g),每个处理播种8行,以纯NB培养液浸泡麦种为对照。
1.2.2 分蘖数的调查和株高的测定 在分蘖期对田间小麦分蘖数进行调查,用直尺测量小麦株高。每小区采用5点调查法,每点调查20株,取其平均值。每个处理重复3次。
1.2.3 根系活力和叶绿素含量的测定 参照张志良等的方法[10]进行。
1.2.4 光合参数的测定 2015年5月上旬,于晴天上午 09:00—11:00进行测定。采用TPS-1便携式光合仪,对JD204M处理区和对照区小麦光合参数净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)进行测定[11]。每处理选择长势一致的小麦苗,每株测定叶龄相对一致的成熟顶生叶片,每个处理至少测定6次重复。
1.2.5 荧光参数的测定 采用Imaging-PAM荧光仪(Heinz Walz GmbH,Germany)于5月上旬晴天上午09:00—11:00进行测定。选取生长良好的叶片暗适应20 min后测定初始荧光(Fo)、最大荧光(Fm);在光适应(5 min)下测定Fm′、Fo′及Fs等荧光参数。根据测得的荧光参数计算:光系统Ⅱ最大光化学效率Fv/Fm=(Fm-Fo)/Fm;PSⅡ实际光化学效率:ΦPSⅡ=(Fm′-Fs)/Fm′。每个处理分别测定8次。
1.3 数据处理
采用Excel 2007进行数据处理,用SPSS 17.0软件进行方差分析和多重比较(LSD法,α=0.05)。
2 结果与分析
2.1 JD204M对小麦分蘖数的影响
从表1可以看出,用内生假单胞菌变异株JD204M处理小麦种子后能提高小麦植株的分蘖数。不同小麦品种提高幅度各异,其分蘖数虽高于各自的对照,但两者之间差异不显著。在14个品种中,郑麦9023分蘖数增加最多,比对照提高34.15%,其次为豫农416和矮优66,分别比对照增加27.91%、27.27%;中育12内生菌处理后与对照相比几乎无变化。
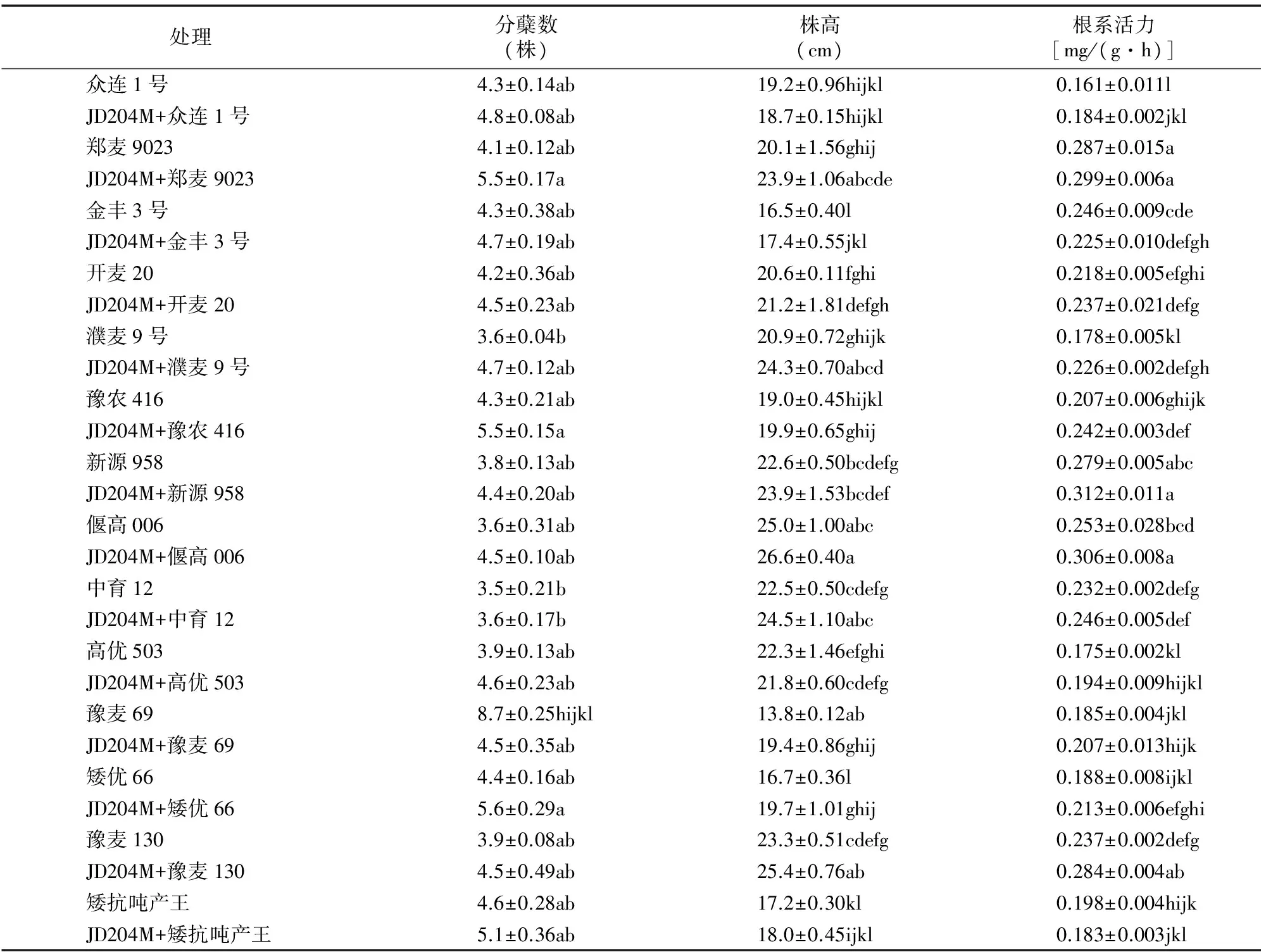
表1 内生细菌JD204M处理对小麦植株分蘖数、株高和根系活力的影响
注:同列数据后不同小写字母表示在0.05水平上差异显著。下表同。
2.2 JD204M对小麦株高的影响
试验结果(表1)表明,用内生菌变异株JD204M处理后对不同品种小麦株高的影响各异。14个品种中,有12个(豫农416、金丰3号、中育12、濮麦9号、郑麦9023、开麦20、矮优66、新源958、豫麦130、豫麦69、偃高006和矮抗吨产王)株高比对照增加了2.91%~40.58%(平均11.73%),2个品种(众连1号和高优503)分别比对照降低2.60%和2.24%。矮优66、濮麦9号、郑麦9023、豫麦69和豫麦130小麦株高与各自的对照相比在0.05水平上达到显著差异。
2.3 JD204M对小麦植株根系活力的影响
表1的结果显示,JD204M对不同小麦植株根系活力的影响有差异。4个JD204M处理的小麦品种(濮麦9号、豫农416、偃高006和豫麦130)植株的根系活力与各自对照相比差异显著。12个小麦品种(矮优66、高优503、中育12、濮麦9号、郑麦9023、开麦20、豫农416、新源958、豫麦69、偃高006、豫麦130和众连1号)的根系活力比对照增加4.18%~26.96%(平均13.81%),金丰3号和矮抗吨产王根系活力分别比对照降低8.54%和7.58%。
2.4 JD204M对小麦叶片叶绿素含量的影响
由表2可以看出,用内生菌变异株JD204M处理后有4个品种(中育12、金丰3号、豫麦69和众连1号)小麦叶片的叶绿素a含量分别小于各自的对照,7个品种(中育12、新源958、偃高006、金丰3号、郑麦9023、众连1号、矮优66)与对照之间具有显著性差异;有3个品种(金丰3号、众连1号、豫麦69)叶绿素b含量小于对照,8个品种(开麦20、新源958、偃高006、金丰3号、豫麦130、郑麦9023、众连1号和矮抗吨产王)与对照之间差异显著;有4个品种(中育12、金丰3号、豫麦69和众连1号)总的叶绿素含量小于对照,除了高优503、开麦20、豫农416外其余品种与对照之间都具有显著性差异。10个品种小麦叶片总叶绿素含量比对照增加3.24%~12.78%(平均7.64%)。
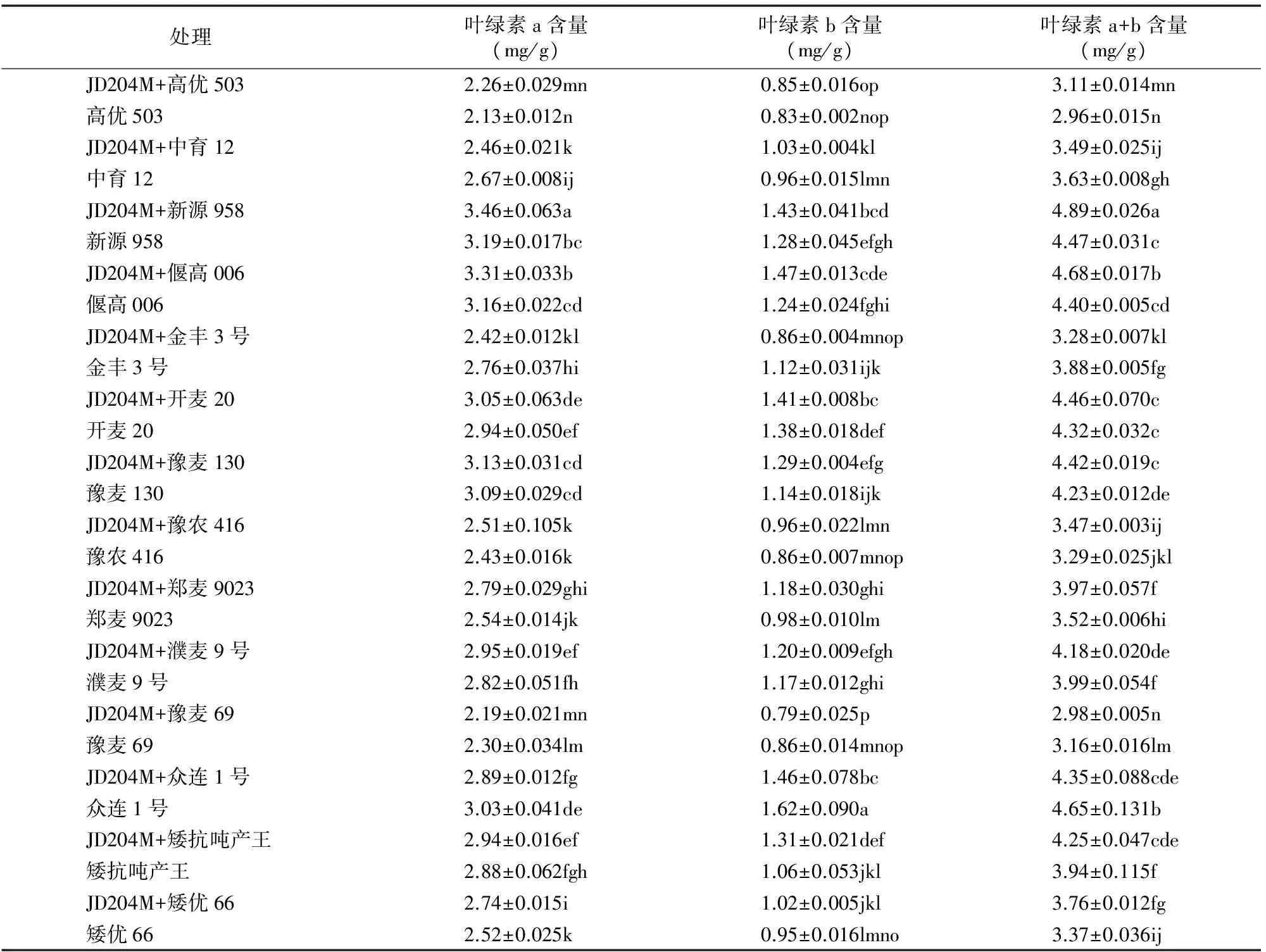
表2 JD204M对小麦植株叶片叶绿素含量的影响
2.5 JD204M对小麦叶片光合特性的影响
2.5.1 JD204M对小麦叶片净光合速率(Pn)的影响 由表3可以看出,接种JD204M后有4个品种(中育12、金丰3号、豫麦69和众连1号)的Pn与对照相比有所降低,其余10个品种(高优503、新源958、偃高006、开麦20、豫麦130、豫农416、郑麦9023、濮麦9号、矮抗吨产王、矮优66)的Pn与对照相比分别增加了20.69%、25.95%、22.82%、16.41%、20.51%、3.33%、14.01%、7.39%、9.20%和21.44%,表明内生假单胞菌可以提高多个小麦品种的光合速率,增强光合活性,有利于叶片对光能的吸收。经过统计分析,中育12、新源958、偃高006这3个品种与对照间具有显著性差异。
2.5.2 JD204M对小麦叶片蒸腾速率(Tr)的影响 由表3可知,用JD204M处理后3个品种(中育12、豫麦69和众连1号)小麦叶片的Tr小于对照,其余11个小麦品种叶片的Tr比对照增加0.41%~20.56%(平均10.74%),2个品种(新源958和开麦20)小麦叶片的Tr与对照相比差异显著,表明小麦接种内生菌后能提高叶片的Tr。
2.5.3 JD204M对小麦叶片气孔导度(Gs)的影响 试验结果(表3)表明,用JD204M处理后3个品种(中育12、豫麦69和众连1号)小麦叶片的Gs小于对照,11个小麦品种叶片的Gs比对照增加3.63%~42.33%(平均20.79%),5个品种(中育12、新源958、偃高006、豫麦130、豫农416)接种内生菌后叶片的Gs与对照相比具有显著性差异,表明内生菌可提高多个小麦品种叶片的Gs,有利于CO2气体的交换和光合速率的增加。
2.5.4 JD204M对小麦叶片胞间CO2浓度(Ci)的影响 由表3可以看出,用JD204M处理后,中育12、金丰3号、豫农416、豫麦69和众连1号品种小麦叶片的Ci高于对照,其余9个品种(高优503、新原958、偃高006、开麦20、豫麦130、郑麦9023、濮麦9号、矮抗吨产王和矮优66)叶片Ci分别比对照降低了9.16%、16.88%、15.31%、13.93%、20.78%、18.96%、8.96%、9.33%和8.71%;新源958、金丰3号、开麦20、豫麦130和郑麦9023接种JD204M后Ci与对照间差异显著。
2.6 JD204M对小麦叶片荧光特性的影响
2.6.1 JD204M对小麦叶片Fv/Fm的影响Fv/Fm值一般是在叶片暗适应20 min后测得,反映经充分暗适应小麦叶片PSⅡ的最大光化学效率,常作为度量植物叶片PSⅡ原初光能转换效率及PSⅡ潜在活性的指标[12]。由表4可以看出,用JD204M接种后,不同小麦品种间Fv/Fm值变化有所差异。除金丰3号、豫麦69和众连1号外,其余小麦品种叶片的Fv/Fm值与对照相比均有所增加,但增加的幅度变化不大,且与对照间均无显著性差异。
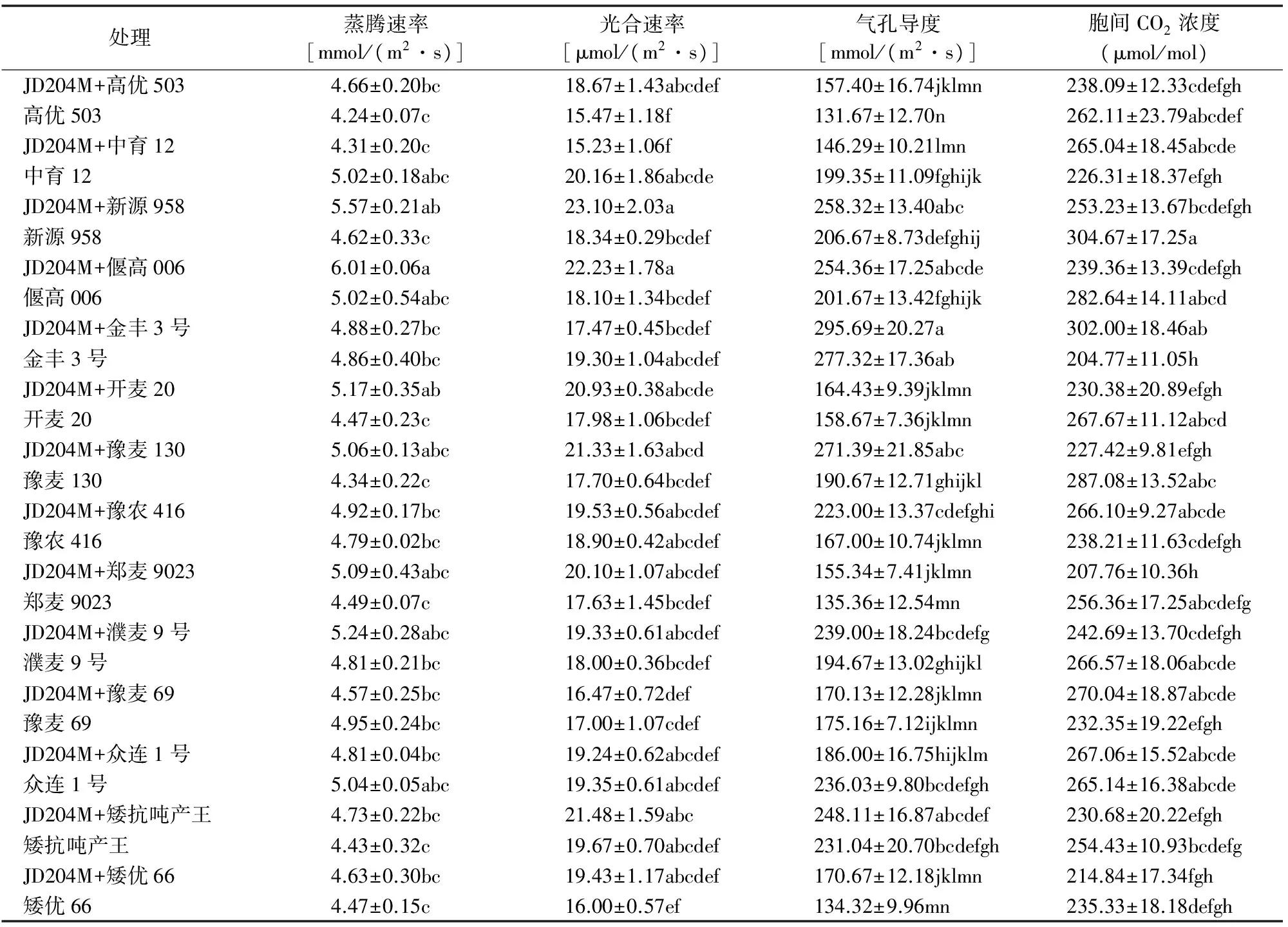
表3 JD204M对小麦植株光合特性的影响
2.6.2 JD204M对小麦实际光化学效率(ΦPSⅡ)的影响ΦPSⅡ是PSⅡ实际光化学效率,指光合电子传递的能量占吸收光能的比例,反映了在光照条件下PSⅡ反应中心部分关闭的情况下的实际原初光能捕获效率[13]。由表4可知,用JD204M处理后12个小麦品种(矮优66、高优503、中育12、濮麦9号、郑麦9023、开麦20、豫农416、新原958、矮抗吨产王、偃高006、豫麦130和众连1号)的实际光化学效率(ΦPSⅡ)与对照相比均有所提高,其中矮抗吨产王和新原958小麦叶片实际光化学效率(ΦPSⅡ)分别比对照增加24.23%和22.20%,达到显著差异,其余品种与对照间均无显著性差异。
2.6.3 JD204M对小麦Fv/Fo的影响Fv/Fo值反映PSⅡ的潜在活性。由表4可以看出,用JD204M处理后3个品种(金丰3号、豫麦69和众连1号)小麦叶片的Fv/Fo与对照相比降低,11个品种(中育12、高优503、新原958、偃高006、开麦20、豫麦130、豫农416、郑麦9023、濮麦9号、矮抗吨产王和矮优66)小麦叶片的Fv/Fo与对照相比分别增加了18.46%、10.63%、14.26%、21.83%、23.50%、18.68%、28.08%、3.79%、21.98%、27.50%和25.47%,但均无显著性差异。
3 讨论
叶绿素含量的高低与小麦产量密切相关。莫瑶等研究发现,接种固氮菌对4个不同甘蔗品种的叶绿素含量提高均有一定的促进作用,且不同品种之间有差异[14-15]。用内生细菌yc8接种后,不同油菜品种的叶绿素含量均有一定程度的提高[16]。本研究结果表明,用JD204M处理后,10个品种小麦叶片的叶绿素a含量高于对照,11个品种叶绿素b含量高于对照,10个品种总叶绿素含量比对照增加 3.24%~12.78%(平均7.64%)。有研究认为叶绿素a有利于吸收长波光,叶绿素b有利于吸收短波光,当叶绿素a/叶绿素b值减少时,能提高叶片光合活性[17]。本研究得出凡是叶绿素a/叶绿素b值小于对照的品种,其小麦产量都高于对照,这与周竹青等研究认为高产小麦品种的总叶绿素含量维持在较高水平,叶绿素a/叶绿素b相对较低,说明该类型品种有较强的光能利用率的研究结果[18]相一致。但也有一些品种与赵昕等研究认为接种AM真菌后,喜树叶片叶绿素a/叶绿素b显著高于无菌根幼苗的结果[19]相一致,这可能与不同的微生物对光合色素的化学特性影响以及不同植物对光强的响应不同有关。
光合参数在一定程度上能很好地反映小麦的抗逆性程度。尤扬等认为胞间CO2浓度(Ci)与光合速率呈负相关[20]。王金龙等对黑麦草研究发现,内生真菌的感染对其宿主植物的蒸腾速率、光合速率以及生物量都有显著影响[21]。
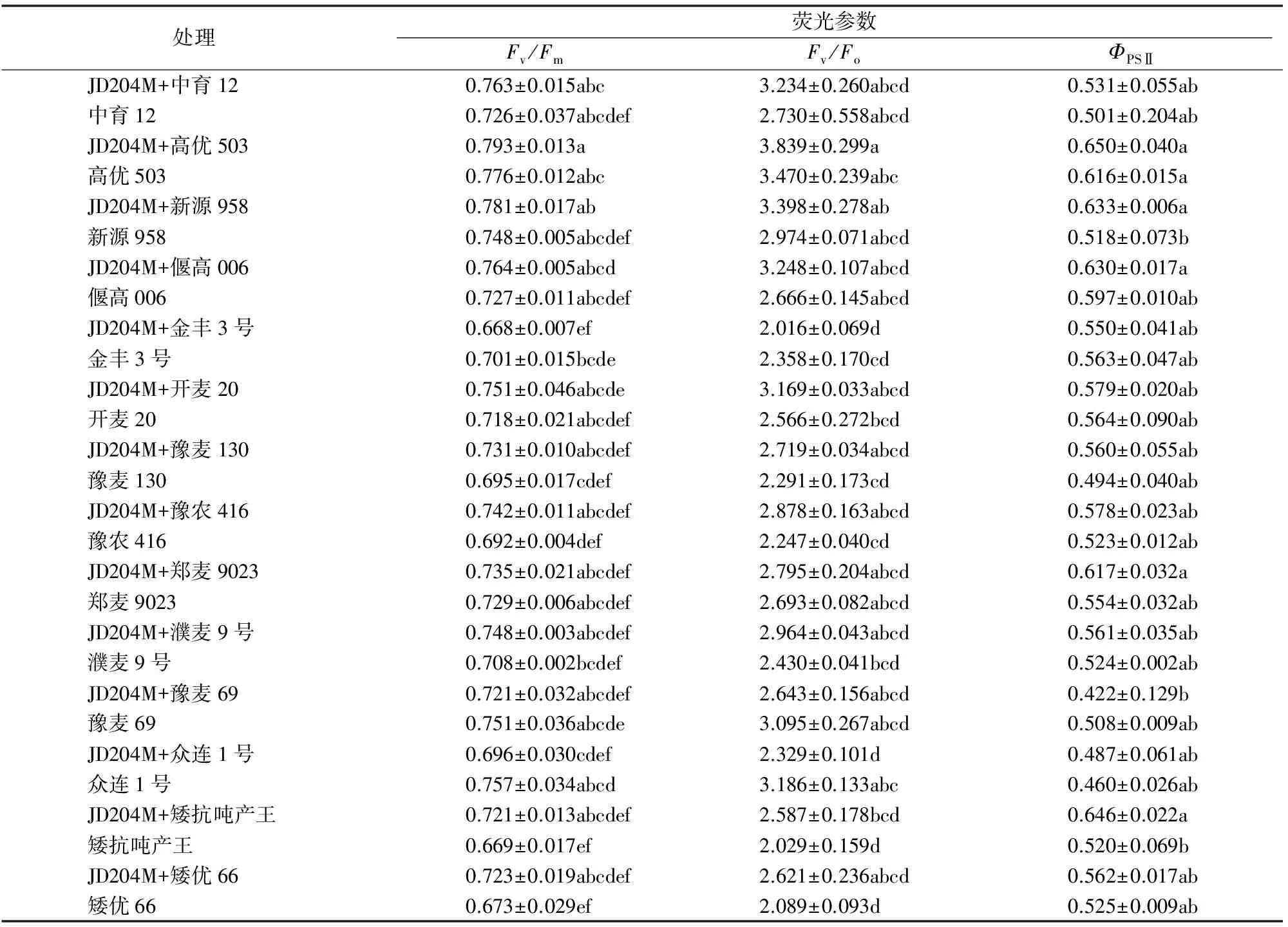
表4 JD204M处理对小麦叶片荧光特性的影响
本研究结果表明,小麦在接种内生假单胞菌JD204M后,不同品种小麦叶片的Pn、Ci、Gs和Tr与各自对照相比,其变化的趋势和幅度有所差异,可能与参与这些光合参数调控的特定基因表达有关,具体的分子机理还待于进一步研究。本试验研究也得出有10个小麦品种的Pn明显高于对照,这可能是在光合作用过程中Ci、Gs和Tr等因子共同协调、相互作用的结果,这与吴凯朝等对甘蔗的研究结果[22]相一致。由于内生假单胞菌JD204M在小麦体内能够很好定植,在小麦的生长发育过程中调控着小麦体内的微环境,从而对小麦叶片表面气孔的开闭和体内水分与其他养分的运输起到调节作用,进而影响着小麦的光合作用;另一方面由于该菌可以固氮和利用铁铵盐(数据未显示),为小麦的生长发育提供所需的氮素和铁素营养,从而有利于光合作用的提高。本研究结果还表明,内生假单胞菌JD204M对不同品种小麦间的光合生理效应存在差异,这可能与内生假单胞菌与小麦的基因互作和适应性有关,具体原因还有待于进一步探讨和研究。
前人研究表明,Fv/Fm、ΦPSⅡ、Fv/Fo等叶绿素荧光参数与光合作用的各个反应过程密切相关,其特性极易受环境条件的变化而变化,能很好地反映植物的抗逆性程度,常用来作为测定植物叶片光合功能受逆程度的探针[23]。本试验结果表明,用内生假单胞菌JD204M处理后,不同小麦品种的叶绿素荧光参数表现出差异,有11个品种的Fv/Fm和Fv/Fo、12个品种的ΦPSⅡ与对照相比有所增大,表明内生菌处理后,小麦能很好地适应光照度的变化,提高小麦叶片PSⅡ的实际光化学效率、电子传递速率,使小麦对光能的吸收和转化效率提高,有利于光合作用的增强,这与史应武对甜菜的研究结论[6]相一致。JD204M有固氮功能,推测可通过调节叶绿素荧光参数来提高小麦叶片的净光合速率,进而提高小麦产量。
[1]Siegel M R.Acremoniumendophytes:our current state of knowledge and future directions for research[J].Agriculture Ecosystems & Environment,1993,44(1/2/3/4):301-321.
[2]Bacon C W,Siegel M R.Endophyte parasitism of tall fescue[J].Journal of Production Agriculture,1988,1:45-55.
[3]Clay K.The potential role of endophytes in ecosystems[M].Boca Raton:CRC Press,1994:73-86.
[4]Richardson M D,Hoveland C S,Bacon C W.Photosynthesis and stomatal conductance of symbiotic and nonsymbiotic tall fesue[J].Crop Science,1993,33(1):145-149.
[5]沈德龙,冯永君,宋 未.内生成团泛菌YS19对水稻乳熟期光合产物在旗叶、穗分配中的影响[J].自然科学进展,2002,12(8):863-865.
[6]史应武.内生菌分离筛选及其对甜菜促生增糖效应研究[D].石河子:石河子大学,2009.
[7]Larran S,Perelló A,Simón M R,et al.Isolation and analysis of endophytic microorganisms in wheat (TriticumaestivumL.) leaves[J].World Journal of Microbiology and Biotechnology,2002,18(7):683-686.
[8]王 刚,李志强.小麦内生细菌的分离及其对小麦纹枯菌的拮抗作用[J].微生物学通报,2005,32(2):20-24.
[9]乔红萍.小麦内生细菌对小麦全蚀病的生物防治研究[D].杨凌:西北农林科技大学,2006.
[10]张志良,瞿伟菁,李小方.植物生理学实验指导[M].4版.北京:高等教育出版社,2009.
[11]蔚晓燕,李 静,唐 明.施氮与接种外生菌根真菌对油松幼苗生物量和光合特性的影响[J].西北农林科技大学学报(自然科学版),2013,41(10):42-48,58.
[12]温国胜,田海涛,张明如,等.叶绿素荧光分析技术在林木培育中的应用[J].应用生态学报,2006,17(10):1973-1977.
[13]Genty B,Briantais J M,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyⅡ fluorescence[J].Biochimica et Biophysica Acta,1989,990(1):87-92.
[14]莫 瑶.接种固氮菌对四个甘蔗种的光合特性和大量元素积累的影响[D].南宁:广西大学,2013.
[15]邢永秀,莫 遥,罗丽静,等.接种固氮菌Klebsiellasp.120对甘蔗光合特性和主要矿质营养元素含量的影响[J].植物营养与肥料学报,2015,21(2):467-474.
[16]张现勇,韩巨才,刘慧平,等.油菜内生细菌yc8发酵液对植物促生作用及其营养代谢的影响[J].安徽农业科学,2007,35(29):9121-9122,9124.
[17]伍泽堂.超氧自由基与叶片衰老时叶绿素破坏的关系(简报)[J].植物生理学通讯,1991,27(4):277-279.
[18]周竹青,朱旭彤,周广生.小麦旗叶光合生理指标与含糖量关系研究[J].华中农业大学学报,2002,21(2):175-178.
[19]赵 昕,宋瑞清,阎秀峰.接种AM真菌对喜树幼苗生长及光合特征的影响[J].植物生态学报,2009,33(4):783-790.
[20]尤 扬,周秀梅,申小雨,等.金桔秋季光合特性初步研究[J].亚热带植物科学,2010,39(1):21-24.
[21]王金龙,高玉葆,任安芝,等.不同氮素营养条件下内生真菌感染对黑麦草光合和蒸腾速率及生物量的影响[J].植物学通报,2004,21(5):539-546.
[22]吴凯朝,梁 俊,韦莉萍,等.内生固氮菌对甘蔗伸长期光合生理特性的影响[J].广西植物,2011,31(5):668-673.
[23]陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.
