防治小麦纹枯病和根腐病高效药剂的筛选及其与香菇多糖联用的防效评价
2018-03-05姜莉莉张中霄王红艳王开运
姜莉莉,张中霄,王红艳,乔 康,王开运,王 东
(1.山东农业大学农学院,山东泰安 271018; 2.山东农业大学植物保护学院,山东泰安 271018)
小麦是我国第二大粮食作物,在保障我国粮食安全方面具有举足轻重的地位[1]。由于气候变暖、耕作和栽培制度变化等原因,小麦纹枯病、根腐病等土传病害的发生和为害日益严重[2-3]。目前,小麦纹枯病、根腐病最直接有效的防治方法仍以化学药剂防治为主[4]。近年来,有关合理使用农药、保护生态环境方面的研究得到广泛关注[5]。多糖类诱抗剂具有安全、广谱、高效等特点,被称为新型生物农药。研究表明,海带多糖、壳寡糖、灵芝多糖等多种功能多糖能够诱导、激活植物的防御反应,增强植物对真菌性病害和病毒病害的抵抗力[6-8]。香菇多糖是从香菇培养基废弃物中提取分离出来的一种生物活性物质,可以减少氧自由基对细胞器的损伤,对细胞凋亡、坏死有很好的抑制作用。王 杰等[9]报道,香菇多糖能够诱导植物或细胞产生并积累抗病性物质,如植保素、几丁质酶等。单宏英等[10]报道,香菇多糖对烟草灰霉病的抑制效果较好,且对烟草种子萌发有明显的促进作用。Wang等[11]报道,香菇多糖用于苹果采后处理可以提高苹果对青霉菌侵染的抵抗力。李鹏鹏等[12]报道,以250 mg·L-1的香菇多糖浸泡黄瓜种子8 h后育苗,对黄瓜霜霉病的防效可达47.86%,并且能够不同程度地提高黄瓜的种子发芽率、幼苗根长、植株鲜重等生理指标。
诱抗剂与许多常规杀菌剂之间有相加或协同作用。一方面,常规杀菌剂能够抑制植物病原菌的生长,给植物提供充足的时间完成由诱导剂诱导的抗性反应;另一方面,常规杀菌剂可以降低植物病原菌的活力,使病原菌很难克服由诱导产生的植物抗性,减少化学杀菌剂的使用次数和使用量。Peng等[13]报道,枯草芽孢杆菌(NJ-18)与杀菌剂氟酰胺和苯醚甲环唑混用对小麦纹枯病防效显著增加,且能够明显降低化学杀菌剂的使用量。李鹏鹏[14]发现,香菇多糖与杀菌剂氟醚菌酰胺配施对黄瓜霜霉病防效显著增加,可使氟醚菌酰胺的用量减少25%。
本研究抑通过平板毒力测定试验筛选防治小麦纹枯病和根腐病的高效杀菌剂,并将其与香菇多糖混合拌种,评价其对这两种小麦病害的温室盆栽防控效果,以期对小麦节药控害及安全生产提供理论依据。
1 材料与方法
1.1 供试材料
1.1.1 供试病原菌
小麦纹枯病菌(RhizoctoniacerealisVander Hoeven)和小麦根腐病菌[Bipolarissorokiniana(Sacc. ex Sorok.) Shoem.],[syn.:Drechslerasorokiniana(Sacc.) Subram. et Jain],由山东农业大学农业微生物省重点实验室提供。
1.1.2 供试小麦品种
山农23,由山东农业大学农学试验站提供。
1.1.3 供试药剂
97%咪鲜胺原药、98%多菌灵原药、95%福美双原药和97%咯菌腈原药,由山东农业大学农药毒理与应用技术省级重点实验室提供,经农业部农药鉴定所检测后封样备用。97%噻呋酰胺原药、95%己唑醇原药和97.5%氟醚菌酰胺原药由山东省联合农药工业有限公司提供。
1.2 杀菌剂对小麦纹枯病菌和根腐病菌的毒力测定
采用菌丝生长速率法[15],用丙酮将各药剂原药配制成1%(m/v)的母液,在超净工作台上将母液用无菌水稀释成系列浓度梯度,通过预试验确定抑制率介于10%~90%之间的5个有效浓度;每50 mL冷却至50~60 ℃的马铃薯葡萄糖琼脂(PDA)培养基中添加1 mL药液,充分混匀后分别倒入3个9 cm灭菌培养皿中,冷却后即为含药培养基平板,控制培养基中的丙酮含量低于2%(v/v),以无菌水为对照。在长至培养皿2/3左右的各供试菌株菌落边缘用直径为7 mm的灭菌打孔器打孔制备菌饼,分别置于含药平板中央,每个处理重复3次,在25 ℃条件下黑暗培养。待对照组菌落直径长至约70 mm时,采用十字交叉法测定菌落直径,取平均值,计算各浓度药剂对菌丝生长的抑制率及药剂对病原菌的EC50值。
1.3 温室盆栽防效测定
将选1.2中毒力较强的药剂,取较优剂量处理小麦种子。将香菇多糖分别按照4 g a.i.·100 kg-1种子和8 g a.i.·100 kg-1种子剂量处理小麦种子。将所选药剂较优剂量中较低剂量与香菇多糖进行复配处理小麦种子,以自来水处理为对照。将质地相似、颗粒均匀、相对含水量约为60%的土壤装于塑料培养盆中。每盆混入20 mL经25 ℃、150 r·min-1培养10 d、浓度均匀的纹枯病菌或相同条件下培养7 d的根腐病菌菌液后,播种10粒上述药剂处理过的种子。每个处理重复3次。置于20±2 ℃、相对湿度为70%±5%、光暗比为14/10的温室中培养,于小麦出苗后7 d、14 d和21 d分别记录小麦病害的发病率和病情指数。小麦纹枯病的分级标准为:0级,不发病;1级,茎部始发病;3级,茎基部病斑环茎小于1/2;5级,茎基部病斑环茎大于1/2,但植株不倒伏或折断;7级,植株枯死、倒伏。小麦根腐病的分级标准为:0级,目测不见病斑;1级,茎基部局部可见褐色小病斑,颜色较浅;2级,茎基部可见较深的褐色病斑,病斑的宽度为茎基部圆周长的1/5以下;3级,茎基部病斑连成长条,病斑宽度为茎基部圆周长度的1/3以下;4级,病斑长达1 cm以上,茎基部病斑为茎基圆周长的1/2以下;5级,病斑长达1 cm以上,茎基部病斑为茎基圆周长的1/2以上。按照下列公式计算病情指数和防治效果。
病情指数=∑(各级病株数×各级代表值)/(调查总株数×最高级代表值)×100%
防治效果=(对照区病情指数-处理区病情指数)/对照区病情指数×100%
1.4 数据处理
数据采用SPSS ver. 16.0进行统计、分析。
2 结果与分析
2.1 杀菌剂对小麦纹枯病菌的毒力
室内毒力测定结果(表1)表明,供试的6种杀菌剂对小麦纹枯病菌均具有较高的生物抑菌活性,其中,95%己唑醇对小麦纹枯病菌的毒力最高,EC50值仅为0.094 mg·L-1;97%咯菌腈次之,EC50值为0.312 mg·L-1;97.5%氟醚菌酰胺的EC50值为4.169 mg·L-1。常用广谱性杀菌剂97%噻呋酰胺、97%咪鲜胺和98%多菌灵对小麦纹枯病菌的EC50值分别为4.695 mg·L-1、5.738 mg·L-1和8.222 mg·L-1。
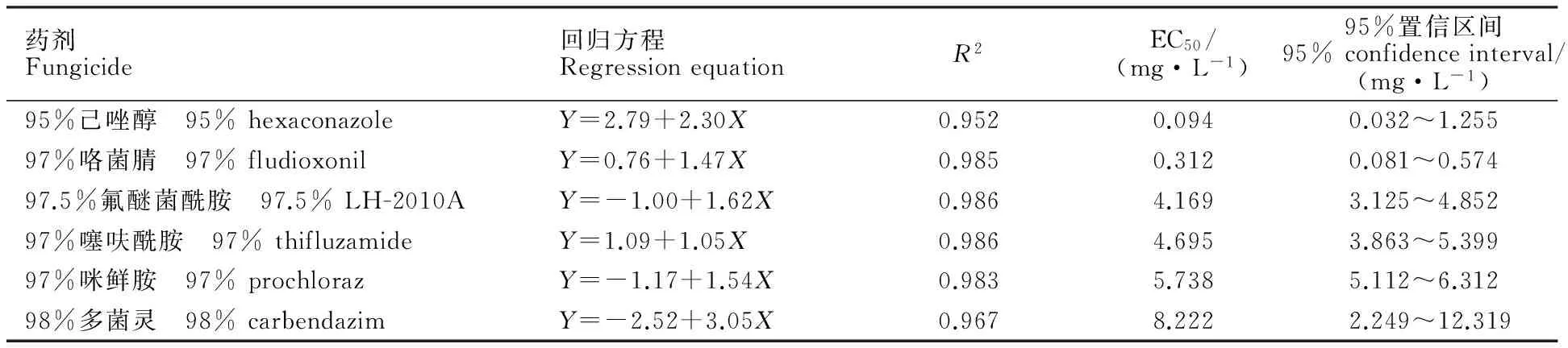
表1 6种杀菌剂对小麦纹枯病菌的毒力Table 1 Toxicity of six fungicides to Rhizoctonia cerealis
2.2 杀菌剂对小麦根腐病菌的毒力
室内毒力测定结果(表2)表明,供试的5种杀菌剂对小麦根腐病菌均具有较高抑菌效果。其中,95%己唑醇对小麦根腐病菌的毒力最高,EC50值为0.144 mg·L-1;97%咪鲜胺次之,EC50值为0.182 mg·L-1;97%咯菌腈的EC50值为0.766 mg·L-1。常用广谱性杀菌剂95%福美双和97.5%氟醚菌酰胺对小麦根腐病菌的EC50值分别为6.915 mg·L-1和43.33 mg·L-1。
综合供试药剂对小麦纹枯病和根腐病病菌的毒力,以95%己唑醇和97%咯菌腈效果较佳。
2.3 杀菌剂和香菇多糖单剂及其复配拌种对小麦纹枯病的防效
温室盆栽防效试验结果(表3)表明,95%己唑醇和97%咯菌腈对小麦纹枯病的防效均随着处理剂量的增大而升高。剂量为1 g a.i.·100 kg-1小麦种子的95%己唑醇和剂量为4 g a.i.·100 kg-1小麦种子的97%咯菌腈在施药后7 d对小麦纹枯病的防效分别为77.5%和75.8%,随着时间的延长,防效略有降低,施药后21 d的防效分别为63.3%和69.4%。剂量为4 g a.i.·100 kg-1小麦种子和8 a.i.·100 kg-1小麦种子的香菇多糖处理后7 d的防效仅分别为25.8%和38.6%。95%己唑醇和香菇多糖按0.5 g a.i.·100 kg-1小麦种子和4 g a.i.·100 kg-1小麦种子复配拌种后7 d和21 d,对小麦纹枯病的防效分别为75.2%和68.4%;97%咯菌腈和香菇多糖按2 g a.i.·100 kg-1小麦种子和4 g a.i.·100 kg-1小麦种子复配拌种后7 d和21 d,对小麦纹枯病的防效分别为77.1%和72.7%。
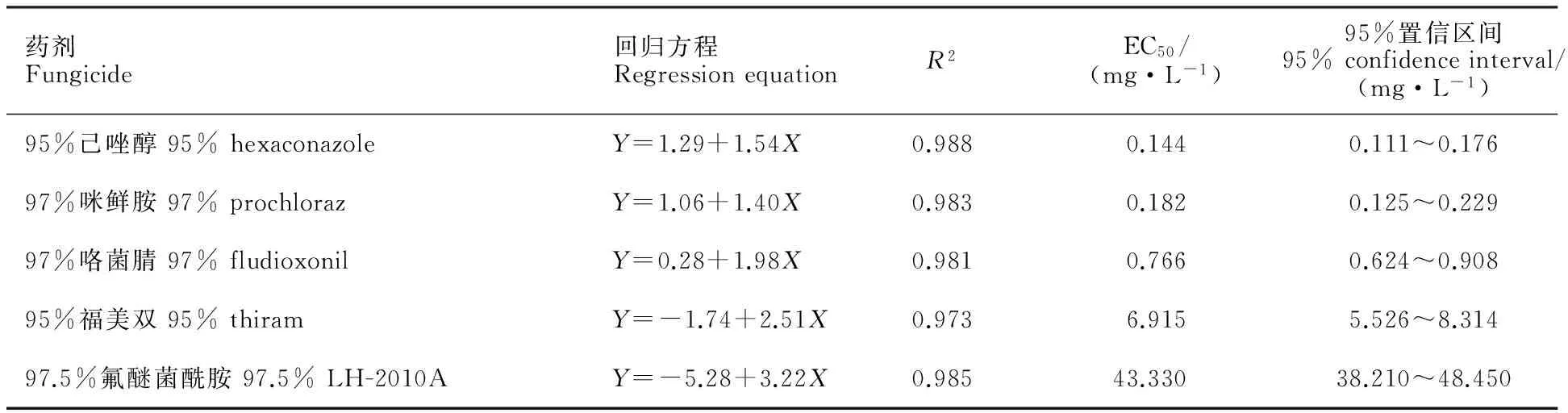
表2 5种杀菌剂对小麦根腐病菌的室内毒力Table 2 Toxicity of five fungicides to Bipolaris sorokiniana

表3 杀菌剂和香菇多糖单剂及联用拌种对小麦纹枯病的温室防效Table 3 Control effect of two fungicides,lentinan and their combinations on wheat sharp eyespot by seed treatment in greenhouse %
2.4 杀菌剂和香菇多糖单剂及复配拌种对小麦根腐病的温室防控效果
温室盆栽防效试验结果(表4)表明,己唑醇和咯菌腈对小麦根腐病均具有较好的防治效果。剂量为1 g a.i.·100 kg-1小麦种子的95%己唑醇和剂量为4 g a.i.·100 kg-1小麦种子的97%咯菌腈施药后7 d对小麦根腐病的防效分别达到80.2%和82.5%,施药后21 d防效降为68.6%和66.1%。单独使用剂量为4 g a.i.·100 kg-1小麦种子和8 g a.i.·100 kg-1小麦种子的香菇多糖后21 d的防效仅为27.5%和36.4%。杀菌剂和香菇多糖联用对小麦根腐病的防效有较大提高,剂量为0.5 g a.i.·100 kg-1小麦种子的95%己唑醇和剂量为4 g a.i.·100 kg-1小麦种子的香菇多糖复配拌种后7 d和21 d对小麦根腐病的防治效果分别为79.4%和76.8%,剂量为2 g a.i.·100 kg-1小麦种子的97%咯菌腈和剂量为4 g a.i.·100 kg-1小麦种子的香菇多糖复配拌种后7 d和21 d对小麦根腐病的防效分别为81.3%和77.3%。
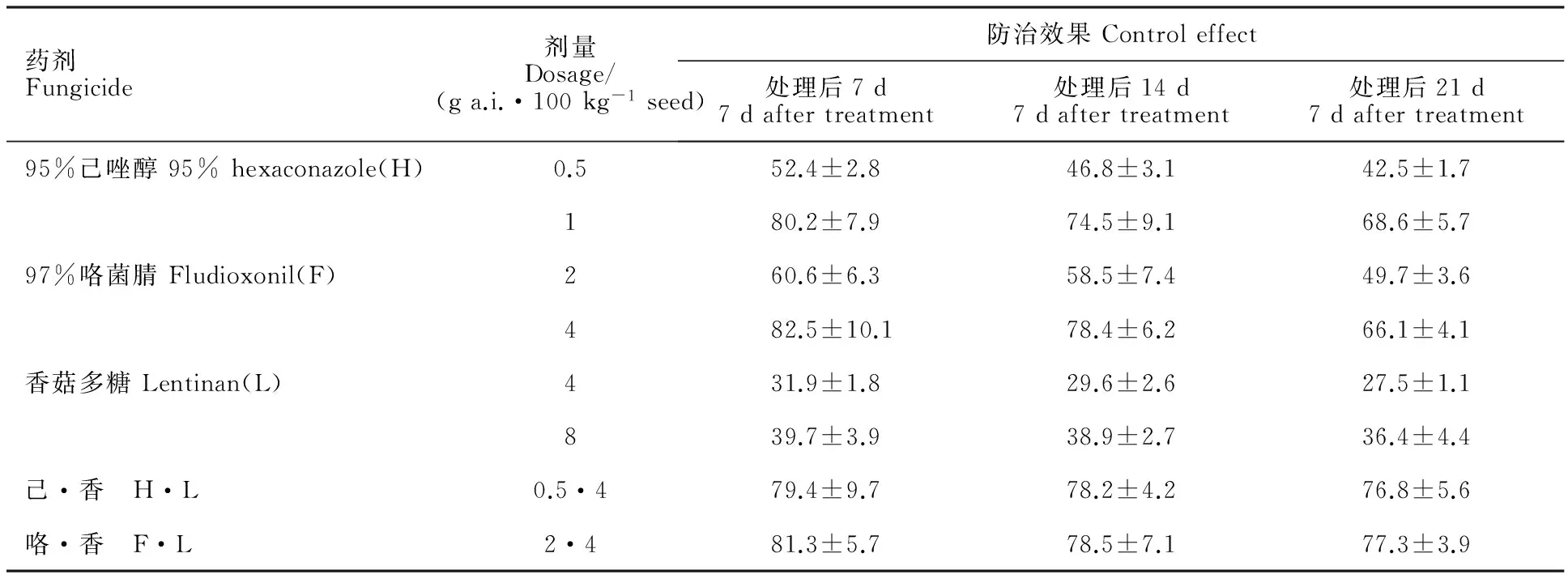
表4 杀菌剂和香菇多糖单剂及联用拌种后对小麦根腐病的温室防控效果Table 4 Control effect of two fungicides,lentinan and their combinations on wheat root rot by seed treatment in greenhouse %
3 讨 论
小麦纹枯病由立枯丝核菌(Rhizoctoniacerealis)侵染所致,近年来,由于秸秆还田面积逐年增加,小麦纹枯病在中国山东西南部和河南北部高产麦区的发生呈逐年加重的趋势,严重威胁着小麦的高产与稳产[2]。小麦根腐病是由多种病原菌单独或混合侵染而引起的小麦病害,其主要病原菌包括根腐蠕孢菌(Bipolarissorokiniana)(异名:Drechslerasorokiniana)、镰刀菌(Fusariumspp.)等,其危害在中国黄淮和华北南部小麦产区呈上升态势[16]。李可凡等[17]报道,携带根腐病病原菌的小麦种子发芽率显著降低,且种子发芽后容易发生死苗。
三唑酮、井冈霉素、戊唑醇等药剂对小麦纹枯病和根腐病具有较高的防治效果,但由于长期频繁使用,病原菌产生抗药性的风险较高[18-19]。基于纹枯病和根腐病的土传性特点,筛选高效种子处理剂显得尤为重要。己唑醇为三唑类内吸广谱性杀菌剂,对禾谷类作物根腐病、纹枯病等的防治效果较好。咯菌腈对镰孢属(Fusarium)、丝核菌属(Rhizoctonia)、长蠕孢属(Helminthosporium)真菌引起的禾谷类作物病害防治效果较好,但内吸性较差。本研究表明,己唑醇对小麦纹枯病菌和根腐病菌的EC50值分别为0.094 mg·L-1和0.144 mg·L-1,咯菌腈对小麦纹枯病菌和根腐病菌的EC50值分别为0.312 mg·L-1和0.766 mg·L-1,抑菌效果均较高。温室防效结果表明,己唑醇对小麦纹枯病和根腐病均有较好的防效,随着施药浓度的升高,防效随之明显上升,剂量为1 g a.i.·100 kg-1小麦种子的95%己唑醇施药后7 d对小麦纹枯病和根腐病的防效分别为77.5%和80.2%,剂量为4 g a.i.·100 kg-1小麦种子的97%咯菌腈对小麦纹枯病和小麦根腐病的防效分别为75.8%和82.5%。香菇多糖单用处理小麦种子对土传病害的早期防效较低,本研究中,剂量为4和8 g a.i.·100 kg-1小麦种子的香菇多糖处理后7 d,对小麦纹枯病和根腐病的防效均低于40%。
将化学农药与生物农药联合使用,是提高防治效果和降低化学药剂施用量的有效途径。将剂量为0.5 g a.i.·100 kg-1小麦种子的95%己唑醇和剂量为4 g a.i.·100 kg-1小麦种子的香菇多糖联合施用后7 d,对小麦纹枯病和根腐病的防效为75.2%和79.4%,明显高于二者单剂施用的防效。97%咯菌腈与香菇多糖的联用处理小麦种子对这两种小麦病害也达到了相似的防效。这与植物激活剂β-氨基丁酸与代森锰锌混用对番茄晚疫病和黄瓜霜霉病具有增效作用的结果相似[20]。由此可见,香菇多糖与己唑醇或咯菌腈联用,可兼治这两种小麦土传病害,有助于小麦生产环节中节药控害,降低环境污染,延长药剂持效期。
[1]ZHANG J H.China's success in increasing per capita food production [J].JournalofExperimentalBotany,2011,62:3707.
[2]HAMADA M S,YIN Y N,CHEN H G,etal.The escalating threat ofRhizoctoniacerealis,the causal agent of sharp eyespot in wheat [J].PestManagementScience,2011,67:1411.
[3]蒋 雯,何 德,陶 松.利用外源基因抗小麦根腐病的研究进展[J].河北农业科学,2010,14(2):50.
JIANG W,HE D,TAO S.Research progress of resistance to wheat root rot using exogenous gene [J].JournalofHebeiAgriculturalSciences,2010,14(2):50.
[4]TEJADA M,GMEZ I,GARCA-MARTNEZ A M,etal.Effects of prochloraz fungicide on soil enzymatic activities and bacterial communities [J].EcotoxicologyandEnvironmentalSafety,2011,74:1708.
[5]ZHANG J X.The potential of a new fungicide fludioxonil for stem-end rot and green mold control on Florida citrus fruit [J].PostharvestBiologyandTechnology,2007,46:262.
[6]王 杰,王开运,张 骞,等.海带多糖对烟草花叶病毒的抑制作用及其对烟草酶活性的影响[J].植物保护学报,2011,38(6):532.
WANG J,WANG K Y,ZHANG Q,etal.Inhibition of laminarin against TMV and effect on protective enzymes in tobacco [J].ActaPhytophylacicaSinica,2011,38(6):532.
[7]张文清,夏 玮,程 俞,等.不同分子量壳多糖对植物病菌的拮抗作用及其诱导提高寄主植物抗病性[J].植物保护学报,2004,31(3):235.
ZHANG W Q,XIA W,CHENG Y,etal.Bacteriostatic effect of chitosans with different molecular weights to phytopathogenic fungi and inducing defense responses [J].ActaPhytophylacicaSinica,2004,31(3):235.
[8]宁玉波,王红艳,乔 康,等.灵芝多糖对番茄抗灰霉病的诱导效应[J].中国农业科学,2016,49(11):2103.
NING Y B,WANG H Y,QIAO K,etal.Induced resistance by polysaccharides isolated fromGanodermalucidumin tomato against gray mold [J].ScientiaAgrculturaSinica,2016(11):2103.
[9]王 杰,王开运.香菇多糖对植物真菌和病毒病害的抗病机理[J].农药,2011,50(1):16.
WANG J,WANG K Y.Discussion on the mechanism of resistance of the polysaccharide of lentinus edodes against pathogenic bacteria and virus of plant [J].Agrochemicals,2011,50(1):16.
[10]单宏英,沈小英,陈德鑫,等.香菇多糖对烟草灰霉病的防治效果研究[J].中国烟草学报,2012,18(4):56.
SHAN H Y,SHEN X Y,CHEN D X,etal.In vitro and in vivo biological control effect of lentinan against tobacco grey mould(Botrytiscinerea) [J].ActaTabacariaSinica,2012,18(4):56.
[11]WANG J,WANG H Y,XIA X M,etal. Synergistic effect of lentinula edodes and pichia membranefaciens on inhibition ofPenicilliumexpansuminfections [J].PostharvestBiologyandTechnology,2013,81:7.
[12]李鹏鹏,王 杰,乔 康,等.香菇多糖浸种对黄瓜幼苗抗霜霉病及生理特性的影响[J].农药,2014,53(4):287.
LI P P,WANG J,QIAO K,etal.The effects of lentinan by seed treatment on induced resistance against downy mildew and physiological characters of cucumber seedlings [J].Agrochemicals,2014,53(4):287.
[13]PENG D,LI S D,CHEN C J,etal.Combined application of bacillus subtilis NJ-18 with fungicides for control of sharp eyespot of wheat [J].BiologicalControl,2014,70:28.
[14]李鹏鹏.香菇多糖诱导黄瓜抗霜霉病的作用及与氟醚菌酰胺混效作用的研究[D].泰安:山东农业大学,2014:36.
LI P P.The effect of lentinan on induce cucumber against downy mildew and mix with LH-2010A [D].Tai’an:Shandong Agricultural University,2014:36.
[15]慕立义.植物化学保护研究方法[M].北京:中国农业出版社,1994:142.
MU L Y.Study method of plant chemical protection [M].Beijing:China Agricultural Press,1994:142.
[16]全国农业技术推广服务中心.2015年全国三大谷类作物重大病虫害发生趋势预报[J].植物保护,2015,41(2):1.
National Agro-technical Extension and Service Centre.Occurrence trend forecast of the major diseases and insect pests of main crops in China in 2015 [J].PlantProtection,2015,41(2):1.
[17]李可凡,袁 方.小麦根腐病的发生规律及防治技术[J].河南农业科学,2003(5):58.
LI K F,YUAN F.Occurrence regularity and control techniques of wheat root-rot [J].JournalofHenanAgriculturalScience,2003(5):58.
[18]孙炳剑,雷小天,袁虹霞,等.小麦纹枯病化学防治药剂的筛选[J].麦类作物学报,2007,27(5):914.
SUN B J,LEI X T,YUAN H X,etal.Screening of the fungicides for the chemical control of wheat sharp eyespot [J].JournalofTriticeaeCrops,2007,27(5):914.
[19]齐永志,李海燕,苏 媛,等.小麦纹枯病菌对噻呋酰胺的敏感性及抗药性突变体的主要生物学性状[J].农药学学报,2014,16(3):272.
QI Y Z,LI H Y,SU Y,etal.Sensitivity to trifluzamide and main biological characteristics of resistant mutants ofRhizoctoniacerealis[J].ChineseJournalofPesticideScience,2014,16(3):272.
[20]BAIDER A,COHEN Y.Synergistic interaction between BABA and mancozeb in controllingPhytophthorainfestansin potato and tomato andPseudoperonosporacubensisin cucumber [J].Phytoparasitica,2003,31(4):399.
