新型CAR-T细胞靶向杀伤HPV16阳性宫颈癌细胞的探索研究
2018-03-04邓丽娜杨奕娜
张 英,滕 娇,汪 月,邓丽娜,杨奕娜
(1深圳市宝安区中心医院,广东深圳518102;2深圳爱生再生医学科技有限公司,广东 深圳518118)
0 引言
在年轻女性中,宫颈癌发病率排名第二,严重威胁女性的健康[1]。人乳头瘤病毒(human papillomavirus,HPV)是宫颈癌的主要致病因子。有研究报道,约90%的宫颈癌是由 HPV持续性感染导致的[2]。根据其致癌性,HPV可分为低危型和高危型两种,其中高危型病毒主要包括HPV16和HPV18等,约 60%的宫颈癌与 HPV16 感染相关[3-4]。
现在可以通过接种疫苗来预防HPV持续感染和宫颈癌的发生[5-7]。但是预防性HPV疫苗不能清除已经发生的HPV感染,或治疗HPV阳性的宫颈癌。在国内治疗宫颈癌临床上经常采用干扰素等改善全身或局部免疫功能,而不是直接针对病毒本身,无法有效清除HPV病毒,其治疗效果存在争议。因此,我们迫切需要开发治疗HPV感染和宫颈癌的有效手段。
近年来,随着肿瘤免疫学等新兴学科和技术的迅速发展,肿瘤免疫疗法取得重大突破,成为继传统手术、化疗和放疗之后新的肿瘤治疗手段。肿瘤免疫疗法的重要代表之一,嵌合抗原受体修饰的T细胞(chimeric antigen receptor T cells,CAR-T),在治疗血液肿瘤中获得突出的疗效[8-11]。 2017年,美国 FDA批准了两款靶向CD19抗原的CAR-T细胞产品Kymriah和Yescarta上市,为治愈难治复发性B细胞前体急性淋巴性白血病或大B细胞淋巴瘤带来希望。与此同时,开发治疗实体瘤的CAR-T细胞日益受到重视,也面临多方面的挑战,如难以找到合适的靶标抗原[12-15]。 HPV 的 E6和 E7 蛋白是高危型 HPV 的主要致癌蛋白,其通过影响细胞周期、细胞凋亡等方面使宿主细胞永生化而致瘤。E7蛋白只在HPV感染的细胞、大多数HPV阳性宫颈癌细胞和癌前病变组织中持续表达,而在正常组织中不表达,因此其可以成为宫颈癌CAR-T细胞治疗的理想靶点。在宫颈癌细胞中,部分E7蛋白可被蛋白酶体切割成短肽片段,由人类白细胞抗原((human lymphocyte antigen,HLA)呈递在细胞表面,其形成的抗原肽-MHC复合物,可以被T细胞识别和攻击。根据已有的研究报道,本实验设计和制备靶向 HPV16 E711-19:HLA-A*0201复合物的CAR-T细胞,并在体外成功验证其杀伤HPV16阳性的Ca Ski细胞株的能力,为开发CAR-T细胞治疗宫颈癌提供了初步的研究支持。
1 材料和方法
1.1 主要试剂 293T、Ca Ski和HeLa细胞为本实验室原有保存样品。X-Vivo 15培养基(Lonza,04-418Q)、RPMI-1640(Gibco,11875093)、DMEM(Gibco,11995065)、胎牛血清(达科为,6021011)、青霉素-链霉素溶液(碧云天,C0222)、胰蛋白酶(Gibco,25200056)、淋巴细胞分离液(Stem Cell,18051)、无菌生理盐水(四川科伦药业,H51021158),细胞冻存液(达科为,DKW36-CFM0100)、Dynabeads®Human T-Expander CD3/CD28(Thermo,11141D)、白细胞介素-2(peprotech,200-02-10)、白细胞介素-7(peprotech,200-07-10)、白细胞介素-15(peprotech,200-15-10)、branched polyethylenimine(Sigma,408727-100ML)、polybrene(SantaCruz,sc-134220)、Genomic DNA Purification Kit(Lifetech,K0512)、Maxi prep 质粒提取试剂盒(Qiagen,12262)、EGFRt mAb(Lilly,Cetuximab)、anti-human IgG Fc antibody-PE(Biolegend,409303)、anti-human CD4-FITC(Biolegend,300505)、mouse IgG1,κ isotype ctrl-FITC(Biolegend,400109)、anti-human CD8 -Cy5.5(Biolegend,344709)、mouse IgG1, κ Isotype Ctrl Antibody-Cy5.5(Biolegend,400149)、Cell Counting Kit-8(东仁化学,CK04)、人 IFN-γ ELISA检测试剂盒(联科生物,70-EK1801)、人白细胞介素-2高灵敏ELISA试剂盒(联科生物,70-EK102HS-48)。
1.2 方法
1.2.1 合成靶向HPV16 E7:HLA的CAR基因 在特异性识别HPV16 E711-19:HLA-A*0201复合物单抗的基础上,设计第三代CAR。CAR的胞外部分为CD8α前导肽、scFv序列和CD8α铰链区,采用CD28的跨膜区和胞内激活域,4-1BB胞内激活域,以及CD3ζ片段。CAR通过“自切割”的多肽序列T2A与截短的EGFR(EGFRt)连接,用于CAR的表达检测。本实验设计的CAR结构如图1所示。

图1 CAR的组成元件示意图
1.2.2 构建HPV16 E7:HLA CAR慢病毒表达载体根据CAR的氨基酸序列,设计相应的基因序列,并对密码子进行优化。合成CAR的基因序列,将其连接到经Xba I和Sal I酶切的慢病毒表达载体pCDHEF1α-MCS-T2A-Puro中。酶切鉴定目的基因片段,并进行Sanger测序验证。采用Qiagen Maxi prep试剂盒提取无内毒素的 pCDH-EF1α-HPV16 E7:HLA CAR-EGFRt、psPAX2和pMD2.G质粒。
1.2.3 包装HPV16 E7:HLA CAR慢病毒 将293T细胞传代至10 cm培养皿,置于培养箱中。待细胞汇合度达到70%,更换新鲜的无血清DMEM培养基。 分别取 8 μg 的 HPV16 E7:HLA CAR、psPAX2和 pMD2.G 质粒,溶于 480 μL 1×HBS(pH 7.4)。 将100 μmol/L PEI储存液用1×HBS 稀释至10 μmol/L,取360 μL PEI溶液滴加至质粒溶液,边加边混匀,室温静置20 min。将DNA-PEI混合物滴加到细胞培养皿中,置培养箱8 h,更换为含血清的完全培养基。48 h后,收集含病毒颗粒的培养基上清,4℃,500×g离心10 min。将离心获得的上清用0.45 μm的滤膜过滤,将滤液转至无菌离心管中,配平后,4℃,50 000×g离心2 h。离心结束后,小心将离心管中的液体吸去,加入1 mL PBS重悬病毒沉淀,置于-80℃保存。
1.2.4 T细胞的分离和激活 将抗凝处理的人外周血样品转移至一个15 mL无菌离心管内,800×g离心20 min。吸去血清层,然后向下层的外周血细胞层加入等体积的生理盐水,轻轻上下颠倒混匀。取一根15 mL离心管,加入5 mL淋巴细胞分离液。使用移液器小心将稀释的血样沿管壁缓慢加至淋巴细胞分离试剂的上层,避免分离试剂与血样的混合,800×g离心20 min。将处于中间的白色单核细胞层吸至一个新的无菌离心管中,加入等体积的生理盐水轻轻混匀,800×g离心5 min,去除上清。重复清洗一次PBMC,调整细胞密度至5×107/mL,转移至2 mL细胞冻存管。用PBS将Dynabeads洗涤2遍,取适量的Dynabeads加入到 PBMC中,轻轻混匀,室温孵育20 min。将2 mL细胞冻存管插入磁极,室温静置1 min,然后轻轻倒置,将管内的液体倒出。将细胞冻存管从磁极中取出,加入3 mL X-Vivo 15培养基(含200 IU/mL IL-2,10 ng/mL IL-7,5 ng/mL IL-15和5 ng/mL IL-21),重悬细胞和beads混合物,并调整细胞密度至0.5-1×106/mL。将细胞置于37℃,5%CO2培养箱中连续48 h后,将细胞密度调整至1×106/mL。
1.2.5 制备 HPV16 E7:HLA CAR-T细胞 按照MOI=20,计算所需要的病毒量。计算公式:所需病毒量(mL)=(MOI*细胞数量)/病毒滴度。从-80℃超低温冰箱中,取出慢病毒,迅速在37℃水浴锅中解冻。向培养的T细胞中加入polybrene至终浓度为6 μg/mL和上述计算所得的病毒量,用移液器轻轻混匀,室温800×g离心1 h。将培养器皿置于37℃,5%CO2的培养箱中,24 h后,更换培养基。每天轻轻吹打beads/细胞团至完全分开,并进行细胞计数,调整细胞密度至0.5-1×106/mL。第8天通过FACS检测细胞EGFRt的表达(指示CAR-T细胞的阳性率),并检测CD4+T、CD8+T细胞的比例。离心收集制备的CAR-T,进行分装和冻存。
1.2.6 CCK-8法检测HPV16 E7:HLA CAR-T细胞的细胞毒性 采用细胞增殖-毒性检测试剂盒检测HPV16 E7:HLA CAR-T细胞对 Ca Ski和 HeLa细胞的杀伤效果。取96孔细胞培养板,每孔接种1×104个Ca Ski或 HeLa细胞(100 μL DMEM 培养基),在37℃,5%CO2条件下培养过夜。向各孔分别加入1×104、5×104、10×104和 20×104个 HPV16 E7:HLA CAR-T细胞(100 μL RPMI-1640培养基),对照组不接种CAR-T细胞,每组3个平行孔。共培养4 h。吸取培养基上清,PBS洗涤培养板孔中细胞两次,去除残留的CAR-T细胞后用于细胞因子检测。在原孔加入 100 μL DMEM 培养基,加入 10 μL CCK-8 溶液,置37℃,5%CO2共孵育2 h。用酶标仪测定OD 450 nm。
细胞活力=[(As-Ab)/(Ac-Ab)]×100%。 As实验孔(含有癌细胞的培养孔、加入CAR-T细胞,加CCK-8);Ac对照孔(含有癌细胞的培养孔、不加CAR-T细胞,加CCK-8);Ab空白孔(不含癌细胞和CAR-T细胞的培养孔、加培养基、加CCK-8)。
1.2.7 ELISA检测IFN-γ和IL-2水平 将上述实验中 HPV16 E7:HLA CAR-T 细胞对与 Ca Ski、HeLa细胞(HPV16 E7:HLA CAR-T 细胞与 Ca Ski、HeLa细胞浓度比例分别都是10∶1)共孵育4 h后收集的培养基上清,12 000 rpm离心5 min,吸取上清。按照人IFN-γ ELISA或人白细胞介素-2高灵敏检测试剂盒说明书,进行细胞因子检测实验。检测结果用Graph-Pad Prism 7软件计算x±s。
2 结果
2.1 CAR慢病毒表达载体构建 利用XbaI和SalI酶将克隆的HPV16 E7:HLA CAR表达质粒进行酶切和琼脂糖凝胶电泳,可以观察到被切割的目的片段在1500 bp和2000 bp之间,与预期的片段大小一致,表明CAR和EGFRt序列成功连接到表达质粒中。
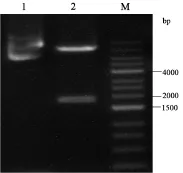
图2 HPV16 E7:HLA CAR表达质粒酶切产物电泳
2.2 HPV16 E7:HLA CAR-T细胞构建及鉴定
FACS分析EGFRt的表达:红色和蓝色部分分别为T细胞对照组、HPV16 E7:HLA CAR-T细胞实验组利用EGFRt抗体进行免疫荧光染色后的流式细胞术分析结果。CAR-T细胞EGFRt表达率为41.2%,即T细胞的慢病毒转导效率。
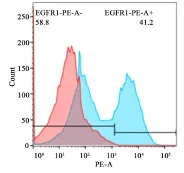
图3 FACS检测EGFRt的表达水平
CAR-T细胞亚群检查:红色部分为阴性对照组,蓝色部分为HPV16 E7:HLA CAR-T细胞利用 CD4或CD8抗体进行免疫荧光染色后的流式细胞术分析结果:(A)CD4+的CAR-T细胞为85.2%,(B)CD8+的CAR-T细胞为30.9%。

图4 FACS分析CD4+以及CD8+的细胞亚群比例
2.3 HPV16 E7:HLA CAR-T细胞体外对Ca Ski细胞杀伤作用横坐标是HPV16 E7:HLA CAR-T细胞数,纵坐标是靶细胞活力。从图中可以看出,HPV16 E7:HLA CAR-T细胞数量与对Ca Ski细胞的杀伤效果成正比。CAR-T细胞与Ca Ski细胞数比值是1∶1、5∶1、10∶1、20∶1时对应的 Ca Ski细胞活力为97.2%、83.2%、56.8%、24.8%,而对HeLa细胞的杀伤作用较小,CAR-T细胞与HeLa细胞数比值是1∶1、5∶1、10∶1、20∶1时对应的HeLa细胞活力为95.1%、103.7%、98.3%、50.7%。 HPV16 E7:HLA CAR-T细胞对Hela细胞的杀伤是在其10倍细胞浓度之前包括10倍情况下无杀伤,20倍细胞浓度的情况下才有较强的杀伤效果。
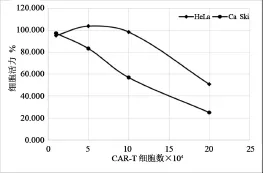
2.4 ELISA检测IFN-γ、IL-2的分泌水平 HPV16 E7:HLA CAR-T 细胞与 Ca Ski、HeLa 细胞浓度比例分别都是10:1时经人IFN-γ ELISA检测试剂盒检测,杀伤Ca Ski细胞上清的IFN-γ的浓度是100.213±8.037 pg/mL,杀伤HeLa细胞上清的IFN-γ的浓度是16.111±3.181 pg/mL。经人白细胞介素2高敏ELISA试剂盒检测杀伤Ca Ski细胞上清的IL-2的浓度是24.313±3.710 pg/mL,杀伤HeLa细胞上清的IL-2的浓度是6.472±3.489 pg/mL。IFN-γ和白细胞介素2具有免疫调节和抗肿瘤的作用,试验结果测的细胞因子浓度和杀伤试验效果结果相符合,即杀伤效果越明显,相应的细胞因子就越多。
3 讨论
在女性所患癌症中,宫颈癌的发病率较高,目前主要治疗手段有手术、放疗、化疗、靶向药物治疗等。此外,宫颈癌可以通过接种HPV疫苗来预防。随着对宫颈癌认识的深入和医疗技术的提高,提高患者术后生活质量,但是手术治疗不能应对已发生转移的患者。放疗容易对患者的卵巢功能造成损伤,大多用于晚期宫颈癌患者。化疗毒性大,肿瘤容易产生耐药性。因此,我们希望能够开发出一种比较安全高效的治疗手段。肿瘤免疫疗法在2013年被《Science》杂志评为年度十大科技突破之首,显示的强大的抗肿瘤效果。CAR-T细胞技术作为肿瘤免疫疗法的重要代表之一,可以用于开发治疗宫颈癌的新技术。
与靶向肿瘤细胞表面蛋白制备的CAR-T细胞相比,靶向抗原肽-MHC复合物的CAR-T细胞特异性高,脱靶毒性小。本实验设计和构建了针对抗原肽-MHC复合物的HPV16 E7:HLA CAR-T细胞,并开展了相关体外细胞实验,对体外杀伤实体瘤细胞进行了初步的探索。本实验证明了制备HPV16 E7:HLA CAR-T细胞是可行的,且具有较高的细胞毒性。在体外杀伤试验中,对非靶细胞在20倍细胞浓度的情况下也有杀伤,分析可能是因为随着细胞数量的增大,CAR-T细胞表面的的其他T细胞抗原受体和癌细胞结合,非靶向抗原肽-MHC复合物的杀伤。本实验主要进行了CAR-T细胞构建和初步的体外细胞实验,结果显示对靶细胞Ca Ski具有明显的杀伤效果,为动物试验和后续深入研究奠定了初步的研究基础。
