八仙花叶柄离体培养和植株再生技术研究
2018-03-03杨宝明黄玉玲李永平张艺萍王丽花
杨宝明 ,苏 艳 ,黄玉玲 ,李永平 ,张艺萍 ,桂 敏 ,王丽花
(1.云南省农业科学院农业环境资源研究所,云南 昆明 650205;2.云南省农业科学院花卉研究所,农业部花卉产品质量监督检验测试中心(昆明),国家观赏园艺工程技术研究中心,云南 昆明 650205)
八仙花(Hydrangea macrophylla)又名绣球花、紫阳花,为虎耳草科八仙花属植物。花大而美,花序呈球形,开花时节,花团锦簇,其花色能红能蓝,令人悦目怡神,是常见的盆栽观赏花木,也是主要的鲜切花。八仙花原产我国四川和日本,在亚洲主要是日本盛产,主要作为家庭盆栽观赏。其花色随土壤pH的变化而变化,在花蕾期施用硫酸铝可使花颜色形成蓝色,施用石灰可使花保持粉红色[1]。我国栽培八仙花的时间较早,在明、清时代建造的江南园林中就栽有八仙花,现代公园和风景区都成片种植,已形成景观[2-3]。八鲜花传统的繁殖方法为扦插、分株和压条等,繁殖速度慢,不能满足市场对种苗的需求,而植物组培技术可在短时间内建立无性繁殖体系,不受外界条件和季节影响,生长周期短,可控性强,可实现周年生产,能稳定地为市场提供性状稳定、品质统一的优良种苗[4-9]。有关八仙花组织培养的研究报道较多,但大部分都以茎段[5-18]、茎尖[19]或叶片[20]为繁殖材料,而以叶柄作为外植体的研究报道[21]很少。
本试验以八仙花叶柄为繁殖材料,通过分析比较不同激素浓度配比对外植体愈伤组织诱导、分化以及植株再生的影响,以筛选适宜的愈伤组织诱导培养基、不定芽增殖培养基和生根培养基,旨在为八仙花的组织培养提供一种新的方法。
1 材料和方法
1.1 材料
取八仙花植物当年生枝条上的中部和上部叶柄(包括叶片)作为外植体。
1.2 方法
1.2.1 外植体的灭菌 在自来水下将外植体冲冼干净,用0.2%的高锰酸钾溶液浸泡15 min,用自来水冲洗干净,剪去叶片,留下叶柄。在超净工作台上先用75%的酒精浸泡20 s,再用0.1%的升汞灭菌12 min,然后用无菌水冲洗5~6次,最后用无菌滤纸吸干外植体表面水分。
1.2.2 愈伤组织的诱导培养 经灭菌的叶柄,用手术刀切长为0.5 cm左右的小块,接种于1~16号处理的培养基中,平放置于培养基表面,30 d后统计出愈率及生长情况,并进行转接。每个处理接种10瓶,每瓶接种1块外植体,重复3次。
1.2.3 不定芽的分化培养 经愈伤组织诱导培养获得的愈伤组织,切割成0.5 cm×0.5 cm的方块,接种于17~24号处理的培养基中,20 d后统计不定芽分化率、芽丛数量和生长情况。每个处理接种10瓶,每瓶接种1块愈伤组织,重复3次。
1.2.4 增殖培养 经不定芽诱导培养获得的小苗或者芽丛,分割为含1~2个茎节的茎段或含有2~3个小芽的芽丛,转接到25~28号处理的培养基中,15 d后统计芽增殖率及生长情况。每15 d为一个转接周期。每处理接种5瓶,每瓶接种6个茎段或芽丛,重复3次。
1.2.5 生根培养 经增殖培养获得的小苗,切成高度为2~3 cm的植株,接种于29~33号处理的培养基中,15 d后统计生根情况。每处理接种5瓶,每瓶接种10株,重复3次。
1.2.6 培养条件 以上培养基均为MS,蔗糖30 g/L,琼脂5.0 g/L,pH值为5.8~6.0,光照强度为1 600~2 000 lx,培养室温度为(25±2)℃。
1.3 测定项目及方法
计算愈伤组织诱导率、不定芽分化率、芽增殖率和生根率。
愈伤组织诱导率=产生愈伤组织的外植体数/接种外植体数×100%;不定芽分化率=产生芽的愈伤组织块数/接种愈伤组织块数×100%;芽增殖率=不定芽产生的数量/接种芽数×100%;生根率=生根苗数/接种苗数×100%。
2 结果与分析
2.1 不同浓度细胞分裂素6-BA与不同浓度生长素NAA,2,4-D配比对不同部位叶柄愈伤组织诱导的影响
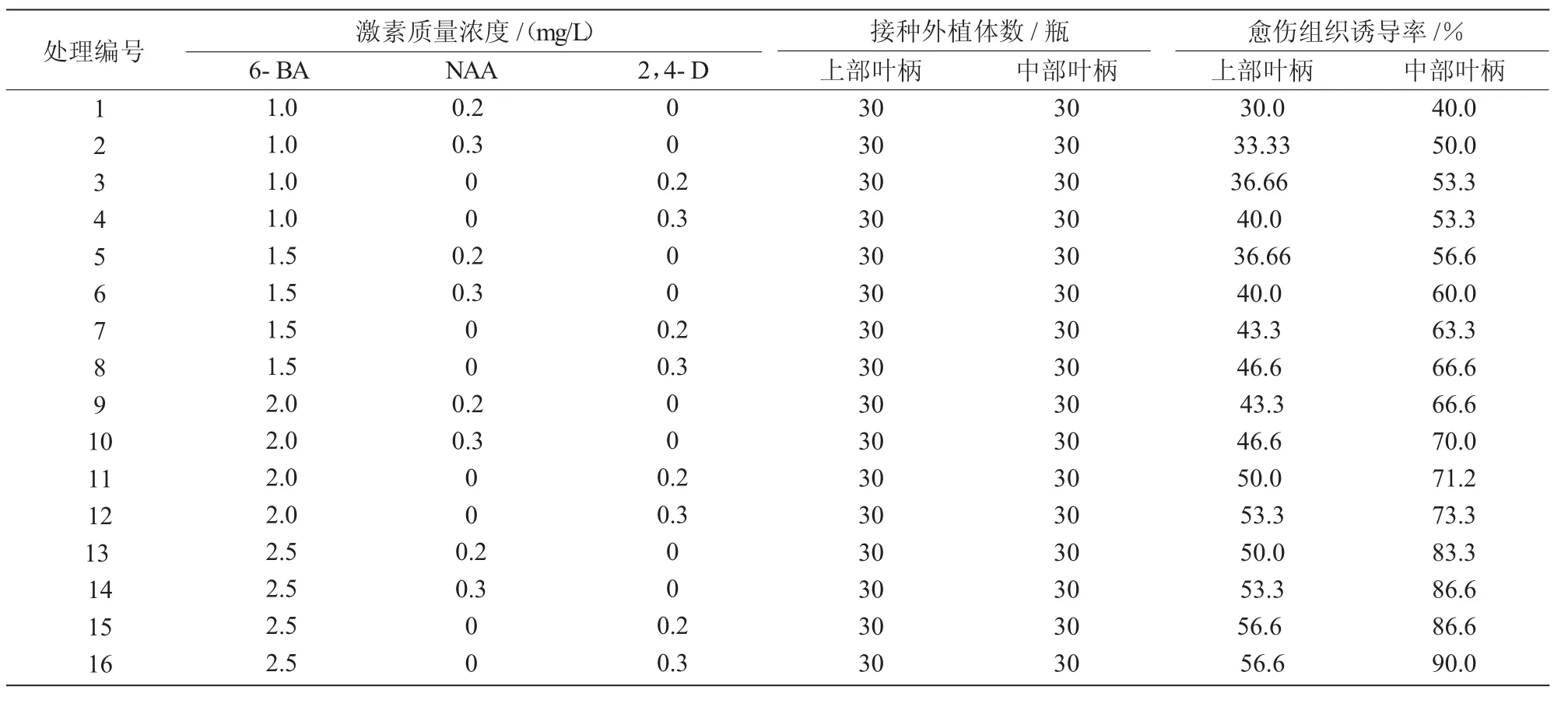
表1 不同浓度激素配比对愈伤组织诱导的影响
从表1可以看出,将上部和中部叶柄分别接种到1~16号培养基中,都能产生愈伤组织,且中部叶柄比上部叶柄愈伤组织诱导率高,诱导效果以14~16号处理较好,在16号培养基中愈伤组织出现最早、生长速度最快,诱导率最高,上部叶柄和中部叶柄的诱导率分别达56.6%和90%,但愈伤组织结构疏松;其次为15号培养基,上部叶柄和中部叶柄的诱导率分别为56.6%和86.6%,愈伤组织结构松紧适中。2,4-D的诱导效果要好于NAA,诱导效果随2,4-D,NAA浓度的增加而增加,其中,在含有2,4-D的培养基中,叶柄接种15d左右切口开始膨大,20 d左右形成明显的愈伤组织细胞团(1 cm×1 cm);含有NAA的培养基中,叶柄接种20 d左右切口才开始膨大,25 d左右才有愈伤组织形成,生长缓慢,30 d愈伤组织诱导情况如图1所示。
2.2 不同浓度细胞分裂素6-BA与不同浓度生长素NAA配比对不定芽分化的影响
由表2可知,在愈伤组织不定芽的分化培养过程中,17~24号处理均能分化不定芽,但不同的处理对不定芽的分化、芽的数量和生长影响不同。随着细胞分裂素6-BA和生长素NAA浓度的增加,不定芽的分化效果明显增强。6-BA为1.5 mg/L,NAA为0.2 mg/L时,分化效果最好,分化率达到90%,芽粗壮、整齐、疏密适中;6-BA为2.0 mg/L,NAA为0.2 mg/L时,不定芽分化较早,但芽点密集、芽伸长不明显、整齐性差,不利于下一步的增殖培养。因此,应以23号处理为好,即MS+6-BA 1.5 mg/L+NAA0.2 mg/L。不定芽的增殖培养情况图2所示。


表2 不同浓度6-BA与NAA配比对愈伤组织不定芽分化的影响

2.3 不同浓度6-BA与不同浓度NAA配比对增殖培养的影响
由表3可知,25~28号处理均能实现芽的增殖,平均增殖芽2.03~7.03个,其中,28号处理芽的增殖数量最高、芽点最多,但芽密集、纤弱;26,27号处理芽的数量较28号处理少,但芽粗壮、整齐、叶片开展,更有利于下一步的生根壮苗培养。因此26,27号处理更有利于芽的增殖培养。

表3 不同浓度6-BA与NAA配比对芽增殖的影响
2.4 NAA和IBA对生根的影响
从表4可以看出,接种在33号培养基上的小苗,生根效果最好,其生根率达90.66%,平均根数达6.45条;其次为31号培养基,生根率达89.33%,平均根数为5.61条(图3为25 d生根培养,图4为生根苗生长情况)。

表4 不同浓度激素处理对生根的影响


3 结论与讨论
应用组培快繁技术是获得性状统一、稳定、优质的八仙花种苗最为有效的途径之一。叶柄可以诱导出完整植株,当以叶柄作外植体时,中部叶片叶柄的诱导效果明显好于上部叶片叶柄。因为上部叶片叶柄因组织幼嫩,在灭菌过程中,损伤大,容易造成部分组织死亡或褐化,影响了诱导效果。
本研究结果表明,在相同浓度的6-BA条件下,2,4-D,NAA 都能诱导出愈伤组织,2,4-D 对愈伤组织的诱导效果明显好于NAA,其可提前5~10 d产生愈伤组织、愈伤组织生长速度快。但2,4-D浓度过高,易造成愈伤组织结构疏松,不利于不定芽的诱导[4]。适宜愈伤组织诱导的最佳培养基为MS+6-BA2.5 mg/L+2,4-D0.2 mg/L。
本研究中,适合不定芽诱导的最佳培养基为MS+6-BA 1.5 mg/L+NAA 0.2 mg/L,诱导率为90%,诱导效果好,易形成不定芽。适合不定芽增殖的最佳培养基为MS+6-BA2.0 mg/L+NAA0.2 mg/L,平均增殖芽5.45个,芽粗壮、整齐、成苗高。适合生根的最佳培养基为MS+IBA0.6 mg/L+NAA0.4 mg/L,其次为MS+NAA 0.8 mg/L。IBA和NAA组合使用的生根效果好于单用NAA的效果,根系粗细适中、柔软,不易折断;NAA单独使用时,生根时间短,但根系粗而脆,出瓶时易折断。
[1]徐振华,王学勇.花团锦簇八仙花[J].植物杂志,1999(4):23.
[2]杨杰雄.花中珍品:八仙花[J].农村实用技术,2002(6):35.
[3]郭伟珍.八仙花栽培技术[J].河北林业科技,2002(1):42-43.
[4]龚伟,王米力,石大兴.八仙花离体培养和植株再生[J].植物生理学通讯,2003,39(6):624.
[5]仼叔辉.八鲜花的组织培养与快繁技术 [J].防护林科技,2006(1):10-11.
[6]段新玲,任东岁,曹新川,等.大花圆锥八仙花组织培养及快速繁殖技术,1999,11(3):14-15.
[7]李杨丽.八仙花离体快繁及盆栽生产相关技术研究 [D].武汉:华中农业大学,2010.
[8]姜巍,张巍巍.变异绣球无性系建立的研究 [J].内蒙古农业科技,2007(5):39-41.
[9]苏荣存,金桂芳.国外引进优良绣球种的组培快繁技术[J].湖北农业科学,2009,48(4):781-782.
[10]殷丽青,胡永红.优良八仙花品种(Hydrangea serrata‘Preziosa’)的离体培养与快速繁殖[J].上海农业学报,2010,26(1):38-41.
[11]吴华芬,刘南祥,诸葛华,等.绣球花的植物组织培养和快速繁殖技术[J].浙江农业科学,2009(1):90-91.
[12]李际红,孟凡志,张友朋.绣球组织培养技术的研究[J].山东林业科技,2002(2):20-22.
[13]韩玉林.优良观赏植物银边绣球的组织培养技术[J].林业实用技术,2009(1):54-55.
[14]杜令阁,胡桂珍,李方元,等.圆锥八仙花的组织培养[J].特产研究,1989(2):25.
[15]邢合龙,原会营,马开,等.八仙花组织培养技术的研究[J].防护林科技,2010(5):48-55.
[16]雷亚灵,李周岐.八仙花茎段组织培养技术研究[J].西北林学院学报,2008,23(4):101-103.
[17]王忠武,建德锋.八仙花茎尖离体培养技术研究[J].北方园艺,2012(9):129-130.
[18]赵盈盈,彭尽晖,陈小超,等.八仙花叶片诱导再生技术[J].湖南农业科学,2015(4):81-84,87.
[19]王云山,周美虹,康黎芳,等.火龙果茎段组织培养快繁技术研究[J].山西农业科学,2012,40(5):455-458,477.
[20]范小峰,杨建霞,杨颖丽.八仙花愈伤组织诱导与快速繁殖[J].经济林研究,2009,27(1):41-44.
[21]谭文澄,戴策刚.观赏植物组织培养技术[M].北京:中国林业出版社,1991.
