具高乙醇耐受力酵母菌的 选育及其在猕猴桃果酒中的应用
2018-03-02陈忠军杨小冲胡佳星袁文艳
陈忠军,杨小冲,赵 洁,胡佳星,袁文艳
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018)
猕猴桃在我国历史悠久,素有“水果之王”的美称。其原产于我国,成熟的猕猴桃果实,果肉多汁,香酸甜度适中,别俱风味,除鲜食外,还可制成果酱、果汁、果脯、糖水罐头等。猕猴桃含丰富维生素C(含量比苹果高数倍乃至数十倍)[1]和维生素E,猕猴桃籽油中的亚麻酸、不饱和脂肪酸和活性油脂[2]及抗突变谷胱甘肽[3]等物质,还具有一定的药用价值。因而得到国内外的重视和欢迎,但是猕猴桃的保藏技术尚不完善,为保持其营养价值的同时又能符合人们饮食结构的改变,石瑞丽[4]以红心猕猴桃为原料探索了猕猴桃果酒的发酵工艺,发酵所得猕猴桃果酒平均酒精度为12%vol,酒体醇厚清澈。酿制的猕猴桃果酒较猕猴桃果汁相比含有更多的多酚及黄酮类物质[5]。但迄今为止,我国对猕猴桃果酒的开发研究仍较少,技术路线尚未成熟,商业规模还未形成,因而开发猕猴桃果酒具有巨大的市场前景。
酵母菌是果酒酿造的重要微生物,在其发酵过程中会产生酒精,而酒精作为酿酒酵母厌氧发酵的产物,当酒精浓度为4%vol时,便会对其细胞本身产生毒害作用,使一些酵母菌株对糖、离子及氨基酸的吸收率降到50%[6],同时抑制细胞的增殖和代谢,使得发酵不完全,酒精产率较低,从而影响产品的质量与产量。吴华昌等[7]为获得耐酒精能力较强的酵母在白酒窖池酒糟中分离得到一株乙醇耐受力为18%vol,产酒精能力为9.5%vol的菌株A2,而传统的酿酒酵母乙醇耐受性只有10%vol左右[8]。因酿酒酵母产酒精能力与耐酒精能力是密不可分的,本文将实验室保存的野生型高产高耐的酵母菌株进行了诱变处理后选育正向突变菌株,并将其作为发酵菌株对猕猴桃果酒的酿造工艺进行研究,为酿酒企业菌株选育及猕猴桃果酒的开发提供参考。
1 材料与方法
1.1 材料与仪器
实验菌种 实验室筛选出的野生型酵母菌株HJ-1;新鲜猕猴桃 购买于家乐福超市;YPD液体培养基 葡萄糖20 g、大豆蛋白胨10 g、酵母浸膏10 g、水1000 mL、pH=6.0、115 ℃灭菌20 min;YPD固体培养基 葡萄糖20 g、大豆蛋白胨10 g、酵母浸膏10 g、琼脂20 g、水1000 mL、pH=6.0、115 ℃灭菌20 min;发酵培养基 葡萄糖350 g、酵母浸膏10 g、大豆蛋白胨20 g、硫酸铵1 g、磷酸二氢钾1 g、硫酸镁1 g、水1000 mL、pH=6.0、115 ℃灭菌20 min;2,3,5-三苯基氯化四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC) 国药集团化学试剂有限公司;柠檬酸钠 大自然生物集团有限公司;蔗糖 市售;实验所用试剂除柠檬酸钠与均蔗糖为食用级,其余均为分析纯。
WBL25B36 三合一多功能家用榨汁机 美的科技企业集团;PB-10精密电子pH计 德国Sartorius;SE602F电子天平 奥豪斯仪器上海有限公司;HZQ-F100全温振荡培养箱 太仓市实验设备厂;LRH-500F生化培养箱 上海一恒科学仪器有限公司;752紫外可见分光光度计 上海佑科仪器仪表有限公司;PAL-1糖度仪 TOKOY ATAGO;WZB数显折光仪 上海仪电物理光学仪器有限公司;SW-CJ-2FD双人单面垂直净化工作台 济南来保医疗器械有限公司。
1.2 实验方法
1.2.1 菌株的活化 将实验菌株接种到YPD液体培养基中,28 ℃恒温培养48 h后,按照2%的接种量,根据上述操作再次进行传代,至第三代活菌浓度为3×107cfu/mL为止,以下实验所用均为三代菌液。
1.2.2 菌株的紫外诱变及正突变菌株的筛选
1.2.2.1 紫外诱变 根据预实验,将出发菌株HJ-1活化后用生理盐水制成浓度为1×108cfu/mL左右的菌悬液在距离30 W紫外灯源25 cm处直接照射120 s时菌株致死率约为85%。选择紫外照射致死率为85%的诱变时间[9],将培养18 h后处于对数生长期的HJ-1菌悬液按上述条件紫外诱变处理120 s,并将诱变处理后的菌悬液按照5%的接种量接种于酒精浓度为16%vol的YPD液体培养基当中,在28 ℃恒温培养箱中暗培养48 h后,用划线的方法接种于YPD固体培养基中并在28 ℃条件下恒温培养24 h,从中挑选菌落饱满且较大的优势菌株。
1.2.2.2 TTC法筛选实验 将挑取的突变菌株采用划线的方法接种于TTC下层培养基[10]中,在28 ℃恒温培养箱中培养48 h后,在TTC下层培养基上覆盖一层TTC上层培养基[10],并于28 ℃的条件下保温培养3 h,观察培养平皿中的显色情况[11],从中筛选出菌落显色明显的突变菌株。
1.2.2.3 杜氏小管筛选实验 将经TTC法筛出的显色明显的突变酵母菌株,按照5%的接种量分别接种于带有杜氏小管的YPD液体培养基中,并排尽小管中的气体,于28 ℃的恒温培养箱中进行培养,分别在培养12、24、36 h时,观察并记录杜氏小管中的产气情况[12]。
1.2.2.4 乙醇耐受力筛选实验 将经TTC法及杜氏小管筛选实验筛得的菌株活化后按照5%的接种量分别接种于酒精浓度为16%、17%、18%、19%、20%的YPD液体培养基中,于28 ℃条件下恒温培养48 h,在λ=660 nm处测各菌液在不同酒精浓度下的吸光值。
1.2.2.5 摇瓶发酵筛选实验 将经乙醇耐受力筛选出的各突变酵母菌株,按照5%的接种量分别接种于发酵培养基中,放于28 ℃,130 r/min振荡培养箱中进行发酵,每间隔24 h测其发酵醪液二氧化碳失重,发酵6 d后测定发酵培养基中残糖含量、酒精度、可溶性固形物折光率及发酵醪液pH。
1.2.2.6 指标测定 残糖含量采用便携式手持糖度仪测定;二氧化碳失重采用电子天平精称的方法[13],测定每间隔24 h发酵醪液的二氧化碳失重;酒精度根据国标GB/T 15038-2006《葡萄酒、果酒通用分析方法》蒸馏后酒精计法[14]测定;pH采用精密电子pH计测定;糖醇转化率[15]:按照公式S(%)=(C/G)×100 进行计算,式中:S为糖醇转化率(%),C为酒精度(%vol),G为消耗糖度(Brix);可溶性固形物折光率:使用数显折光仪进行测定。
1.2.3 猕猴桃果酒生产工艺 为确保酵母能够发酵完全,发酵前在猕猴桃果浆中按照100 g/L的比例添加蔗糖,固不在以糖添加量为影响因素设计单因素实验。
1.2.3.1 猕猴桃果酒的工艺流程 猕猴桃鲜果→猕猴桃的分选→清洗→去皮→破碎打浆→调整成分→接种酵母菌→恒温发酵→12 ℃陈酿90 d→过滤澄清→果酒
1.2.3.2 果浆初始pH对果酒品质的影响 猕猴桃果浆初始pH为4.5,用柠檬酸钠将猕猴桃果浆的pH分别调为4.5、4.8、5.2、5.5、6.0,在此基础上对猕猴桃果浆分别接入2%的菌种,SO2添加量为60 mg/L在24 ℃下发酵7 d,以酒精度和感官评定为指标,研究pH对猕猴桃果酒发酵的影响。
1.2.3.3 接种量对果酒品质的影响 猕猴桃果浆在SO2添加量为60 mg/L,果浆初始pH为4.5条件下分别以体积分数为1%、2%、3%、4%、5%的接种量进行接种,然后置于24 ℃恒温发酵7 d,测定酒精度,并进行感官评定。

表2 感官评定标准Table 2 Sensory evaluation criteria
1.2.3.4 SO2添加量对果酒品质的影响 猕猴桃果浆在接种量为2%,果浆初始pH为4.5的基础上,调整SO2添加量[16]分别为30、60、90、120、150 mg/L,然后将其置于24 ℃条件下恒温发酵7 d,测定酒精度,并进行感官评定。
1.2.3.5 发酵温度对果酒品质的影响 猕猴桃果浆在接种量为2%,SO2添加量为60 mg/L,果浆初始pH为4.5的基础上分别在20、22、24、26、28 ℃的温度下恒温发酵7 d,测定酒精度,并进行感官评定。
1.2.3.6 发酵时间对果酒品质的影响 猕猴桃果浆在接种量为2%,SO2添加量为60 mg/L,果浆初始pH为4.5的条件下,24 ℃分别发酵5、6、7、8、9 d,测定酒精度,并进行感官评定。
1.2.3.7 正交实验 在单因素水平实验的基础上,选择影响显著的果浆初始pH、接种量、SO2添加量、发酵温度作为影响猕猴桃果酒发酵的主要因素,并根据表1设计L9(34)正交实验,以感观评定及酒精度作为指标,确定猕猴桃果酒的最佳生产工艺。
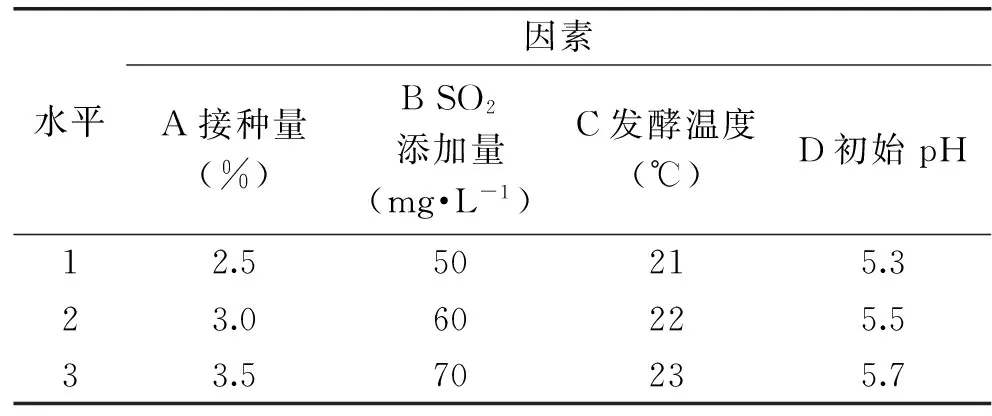
表1 实验因素与水平Table 1 Experimental factors and levels
1.2.3.8 感官评定指标 发酵的猕猴桃果酒共邀请12名实验室的成员进行品尝,并根据表2感官评定标准进行感官评分,评定分数采用100分制,取其总分的平均分值为最终的感官评价得分。
1.2.4 数据处理 实验重复三次,以减少实验误差。实验数据利用Excel软件进行处理分析。
2 结果与讨论
2.1 正突变菌株的筛选
将处于对数生长期的HJ-1菌株经紫外诱变处理后,经16%vol酒精浓度的YPD液体培养基筛选后采用划线的方法从中共挑出6株菌株长势比较健壮,菌落较大且饱满的突变菌株HJ-1A、HJ-1B、HJ-1C、HJ-1D、HJ-1E、HJ-1F,作为后续实验菌株。
2.1.1 TTC法筛选实验 采用划线的方法,将6株突变菌株接种于TTC培养基中,6株突变菌株中HJ-1B、HJ-1C、HJ-1E与HJ-1F菌株的显色结果最明显,为深红色,其次为HJ-1A菌株与HJ-1D菌株,显色为红色,根据菌株产酒精能力越强,显色反应越明显原理[17]共挑选出HJ-1F、HJ-1B、HJ-1E与HJ-1C四株酵母菌株,进行杜氏小管筛选实验。
2.1.2 杜氏小管筛选实验 HJ-1B、HJ-1C、HJ-1E、HJ-1F四株突变菌株的产气情况如表3所示。
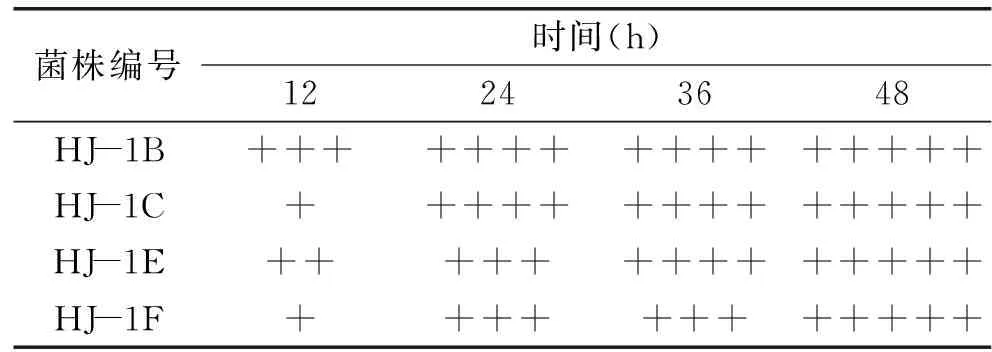
表3 杜氏小管筛选产气结果Table 3 The result of screening of gas production in the proximal tubule
注:“+”表示气体约占杜氏小管体积的1/5;“++”表示气体约占杜氏小管体积的2/5;“+++”表示气体约占杜氏小管体积的3/5;“++++”表示气体约占杜氏小管体积的4/5;“+++++”表示杜氏小管充满气体。
由表3可知,其中HJ-1B菌株的产气性能最好,其次为HJ-1C。培养12 h后菌株HJ-1C仅有少量产气,当培养至24 h时产气已约占杜氏小管体积的4/5。可能在培养初期菌株以增殖为主,发酵性能较差,产气较少,增殖完成后,菌株活性增强,发酵性能突出,故产气剧增。HJ-1B与HJ-1C在培养24 h时,产气已充满杜氏小管体积的4/5,而HJ-1E与HJ-1F在24 h时杜氏小管中气体仅占3/5,HJ-1E直至36 h时,小管中才充满了4/5的气体,HJ-1F菌株在48 h后产气才将杜氏小管充满,故将HJ-1B与HJ-1C、HJ-1E作为乙醇耐受力筛选实验菌株。
2.1.3 乙醇耐受力筛选实验 HJ-1B与HJ-1C、HJ-1E三株突变菌株在不同酒精浓度的YPD液体培养基中的生长情况如图1可知,HJ-1B与HJ-1E菌株的乙醇耐受力最好,最高可耐受18%vol的酒精,其次为HJ-1C菌株,乙醇耐受力为17%vol。当酒精浓度达到19%vol时,三株突变菌株均不能正常生长。因此,将HJ-1B与HJ-1E作为发酵菌株,进行摇瓶发酵实验。

表4 摇瓶发酵实验结果Table 4 The result of shake flask fermentation
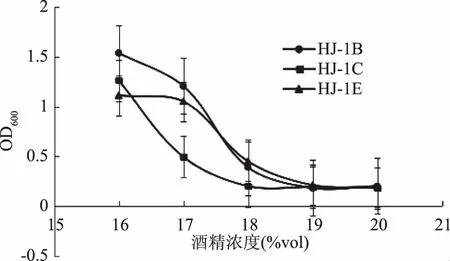
图1 突变菌株的酒精耐受实验Fig.1 Alcohol tolerance test of mutant strain
2.1.4 摇瓶发酵筛选实验 HJ-1B与HJ-1E两株突变菌株摇瓶发酵6 d后的结果如表4所示。
由表4可知,HJ-1E菌株产酒精能力最强,酒精度为11.9%vol,糖醇转化率为68.79%,而HJ-1B菌株产酒精能力稍弱为10.4%vol,两突变菌株比实验室保藏菌株HJ-1产酒精能力(9.8%vol)与乙醇耐受力(15%vol)均有所提高,其中HJ-1E菌株的乙醇耐受性与产酒精能力最为突出,较出发菌株,其产酒精能力与乙醇耐受力分别提升了21.43%与20%,故将HJ-1E正向突变菌株作为猕猴桃果酒酿造菌株。
2.2 猕猴桃果酒加工工艺优化
2.2.1 果浆初始pH对果酒的影响 猕猴桃压果浆在不同pH条件下发酵的结果见图2。
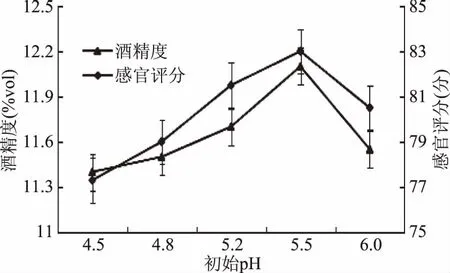
图2 初始pH对果酒质量的影响Fig.2 Effect of initial pH on fruit wine quality
由图2可知,pH对感官指标、酒精度的影响比较大。在一定的pH范围内,随着猕猴桃果浆pH的增大,猕猴桃果酒的酒精度逐渐上升,感官评分增加。果浆初始pH若过高,不仅仅会破坏猕猴桃果浆中的营养成分,还会使果浆变成褐色,从而降低猕猴桃果酒的品质[18]。当初始pH为5.5时,猕猴桃果酒酒精度及感官评分均最高,说明猕猴桃果酒发酵适宜的pH为5.5。
2.2.2 接种量对果酒的影响 猕猴桃果浆分别按照不同的接种量接种发酵结果见图3。在一定范围内,接种量越大,发酵速度越快。一定程度的扩大接种量,可以提高菌体增殖速度,酵母菌株的代谢物也会随之增多。但接种量过大,果汁中的营养物更多地消耗在菌体细胞生长繁殖上,导致代谢底物变少,发酵产物并不会因接种量增大而变多。由图3可知,当接种量为3%时猕猴桃果酒酒精度高且感官评分最高,表明在猕猴桃果酒酿造时适宜的接种量为3%。
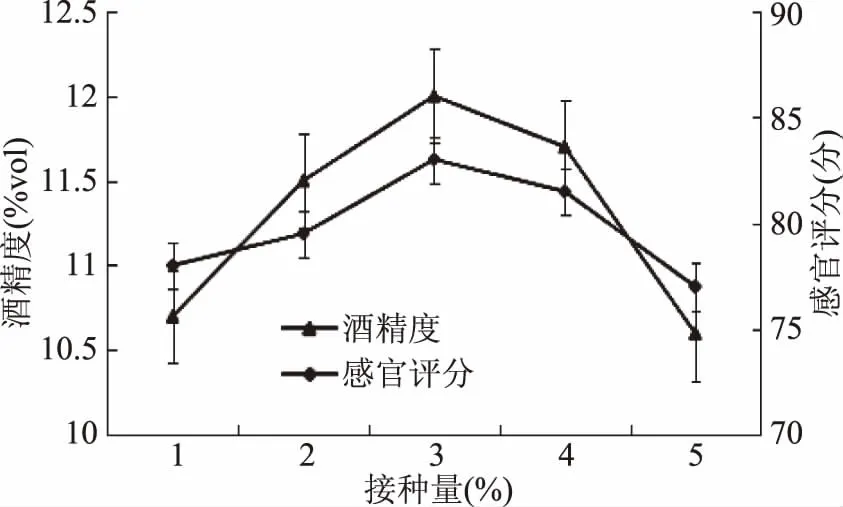
图3 接种量对果酒质量影响Fig.3 Effect of inoculum concentration on fruit wine quality
2.2.3 SO2添加量对果酒的影响 猕猴桃果浆在添加不同浓度的SO2条件下发酵结果见图4,可得随着SO2添加量的增大,酒精度呈现先上升后下降的趋势。当SO2添加量为60 mg·L-1时猕猴桃果酒的酒精度和感官评定均为最高。随着SO2浓度的上升,虽能较好的抑制杂菌的生长,避免果酒因氧化而变色,但是浓度过高的SO2会超过酵母自身的耐受能力,对其呼吸作用产生抑制,使得发酵性能降低,酒精度呈递减趋势,这表明猕猴桃果酒生产时适宜的SO2添加量为60 mg·L-1。
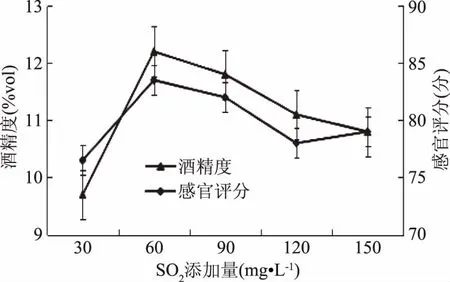
图4 SO2添加量对果酒质量影响Fig.4 Effect of SO2 addition on fruit wine quality
2.2.4 发酵温度对果酒的影响 猕猴桃果浆在不同温度下发酵的结果如图5,可知,发酵温度对猕猴桃果酒感官评定的影响较明显,在发酵温度为22 ℃时,酒精度数和感官评定分值均为最高。造成这一现象的主要原因是随着发酵温度的升高,菌体繁殖速度加快,猕猴桃果汁里较多的糖分被用于菌体自身生长,导致糖醇转化率降低,所酿猕猴桃果酒因酒精度偏低,口感一般,感官评分也相对较低。将发酵温度控制在22 ℃,在此温度下酿制的猕猴桃果酒不仅酸甜可口,而且果香浓郁。
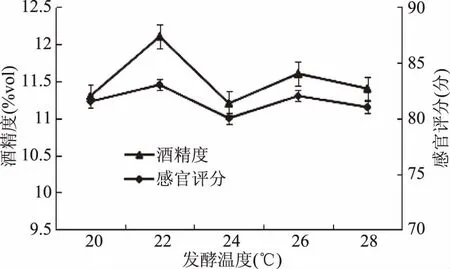
图5 发酵温度对果酒质量影响Fig.5 Effect of fermentation temperature on fruit wine quality
2.2.5 发酵时间对果酒的影响 猕猴桃果浆不同时间下恒温发酵的结果如图6所示,随着发酵时间的延长,酒精度呈上升趋势,当发酵时间为8 d时,酒精度和感官评定都达到最高,并逐渐趋于平稳。说明猕猴桃果酒在发酵8 d时品质达到最佳。
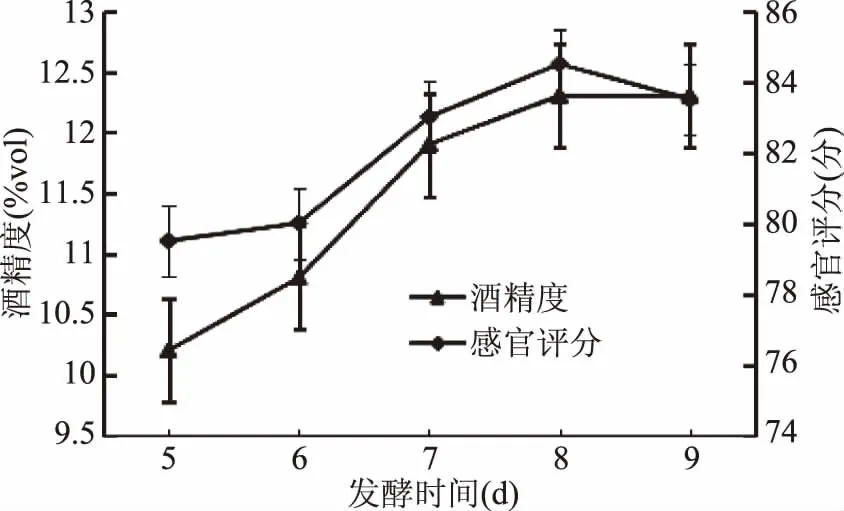
图6 发酵时间对果酒品质影响Fig.6 Effect of fermentation time on fruit wine quality
2.2.6 正交实验 根据单因素实验选定猕猴桃果浆初始pH、接种量、SO2添加量、发酵温度四因素设计L9(34)正交实验,其实验结果见表5。
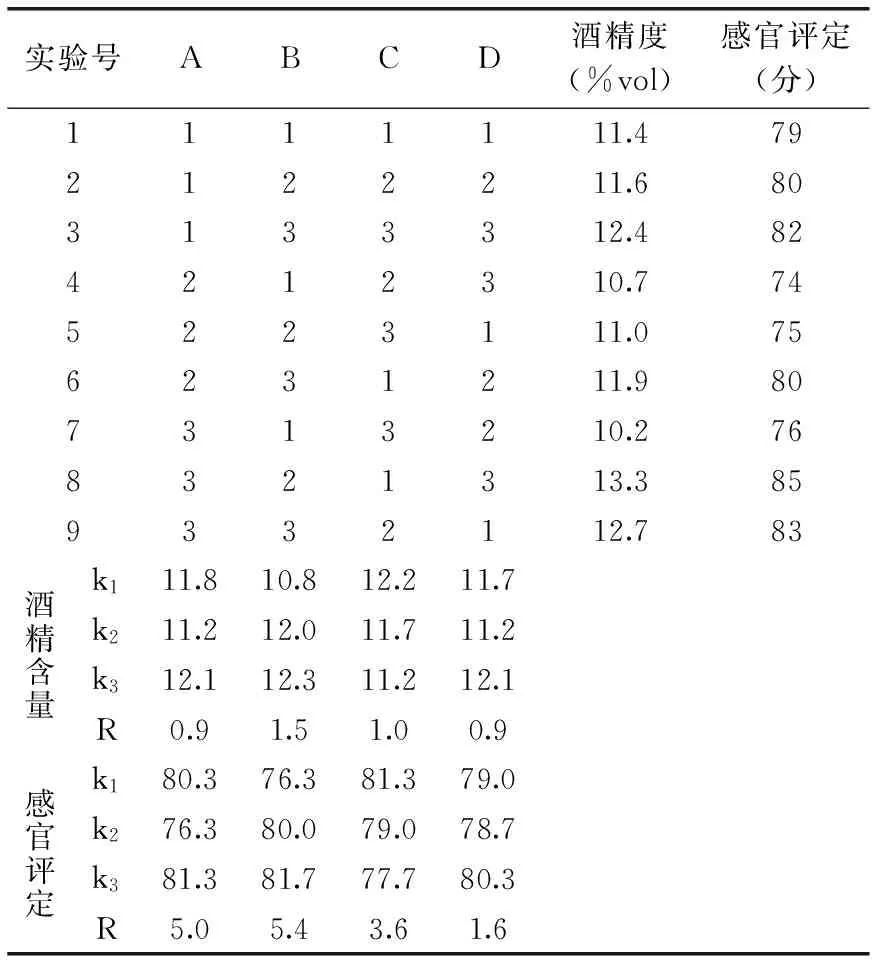
表5 正交实验结果Table 5 The result of Orthogonal test
由表5可知,SO2添加量对果酒的酒精度及感官得分的影响最大。从发酵酒精度及感官评定结果显示最佳组合为A3B3C1D3。即猕猴桃果酒的最佳工艺条件为:酵母菌接种量3.5%,SO2添加量70 mg/L,初始pH5.7,21 ℃发酵8 d。
2.2.7 验证实验 对正交实验所得最佳工艺组合A3B3C1D3进行验证实验,实验重复三次。在酵母菌接种量3.5%,SO2添加量70 mg/L,初始pH5.7,21 ℃发酵8 d条件下酿造的猕猴桃果酒酒体清澈、果香浓郁、入口甘爽,酒精度为13.3%vol,残糖为4.9 Brix,糖醇转化率可达52.44%。猕猴桃果酒最终的感官评分为86分,均优于正交实验其他组合,表明正交实验所得的此优化工艺稳定可行。
3 结论
以自然界筛出的具有高乙醇耐受力酵母菌株HJ-1为出发菌株,紫外诱变处理后经三级筛选最终获得一株发酵性能提高的正向突变的菌株HJ-1E。发酵6 d后HJ-1E菌株可产酒精11.9%vol,乙醇耐受力为18%vol,较出发菌株HJ-1相比,HJ-1E菌株产酒精能力与乙醇耐受力分别提高了21.43%与20%,是一株极具研究与应用价值的酵母菌株。
将HJ-1E酵母菌株应用于猕猴桃果酒的发酵,通过单因素及正交实验,确定了果酒的最佳发酵工艺条件为:酵母菌接种量3.5%,初始pH5.7,发酵温度21 ℃,SO2添加量70 mg/L,在此条件下发酵8 d,猕猴桃果酒酒精度为13.3%vol,具有浓郁的猕猴桃果香和酒香。
[1]耿敏.猕猴桃加工工艺探究分析[J].食品安全导刊,2016(27):127.
[2]袁云香.猕猴桃营养成分的提取工艺研究进展[J].江苏农业科学,2013,41(2):221-222.
[3]任显锐.猕猴桃果酒酵母的筛选及发酵工艺优化探索[J].内江科技,2017(3):34-39.
[4]石瑞丽.红心猕猴桃果酒酿造工艺研究[J].酿酒科技,2017(6):86-90.
[5]张丽华,惠伟,屠荫华.猕猴桃在食品加工中的开发利用[J].氨基酸和生物资源,2015,37(2):6-9.
[6]赖颖,郭婕,郭静娜. 浓香型白酒生产中耐酒精酵母菌的选育研究[J]. 酿酒科技,2015(1):31-36.
[7]吴华昌,肖辰,邓静,等.一株耐高浓度乙醇酒精酵母的筛选及发酵特性的研究[J].中国酿造,2012,31(3):111-115.
[8]彭源德,朱作华,唐守伟,等. 耐高温、高浓度酒精酵母的选育与耐受性能初步鉴定[J].中国麻业科学,2010,32(3):135-142.
[9]曹礼,王晓亲,李彩霞,等.酿酒酵母菌的紫外诱变及其突
变株的性能测定[J].中国酿造,2009(10):66-68.
[10]李忠英,陈杰山,罗跃中,等.高效酒精酵母菌的选育及鉴定[J].食品研究与开发,2014,35(7):104-107.
[11]杨东升,朱丽元,谢晓红,等.UV处理筛选耐高浓度乙醇酿酒酵母菌株[J].中国酿造,2010(10):35-38.
[12]成少宁,许先猛,马欣,等.废糖液酒精发酵中酵母菌的分离、筛选和验证[J].食品与发酵科技,2016,52(1):6-10.
[13]王凤梅,马利兵. 内蒙古西部地区本土葡萄酒酿酒酵母发酵特性研究[J]. 生物技术通报,2015,31(9):204-208.
[14]中华人民共和国国家质量监督检验检疫总局中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2007.
[15]方佩佩,王世清,李静,等. 紫外诱变法选育高产酒精及酯类酿酒酵母[J]. 粮油食品科技,2016,24(1):86-90.
[16]周元,张强,傅虹飞,等.猕猴桃果酒酵母的筛选及发酵工艺优化[J].西北农林科技大学学报,2014,42(12):151-160.
[17]王梅,张澎湃,帅桂兰,等.TTC在黄酒酵母选育中的应用[J].酿酒,2001,28(5):62-64.
[18]徐清萍,朱广存.野生猕猴桃酒发酵工艺研究[J]. 酿酒科技,2010(10):79-81.
