不同方法提取海洋硅藻粗多糖的比较
2018-03-02陈利华成家杨
陈利华,王 欣,成家杨
(北京大学深圳研究生院 环境与能源学院,广东 深圳 518055)
海洋微藻多糖是海洋微藻的生物活性物质之一[1],由多个相同或不同的单糖基通过糖苷键相连而形成的高分子碳水化合物组成,是微藻体中最重要的组成成分之一[2]。微藻多糖约占藻体干质量的20%~70%,是一类混合物,总体分为三类:最外层细胞壁多糖、细胞壁多糖间的粘多糖、细胞内的贮藏多糖。微藻多糖除了具有工业价值外,还具有多种生物活性及药用功能[3]。目前,关于海洋藻多糖的研究远不及陆地植物和大型藻类多[4-9]。海洋硅藻作为海洋浮游生物的主要类群(类数和生物量一般占80%以上),具有种类多、繁殖快、分布广等特点,是海洋硅藻多糖的主要来源之一[10]。
目前,大多数研究以海洋硅藻为对象开展了硅藻多糖抗肿瘤、抗病毒、抗辐射和提高免疫力等活性方面的研究,包括羽纹藻、舟形藻等[11-14],而对于硅藻多糖的提取方法研究较少。硅藻粗多糖可为后续的活性研究提供原料来源,是硅藻多糖研究的一个重要方面[15-18]。已报道的海洋硅藻多糖提取过程主要包括:冷水或热水提取、稀酸、稀碱或稀盐溶液提取[19-21],添加有机沉淀剂(如乙醇等),离心去除蛋白及残渣,最后用冷冻干燥法获得粗多糖[22]。随着对提取工艺的不断改进,出现了一些新的提取工艺,包括酶辅助提取法、超声波辅助提取法、超临界流体萃取及加压液体萃取等方法[23],超声波法可以使硅藻干粉在浸取过程中更好地溶解出多糖,此外,还可以利用冻融破碎法[24]。这些方法常被用作提取前预处理,但是利用上述提取方法得到的物质为粗多糖,含有较多的杂质如核酸、蛋白质和少量的无机盐,需要进行进一步提纯[25]。尽管一些研究提出了有效的海洋微藻多糖提取方法,但多数研究是利用同一类提取方法,同时利用多种方法对同一微藻生物质进行多糖提取,并对其粗多糖提取率及总糖含量进行比较的研究较少,这导致无法明确某一种或某一类微藻生物质所对应的最佳粗多糖提取方法。不同种类微藻的细胞结构及成分存在差异,适用的粗多糖提取方法可能不同。因此,比较不同提取方法对同一类微藻生物质粗多糖的提取效果具有重要意义。
本研究以室外培养的海洋硅藻干粉为材料,采用9种不同提取方法提取硅藻粗多糖(水提法、酸法、碱法、超声法及冻融法等)。考察了不同提取方法下粗多糖的提取率及多糖总糖、蛋白质及硫酸基含量,以筛选出较佳的提取方法。然后利用筛选的方法从4种纯种海洋硅藻中提取粗多糖,以筛选出适合提取多糖的硅藻藻种。
1 材料与方法
1.1 材料与仪器
试验用藻:(1)深圳大鹏新区海洋微藻培养基地露天培养获得的海洋硅藻藻粉(约70%(细胞数比例)为角毛藻,其余30%由舟形藻、菱形藻、海链藻及茧形藻组成);(2)4种纯种硅藻分别为角毛藻、菱形藻、茧形藻、海链藻。
试剂:无水乙醇、氢氧化钠(粒)、无水碳酸钠、无水葡萄糖、苯酚、硫酸钾、氯化钡、明胶、三氯乙酸、浓盐酸、浓硫酸均为分析纯。需要配制试剂:1 mol·L-1HCl、0.5%明胶、1%氯化钡- 明胶、3%三氯乙酸。
试验仪器:电热鼓风干燥箱(DHG- 9140A)、电子分析天平(AL104/01)、离心机(Centrifuge5810R)、智能恒温水浴锅(SCG- 4)、超声波细胞粉碎机、紫外可见分光光度计、pH计(Startorius PB- 10)、台式冷冻干燥机、红外消化炉。
1.2 试验方法
1.2.1 样品预处理
将混合海洋硅藻粉研磨过325目筛,得到均匀的硅藻粉,用于后续试验的藻粉来源。
1.2.2 海洋硅藻粗多糖提取方法
比较9种不同方法(水浸提法、稀酸提取法、稀碱提取法、超声+冻融法、冻融+加热法、超声+冻融+加热法、4% NaOH 、4% NaOH+冻融法与4% NaOH+冻融+加热法)的粗多糖提取率,选出最佳的提取方法。在提纯过程中采用乙醇分级沉淀法,考察同一方法下不同倍体积乙醇对粗多糖提取率的影响。每种方法使用的料液比均为1∶30 (质量体积比)、提取时间为4 h。具体提取操作方法如下:
(1)水浸提取法[23]:提取温度分别设定为50、60、70、80、90和100 ℃,藻水混合液在设定的温度下加热,在4 000g下离心20 min获得上清液。
(2)稀酸提取:用0.1 mol·L-1HCl提取后离心获得上清液。
(3)稀碱提取:用0.1 mol·L-1NaOH提取后离心获得上清液。
(4)超声+冻融法:对藻水混合液进行超声破碎90 min,反复冻融4次,离心取上清液。
(5)冻融+90 ℃:对藻水混合液进行超声破碎90 min后反复冻融4次,置于水浴锅中90 ℃恒温水浴加热4 h,4 000g离心20 min,分别收集上清液和沉淀。沉淀中继续加入等体积去离子水,90 ℃恒温水浴加热2 h,4 000g离心20 min,收集上清液。将2次得到的上清液混合。
(6)超声+冻融+90 ℃:将藻水混合液超声破碎90 min后反复冻融4次,90 ℃恒温水浴加热4 h,4 000g离心20 min,收集上清液。
(7)4% NaOH法:将硅藻干粉按一定比例置于4% NaOH溶液中,使其充分反应,4 000g离心20 min得到上清液。
(8)4% NaOH+冻融法:将硅藻干粉置于4% NaOH溶液中,使其充分反应,反复冻融4次,4 000g离心20 min得到上清液。
(9)4% NaOH+冻融+90 ℃法:将硅藻干粉按一定比例置于4% NaOH溶液中,反复冻融4次,4 000g离心20 min,分别收集上清液与藻渣;然后将藻渣置于沸水浴中加热3 h,离心得到上清液。
分别将上述方法得到的上清液加热浓缩至原体积的1/4以去除溶液中的蛋白质,然后冷却至室温。分别用0.4、1、2、3、4和5倍体积的无水乙醇进行沉淀提纯。将得到的沉淀物置于冻干机中干燥,得到粗多糖干粉。
1.2.3 粗多糖提取率计算方法
粗多糖提取率为提取得到的粗多糖干粉质量(g)相对硅藻干粉质量(g)的百分比,即:
粗多糖提取率=m粗多糖/m硅藻× 100%。
1.2.4 粗多糖组成成分分析方法
总糖含量测定[24]:采用硫酸- 苯酚法测定样品的总糖含量,配制0.1 mg·mL-1葡萄糖标准溶液,分别量取0.1、0.2、0.4、0.5、0.6、0.7、0.8、1.0、1.2、1.4、1.6 mL标准溶液,置于15 mL刻度试管,准确加蒸馏水至2.0 mL,分别加入1.0 mL 5%苯酚溶液和5.0 mL浓硫酸,用涡旋混合器混合均匀,于沸水浴加热5 min,取出后室温下冷却15 min,分别在480、490 nm测定吸光度。以葡萄糖质量为横坐标,吸光度为纵坐标,绘制标准曲线。根据标准曲线及换算因子计算样品总糖含量。
蛋白质含量测定:采用凯氏定氮法测定粗多糖中的蛋白质含量,将粗多糖样品与浓硫酸和催化剂(K2SO4、CuSO4·5H2O)一同加入消解管内加热消化,使蛋白质分解,其中碳和氢被氧化为二氧化碳和水逸出,样品中的有机氮转化为氨与硫酸结合成硫酸铵。将消化液转入凯氏定氮反应器内,用0.1 mol·L-1盐酸吸收后再用已经标定过的NaOH溶液进行滴定。
硫酸钡比浊法测定硅藻多糖中硫酸基含量[25]:将硫酸盐标准样品108.75 mg K2SO4溶于100 mL 1 mol·L-1HCl中,即得到0.6 mg·mL-1硫酸基标准溶液。称取多糖样品10 mg,加入5mL 1 mol·L-1HCl中,于110 ℃加热水解8 h,冷却后,8 000g,离心20 min,保存备用。
标准曲线绘制方法:首先准确吸取预先配制好的硫酸基标准溶液0、0.04、0.08、0.10、0.12、0.14、0.16、0.18、0.2 mL于消解管中,加盐酸至0.2 mL;以0.2 mL 1 mol·L-1HCl溶液作为空白。然后加入三氯乙酸3.8 mL及氯化钡- 明胶1.0 mL,振荡摇匀,室温静置15 min,于360 nm测吸光度D1;以1.0 mL明胶溶液代替氯化钡溶液,相同方法测吸光度D2;以硫酸基毫克数为横坐标,纵坐标为吸光度(D1-D2)绘制标准曲线。
1.2.5 数据处理
试验中样品提取及测定均设置2个平行样。试验数据采用Orgin 8.6、SPSS11.5软件进行样本方差、样本检验统计分析,以P<0.05为差异显著以P<0.01为差异极显著。
2 结果与分析
2.1 不同提取方法的粗多糖提取率
2.1.1 水提法
如图1所示,水提法的粗多糖提取率比较低,均低于4.3%。同一温度下,随着乙醇体积的增加,粗多糖的提取率呈显著上升趋势(P<0.05),但当提取温度达到100 ℃,各处理差异不显著(P>0.05)。说明乙醇体积是影响多糖提取率重要因素之一,各种多糖在不同浓度的乙醇中具有不同的溶解度,随着乙醇体积的增大,逐级沉淀出分子量由大到小的多糖类物质;但温度高时,这种作用不明显。相同乙醇体积下,温度不同,提取率亦不同,但两者间无明显正相关或负相关规律(P>0.05),表明醇沉体积对粗多糖提取的影响比温度更大。总体来说,水提法粗多糖提取效率不高,原因可能是硅藻细胞壁为纳米硅质结构,不易被破坏[25-27],藻体细胞内含有藻胆蛋白、高度不饱和脂肪酸等生物活性物质,长时间的加热会导致这些有效成分的破坏,所以水提法不利于藻体细胞的综合利用。
2.1.2 其他物理化学方法
对比图1和图2可以看出,稀酸法或稀碱法提取的粗多糖总量均明显高于水提法,这可能是由于稀酸和稀碱法破坏了硅藻的细胞壁结构,溶解出胞内的多糖、纤维素、半纤维素等物质,这些多糖类物质可能更易溶于酸性或是碱性溶剂,从而增加了多糖的产量[22]。稀酸法的粗多糖提取率随着乙醇体积的增加大致呈现先上升后下降趋势,在乙醇体积为4倍时,粗多糖提取率达到最大,而稀碱法的粗多糖提取率随乙醇体积的增加变化不显著。同时,3种物理提取法(超声+冻融、冻融+90 ℃、超声+冻融+90 ℃)的多糖提取率随乙醇体积的增加变化不明显,最高提取率分别为5.58%、3.99%、5.23%,略高于水提法,表明超声、冻融操作对多糖提取具有一定程度的促进作用。

相同乙醇体积下,不同柱子上无相同大写字母表示差异极显著(P<0.01),无相同小写字母表示差异显著(P<0.05)。下同。At the same ethanol volumes, data on the bars marked without the same uppercase letter indicated significant differences at P<0.01, data on the bars marked without the same lowercase letter indicated significant differences at P<0.05. The same as below.图1 不同温度下水提法的多糖提取率Fig.1 Extraction rate of polysaccharide by water extraction at different temperatures
在浓碱(4% NaOH)法中,多糖提取率随乙醇体积的增加,呈现显著性差异(P<0.05),在乙醇体积为3倍时,多糖提取率达到最大(28.44%);浓碱+冻融法中,乙醇体积为3倍时多糖提取率达到最大(33.14%);浓碱+冻融+90 ℃法中,乙醇体积增加到2倍时,多糖提取率显著增加,乙醇体积为3倍时提取率达到最大(44.40%)。在浓碱的基础上同时使用冻融或加热的物理方法,如浓碱+冻融、浓碱+冻融+90 ℃,用3倍体积乙醇沉淀,多糖提取率最高,表明4% NaOH提取之后辅助冻融法可提高粗多糖的提取率。这是因为冻融过程促使细胞膜的疏水键结构破裂,增加了细胞的亲水功能;同时,冷冻可促使细胞内水结晶,形成冰粒,引起细胞膨胀破裂,之后的加热则进一步破坏硅藻细胞壁的纳米硅质结构,从而提高了提取率[20-21]。
在以往的一些研究中,虽然对比了同一方法下不同提取条件(温度、pH等)对粗多糖提取的影响,但仅仅对同一醇沉体积下得到的多糖结果进行对比[10,13-14]。本实验考察了不同方法中不同醇沉体积获得的粗多糖提取率,能更充分反映不同方法对粗多糖提取率的影响。
2.2 粗多糖成分
以上结果表明,不同提取方法的硅藻粗多糖提取率存在差异,推测不同方法提取的粗多糖成分亦可能存在差异,单以多糖提取率为指标衡量提取方法的优劣较片面。因此,本研究进一步对不同粗多糖的总糖、蛋白质和硫酸基含量进行了分析。
2.2.1 总糖含量
将提取出的粗多糖分别配制成0.1 mg·mL-1样品溶液,按照1.2.4节硫酸- 苯酚测定方法测定其总糖含量。以葡萄糖为标准品,分别在490、480 nm下绘制总糖标准曲线图(图3),所得的线性回归方程分别为:y=7.533x-0.099(R2=0.996),y=7.614 3x-0.135(R2=0.999 8)。

1,稀酸法(0.1 mol·L-1 HCl pH=3);2,稀碱法(0.1 mol·L-1 NaOH pH=10);3,超声+冻融;4,冻融+90 ℃;5,超声+冻融+90 ℃;6,浓碱(4% NaOH);7,浓碱(4% NaOH)+冻融;8,浓碱(4% NaOH)+冻融+90 ℃。图4、图5、图6、图7同。1, Acid extraction (0.1 mol·L-1 HCl pH=3); 2, Alkali extraction (0.1 mol·L-1 NaOH pH=10); 3, Ultrasonic+freeze thawing; 4, Freeze thawing+90 ℃; 5, Ultrasonic+freeze thawing+90 ℃; 6, Concentrated alkaline (4% NaOH); 7, Concentrated alkaline(4% NaOH)+freeze thawing; 8, Concentrated alkaline(4% NaOH)+freeze thawing+90 ℃. the same as Fig.4, 5,6 and 7.图2 不同提取方法的多糖提取率Fig.2 Extraction rate of polysaccharide by different methods

A,490 nm总糖含量测定标准曲线;B,480 nm总糖含量测定标准曲线;C,硫酸基含量测定标准曲线A, Standard curve of total sugar content under 490 nm; B, Standard curve of total sugar content under 480 nm; C, Standard curve of sulfate group图3 总糖含量和硫酸基含量测定标准曲线Fig.3 Standard curve of total sugar content and sulfate group content
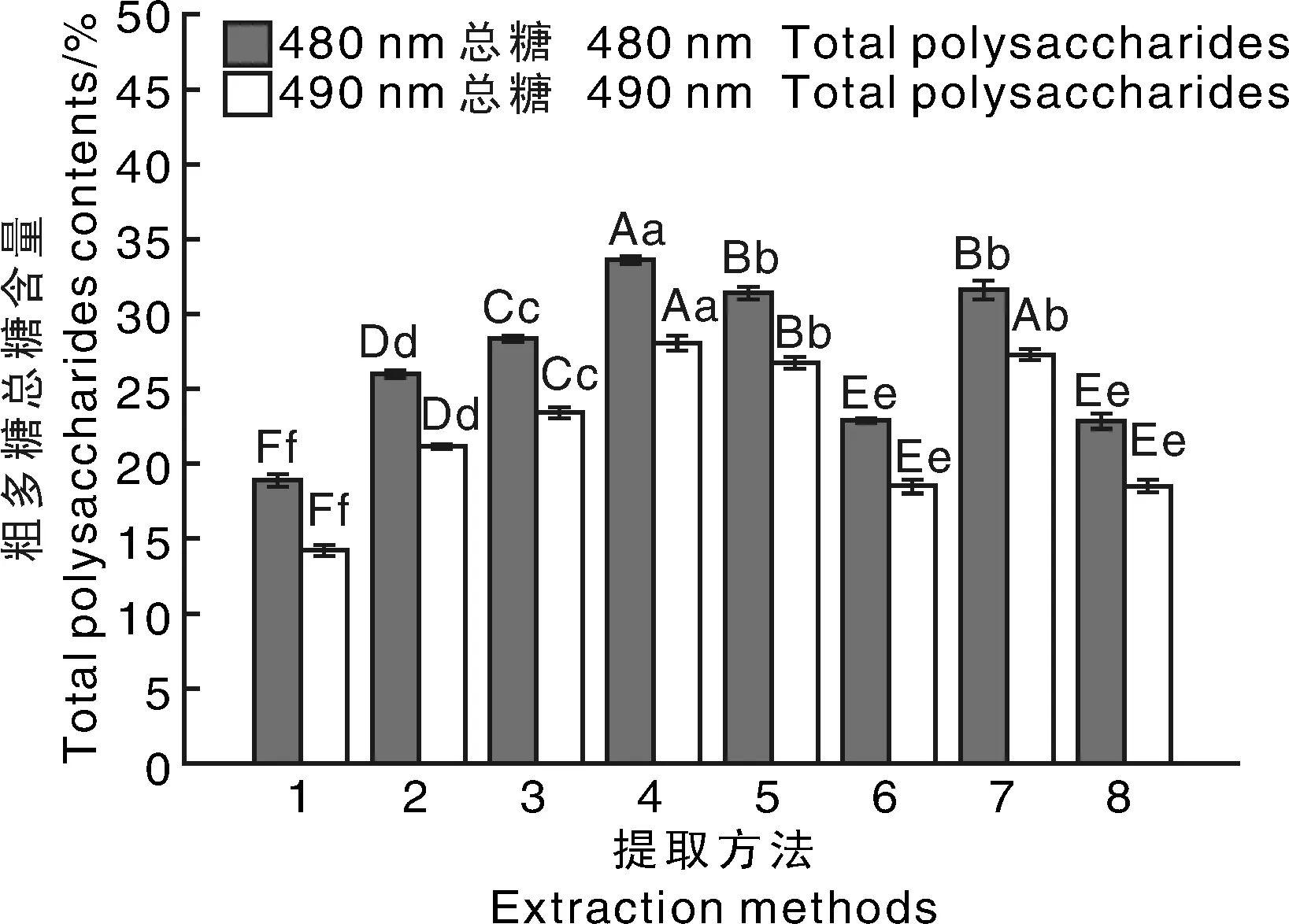
相同波长下,柱状图上无相同小写字母的表示各处理间差异显著(P<0.05),无相同大写字母的表示各处理间差异极显著(P<0.01)At the same wave length, data on the bars marked without the same uppercase letter indicated significant differences at P<0.01, data on the bars marked without the same lowercase letter indicated significant differences at P<0.05.图4 不同提取方法所得多糖的总糖含量Fig.4 Contents of total sugar in polysaccharide extracted by different methods
试验测得的水提法得到粗多糖样品总糖含量为4%~5%,其他8种方法粗多糖样品的总糖含量测定结果如图4所示。总体来看,每种方法提取出的硅藻粗多糖中戊糖及糖醛酸均高于己糖含量(硫酸- 苯酚法中,己糖在490 nm有最大吸收,戊糖及糖醛酸在480 nm有最大吸收)。冻融+90 ℃法提取的粗多糖总糖含量最高,为33.62%(480 nm)和28.06%(490 nm)。不同方法的粗多糖总糖含量大小为:冻融+90 ℃>浓碱+冻融法>超声+冻融+90 ℃>超声+冻融>稀碱法(pH=10)>浓碱+冻融+90 ℃>浓碱法(4% NaOH)>稀酸法(pH=3),这与粗多糖提取率大小顺序不同。尽管冻融+90 ℃及超声+冻融+90 ℃的粗多糖提取率最低(图2),但其粗多糖的总糖含量高于其他方法,表明添加额外的化学试剂会一定程度上降低粗多糖的纯度。酸性条件下,粗多糖的总糖含量最低,这是由于酸性条件下某些多糖(糖苷键)发生降解或破坏;碱性条件下,粗多糖中的杂质较多,使纯度下降;相比之下,浓碱法+冻融方法提取的粗多糖却保持了较高的多糖含量。这有可能是由于冻融促进了硅藻胞内多糖的溶出,弥补了碱液的负作用,间接提高了粗多糖中的多糖含量。
2.2.2 蛋白质含量
凯氏定氮法测定结果表明,本研究中硅藻干粉中蛋白质含量为14.40%,说明硅藻干粉中含有一定量的蛋白质。水提法得到的粗多糖样品中蛋白质含量为0.8%左右,其他方法提取的粗多糖样品中蛋白质含量为3.89%~8.58%,大小为超声+冻融>冻融+90 ℃>超声+冻融+90 ℃>浓碱+冻融法>稀碱法(pH=10)>浓碱+冻融+90 ℃>稀碱法(pH=10)>稀酸法(pH=3)>浓碱法(4% NaOH)(图5)。
2.2.3 硫酸基含量
硫酸多糖(sulfated polysaccharide)为多糖的硫酸化衍生物,是多糖分子链中单糖分子的部分羟基被硫酸基取代而形成的一类多功能活性物质[3]。研究表明,硫酸多糖的许多生物活性功能除与多糖结构、水溶性、分子量等有关外,与硫酸基含量(糖基所带硫酸基的个数)亦有着直接联系[28-31]。基于此,本研究考察了不同提取方法所得粗多糖中硫酸基的含量。
用干燥至恒质量的K2SO4配制标准溶液,得到的线性回归方程为y=3.0175x-0.0024(R2=0.999 1)(图3- C)。不同提取方法所得粗多糖中硫酸基的含量如图6所示。水提法得到的粗多糖样品中硫酸基含量为0.03%~0.11%,稀酸法(pH=3)、稀碱法(pH=10)、超声+冻融、冻融+90 ℃、超声+冻融+90 ℃、浓碱法、浓碱+冻融法、浓碱+冻融+90 ℃法提取的粗多糖中硫酸基含量分别为6.58%、1.65%、3.55%、3.94%、2.86%、0.97%、3.23%和1.90%,表明稀酸条件下多糖中的硫酸基不易受破坏,而碱性条件则会造成硫酸基的流失,这是由于碱性条件下硫酸基容易生成3, 6- 内醚衍生物或发生Walden转化,导致硫酸基脱落[28]。冻融及加热操作可弥补碱法对硫酸基的负作用,使硫酸基含量保持较高水平。
2.3 不同提取方法下单位质量硅藻的多糖组分
本研究中水提法得到的粗多糖样品的总糖、蛋白质、硫酸基含量相对较低,以下只对其余8种方法得到粗多糖样品进行比较。综合粗多糖提取率与单位质量粗多糖的成分结果,计算出单位质量藻粉提取的物质组成成分,结果如图7所示。总体来看,碱法条件下单位质量藻粉获得的总糖量较高,是其他方法的5~10倍,浓碱法+冻融法所得的总糖量最高。不同提取方法单位质质量藻粉获得的总糖量大小为浓碱+冻融法>
浓碱+冻融+90 ℃>浓碱法(4% NaOH)>稀酸法(pH=3)>超声+冻融+90 ℃>稀碱法(pH=10)>超声+冻融>冻融+90 ℃。尽管碱提法的粗多糖总糖含量总体较低,但粗多糖的提取率明显高于其他方法,获得的总糖总量更高。同样,虽然冻融加热法等物理方法的单位粗多糖总糖含量较高,但由于其粗多糖提取率明显低于酸提法或碱提法,导致单位硅藻干粉中提取的总糖含量较低。蛋白质含量与多糖量呈相似趋势,不同提取方法单位质量藻粉获得的硫酸基含量大小为浓碱+冻融法>浓碱+冻融+90 ℃>稀酸法(HCl,pH=3)>浓碱法(4% NaOH)>超声+冻融>稀碱法(NaOH,pH=10)≈冻融+90 ℃≈超声+冻融+90 ℃。这些结果表明,浓碱+冻融法从单位质量硅藻干粉中提取出的总糖和硫酸基含量较高,优于其他方法。
在刘筱潇等[14]的研究中,仅从不同提取条件对粗多糖提取率的影响筛选出3种硅藻多糖适宜的提取方法,未对每种粗多糖样品的多糖含量进行测定。戴军等[10]以粗多糖的多糖含量为评价指标,优化了杜氏盐藻多糖的提取工艺,未将粗多糖提取率考虑在内。微藻生物质多糖的最终得率与粗多糖得率、粗多糖中的多糖含量相关。因此,相比于以往的一些研究,本研究结果能准确地反映不同提取方法的优劣。
2.4 纯种硅藻粗多糖的提取
采用筛选出的浓碱+冻融法对4种纯种硅藻粉(角毛藻、菱形藻、茧形藻、海链藻)进行粗多糖提取,醇沉体积为3倍。提取结果如图8- A所示,角毛藻、菱形藻、茧形藻、海链藻的粗多糖提取率分别为38.28%、26.39%、62.06%、13.79%。

A,多糖提取率;B,粗多糖组分;C,单位质量生物质(藻粉)的粗多糖组分。A, Extraction rate of polysaccharide; B, Components of crude polysaccharide; C, Components of per unit diatom biomass (dry powder).图8 不同硅藻的多糖提取效果比较Fig.8 Comparison of polysaccharides extraction effects from different marine diatom species
同时测定了粗多糖的总糖含量(480、490 nm)和硫酸基含量。结果(图8- B)显示,4种纯种硅藻的总糖含量均在30%左右,硫酸基含量顺序为角毛藻>海链藻>菱形藻>茧形藻,表明这4种硅藻的粗多糖纯度相当,但硫酸基含量存在明显差异。结合粗多糖提取率及粗多糖组分含量,计算出单位质量硅藻生物质提取的总糖含量为茧形藻(约24%)>角毛藻>菱形藻>海链藻(约5%);硫酸基含量顺序为角毛藻(5.05%)>菱形藻>海链藻>茧形藻(0.51%)(图8- C)。虽然茧形藻的粗多糖总糖与其他3种藻相当,但由于其提取率较高,提取出的总糖含量也明显高于其他3种藻粉,表明茧形藻适用于硅藻多糖提取,而角毛藻则适用于硫酸基多糖的提取和开发。
3 结论
水提法的粗多糖提取率最低,均低于4.3%,其中总糖含量为4%~5%,蛋白质含量为0.8%,硫酸基含量为0.03%~0.11%,其他8种方法中,浓碱法粗多糖提取率最高。除水提法之外,其他8种提取方法中,与物理法(超声/冻融/加热)相比,化学试剂法(添加酸与碱)均能一定程度降低单位质量粗多糖的总糖含量;粗多糖中蛋白质含量均较低,总体变化趋势与总糖含量相似;而硫酸基含量以稀酸法最高,碱法最低。单位质量硅藻干粉的总糖含量以浓碱+冻融法最高,冻融+90 ℃法最低。浓碱+冻融法提取的单位硅藻干粉总糖含量为10.49%(480 nm)和9.04%(490 nm),蛋白质杂质含量为2.14%,硫酸基含量为1.07%。4种纯种硅藻(角毛藻、菱形藻、茧形藻、海链藻)中,从茧形藻提取的粗多糖总糖含量最高,为23.96%(480 nm)和24.79%(490 nm);从角毛藻提取的粗多糖硫酸基含量最高,为5.05%。
[1] 高亚辉, 梁君荣, 陈长平, 等. 海洋硅藻多样性与生态作用研究[J]. 厦门大学学报(自然科学版), 2011, 50(2): 455-464.
GAO Y H, LIANG J R, CHEN C P, et al. Studies on biodiversity and ecological importance of marine diatoms[J].JournalofXiamenUniversity(NaturalScience), 2011, 50(2): 455-464. (in Chinese with English abstract)
[2] 孙惠洁. 红毛藻多糖的提取纯化及其性质的研究[D].厦门: 集美大学, 2008.
SUN H J. Extraction, purification and characterization of ploysaccharides fromBangiafusco-purpurea[D]. Xiamen: Jimei University, 2008. (in Chinese with English abstract)
[3] HAYSAHI K, HAYASAHI T, KOJIMA I. A natural sulfated polysaccharide, calium spirulan, isolation fromSpirulinaplatensis:invitroandinvivoevaluation of anti- herps simp lex virus and anti- human immunodeficiency virus activities[J].AIDSResearchHumanRetroviruses, 1996, 12(15): 1463-1471.
[4] 陈姣, 徐继林, 李艳, 等. 3种海洋硅藻不同培养阶段挥发性成分的比较分析[J]. 海洋学报, 2014, 36(8): 49-64.
CHEN J, XU J L, LI Y, et al. Analysis of volatile components from three marine diatoms at different growth stages[J].ActaOceanologiaSinica, 2014, 36(8): 49-64. (in Chinese with English abstract)
[5] 王大志, 黄世玉, 程兆第. 三种海洋硅藻胞外多聚物形态、微细结构及组成的初步研究[J]. 海洋与湖沼, 2004, 35(3): 273-278.
WANG D Z, HUANG S Y, CHENG Z D. Morphology, fine structure and chemical composition of extracellular polymeric substances in three marine diatom species[J].OceanologiaetLimnologiaSinica, 2004, 35(3): 273-278. (in Chinese with English abstract)
[6] 金德祥. 海洋硅藻学[M]. 厦门: 厦门大学出版社, 1991: 70-78.
[7] 高亚辉. 海洋微藻分类生态及生物活性物质研究[J]. 厦门大学学报(自然科学版), 2001, 40(2): 566-573.
GAO Y H. Studies on taxonomy, ecology and bioactive products of marine microalgae[J].JournalofXiamenUniversity(NaturalScience), 2001, 40(2): 566-573. (in Chinese with English abstract)
[8] ARMBRUST E V. The life of diatoms in the world′s oceans[J].Nature, 2009, 459: 185-192.
[9] HOAGLAND K D, ROSOWSKI J R, GRETZ M R, et al. Diatom extracellular polymeric substances: Function, fine structure, chemistry, and physiology[J].JournalofPhycology, 1993, 29(5): 537-566.
[10] 戴军, 王旻, 尹鸿萍, 等. 杜氏盐藻多糖提取工艺的优化[J]. 食品与发酵工业, 2007, 33(3): 123-127.
DAI J, WANG M, YIN H P, et al. Optimization of extraction technique of polysaccharides fromDuanaliellasalina[J].FoodandFermentationIndustries, 2007, 33(3): 123-127. (in Chinese with English abstract)
[11] 王长海, 温少红, 鞠宝. 紫球藻多糖的提取和测定[J]. 中国海洋药物, 1999 (1): 22-25.
WANG C H, WEN S H, JU B. Abstraction and measurement of polysaccharides inPorphyridiumcruentum[J].ChineseJournalofMarineDrugs, 1999 (1): 22-25. (in Chinese with English abstract)
[12] 张新宇, 王雷, 李光友, 等. 绿色巴夫藻硒多糖的提取、分离与纯化[J]. 海洋与湖沼, 2000, 31(6): 643-646.
ZHANG X Y, WANG L, LI G Y, et al. Extraction, isolation, and purification of selenium polysaccharides inPavlovavirdis[J].OceanologiaetLimnologiaSinica, 2000, 31(6): 643-646. (in Chinese with English abstract)
[13] 徐锡莲, 童微星, 雷引林, 等. 盐藻胞外多糖分离纯化方法研究[J]. 食品与生物技术学报, 2007, 26(4): 28-33.
XU X L, TONG W X, LEI Y L, et al. Separation and purification of extracellular polysaccharides fromDunaliellasalina[J].JournalofFoodScienceandBiotechnology, 2007, 26(4): 28-33. (in Chinese with English abstract)
[14] 刘筱潇, 孙颖颖, 管习超, 等. 3种海洋微藻多糖提取工艺的研究[J]. 海洋通报, 2010, 29(5): 534-539.
LIU X X, SUN Y Y, GUAN X C, et al. Study on the extraction process of polysaccharide from three species of marine microalgae[J].MarineScienceBulletin, 2010, 29(5): 534-539. (in Chinese with English abstract)
[15] HELLEBUST J A. Extracellular products[M]//STEWART W D P. Algal physiology and biochemistry. Berkeley: University of California press, 1974: 838-863.
[16] FOGG G E. The ecological significance of extracellular products of phytoplankton photosynthesis[J].BotanicaMarina, 2009, 26(1): 3-14.
[17] POULET S A, MARTIN- JÉZÉQUEL V. Relationships between dissolved free amino acids, chemical composition and growth of the marine diatomChaetocerosdebile[J].MarineBiology, 1983, 77(1): 93-100.
[18] TOSHIMITSU HAYASHI A, HAYASHI K, MAEDA M, et al. Calcium spirulan, an inhibitor of enveloped virus replication, from blue- green algaSpirulinaplatensis[J].JournalofNaturalProducts, 1996, 59(59): 83-87.
[19] 郑维发, 陈才法, 鲍康德, 等. 新月菱形藻胞外多糖的成分及其硫酸酯的制备[J]. 中草药, 2005, 36(12): 1790-1793.
ZHENG W F, CHEN C F, BAO K D, et al. Components of exopolysaccharides ofNitzschiaclosteriumand preparation of their sulfated products[J].ChineseTraditionalandHerbalDrugs, 2005, 36(12): 1790-1793. (in Chinese with English abstract)
[20] 李亚清. 海洋微藻多糖的提取分离纯化和结构特征研究[D]. 大连: 大连理工大学, 2004.
LI Y Q. Extraction, purification and structural characteristics of polysaccharides from marine microalgae [D]. Dalian: Dalian University of Technology, 2004. (in Chinese with English abstract)
[21] 冯以明. 四种绿藻多糖的提取分离及其结构与抗凝活性研究[D].青岛 :中国海洋大学, 2012.
FENG Y M. Extraction, isolation, structure and anticoagulant activity of four green algae polysaccharides[D]. Qingdao: Ocean University of China, 2012. (in Chinese with English abstract)
[22] 周卫松. 裙带菜中岩藻黄质、岩藻多糖的综合提取纯化研究[D]. 杭州: 浙江大学, 2014: 34-36.
ZHOU W S. Study on purification of comprehensive extraction of fucoxanthin and fucoidan inUndariapinnatifida[D]. Hangzhou: Zhejiang University, 2014: 34-36. (in Chinese with English abstract)
[23] KADAM S U, TIWARI B K, O’DONNELL C P. Application of novel extraction technologies for bioactives from marine algae[J].JournalofAgricultural&FoodChemistry, 2013, 61(20): 4667-4675.
[24] 欧阳平凯, 胡永红, 姚忠. 生物分离原理及技术[M]. 北京: 化学工业出版社, 2010: 170-178.
[25] 夏冰. 螺旋藻多糖提取纯化方法研究[D]. 西安: 西安建筑科技大学, 2010.
XIA B. Study on extraction and purification of Polysaccharides fromSpirulinaplatensis[D]. Xi’an: Xi’an University of Architecture and Technology, 2010. (in Chinese with English abstract)
[26] 宫春宇, 潘迎捷. 硫酸钡比浊法对龙须菜多糖中硫酸基含量的测定[J]. 天然产物研究与开发, 2009 (B10): 402-405.
GONG C Y, PAN Y J. Determination of the content of sulfate group inGracilarialemaneiformispolysaccarides by barium sulfate turbidity[J].NaturalProductResearchandDevelopment, 2009 (B10): 402-405. (in Chinese with English abstract)
[27] 刘艳, 杨海波, 赵莲华, 等. 扁藻多糖的分离分析及其生物活性的初步研究[J]. 生物技术, 2007, 17(2): 53-56.
LIU Y, YANG H B, ZHAO L H, et al. Separation and analysis of polysaccharide fromPlatymonassubcordigoramis(Will) Hanzen and primary studies on its’ anticancer activity[J].Biotechnology, 2007, 17(2): 53-56. (in Chinese with English abstract)
[28] GROTH T, WAGENKNECHT W. Anticoagulant potential of regioselective derivatized cellulose[J].Biomaterials, 2001, 22(20): 2719-2729.
[29] 邓成华, 杨祥良, 王雁, 等. 取代度对硫酸酯化虎奶多糖抗氧化活性的影响[J]. 华中科技大学学报(自然科学版), 2000, 28(5): 104-107.
DENG C H, YANG X L, WANG Y, et al. Effect of degree of substitution on the antioxidative activities of the sulfated Hunai polysaccharide[J].JournalofHuazhongUniversityOfence&Technology(NaturalScience), 2000, 28(5): 104-107. (in Chinese with English abstract)
[30] MEI W Z, LIN L I, YUAN G S, et al. Review on structure- activity relationship of active polysaccharides[J].ModernChemicalIndustry, 2002, 22(8): 18-21, 23.
[31] 刘占峰, 孙汉文. 多糖的化学修饰研究进展[J]. 河北大学学报(自然科学版), 2005, 25(1): 104-108.
LIU Z F, SUN H W. Progress of the research on chemically modifications of polysaccharide[J].JournalofHebeiUniversity(NaturalScience), 2005, 25(1): 104-108. (in Chinese with English abstract)
