猪圆环病毒2型与高致病性猪繁殖与呼吸综合征病毒混合感染的诊治
2018-03-02谌春燕杨克礼
谌春燕,杨克礼
(1.湖北省襄阳市动物卫生监督所,湖北 襄阳 441021;2.湖北省农业科学院畜牧兽医研究所,武汉 430064)
猪圆环病毒(Porcine cirovirus,PCV)是近年来危害我国养猪业健康发展的主要疫病之一,根据其基因组不同分为猪圆环病毒1型 (Porcine cirovirus type 1,PCV1)和猪圆环病毒 2 型(Porcine cirovirus type 1,PCV2)。 PCV1 对动物没有致病作用,PCV2是断奶仔猪多系统衰竭综合征的主要病原。该病多以5~12周龄的仔猪发病率较高,主要临床表现为呼吸困难、贫血、进行性消瘦、生长迟缓、偶有黄疽和腹泻等。
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒 (Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种猪的重要传染病。该病以妊娠母猪死产、流产、弱仔、木乃伊胎等繁殖障碍以及各生长阶段猪的呼吸道症状和高死亡率为特征。2006年,我国南方地区暴发了由PRRSV高致病性突变株引起的高发病率、高死亡率的HPPRRS,近年来在我国猪群中仍有流行,给我国养猪业带来了巨大的经济损失[1,2]。
PCV2和PRRSV感染猪后均可损坏其免疫系统,导致免疫抑制,两种病毒的共感染具有明显的协同致病作用。高致病性PRRSV的出现及其与PCV2的共感染明显提高了猪群的发病率和死亡率,给养猪业带来巨大的威胁。
2017年5月,襄阳某500头基础母猪场的猪只先后大量发病,各阶段的猪均有发病和死亡,持续近30 d,经济损失较大。临床症状主要表现为发热(体温升高至41℃左右),食欲下降,呼吸困难、咳嗽,部分病猪皮肤发红,部分病猪皮肤苍白,部分母猪流产,仔猪和母猪均有死亡。剖检病变主要表现为间质性肺炎,肾表面有出血点,脾肿大,颌下淋巴结及腹股沟淋巴结肿大。笔者将猪场送检的病料送至湖北省农业科学院畜牧兽医研究所进行PCR检测,诊断为PCV2和HP-PRRSV的混合感染。根据临床及实验室诊断结果,我们提出了综合防控技术方案,经实施后,疫情得到了有效控制。现总结报告如下。
1 材料与方法
1.1 病料
发病场送检病猪脾、肺及淋巴结等组织样品共8份。
1.2 主要试剂
病毒DNA/RNA提取试剂盒、反转录试剂盒、dNTPs、TaqDNA 聚合酶、DL2000 DNA Marker等均购自TaKaRa公司;PCV2及PRRSV检测引物由上海Sangon生物工程公司合成。
1.3 病毒核酸的提取
将病料组织与DMEM溶液按1∶5混合,充分匀浆,-80℃至室温反复冻融3次,立即提取核酸或置-80℃保存备用。病毒核酸的提取利用病毒DNA/RNA提取试剂盒按照说明书操作进行。
1.4 PCV2 PCR 扩增
取提取的DNA,使用针对PCV2 ORF2基因设计的引物,上游引物 PCV2-F:5’-CGAGCTCATGACG TATCCAAGGAGGC-3’,下游引物 PCV2-R:5’-CCC AAGCTTTTAGGGTTTAAGTGGGGG-3’进行 PCR 扩增,产物预期大小约720 bp。PCR反应体系为50 μL:10×PCR buffer 5 μL,dNTPs(10 mmol/L)2 μL,上、下游引物各 1μL,模板 DNA 4μL,Taq 酶0.5μL(5U/μL),加灭菌超纯水至50μL;PCR反应参数如下:95℃变性 5 min,94℃变性 1 min,56℃退火 45 s,72℃延伸1min,共进行30个循环,72℃延伸10 min。取5μL PCR产物经1%琼脂糖凝胶电泳检测,紫外观测仪下观察记录结果。
1.5 PRRSV 一步法 RT-PCR 扩增
PRRSV 一步法 RT-PCR 扩增参照 Yang 等[3]的文献进行,PRRSV经典株PCR预期产物大小约330 bp、PRRSV高致病性变异株PCR预期产物大小约240 bp。 50 μL 反应体系包括:5 μL 10×buffer,0.5 μL Taq polymerase(5 U/μL),0.5 μL reverse transcriptase(5 U/μL),0.5 μL RNase inhibitor (40 U/μL),4 μL RNA模板,5μL dNTP (10 mmol/L),1μL PRRSV NSP2-F(100 μmol/L),1 μL PRRSV NSP2-R(100 μmol/L)和 32.5 μL 灭菌水。PCR 扩增参数如下:45℃30min,94℃ 5 min;扩增条件为 94℃ 30 s,55℃ 30 s,72℃30 s;30 个循环后,72 ℃延伸 10 min。 取 5 μL PCR产物经1%琼脂糖凝胶电泳检测,紫外观测仪下观察记录结果。
1.6 防治措施
全面消毒:用漂白粉、氢氧化钠或生石灰对猪舍进行一次全面的消毒,并坚持每周对猪舍彻底消毒1~2次。
紧急接种:对无明显症状的猪只,分别紧急免疫自家苗 2~4 mL。
对症治疗:对出现继发感染的猪只,应用抗菌药物进行治疗,如环丙沙星、头孢类药物等;对呼吸困难的猪只使用止咳平喘药物,如麻黄碱、氨茶碱等;对高热猪只使用退热药物,如安乃近、氨基比林等。
辅助治疗:猪圆环病毒与猪繁殖与呼吸综合征病毒均为病毒性疫病,使用抗生素治疗无效,只能对症治疗并控制继发感染。建议配合使用病毒灵、干扰素、免疫球蛋白、高免血清等广谱抗病毒的药物进行辅助治疗,同时可配合使用甘草合剂、黄芪多糖等增强免疫力的药物。
加强管理:定期对猪舍、用具等设施进行灭菌消毒;禁止闲杂人员、外来车辆等出入,防止外来病原传染;对病死猪进行无害化处理;一旦发现疫情,及时上报并隔离,避免疫情进一步扩散;定期进行免疫接种,做好预防工作。
2 结果与分析
2.1 PCV2 PCR 检测结果
以病猪组织中提取的病毒DNA为模板,利用设计的PCV2特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分析,结果所检测的8份组织样品有7份扩增出与PCV2预期扩增产物大小一致的目的条带,即为PCV2阳性(图1)。
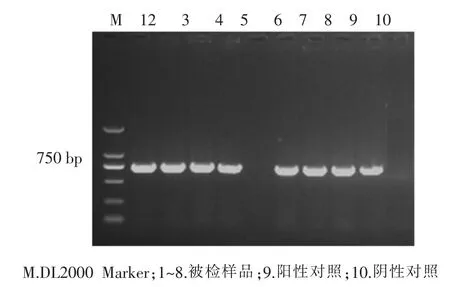
图1 PCV2 PCR扩增产物电泳图
2.2 PRRSV RT- PCR 检测结果
以病猪组织中提取的病毒RNA为模板,反转录合成cDNA第一链后,利用设计的PRRSV特异性引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳分析,结果所检测的8份组织样品均扩增出与HPPRRSV预期扩增产物大小一致的目的条带,即为HP-PRRSV 阳性(图 2)。
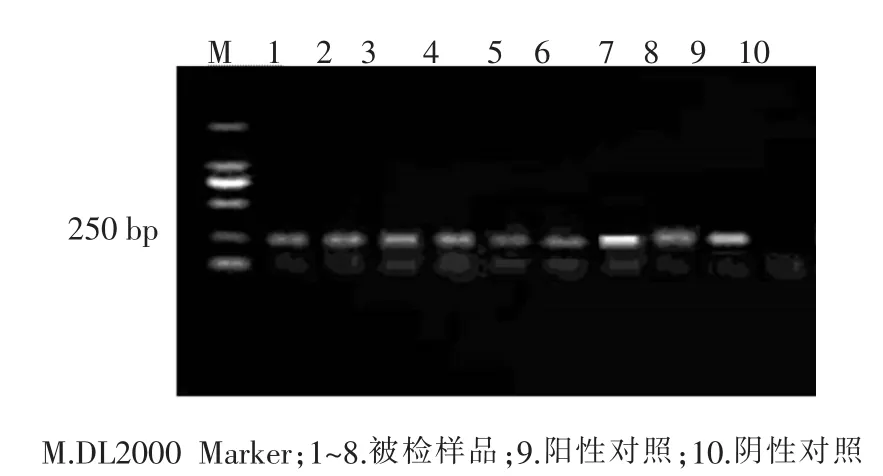
图2 PRRSV RT-PCR扩增产物电泳图
综合以上结果可知,除一份组织样品为PCV2阴性外,其他组织样品检测结果猪圆环病毒2型和高致病性猪繁殖与呼吸综合征病毒均为阳性,结合临床表现判定该猪场本次暴发的疫情为猪圆环病毒2型和高致病性猪繁殖与呼吸综合征病毒混合感染导致。
2.3 防治效果
采用上述综合防控措施10 d后,该猪场的病情逐步得到控制,30 d后疫情平息,生产恢复正常并逐步达到发病前的水平。
3 小结与讨论
根据实验室分子生物学检测结果,PCV2的阳性率为 87.5%(7/8),HP-PRRSV 的阳性率为 100%(8/8),结合临床症状、剖检病理变化,确诊该猪场发生的疫病为PCV2与HP-PRRSV的混合感染。
PCV2和HP-PRRSV都会导致机体产生免疫抑制,抵抗力降低,容易引起其他病毒或细菌的继发或并发感染,从而引起感染猪的大量死亡[4-6]。临床上,PCV2与HP-PRRSV的混合感染与其他病原体感染所引起的呼吸系统疫病的表现极为相似,并常伴随其他混合感染或(和)继发感染。因此,仅根据流行病学、临床症状以及剖检变化很难对疫病作出正确诊断。PCR方法是当前的一种快速简便、准确可靠的检测方法,可以用于临床诊断。
由于PCV2和HP-PRRSV均是病毒性疫病,临床上使用常规的方法控制其混合感染效果很不理想。本研究中使用自家苗进行防治,配合注射敏感抗生素、免疫增强剂等,同时采用加强饲养管理等综合防控措施,取得了理想的防治效果。自家苗是在无菌条件下采集病猪的肺、脾、肾、淋巴结等组织经过甲醛灭活制成的,可用于发病场或发病地区PCV2与HP-PRRSV混合感染的防治,但由于安全性等因素尚不能在生产中推广应用。临床使用时应先做安全性试验,若有不良反应出现,需立即停止使用[7]。
PCV2和PRRSV均可以破坏猪的免疫系统,导致猪免疫系统抑制。已有的研究表明,这两种病毒在猪体内可以相互促进增殖,混合感染具有明显的协同致病作用,可以加重或者扩大感染猪免疫器官的病理变化,导致更加严重的免疫抑制,使得机体对猪瘟、口蹄疫等疫苗抗体的生成产生抑制,造成猪群的主动免疫抗体滴度不足,导致猪瘟、口蹄疫等疫病的暴发[8]。因此,加强对猪场PCV2和PRRSV的预防,对猪场其他疫病的防控有着重要的意义。
[1] TIAN K G,YU X L,ZHAO T Z,et al.Emergence of fatal PRRSV variants:unparalleled outbreaksofatypicalPRRS in China and molecular dissection of the unique hall mark[J].PloS ONE,2007,2(6):e526.
[2] TONG G Z,ZHOU Y J,HAO X F,etal.Highlyvirulent porcine reproductive and respiratory syndrome virus emerged in China [J].Transbound Emerg Dis.,2008,55(3-4):152-164.
[3] YANG K L,LI Y H,DUAN Z Y,et al.A one-step RT-PCR assay to detect and discriminate porcine reproductive and respiratory syndrome viruses in clinical specimens[J].Gene,2013,531:199-204.
[4] ALLAN G M,ELLIS J A.Porcine circoviruses:A review[J].Journal of Veterinary Diagnostic Investigation,2000,12(1):3-14.
[5] LYOO K S,PARK Y H,PARK B K.Prevalence of porcine reproductive and respiratory syndrome virus,porcine circovirus type 2 and porcine parvovirus from aborted fetuses and pigs with respiratory problems in Korea [J].J Vet Sci,2001,2 (3):201-207.
[6] WELLENBERG G J,STOCKHOFE-ZURWIEDEN N,BOERSMA W J,et al.The presence of co-infections in pigs with clinical signs of PMWS in the Netherlands:A case-control study[J].Res Vet Sci,2004,77(2):177-184.
[7]陈金山,陈俊杰,吴玉苹,等.猪圆环病毒感染组织灭活苗的临床应用效果观察[J].动物医学进展,2009,30(11):124-126.
[8]王天户,娄忠子,刘思当.猪PRRSV单独感染及与PCV2混合感染的免疫病理学研究[J].西南农业学报,2008,21(1):187-190.
