长链非编码RNA PVT1调控miR-551通过Wnt信号通路对卵巢癌迁移和侵袭的影响*
2018-03-01聂金霞徐明明
聂金霞, 刘 娅, 徐明明
(郑州市妇幼保健院妇产科, 河南 郑州 450000)
卵巢癌是最常见的女性生殖系统肿瘤,是全世界女性恶性肿瘤死亡的最主要原因[1]。虽然现在有多重治疗方法,比如手术治疗、化疗、放疗及生物靶向治疗,可以改善大部分早期患者预后,但是晚期患者复发率仍很高[2]。所以卵巢癌早期诊断很重要,这是提升卵巢癌患者生存率的重要方式[3]。
长链非编码RNA(long non-coding RNA,lncRNA)PVT1(plasmacytoma variant translocation 1)位于人染色体8q24.21,与多种肿瘤细胞增殖、凋亡、淋巴侵袭、转移和预后相关[4]。PVT1在胃癌、肝细胞癌、非小细胞肺癌和乳腺癌中异常表达[5-8]。 最近的研究发现,PVT1在卵巢癌中表达上调,并且PVT1作为促癌基因可以增加卵巢癌的高发风险[9]。然而,PVT1的靶基因及其调节卵巢癌肿瘤发生的分子机制仍然是未知的。
微小RNA(microRNA,miR)-551在很多组织中存在,一旦出现表异常或突变,容易诱发各种肿瘤的发生,包括胃癌、肝细胞癌、肺癌、乳腺癌和卵巢癌等[10]。最近研究显示,miR-551在多种人类组织中发挥了双向的作用。它在肝细胞癌和宫颈癌中发挥癌基因的功能,但在胰腺癌和卵巢癌中起肿瘤抑制因子的作用[11]。
本研究通过探讨PVT1和miR-551在卵巢癌中的相互作用,揭示它们致卵巢癌作用的潜在机制。我们的研究结果表明,PVT1通过诱导miR-551的表达激活Wnt信号通路,从而实现致卵巢癌作用。
材 料 和 方 法
1细胞株
卵巢癌细胞株SKOV3、ES-2、A2780及OVCA432购买于上海细胞研究所。细胞培养在含5%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基中,5%CO2、37 ℃恒温培养。
2材料和试剂
兔单克隆抗Wnt1、GSK-3和APC抗体购于Abcam;miR-551-inhibitor购于上海吉玛基因有限公司;SsoFast EvaGreen试剂及Lipofectamine 2000转染试剂购于TaKaRa;Trizol购自Ambion;逆转录试剂盒(FSQ-101)购自TOYOBO;PCR试剂盒购自Sigma;萤光素酶活性检测试剂盒购自Promega;萤光素酶报告载体由Promega公司合成。
3方法
3.1qPCR检测卵巢癌组织和卵巢癌细胞中PVT1和miR-155的表达水平 提取卵巢癌组织和各卵巢癌细胞总RNA,并逆转录合成相应cDNA。PVT1的上游引物序列为5’-TGAGAACTGTCCTTACGTGACC-3’,下游引物序列为5’-AGAGCACCAAGACTG GCTCT-3’;miR-551的上游引物序列为5’-TGGAGCGATGTGCGATGAGC-3’,下游引物序列为5’-AGAGCACCAAGACTGGCTCT;内参照GAPDH的上游引物的序列为5’-TTGGTATCGTGGAAGGACTCA-3’,下游引物序列为5’-TGTCATCATATTT GGCAGGTT-3’。扩增条件为:95 ℃初始变性10 min; 95 ℃ 10 s, 60 ℃ 30 s, 45个循环。使用LightCycler 480 Probes Master试剂盒(Roche Applied Science)在PCR仪器(Roche Applied Science)中进行qPCR。采用2-ΔΔCt法分析相对表达量。
3.2双萤光素酶活性检测 将萤光素酶报告载体与miR-551-inhibitor共转染ES-2细胞,以转染pRL-TK作为标准内质控。转染36 h后,收获细胞。按萤光素酶活性检测试剂盒说明书检测ES-2细胞中萤光素酶活性。相对萤光素酶活性=萤火虫萤光素酶活性值/海肾萤光素酶活性值。
3.3Western blot方法 从卵巢癌细胞ES-2中提取总蛋白。将总蛋白的等分试样(40 mg)行10% SDS-PAGE,然后电转至PVDF膜上。以1∶1 000、1∶1 000和1∶200的稀释度分别使用抗Wnt1、GSK-3和APC抗体进行孵育,4 ℃过夜,次日PBS洗涤后,加入 II 抗,室温孵育PBS充分洗涤后进行ECL显影,拍照并统计相对表达量。
3.4细胞侵袭能力的测定 使用Transwell实验进行卵巢癌细胞侵袭能力测定。将5×104个细胞接种在含无血清培养基的上室中,下室装有含10%胎牛血清的培养基。 37 ℃孵育48 h后,棉球擦拭上室细胞,使用结晶紫染色下室细胞。观察并计数穿透Transwell膜的细胞数。实验重复3次。
比如,当教师在讲解课文《小蝌蚪找妈妈》时,首先,教师可以结合自己对文章的理解,制作出教学的大纲:小蝌蚪找妈妈的起因、小蝌蚪找妈妈的过程、找错妈妈的原因、最终的结果。其次,教师可以针对教学大纲制作教学视频,帮助学生形成知识脉络,降低学生的学习难度。在正式教学的过程中,教师可以要求学生按照视频中所体现的知识结构对课文进行学习,加深对知识的理解,提升自身的学习质量。
3.5细胞迁移能力的测定 将细胞密度调整为5×108/L,接种到6孔板中,置于 5% CO2温箱孵育过夜,使细胞汇合度达到 100%。细胞划痕先用记号笔在每个孔的背面做好标记,以保证获取数据的位置保持一致。用无菌枪头,垂直于标记线快速进行划痕。并用 PBS 缓冲液反复冲洗细胞孔,将悬浮细胞去除。向培养孔加入不含血清的DMEM 培养基,5% CO2、37 ℃孵育。按照实验设计中的时点取样,在显微镜下拍照,测量划痕的初始距离(0 h);在24 h、48 h和72 h后,分别测量划痕的距离,并拍照,计算细胞的迁移率。实验重复3次。
3.6裸鼠体内成瘤实验 将2×107个卵巢癌细胞ES-2离心,用50 μL PBS稀释重悬待用。取10只4周龄的裸鼠,分为阴性对照(negative control,NC)组和PVT1-siRNA组,每组5只。将转染NC序列和PVT1-siRNA的卵巢癌细胞分别注射入2组裸鼠的左侧腋下,6周后将肿瘤剥除,测量并称重。
4统计学处理
采用 SPSS 13.0进行统计学处理,数据用均数±标准差(mean±SD)表示,两组之间数据比较采取独立样品t检验,多组间数据比较采用单因素方差分析,以P<0.05 表示差异具有统计学意义。
结 果
1PVT1和miR-551在卵巢癌组织中的表达水平
与正常卵巢组织比较,PVT1 在卵巢癌组织中的表达显著升高(P<0.05), miR-551在卵巢癌组织中的表达降低(P<0.05),表明PVT1和miR-551在卵巢癌中分别扮演促癌和抑癌的作用。在4种不同的卵巢癌细胞株中,ES-2细胞株中PVT1的表达水平明显高于其它3种细胞,因此后续实验选取ES-2作为实验细胞株,见图1。

Figure 1. The expression of PVT1 and miR-551 detected by qPCR in ovarian cancer tissue, normal ovarian tissue and different ovarian cancer cell lines. Mean±SD.n=3.*P<0.05vsnormal tissue;##P<0.01vsES-2.
图1qPCR检测PVT1和miR-551在卵巢癌组织中的表达情况
2PVT1可以调控卵巢癌细胞miR-551的表达水平
生物信息学分析发现,PVT1和miR-551有可结合的位点,见图2A。双萤光素酶实验表明,PVT1可以靶向调控miR-551的表达,见图2B。我们推测,miR-551可能是PVT1下游的相应靶点,PVT1可能通过调控miR-551的表达来影响卵巢癌的生物学行为。
Transwell结果显示,NC组通过Matrigel的细胞数量明显多于PVT1-siRNA组,差异有统计学意义(P<0.01),表明抑制PVT1的表达可以下调卵巢癌细胞的侵袭能力,见图3A。与NC组相比,在24 h、48 h和72 h时,PVT1-siRNA组的迁移率明显降低(P<0.05或P<0.01),表明抑制PVT1的表达可以下调卵巢癌细胞的迁移能力,见图3B。
4miR-551可以逆转PVT1对卵巢癌细胞的迁移和侵袭能力的影响
抑制PVT1的表达后,再抑制miR-551的表达情况,观察卵巢癌细胞迁移和侵袭能力的变化。Trans-well结果显示,PVT1-siRNA组通过Matrigel的细胞数量明显少于PVT1-siRNA+miR-551-inhibitor组(P<0.01),表明抑制PVT1的表达后,通过抑制miR-551可以恢复卵巢癌细胞的侵袭能力,见图4A。划痕实验结果表明,与PVT1-siRNA组相比,在24 h、48 h和72 h时,PVT1-siRNA+miR-551-inhibitor组迁移率明显增高(P<0.05或P<0.01),表明抑制PVT1的表达后,通过下调miR-551可以恢复卵巢癌细胞的迁移能力,见图4B。
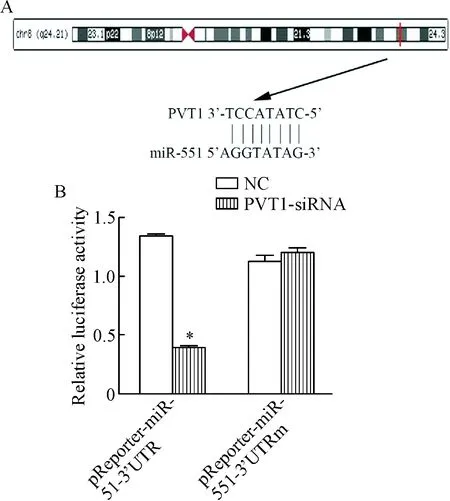
Figure 2. Relationship between PVT1 and miR-155. A: the binding sequences of PVT1 and miR-551; B: the results of dual-luciferase reporter assay indicated that miR-551 was a direct target of PVT1. Mean±SD.n=3.*P<0.05vsNC group.
图2萤光素酶报告基因检测miR-551是PVT1的直接靶点
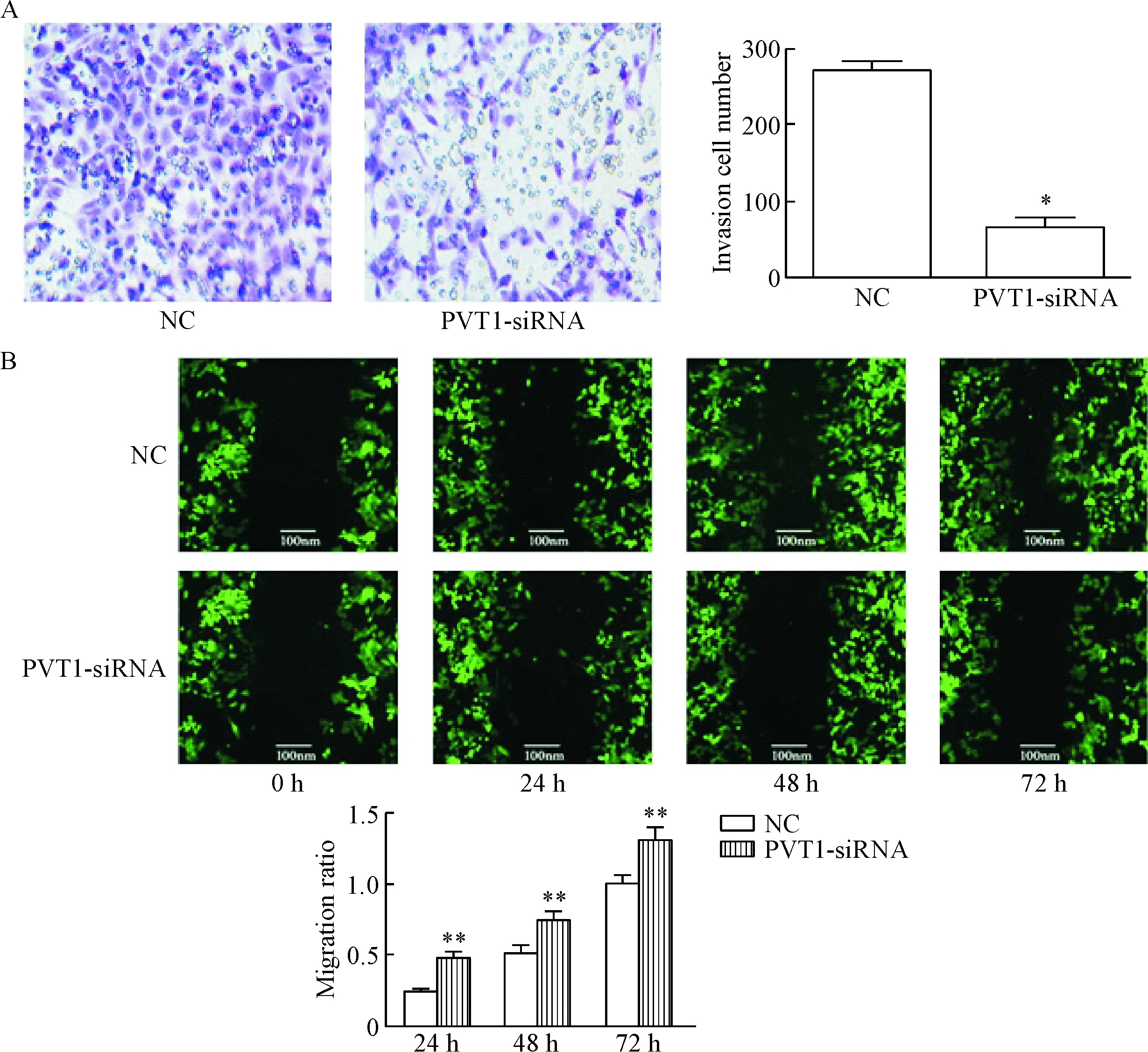
Figure 3. The effects of PVT1-siRNA on the invasion and migation abilities of the ovarian cancer cells were detected by Transwell assay (A) and scratch test (B), respectively (×40). Mean±SD.n=3.*P<0.05,**P<0.01vsNC group.
图3Transwell实验和细胞划痕实验检测PVT1-siRNA对卵巢癌细胞侵袭和迁移能力的影响
5PVT1对Wnt通路蛋白水平的影响
Western blot实验结果显示,与NC组相比,PVT1-siRNA组中Wnt1、GSK-3和APC蛋白的表达水平明显下降(P<0.05),表明PVT1的表达下调可以影响Wnt1、GSK-3和APC蛋白的表达水平,从而影响Wnt信号通路的激活,见图5。
6抑制PVT1对卵巢癌细胞体外成瘤能力的影响
与NC组相比,PVT1-siRNA组裸鼠肿瘤的重量和体积都明显减小(P<0.05),表明抑制PVT1的表达可以抑制卵巢癌细胞的体外成瘤能力,见图6。
讨 论
许多研究表明,PVT1基因组区域位于人染色体8q24,与许多肿瘤的发生发展过程相关[12]。PVT1基因的易位容易引起伯基特淋巴瘤和小鼠浆细胞瘤相关的特征性病变[13]。有其他学者关于PVT1与细胞存活能力的实验是探讨PVT1干扰靶向性RNA的能力,没有探讨对其分子机制的影响过程。我们的研究表明,PVT1表达水平的降低可以导致细胞侵袭和迁移能力的减弱,证明了PVT1在卵巢癌中的促癌作用。并且根据其他学者的研究,PVT1的表达也间接影响p53基因水平,表明可能PVT1也可能参与p53基因的正反馈调节通路[14]。
LncRNA PVT1在各种癌症中广泛存在的有效预测因子,已被证明在多种生物肿瘤的进展过程中起重要作用,如增殖、凋亡、迁移和侵袭[15]。在我们以前的研究中,我们确认PVT1预测患者预后和调节卵巢癌的生长。 然而,潜在的分子机制和相关的靶向基因仍不清楚。 在这项研究中,我们实验证据表明PVT1可以通过miR-551的负调节显示致癌活性。PVT1通过介导miR-551表达促进卵巢癌的转移进展。
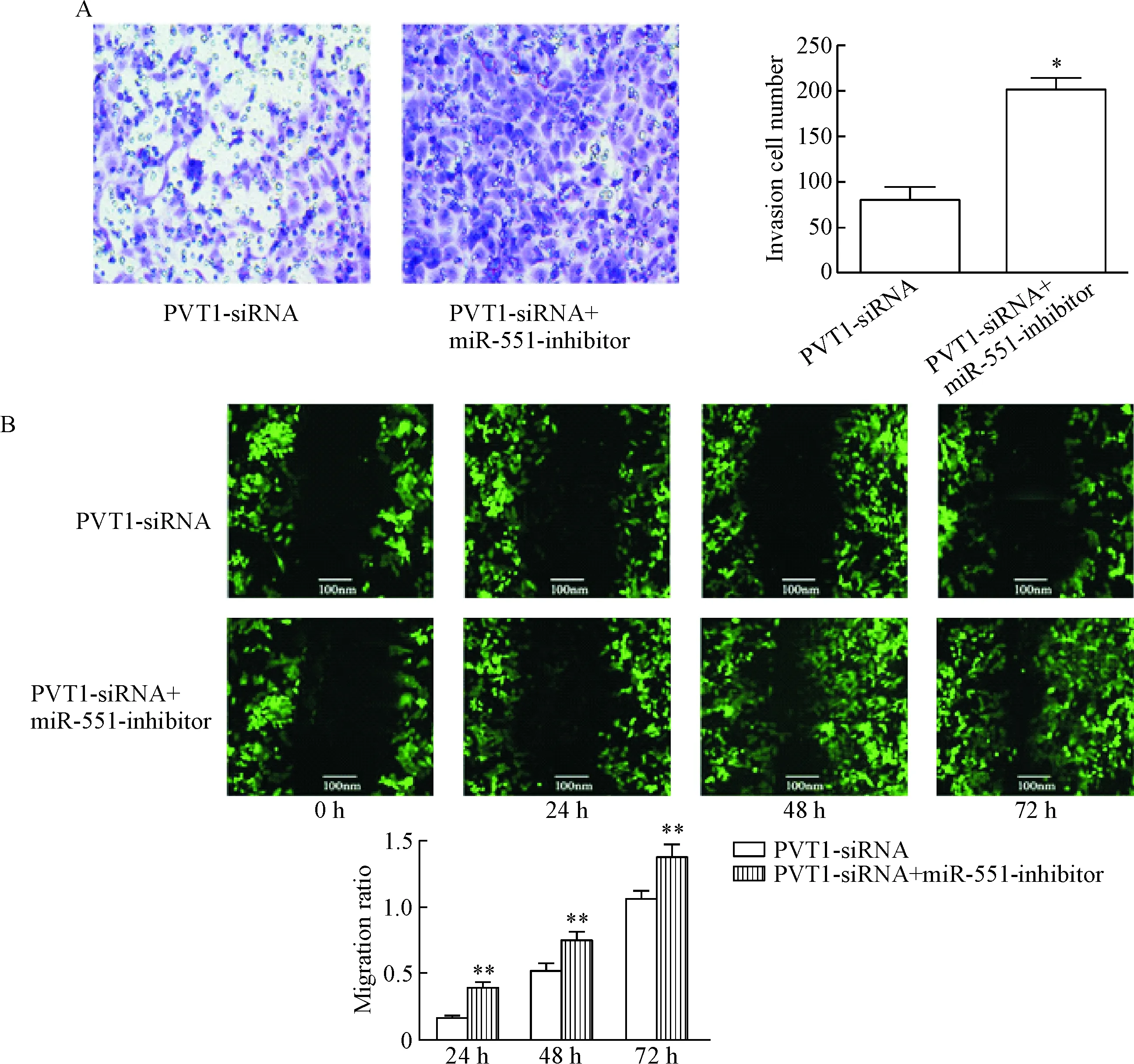
Figure 4. The effects of miR-551-inhibitor on the invasion and migration abilities of the ovarian cancer cell were detected by Transwell assay (A) and scratch test (B), respectively (×40). Mean±SD.n=3.*P<0.05,**P<0.01vsPVT1-siRNA group.
图4Transwell实验和细胞划痕实验检测miR-551-inhibitor对卵巢癌细胞侵袭和迁移能力的影响
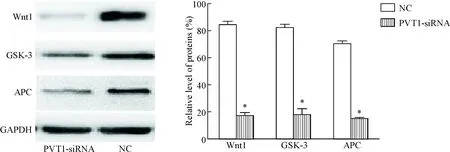
Figure 5. The effects of PVT1 on the expression of Wnt signaling pathway-related proteins. Mean±SD.n=3.*P<0.05vsNC group.
图5PVT1对Wnt信号通路相关蛋白表达的影响
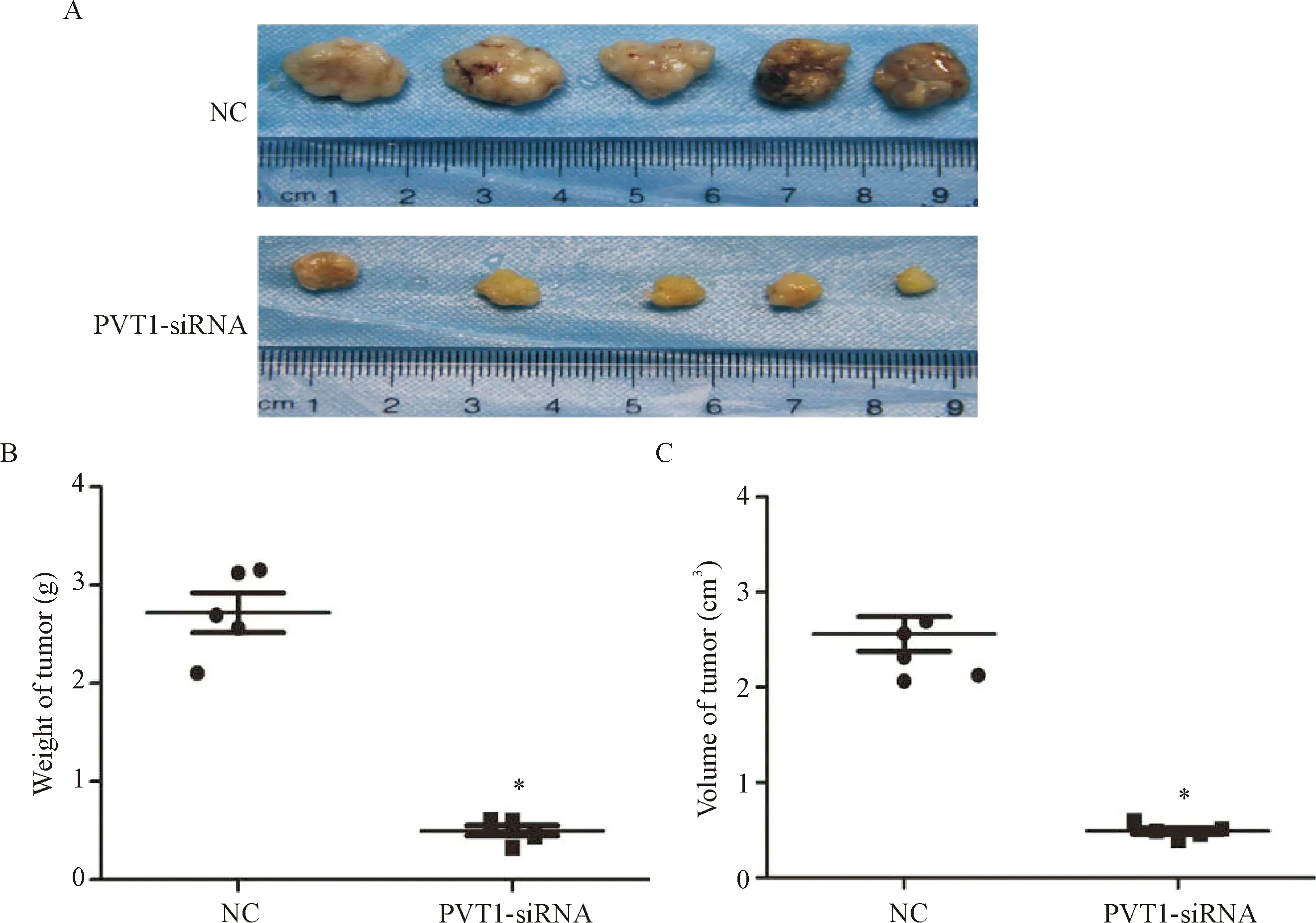
Figure 6. Theinvivotumorigenesis of the ovarian cancer cells transfected with PVT1-siRNA. A: the tumor size; B: the tumor weight; C: the tumor volume. Mean±SD.n=3.*P<0.05vsNC group.
图6体内实验探讨PVT1-siRNA对卵巢癌细胞体内成瘤能力的影响
以前的研究表明,PVT1在多种人类癌症中过表达,并与细胞增殖、凋亡、淋巴结侵袭、转移和肿瘤预后相关[20]。最近的研究表明,PVT1的上调抑制了胃癌细胞系的凋亡,增加了MDR1、MRP、mTOR和HIF-1α的表达,促进了多药耐药的发展。在本项研究中,我们调查卵巢癌中miR-551的生物学功能,证实了miR-551可以恢复PVT1对卵巢癌细胞迁移和侵袭的抑制作用。由于两者之间负调节的关系,当miR-551在卵巢癌细胞中被抑制时,PVT1-siRNA的抑癌作用被抵消。这些结果表明PVT1调节卵巢癌细胞迁移和侵袭的作用机制与miR-551密切相关。它提供了在功能方面的PVT1和miR-551之间的相互抑制的证据。
总之,我们的研究表明lncRNA PVT1和miR-551在卵巢癌发生和发展中的互相调节关系。 更好地理解调控卵巢癌肿瘤发生的分子机制,有助于卵巢癌的早期诊断及治疗方案的制定,为卵巢癌的临床诊断和治疗提供必要的帮助。
[1] 李 枫, 姚 丽, 张喜红, 等. miRNA-22 在卵巢癌组织的表达及其对卵巢癌细胞增殖、迁移与侵袭的影响[J]. 中国病理生理杂志, 2016, 32 (12):2251-2255.
[2] Bojesen SE, Pooley KA, Johnatty SE, et al. Multiple independent variants at the TERT locus are associated with telomere length and risks of breast and ovarian cancer[J]. Nat Genet, 2013, 45(4):371-384.
[3] 苏芳静, 张 斌, 田林燕, 等. 穿心莲内酯对卵巢癌细胞株SKOV-3侵袭与凋亡的影响[J]. 中国病理生理杂志, 2017, 33(7):1328-1331.
[4] Zhang Z, Zhu Z, Zhang B, et al. Frequent mutation of rs13281615 and its association with PVT1 expression and cell proliferation in breast cancer[J]. J Genet Genomics, 2014, 41(4):187-195.
[5] Ding C, Yang Z, Lv Z, et al. Long non-coding RNA PVT1 is associated with tumor progression and predicts recurrence in hepatocellular carcinoma patients[J]. Oncol Lett, 2015, 9(2):955-963.
[6] Ding J, Li D, Gong M, et al. Expression and clinical significance of the long non-coding RNA PVT1 in human gastric cancer[J]. Onco Targets Ther, 2014, 7(3):1625-1630.
[7] Takahashi Y, Sawada G, Kurashige J, et al. Amplification of PVT-1 is involved in poor prognosis via apoptosis inhibition in colorectal cancers[J]. Br J Cancer, 2014, 110(1):164-171.
[8] Fang XY, Pan HF, Leng RX, et al. Long noncoding RNAs: novel insights into gastric cancer[J]. Cancer Lett, 2015, 356(2 Pt B):357-366.
[9] Soubra A, Konety B, Bagchi A. Mp61-06 increased PTV1 expression correlates with advanced stage and hormone resistance of prostate cancer[J]. J Urol, 2015, 193(4):e748-e749.
[10] Mittal RD, Gangwar R, George GP, et al. Investigative role of pre-microRNAs in bladder cancer patients: a case-control study in North India[J]. DNA Cell Biol, 2011, 30(6):401-406.
[11] Bhaumik D, Scott GK, Schokrpur S, et al. Expression of microRNA-146 suppresses NF-κB activity with reduction of metastatic potential in breast cancer cells[J]. Oncogene, 2008, 27(42):5643-5647.
[12] Zhao J, Ohsumi TK, Kung JT, et al. Genome-wide identification of Polycomb-associated RNAs by RIP-seq[J]. Mol Cell, 2010, 40(6):939-953.
[14] Maclaine NJ, Hupp TR. The regulation of p53 by phosphorylation: a model for how distinct signals integrate into the p53 pathway[J]. Aging (Albany NY), 2009, 1(5): 490-502.
[15] Gieni RS, Hendzel MJ. Polycomb group protein gene silencing, non-coding RNA, stem cells, and cancer[J]. Biochem Cell Biol, 2009, 87(5):711-746.
[16] Wei Z, Liu Y, Wang Y, et al. Downregulation of Foxo3 and TRIM31 by miR-551b in side population promotes cell proliferation, invasion, and drug resistance of ovarian cancer[J]. Med Oncol, 2016, 33(11):126.
[17] Tang H, Kong Y, Guo J, et al. Diallyl disulfide suppresses proliferation and induces apoptosis in human gastric cancer through Wnt-1 signaling pathway by up-regulation of miR-200b and miR-22[J]. Cancer Lett, 2013, 340(1):72-81.
[19] You L, Chang D, Du HZ, et al. Genome-wide screen identifies PVT1 as a regulator of Gemcitabine sensitivity in human pancreatic cancer cells[J]. Biochem Biophys Res Commun, 2011, 407(1):1-6.
[20] Ding J, Li D, Gong M, et al. Expression and clinical significance of the long non-coding RNA PVT1 in human gastric cancer[J]. Onco Targets Ther, 2014, 7(3):1625-1630.
