槲皮素通过抑制c-Jun的表达水平增强5-氟尿嘧啶对胃癌细胞凋亡的诱导活性*
2018-03-01沈杨炳冯依力
黄 晔, 廖 阳, 沈杨炳, 冯依力
(1浙江省皮肤病防治研究所药剂科, 浙江 湖州 313200; 2浙江中医药大学, 浙江 杭州 310053; 3浙江大学医学院附属邵逸夫医院, 浙江 杭州 310016)
胃癌是发病率最高的消化道恶性肿瘤,手术是治疗胃癌最有效的治疗手段。然而由于胃癌的早期症状不明显,而且肿瘤转移能力较强,因此不少胃癌患者在确诊时肿瘤发展已经处于中晚期,严重影响手术的治疗效果[1-2]。对于这些中晚期胃癌患者而言,化疗是不可替代的重要治疗方法。然而大剂量的化疗药物对患者有很大的副作用,患者顺应性较差,而且大剂量化疗药物的使用容易造成肿瘤细胞对化疗的抵抗[3-4]。因此联合应用一些辅助治疗药物降低化疗药物的剂量并提高化疗药物的抗肿瘤活性具有十分重要的意义。
5-氟尿嘧啶(5-fluorouracil)是目前治疗胃癌的一线化疗药物,具有广谱的抗肿瘤活性。5-氟尿嘧啶是一种DNA致损药物,能干扰肿瘤细胞DNA的合成,从而阻断肿瘤细胞DNA的复制和修复,并诱导肿瘤细胞进入凋亡程序。尽管5-氟尿嘧啶对胃癌有较好的治疗效果,然而它的副作用也较大,病人的顺应性较低[5-7],因此降低5-氟尿嘧啶的使用剂量并提高胃癌细胞对5-氟尿嘧啶的敏感性是提高化疗效果并改善患者顺应性的有效方法。
槲皮素(quercetin)是一种天然黄酮类化合物,具有很好的抗氧化和抗炎作用,近几年的研究表明,槲皮素还有一定的抗肿瘤效应,能增强肿瘤细胞对凋亡信号通路的敏感性[8]。然而,槲皮素是否对胃癌的化疗有辅助治疗作用至今还未有充分报道。本研究的目的在于探讨槲皮素是否能增强5-氟尿嘧啶对胃癌细胞的凋亡诱导活性并研究其机制。
材 料 和 方 法
1细胞培养
人胃癌细胞系BGC-823购于美国模式培养物保存中心(American Type Culture Collection,ATCC),在含10%胎牛血清的RPMI-1640培养基中培养,置于37 °C恒温培养箱中培养并通入5% CO2。
2实验试剂
5-氟尿嘧啶、槲皮素、MTT和凋亡检测试剂盒购于Sigma-Aldrich; RPMI-1640培养基购于Gibco;蛋白G免疫共沉淀琼脂糖珠及抗c-Jun、p-c-Jun、活化转录因子(activating transcription factor,ATF)2、Bcl-xL、细胞色素C(cytochrome C)、caspase-9、caspase-3和GAPDH抗体购于Santa Cruz;ECL试剂盒购于Pierce; pcDNA3.1和Lipofectamine 2000购于Invitrogen。
3方法
3.1c-Jun重组质粒的构建和转染 人类c-jun基因的开放阅读框架序列经PCR扩增后以分子克隆的方法与pcDNA3.1连接,构建成c-Jun重组过表达质粒,分别将2 mg/L空质粒和c-Jun重组过表达质粒用Lipofectamine 2000进行包裹,后将其加入到无血清培养基混合。将BGC-823细胞接种在6孔板上孵育过夜,后于培养板中加入上述含质粒和Lipofectamine 2000的无血清培养基中孵育6 h,之后弃去该无血清培养基并加入新鲜的含10%胎牛血清的RPMI-1640培养基培养24 h。
3.2细胞活力的检测 前期预实验结果显示,槲皮素单独处理对BGC-823细胞的杀伤活性较弱,其半抑制浓度(half maximal inhibitory concentration,IC50)需达到225 μmol/L,临床上很难实现,因此将槲皮素作为辅助治疗药物,测试10 μmol/L槲皮素对5-氟尿嘧啶的协同作用。另外,预实验结果显示,将BGC-823细胞暴露于槲皮素48 h能充分发挥其对5-氟尿嘧啶的协同杀伤活性,因此,本实验选择48 h作为5-氟尿嘧啶联合槲皮素对BGC-823细胞的作用时间。在进行5-氟尿嘧啶和槲皮素的联合治疗前,分别将转染了空质粒和c-Jun重组过表达质粒的BGC-823细胞按每孔5×103的密度接种在96孔板上孵育过夜,之后用0~5 μmol/L 5-氟尿嘧啶及10 μmol/L的槲皮素处理肿瘤细胞48 h。药物处理完毕后在培养基中加入20 mL MTT (5 g/L),37 °C恒温培养箱中培养4 h,移除孔内培养基,加入100 μL DMSO,570 nm波长下测定吸光度(A)值。细胞活力结果用药物处理组与对照(control)组的A值比值表示。根据MTT实验结果绘制细胞活力随5-氟尿嘧啶浓度变化的曲线,根据曲线计算5-氟尿嘧啶对BGC-823细胞的IC50。
3.3无线粒体的细胞质分离 分别将空质粒和c-Jun重组过表达质粒转染的BGC-823细胞用2 μmol/L的5-氟尿嘧啶及10 μmol/L的槲皮素处理48 h。药物处理完毕后用线粒体分离试剂盒按试剂说明书步骤将BGC-823细胞中的线粒体从细胞质中分离出来,取无线粒体的细胞质进行后续的Western blot实验。
3.4Western blot实验 分别将空质粒和c-Jun重组过表达质粒转染的BGC-823细胞用2 μmol/L的5-氟尿嘧啶及10 μmol/L的槲皮素处理48 h。药物处理完毕后提取BGC-823细胞中的总蛋白质。将等量的总蛋白质用12.5% SDS-PAGE进行分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用抗c-Jun、p-c-Jun、ATF2、Bcl-xL、cytochrome C、caspase-9、caspase-3和GAPDH抗体孵育过夜,之后再用带辣根过氧化物酶的Ⅱ抗孵育2 h,蛋白条带用ECL试剂盒显色发光。目的蛋白的相对表达用目标蛋白灰度值与GAPDH灰度值的比值表示,蛋白灰度值分析用ImageJ软件处理。
3.5免疫共沉淀实验 分别将空质粒和c-Jun重组过表达质粒转染的BGC-823细胞用2 μmol/L的5-氟尿嘧啶及10 μmol/L的槲皮素处理48 h。药物处理完毕后裂解细胞,12 000 r/min离心10 min,收取上清液分成等量2份,1份直接进行Western blot实验检测ATF2和c-Jun的蛋白表达水平作为对照(input),另外 1 份加入抗ATF2抗体孵育过夜。孵育完毕后加入蛋白G琼脂糖珠孵育2 h,之后12 000 r/min离心10 min收集沉淀的蛋白G琼脂糖珠,加入上样缓冲液进行Western blot实验,检测与ATF2结合的c-Jun蛋白。
3.6流式细胞术检测细胞凋亡 分别将空质粒和c-Jun重组过表达质粒转染的BGC-823细胞用2 μmol/L的5-氟尿嘧啶及10 μmol/L的槲皮素处理48 h。药物处理完毕后按照凋亡试剂盒说明书将BGC-823细胞用碘化丙啶(propidium iodide,PI)和Annexin V进行染色孵育20 min。孵育完成后用生理盐水洗涤3次,采用流式细胞术检测肿瘤细胞的凋亡,Annexin V阳性细胞即为凋亡细胞。
4统计学处理
用SPSS 15.0统计分析软件进行数据处理和统计学分析。所有实验重复3次,实验数据用均数±标准差(mean±SD)表示,两组间均数的比较采用 Student’st检验,多组间均数的比较采用单因素方差分析 (one-way ANOVA ),以P<0.05为差异有统计学意义。
结 果
1槲皮素通过下调c-Jun的表达增强5-氟尿嘧啶对BGC-823细胞的杀伤活性
MTT实验结果显示,槲皮素联合处理能明显提高BGC-823细胞对5-氟尿嘧啶的敏感性,降低5-氟尿嘧啶对BGC-823细胞的IC50,表明槲皮素辅助治疗能明显增强5-氟尿嘧啶的抗胃癌活性,见图1A。Western blot实验结果显示,5-氟尿嘧啶单独处理BGC-823细胞能显著诱导c-Jun蛋白磷酸化;然而槲皮素联合处理能显著抑制BGC-823细胞中c-Jun蛋白的表达,并抑制5-氟尿嘧啶诱导的c-Jun磷酸化,见图1B。MTT实验结果显示,转染c-Jun重组过表达质粒后,槲皮素联合5-氟尿嘧啶对BGC-823细胞的杀伤活性明显降低,见图1C。这些结果提示槲皮素下调c-Jun的表达且抑制5-氟尿嘧啶诱导的c-Jun磷酸化,从而增强胃癌细胞对5-氟尿嘧啶的敏感性。
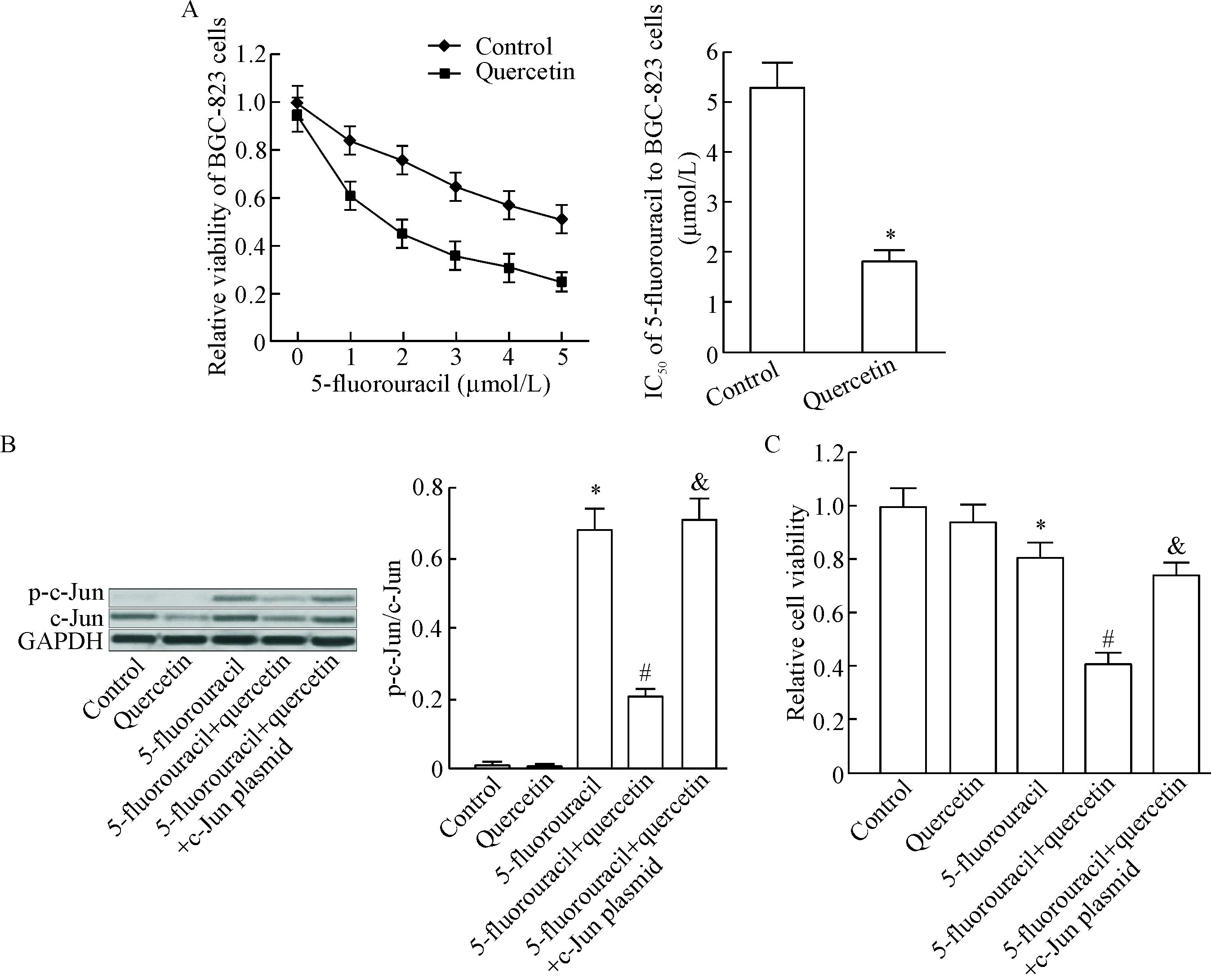
Figure 1. Quercetin enhanced 5-fluorouracil-induced death of BGC-823 cells by down-regulating the expression of c-Jun. A: quercetin decreased the IC50of 5-fluorouracil to BGC-823 cells; B: quercetin down-regulated the expression of c-Jun, and suppressed phosphorylation of c-Jun induced by 5-fluorouracil in BGC-823 cells; C: transfection with c-Jun plasmid inhibited the death of BGC-823 cells co-treated with 5-fluorouracil and quercetin. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs5-fluorouracil group;&P<0.05vs5-fluorouracil+quercetin group.
图1槲皮素通过下调c-Jun的表达而增强5-氟尿嘧啶对BGC-823细胞的杀伤活性
2槲皮素抑制5-氟尿嘧啶诱导的c-Jun/ATF2异二聚体的形成
免疫共沉淀和Western blot实验结果显示,5-氟尿嘧啶能显著诱导c-Jun和ATF2的相互作用;然而联用槲皮素后,5-氟尿嘧啶诱导的c-Jun/ATF2异二聚体的形成受到明显抑制;转染c-Jun过表达质粒后,槲皮素对5-氟尿嘧啶诱导的c-Jun/ATF2异二聚体的抑制作用明显减弱,表明槲皮素通过下调c-Jun表达抑制5-氟尿嘧啶诱导的c-Jun/ATF2异二聚体的形成,见图2A。c-Jun/ATF2异二聚体能诱导肿瘤细胞Bcl-xL蛋白的过表达[9]。Western blot实验结果显示,5-氟尿嘧啶单独处理能明显诱导BGC-823细胞Bcl-xL的表达,然而联用槲皮素后,5-氟尿嘧啶诱导的Bcl-xL的过表达受到明显抑制,见图2B。上述结果表明槲皮素通过下调c-Jun的表达而抑制5-氟尿嘧啶诱导的c-Jun/ATF2异二聚体的形成,从而抑制Bcl-xL蛋白的过表达。

Figure 2. Quercetin inhibited 5-fluorouracil-induced formation of c-Jun/ATF2 heterodimer in BGC-823 cells. A: quercetin inhibited 5-fluorouracil-induced interaction between c-Jun and ATF2 in BGC-823 cells; B: quercetin inhibited 5-fluorouracil-induced overexpression of Bcl-xL in BGC-823 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs5-fluorouracil group;&P<0.05vs5-fluorouracil+quercetin group.
图2槲皮素抑制5-氟尿嘧啶诱导的c-Jun/ATF2异二聚体的形成
3槲皮素促进5-氟尿嘧啶诱导的线粒体途径凋亡
Western blot实验结果显示,槲皮素能明显促进BGC-823细胞中5-氟尿嘧啶诱导的细胞色素C从线粒体中释放到细胞质中;同时,槲皮素能明显促进5-氟尿嘧啶对caspase-9和caspase-3的活化,进而促进BGC-823细胞中5-氟尿嘧啶诱导凋亡的发生;然而,转染c-Jun过表达质粒后,槲皮素对5-氟尿嘧啶诱导的线粒体途径凋亡的促进作用受到明显抑制,见图3。这些结果表明槲皮素通过下调c-Jun的表达而促进5-氟尿嘧啶对BGC-823细胞凋亡的诱导活性。
讨 论
槲皮素是一种具有很强药理学活性的天然黄酮类化合物,有研究发现槲皮素还具有一定的抗肿瘤作用,如槲皮素能抑制神经胶质瘤细胞的增殖和迁移[10];又如槲皮素还能通过损伤肺癌细胞的细胞骨架而发挥抗肿瘤活性[11]。然而,槲皮素是否对胃癌的化疗有辅助治疗作用,至今还未充分报道。在本研究中,我们发现将胃癌细胞BGC-823用槲皮素进行辅助治疗能明显提高其对5-氟尿嘧啶的敏感性,降低5-氟尿嘧啶的IC50,表明槲皮素对胃癌细胞的5-氟尿嘧啶化疗有显著的协同作用。
c-Jun是一种转录因子蛋白,属于核转录激活蛋白1(activator protein, AP-1)家族成员,受上游分子JNK的调节。研究表明,当肿瘤细胞的DNA受5-氟尿嘧啶等药物损伤时,JNK蛋白会发生活化从而激活c-Jun,使之磷酸化。磷酸化的c-Jun 能促进肿瘤细胞的增殖和转移,并抑制肿瘤细胞发生凋亡。更为重要的,文献报道c-Jun的过度磷酸化是导致肿瘤细胞发生化疗抵抗的重要机制[12-16]。在本研究中,结果发现当胃癌细胞用5-氟尿嘧啶进行治疗时,胃癌细胞中的c-Jun蛋白会发生高度磷酸化以抵抗5-氟尿嘧啶对胃癌细胞的杀伤作用。然而当用槲皮素进行联合治疗时,结果发现胃癌细胞中的c-Jun蛋白表达水平受到明显抑制,并由此抑制了5-氟尿嘧啶依赖的c-Jun蛋白磷酸化,证明了c-Jun的下调是槲皮素发挥协同作用的重要机制。
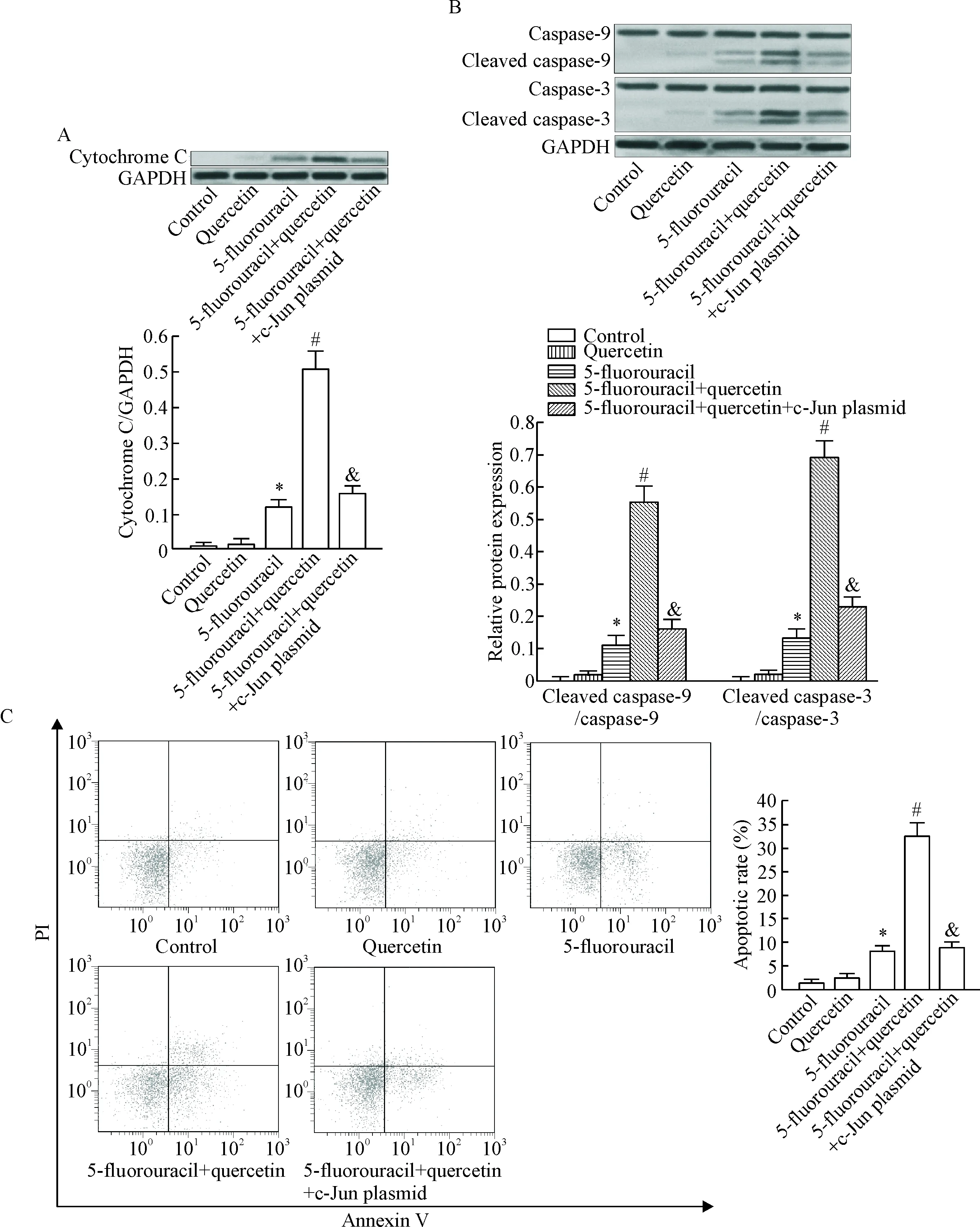
Figure 3. Quercetin promoted 5-fluorouracil-induced mitochondrial apoptosis in BGC-823 cells. A: quercetin promoted 5-fluorouracil-induced release of cytochrome C from mitochondria into cytoplasm in BGC-823 cells; B: quercetin promoted 5-fluorouracil-induced activation of caspase-9 and caspase-3 in BGC-823 cells; C: quercetin promoted 5-fluorouracil-induced apoptosis in BGC-823 cells. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vs5-fluorouracil group;&P<0.05vs5-fluorouracil+quercetin group.
图3槲皮素促进BGC-823细胞中5-氟尿嘧啶诱导的线粒体途径凋亡
c-Jun在发生磷酸化后,能与ATF2等转录因子形成二聚体,该二聚体能诱导Bcl-xL抗凋亡蛋白的表达,从而抑制肿瘤细胞发生线粒体途径的凋亡[9, 17]。在本研究中,结果发现5-氟尿嘧啶单独处理能显著诱导胃癌细胞中c-Jun/ATF2复合物的形成,同时诱导胃癌细胞中Bcl-xL抗凋亡蛋白的过表达;然而槲皮素联合治疗能通过下调c-Jun蛋白的表达抑制胃癌细胞中c-Jun/ATF2复合物的形成,从而抑制5-氟尿嘧啶诱导的Bcl-xL过表达。因此,槲皮素促进5-氟尿嘧啶对线粒体的损伤作用,使之释放细胞色素C等凋亡活性物质到细胞质中,诱导caspase-9和caspase-3发生活化,最终导致凋亡的发生。
综上所述,本研究证明了槲皮素能通过c-Jun/ATF2/Bcl-xL途径显著增强5-氟尿嘧啶对胃癌的凋亡诱导活性。这些研究为降低5-氟尿嘧啶的使用剂量、增加其对胃癌的治疗效果提供了新的策略和思路。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1):11-30.
[2] Zhang J, Zhao J, Gao N, et al. MECP2 expression in gastric cancer and its correlation with clinical pathological parameters[J]. Medicine (Baltimore), 2017, 96(31):e7691.
[3] Bao J, Xu Y, Wang Q, et al. miR-101 alleviates chemoresistance of gastric cancer cells by targeting ANXA2[J]. Biomed Pharmacother, 2017, 92:1030-1037.
[4] Li L, Wu C, Zhao Y. miRNA-34a enhances the sensitivity of gastric cancer cells to treatment with paclitaxel by targeting E2F5[J]. Oncol Lett, 2017, 13(6):4837-4842.
[5] 李 强, 曹明溶, 刘志龙, 等. 去氢骆驼蓬碱诱导HepG2细胞凋亡并增强其对5-氟尿嘧啶和顺铂的敏感性[J]. 中国病理生理杂志, 2013, 29(2):284-289.
[6] Sistonen J, Büchel B, Froehlich TK, et al. Predicting 5-fluorouracil toxicity: DPD genotype and 5,6-dihydrouracil:uracil ratio[J]. Pharmacogenomics, 2014, 15(13):1653-1666.
[7] Xu GY, Tang XJ. Troxerutin (TXN) potentiated 5-fluorouracil (5-FU) treatment of human gastric cancer through suppressing STAT3/NF-κB and Bcl-2 signaling pathways[J]. Biomed Pharmacother, 2017, 92:95-107.
[8] Xiang T, Fang Y, Wang SX. Quercetin suppresses HeLa cells by blocking PI3K/Akt pathway[J]. J Huazhong Univ Sci Technolog Med Sci, 2014, 34(5):740-744.
[9] Salameh A, Galvagni F, Anselmi F, et al. Growth factor stimulation induces cell survival by c-Jun. ATF2-depen-dent activation of Bcl-xL[J]. J Biol Chem, 2010, 285(30):23096-23104.
[10] Liu Y, Tang ZG, Lin Y, et al. Effects of quercetin on proliferation and migration of human glioblastoma U251 cells[J]. Biomed Pharmacother, 2017, 92:33-38.
[12] Liu S, Guo C, Wang J, et al. ANXA11 regulates the tumorigenesis, lymph node metastasis and 5-fluorouracil sensitivity of murine hepatocarcinoma Hca-P cells by targeting c-Jun[J]. Oncotarget, 2016, 7(13):16297-16310.
[13] Shao J, Teng Y, Padia R, et al. COP1 and GSK3-β co-operate to promote c-Jun degradation and inhibit breast cancer cell tumorigenesis[J]. Neoplasia, 2013, 15(9):1075-1085.
[14] Yang Z, Zhang Y, Wang L. A feedback inhibition between miRNA-127 and TGF-β/c-Jun cascade in HCC cell migration via MMP13[J]. PLoS One, 2013, 8(6):e65256.
[15] Watanabe T, Hiasa Y, Tokumoto Y, et al. Protein kinase R modulates c-Fos and c-Jun signaling to promote prolife-ration of hepatocellular carcinoma with hepatitis C virus infection[J]. PLoS One, 2013, 8(7):e67750.
[16] Chen L, Bourguignon LY. Hyaluronan-CD44 interaction promotes c-Jun signaling and miRNA21 expression lea-ding to Bcl-2 expression and chemoresistance in breast cancer cells[J]. Mol Cancer, 2014, 13:52.
[17] Yu S, Huang H, Deng G, et al. miR-326 targets antiapoptotic Bcl-xL and mediates apoptosis in human platelets[J]. PLoS One, 2015, 10(4):e0122784.
