单宁酸调控ATF6⁃CHOP通路增强顺铂诱导肝癌HepG2细胞凋亡的作用
2018-02-28耿娜娜吴明松郑翔杨蕾王宏阳李学英
耿娜娜 吴明松, 郑翔 杨蕾 王宏阳 李学英
1贵州省普通高等学校口腔疾病研究特色重点实验室,医学与生物学研究中心(贵州遵义 563000);遵义医学院2口腔学院(贵州遵义 563000);遵义医学院医学3遗传学教研室(贵州遵义 563000)
肝细胞癌(hepatocellular carcinoma,HCC)在我国的发病率和病死率均较高,每年新发病率约占全球的55%,且呈上升趋势[1-2]。肝癌早期发现困难,多数病患就诊时已丧失手术最佳时机,此外还具有恶性化程度高、生长增殖迅速、转移范围广和易复发等特点,因此其临床疗效不太理想。HCC治疗以手术切除为首选,但术后复发率较高,需借助辅助性手段,其中化疗是中晚期肝癌最常用的手段之一[2-3]。顺铂(cis⁃dichlorodiamine platinum,CDDP)是一种疗效很好、具有广谱性抗癌的化疗药物,临床上可用于治疗肝癌。然而,CDDP的毒副作用也较大,且随着肝癌对化疗药物的敏感性降低和耐药性增加,使得肝癌的治疗受到较大程度的限制,因此寻找一种既能增加CDDP的化疗活性,同时又能降低其毒副作用的药物,探索肝癌治疗的新方法,具有十分重要的意义。单宁酸(tannic acid,TA)是一种天然多酚类物质,可抑制多种肿瘤细胞的生长增殖。笔者前期的研究表明,TA能够通过内质网应激(endoplasmic reticu⁃lum stress,ERS)凋亡途径增强CDDP抗肝癌细胞HepG2的作用,降低CDDP的用量,从而减轻CDDP的化疗毒性,但二者协同的具体分子机制尚未完全阐明。转录活化因子6(activating transcription factor 6,ATF6)通路是ERS的主要通路之一。在ERS下,ATF6转运至高尔基体,经特定蛋白酶水解后被活化,活化的ATF6可促进C/EBP同源蛋白(C/EBP⁃homologous protein,CHOP)等ERS相关分子的表达。因此,本研究探讨了ATF6⁃CHOP通路在TA与CDDP协同抗肝癌中的作用,为肝癌的临床治疗方案提供一定的理论依据。
1 材料与方法
1.1 材料 人肝癌细胞系HepG2,由中国科学院细胞库提供。
1.2 仪器与试剂 单宁酸(C76H52O46)由Sigma公司生产,顺铂注射液[Cl2(NH3)2Pt]由山东齐鲁制药公司生产,RPMI⁃1640培养基来源于Gibco公司,胎牛血清购自浙江天杭生物科技有限公司,RNAi⁃soTMPlus购自TaKaRa Biotechnology公司,dNTP Mix(10 mmol/L)购自上海生工生物公司,M⁃MLV逆转录酶购自Promega公司,实时荧光定量PCR试剂盒购自Bio⁃Rad公司,PCR引物由上海生工生物公司合成,兔抗人多抗ATF6和ATF6B、兔抗人β⁃actin单抗和抗兔的二抗均购自Protein⁃Tech Group公司;Nanodrop 2000超微量分光光度计(Thermo Scientific公司),CFX ConnectTMOptics Module PCR仪(Bio⁃Rad公司),IX73倒置荧光显微镜(Olympus公司),GOLD⁃SIM二氧化碳培养箱(西盟国际公司)。
1.3 实验方法
1.3.1 细胞培养 HepG2细胞系培养于1640培养基中,内含10%胎牛血清、100 μg/mL链霉素、100 U/mL青霉素、2.0 g/L NaHCO3,置于37℃、95%空气、5%CO2的培养箱中培养。
1.3.2 实时荧光定量PCR 用180 μmol/L TA、0.9 μg/mL CDDP单独或联合处理细胞24和48 h后,收集细胞,提取总RNA,按试剂盒方法合成cDNA。引物:β⁃actin,F:CGGGAAATCGTGCGT⁃GAC,R:CAGGAAGGAAGGCTGGAAG;ATF6(α),F:TCCTCGGTCAGTGGACTCTTA,R:CTTGGGCTG AATTGAAGGTTTTG;CHOP,F:CAAGAGGTCCTG TCTTCAGATGA,R:TCTGTTTCCGTTTCCTGGTTC。实时荧光定量PCR反应体系为:cDNA 1 μL,Sso Fast Eva Green supermix 5 μL,3′引物和 5′引物各0.5 μL,无菌水补足至 10 μL。PCR 反应程序为:94 ℃ 60 s,95 ℃ 20 s,56 ℃(β⁃actin)、62.4 ℃(ATF6)或58℃(CHOP)30 s,40个循环周期。每个样品设3管重复。以β⁃actin作为内参,采用2⁃△△CT的方法,用3次重复的平均值计算基因相对表达量。
1.3.3 蛋白免疫印迹 药物处理24和48 h后,裂解细胞,提取总蛋白质,以BCA法测定蛋白质浓度,取一定体积量蛋白样品,进行变性、SDS⁃PAGE电泳、将蛋白质转至PVDF膜、5%脱脂牛奶封闭2 h、孵育一抗(ATF6 1∶3 000;ATF6B 1∶1 000;CHOP 1∶1 000;β⁃actin 1∶10 000)、洗涤后加二抗(1∶2 000)、加ECL发光试剂曝光与显影。
1.4 统计学方法 实验数据用表示,采用SPSS 22.0统计软件进行分析,IPP软件分析蛋白免疫印迹条带灰度值,两组间比较采用独立样本t检验进行分析,多组间比较采用单因素方差分析(one⁃way ANOVA),以P< 0.05表示差异有统计学意义。
2 结果
2.1 TA与CDDP联合促进HepG2细胞ATF6的表达 结果显示,与对照组相比,24和48 h时,TA组、CDDP组和联合用药组ATF6 mRNA水平(图2A)和蛋白水平(图1、图2B)均显著升高(P<0.01或P<0.05)。与24 h相比,48 h时TA组、CDDP组ATF6 mRNA和蛋白水平均呈升高趋势,联合用药组ATF6 mRNA水平呈升高趋势,蛋白水平呈降低趋势。

图1 Western Blot检测ATF6、ATF6B和CHOP蛋白的表达Fig.1 Detection of ATF6、ATF6B and CHOP levels by Western Blot
2.2 TA与CDDP联合促进HepG2细胞ATF6B蛋白的表达 结果显示,与对照组相比,24和48 h时,TA组、CDDP组和联合用药组ATF6B蛋白水平均显著升高(P<0.05或P<0.01)。与24 h相比,48 h时TA组、CDDP组ATF6B蛋白水平呈升高趋势,联合用药组呈降低趋势(图1、图3)。
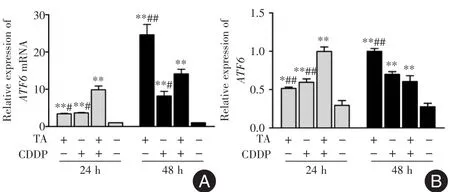
图2 TA与CDDP对ATF6表达的影响Fig.2 Effects of TA and CDDP on ATF6 expression level
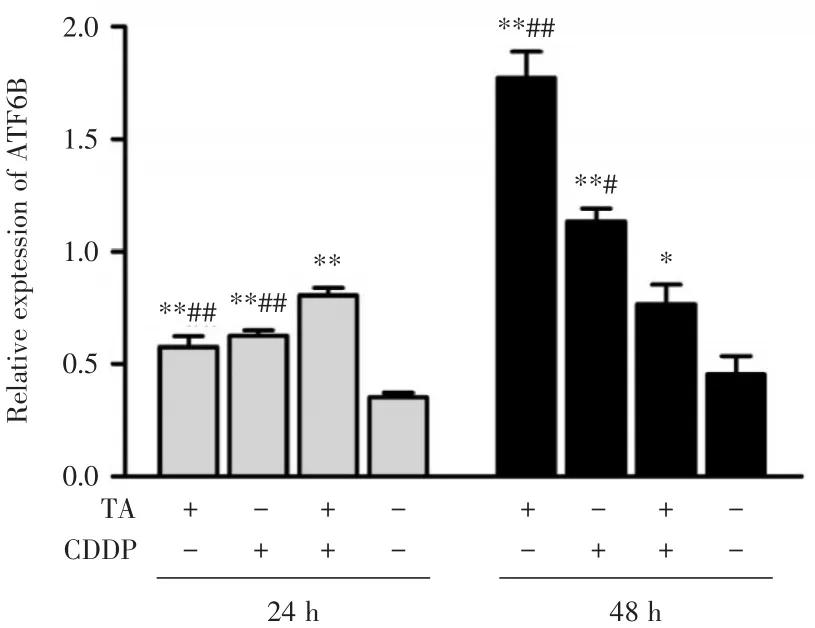
图3 TA与CDDP对ATF6B蛋白表达的影响Fig.3 Effects of TA and CDDP on ATF6B expression level
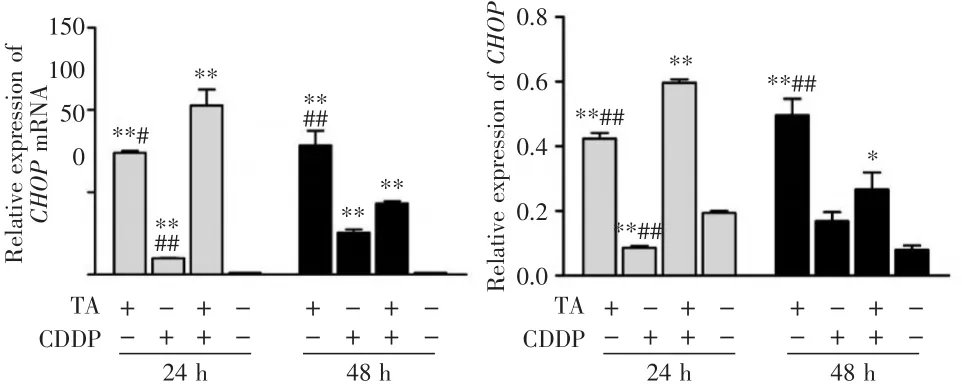
图4 TA与CDDP对CHOP表达的影响Fig.4 Effects of TA and CDDP on CHOP expression level
2.3 TA与CDDP联合促进HepG2细胞CHOP的表达 结果显示,与对照组相比,24和48 h时,TA组、CDDP组和联合用药组CHOP mRNA水平(图4A)和蛋白水平(图1、图4B)均显著升高(P<0.01或P<0.05)。与24 h相比,48 h时TA组、CDDP组CHOP mRNA和蛋白水平均呈升高趋势,联合用药组CHOP mRNA和蛋白水平均呈降低趋势。
3 讨论
肿瘤细胞中部分ERS是由不同的微环境改变所引发的,如缺氧、酸中毒等[4]。这种应激环境能够激活未蛋白折叠反应(unfolded protein response,UPR),UPR作为一种促进癌细胞适应应激和生存的选择性因素,从而增加癌细胞对某些化疗药物的抵抗性[5-6]。ERS发生时,一方面细胞启动生存途径,增加蛋白质的正确折叠,降低和清除错误折叠的蛋白质,促使内质网恢复稳态;另一方面,当内质网的功能紊乱持续进行,ERS时间过长、强度过大时,最终会通过ERS凋亡通路启动细胞凋亡[7-8]。因此,通过诱导ERS促使肿瘤细胞发生凋亡,有望成为肿瘤治疗的新方法、新途径[8],而ATF6就是ERS的一个主要靶点[9]。
ATF6是内质网上一种Ⅱ型跨膜蛋白,有ATF6α(ATF6)和 ATF6β(ATF6B)两种亚型,其 N端位于细胞质内,具有锌指结构(b⁃ZIP),C端位于内质网腔中,可感受ERS。ERS发生时,ATF6与78kDa调节血糖蛋白(glucose regulated protein,GRP78)分离后被运输至高尔基体,高尔基体中的S1P(site 1 protease)和S2P(site 2 protease)蛋白酶相继水解ATF6,释放b⁃ZIP结构域,激活ERS元件基因启动子区域,活化CHOP,诱导折叠酶和伴侣蛋白的转录,同时促进X盒结合蛋白1(X box⁃binding protein⁃1,XBP⁃1)转录的激活。激活后的CHOP和XBP1能促进细胞凋亡的发生[10]。对HBV诱导的肝癌患者研究中发现,ATF6表达显著升高,提示ATF6的高表达可能与肝癌的易感性有关[11]。另有研究表明,在二乙基亚硝胺诱导的肝癌病变小鼠及肝癌HepG2细胞中,褪黑素可激活ATF6通路,并促进CHOP的表达,来诱导细胞凋亡[12-13]。CHOP能够增强应激细胞的蛋白质合成,诱发氧化应激和ATP耗竭,产生蛋白毒性[14-15]。非ERS下,CHOP的表达水平并不高;ERS下,CHOP转录水平大大提高,其高表达影响了内质网对蛋白折叠的修饰,导致细胞周期停滞和DNA损伤,诱导细胞凋亡发生,CHOP被认为是ERS凋亡通路激活的特异性分子之一[16]。
本研究显示,在无ERS的对照组细胞中ATF6、ATF6B和CHOP的水平均较低,但在TA组、CDDP组、联合用药组中三者的表达均显著上调,表明TA与CDDP的协同抗HepG2作用与ATF6⁃CHOP通路的激活密切相关。代荣阳等[17]利用顺铂化疗肝癌时,肝癌细胞中ATF6表达上调,激活了ERS通路,最终诱导细胞凋亡发生,本研究结果与其具有一致性。TA与CDDP协同抗HepG2的主要机制可能是当细胞受到ERS刺激之后,ATF6信号转导通路被激活,其下游的ATF6和ATF6B可与CHOP启动子上的内质网应激反应元件(ERS re⁃sponse element,ERSE)结合,诱导CHOP的表达,高表达的CHOP能抑制抑凋亡蛋白Bcl⁃2的表达,同时诱导促凋亡蛋白Bax由细胞质向线粒体移位,从而触发细胞的Bax/Bad系统,激活Caspase⁃9和Caspase⁃3分子,启动Caspase级联反应,诱导细胞凋亡发生[18]。尽管本研究中TA与CDDP联合用药24和48 h后,ATF6⁃CHOP通路的激活水平基本是一致的,但在48 h时ATF6、ATF6B和CHOP的表达水平整体呈现一定的下降趋势,可能是由于细胞早期时活力高,应对应激的能力较好;但经过长时间的药物干预后,细胞凋亡水平持续上调,细胞活力和应对应激的能力反而有所下降,ATF6、ATF6B和CHOP的表达随之降低,还需进一步研究其具体机制。最新研究表明,衣霉素能够增强肝癌细胞中CHOP的表达,特异性敲除CHOP基因后,衣霉素诱导的细胞自噬增强,同时ERS诱导的细胞凋亡被抑制[19],提示本研究中TA联合CDDP促进HepG2细胞中CHOP的高表达,不仅与诱导细胞发生凋亡密切相关,可能还与诱导细胞发生自噬有关,有待进一步深入研究。
综上所述,本研究表明TA联合CDDP增强了肝癌HepG2细胞中ATF6、ATF6B和CHOP分子的激活水平。本研究首次证实了内质网应激ATF6⁃CHOP通路与TA协同增强CDDP抗肝癌的作用密切相关,为临床上肝癌的治疗方案提供了新思路,但还需要在动物实验研究中进一步证实。
[1]ELSERAG H B.Epidemiology of viral hepatitis and hepatocellu⁃lar carcinoma[J].Gastroenterology,2012,142(6):1264⁃1273.
[2]LAU W Y,SANGRO B,CHEN P J,et al.Treatment for hepa⁃tocellular carcinoma with portal vein tumor thrombosis:the emerging role for radioembolization using yttrium⁃90[J].Oncol⁃ogy,2013,84(5):311⁃318.
[3]HERNANDEZGEA V,TOFFANIN S,FRIEDMAN S L,et al.Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J].Gastroenterology,2013,144(3):512 ⁃527.
[4]MA Y,HENDERSHOT L M.The role of the unfolded protein response in tumourdevelopment:friend or foe[J].Nat Rev Cancer,2004,4(12):966⁃977.
[5]WANG M,KAUFMAN R J.The impact of the endoplasmic re⁃ticulumprotein⁃folding environment on cancer development[J].Nat Rev Cancer,2014,14(9):581⁃597.
[6]CLARKE H J,CHAMBERS J E,LINIKER E,et al.Endoplas⁃mic reticulum stressin malignancy[J].Cancer Cell,2014,25(5):563⁃573.
[7]EALY S J,GORMAN A M,MOUSAVI⁃SHAFAEI P,et al.Targeting the endoplasmic reticulumstress response as an anti⁃cancer strategy[J].Eur J Pharmacol,2009,625(1⁃3):234⁃246.
[8]吴明松,郑翔,耿娜娜,等.布雷菲德菌素A联合顺铂增强肺癌GLC⁃82细胞PERK⁃ATF4通路的激活水平[J].实用医学杂志,2016,32(14):2302⁃2305.
[9]DUFEY E,URRA H,HETZ C.ER proteostasis addiction in cancer biology:Novel concepts[J].Seminars Cancer Biolo,2015,33:40.
[10]ANZ M A,RAQUEL O,THADEU C C,et al.Melatonin acti⁃vates endoplasmic reticulum stress and apoptosis in rats with di⁃ethylnitrosamine⁃induced hepatocarcinogenesis[J].PLos One,2015,10(12):e0144517.
[11]WU X,XIN Z,ZHANG W,et al.A missense polymorphism in ATF6 gene is associated with susceptibility to hepatocellular carcinoma probably by altering ATF6 level[J].Int J Cancer,2014,135(1):61⁃68.
[12]YI P,HIGA A,TAOUJI S,et al.Sorafenib⁃mediated targeting of the AAA+ATPase p97/VCP leads to disruption of the secreto⁃ry pathway,endoplasmic reticulum stress,and hepatocellular cancer cell death[J].Molecular Cancer Therapeutics,2012,11(12):2610⁃2620.
[13]BU L J,YU H Q,FAN L L,et al.Melatonin,a novel selec⁃tive ATF⁃6 inhibitor,induces human hepatoma cell apoptosis through COX ⁃2 downregulation.[J].World J Gastroenterol,2017,23(6):986.
[14]WANG M,KAUFMAN R J.The impact of the endoplasmic re⁃ticulumprotein⁃folding environment on cancer development[J].Nat Rev Cancer,2014,14(9):581⁃597.
[15]HAN J,BACK S H,HUR J,et al.ER⁃stress⁃induced tran⁃scriptional regulation increases protein synthesis leading to cell death[J].Nat Cell Biol,2013,15(5):481⁃490.
[16]QUICK Q A,FAISON M O.CHOP and caspase 3 induction un⁃derlie glioblastoma ceils death in response to endoplasmic retic⁃ulum stress[J].Exp Ther Med,2012,3(3):487⁃492.
[17]代荣阳,段春燕,刘友平,等.未折叠蛋白反应通过自噬抑制顺铂诱导的肝癌细胞凋亡[J].泸州医学院学报,2011,34(5):460⁃465.
[18]OYADOMARI S,MORI M.Roles of CHOP/GADD153 in endo⁃plasmic reticulum stress[J].Cell Death Differ,2004,11(4):381⁃389.
[19]LEI Y,WANG S,REN B,et al.CHOP favors endoplasmic re⁃ticulum stress⁃induced apoptosis in hepatocellular carcinoma cells via inhibition of autophagy[J].PLos One,2017,12(8):e0183680.
