万寿菊生物熏蒸对连作苹果幼苗和土壤微生物的影响*
2018-02-28王晓芳徐少卓段亚楠王海燕盛月凡毛志泉
王晓芳 徐少卓 王 玫 段亚楠 王海燕 盛月凡 毛志泉†
(1 作物生物学国家重点实验室/山东农业大学园艺科学与工程学院,山东泰安 271018)
(2 山东省果树研究所,山东泰安 271000)
连作障碍(Hazard posed by continuous cropping to replanting)在全世界苹果主产区普遍发生[1]。近年来,越来越多的研究证实土传病虫害是导致连作障碍的主要原因,如真菌中的柱孢属(Cylindrocarpon)、丝核菌属(Rhizoctonia)、疫霉属(Phytophthora)、腐霉属(Pythium)及镰刀菌属(Fusarium)等[2-4],各主产区的致病菌种差异很大;某些线虫也可能与连作障碍相关,如穿刺根腐线虫(Pratylenchus penetrans)[5]。因此,研究建立防治土传病虫害的措施是缓解苹果连作障碍的根本。土壤熏蒸(消毒)是破解连作障碍这一难题的有效措施,目前主要依靠化学熏蒸剂,如溴甲烷、棉隆和氯化苦等。溴甲烷能高效、广谱地杀死各种有害生物,但其严重影响地球环境和人类健康,已被淘汰;其他化学药剂虽尚未淘汰,但长期大量使用会对环境和农作物产生污染,危害人类健康[6],而且化学熏蒸导致土壤酶活性显著下降,极大地降低了农业土壤的可持续生产力[7-8]。因此,发展可行的替代技术抑制土传病虫害并进行有效病虫害管理成为当前研究的热点,生物熏蒸(Biofumigation)应运而生。
生物熏蒸是利用动植物的有机质在分解过程中产生的挥发性杀生气体抑制或杀死土壤中有害生物的方法。Smolinska等[9]研究表明,埃塞俄比亚芥菜(Brassica carinata)、黑芥子(B. nigra)和芥菜(B. juncea)含有较高的硫代葡萄糖苷(GSLs)能释放出异硫氰酸酯(ITCs),对土壤中的尖孢镰孢菌(Fusarium oxysporum)病原体有很好的抑制作用。目前,菊科植物、绿肥、家禽粪便等均被用作生物熏蒸材料以有效防治土传病害及植物根结线虫[10-11],但关于生物熏蒸的报道主要是使用芸薹属植物。本研究前期室内抑菌试验发现万寿菊(Tateges erecta)具有较强的抑菌效果。万寿菊为菊科万寿菊属一年生草本植物,其含有的挥发性成分具有抗菌、抑菌及杀虫等多种生物活性。范志宏等[12]研究表明,万寿菊根提取物对西瓜枯萎病菌有明显的抑制作用,其中以精油类的抑菌效果最好,且能促进植株生长,有效减轻西瓜枯萎病菌对植株的毒害作用。作为一种商业化色素的新来源,万寿菊的种植面积日益增长,对于万寿菊鲜花的利用研究较多,并已用于工业生产中。但对于万寿菊秸秆及叶子,采收后的万寿菊植株大部分被随意抛弃或就地焚烧,造成资源浪费且焚烧产生大量有害气体,对环境造成严重的污染[13]。寻求高效、经济的万寿菊废弃植株利用途径是值得研究的课题,用万寿菊作为生物熏蒸剂克服苹果连作障碍尚未见报道。本研究用万寿菊风干粉末对老龄苹果园土壤进行熏蒸,探讨万寿菊生物熏蒸对苹果幼苗及连作土壤环境的影响,以期为生产中利用生物熏蒸防治苹果连作障碍提供理论依据。
1 材料与方法
1.1 试验材料
试验于2015年4月—2016年12月在山东农业大学园艺科学与工程学院、国家苹果工程技术研究中心及作物生物学国家重点实验室进行。
试验用土取自山东省泰安市满庄镇小王庄村25 a生老龄苹果园,取自距树干80 cm,去表层土后深10~40 cm的区域,多点随机取样,混匀备用。土壤类型为棕壤。土壤基本理化性质如下:硝态氮铵态氮有效磷9.3 mg kg-1,速效钾90.6 mg kg-1,有机质5.3 g kg-1。
供试植物材料为实生平邑甜茶(M a l u shupehensisRehd.)苹果幼苗,种子于4℃层积30 d左右,待种子露白后,于2015年12月9日播种于育苗基质中,幼苗长至6片真叶,备用。
熏蒸用万寿菊(Tateges erecta)为播种繁育的盆栽试材,于2015年4月中旬播种,8月中旬收集全株,用自来水冲洗干净后,自然风干,以粉碎机粉碎,过30目筛,装入封口袋备用。
1.2 试验设计
试验设置5个处理,分别为:①老龄苹果园土壤对照(未作处理,CK);②覆膜(未拌入万寿菊,F);③万寿菊1.5 g kg-1+覆膜(1.5T+F);④万寿菊6.0 g kg-1+覆膜(6.0T+F);⑤万寿菊15.0 g kg-1+覆膜(15.0T+F)。
2016年1月10日进行熏蒸处理,在每个泥瓦盆盆底(盆直径23 cm,高18 cm)放置滤纸,将不同添加量的万寿菊(0、1.5、6、15 g kg-1)与老龄苹果园土壤拌匀后装盆,每盆装3.0 kg混合土,浇透水,覆膜熏蒸,15 d后,去膜晾7 d。选取长势一致的6叶平邑甜茶幼苗进行移栽。每处理20盆,每盆2株幼苗,随机排列,正常肥水管理,每个月施1次复合肥(氮磷钾复混肥料15-15-15),每盆施用6 g,施肥后浇水,每3天浇水1次,每次浇水500 ml。
栽植幼苗生长120 d取样测定相关指标。土壤样品采集:每个处理取3盆作为3次重复,去掉表层土壤和盆周围的土壤,取根际土,并将土壤装入黑色塑料袋带回实验室,过12目筛(1.70 mm)取大约500 g分装至3个封口袋保存,一份4℃冷藏备用,用于土壤微生物数量的测定;一份风干,用于土壤酶测定;一份-20℃冰箱保存,用于提取DNA,进行末端限制性片段长度多态性(Terminal restriction fragment length polymorphism,T-RFLP)分析及实时荧光定量分析。植物样品整株采集,轻轻抖落根部土壤,用清水冲洗干净,将样品及时带回实验室进行处理,测定株高、干重等指标。
1.3 测定指标及方法
生物量测定采用常规称重方法。
根系形态指标测定:将平邑甜茶幼苗根系用清水洗净,放于盛有水的硬塑料盒中,在水中平铺展开,使用专业版WinRHIZO(2007年版)根系分析系统处理样品图像,记录根长度、根系表面积和根体积。
土壤酶测定参照关松荫[14]的方法。脲酶测定采用比色法,以24 h后1 g土壤中NH3-N的质量(mg)表示脲酶活性,用NH3-N mg g-1d-1表示。过氧化氢酶采用容量法,以1 g土壤的 0.1 mol L-1高锰酸钾毫升数表示过氧化氢酶活性,用ml g-1表示。磷酸酶采用磷酸苯二钠比色法,以1 g土壤的酚毫克数表示磷酸酶活性,用mg g-1d-1表示。蔗糖酶测定采用比色法,以24 h后1 g土壤中葡萄糖的质量(mg)表示蔗糖酶活性,用mg g-1d-1表示。
土壤微生物测定:细菌、真菌、放线菌均用平板涂抹法测定,测定前计算水分系数。细菌采用牛肉膏蛋白胨培养基,真菌采用马丁氏培养基,放线菌采用高氏一号培养基[15]。
样品基因组总DNA的提取及纯化按照E. Z.N.A. Soil DNA Kit说明书进行操作,用于T-RFLP技术分析和实时荧光定量核酸扩增检测系统(qPCR)。
T-RFLP分析:①ITS-PCR扩增。用于内转录间隔区(Internal transcribed spacer,ITS)片段扩增的引物采用带羧基荧光素(FAM)荧光标记的真菌通用引物ITS1-F-FAM和ITS4,由上海生工生物工程技术服务有限公司合成。ITS1-F-FAM(5′→3′):CTTGGTCATTTAGAGGAAGTAA;ITS4(5′→3′):TCCTCCGCTTATTGATAGC。ITS扩增反应体系为:12.5 μl 2 × Taq MasterMix,1 μl DNA模板,ITS1-F和ITS4(10 μmol L-1)各1.5 μl,加dd H2O至25 μl。PCR反应条件:94℃预变性3 min;94℃变性60 s,51℃退火60 s,72℃延伸60 s,共34个循环;最后72℃延伸10 min。取5 μl ITS-PCR扩增产物经2%琼脂糖凝胶电泳检测,按照 PCR产物纯化试剂盒说明书进行PCR产物纯化,-20℃保存备用。②酶切。用限制性内切酶Hha I对上述PCR纯化产物进行酶切。酶切反应体系为30 μl:含10 μl ITS-PCR纯化产物、2 μl Hha I(10 U μl-1)、2 μl 10×Buffer,加dd H2O至30 μl。置于37℃水浴中温育4 h,酶切完毕后65℃水浴20 min终止反应。将酶切产物送至生工生物工程(上海)股份公司进行测序。对测序结果进行真菌群落多样性分析(多样性指数、优势度指数、均匀度指数和丰富度指数)、聚类分析和主成分分析[16]。
实时荧光定量采用CFX ConnectTMReal-Time System(Bio-Rad,美国)对土壤中层出镰孢菌基因拷贝数进行绝对定量分析。实时荧光定量PCR体系依据SYBR Premix Ex TaqTMKit TaKaRa试剂盒说明步骤完成。25 μl PCR反应体系:DNA模板1.5 μl;SYBR Premix Ex Taq Ⅱ 12.5 μl;引物各1 μl;ddH2O 9 μl。层出镰孢菌PCR扩增反应程序:95℃预变性30 s;95℃变性5 s;60℃退火30 s;共计40个循环[17]。
1.4 数据分析
试验数据采用Microsoft Excel 2003进行计算和作图,通过SPSS 19.0进行方差分析,采用邓肯(Duncan’s)新复极差法进行差异显著性检测,用Origin 8.5完成对试验数据的制图。
2 结 果
2.1 万寿菊生物熏蒸对平邑甜茶幼苗生长的影响
与对照相比,不同添加量的万寿菊生物熏蒸处理均对苹果幼苗生长有促进作用,均使平邑甜茶幼苗生物量有所增加(表1)。其中以6.0T+F处理的效果最好,其株高、地径、地上部及根系干重分别为对照的3.6倍、1.5倍、8.1倍和13.1倍,与对照差异显著。1.5T+F处理的分别为对照的2.1倍、1.1倍、3.9倍、5.8倍;15.0T+F处理的分别为对照的1.9倍、1.3倍、4.8倍、6.4倍(表1)。单独覆膜处理对平邑甜茶幼苗生长有促进作用,各项指标分别为对照的1.3倍、1.2倍、2.2倍和3.1倍。
2.2 万寿菊生物熏蒸对平邑甜茶幼苗根系的影响
与对照相比,不同添加量的万寿菊生物熏蒸处理均对苹果幼苗根系生长起到明显促进作用(表2)。其中以6.0T+F处理的效果最好,平邑甜茶幼苗的根长度、根表面积、根体积及根尖数显著增加,分别较对照增加了226.5%、333.0%、548.4%和142.7%,与对照差异显著。1.5T+F处理的分别增加了52.4%、45.9%、82.8%、43.9%;15.0T+F处理的分别增加了42.4%、98.3%、178.9%、18.4%。单独覆膜处理对平邑甜茶幼苗根系生长也有促进作用,各项指标分别较对照增加33.4%、41.4%、73.9%和3.2%,但与对照差异不显著。
2.3 万寿菊生物熏蒸对苹果连作土壤酶活性的影响
与对照相比,不同添加量的万寿菊生物熏蒸处理显著提高了连作土壤酶活性(图1)。其中,脲酶、磷酸酶活性以6.0T+F处理的效果最好,分别较对照高103.6%、77.6%(图1A、图1B);蔗糖酶活性以15.0T+F处理的最高,较对照高302.0%,6.0T+F处理的较对照高200.4%(图1C)。过氧化氢酶活性以6.0T+F和15.0T+F处理的活性最高,均较对照高64.6%(图1D)。单独覆膜处理使脲酶、磷酸酶、蔗糖酶、过氧化氢酶活性分别提高37.7%、20.3%、88.9%和10.8%。
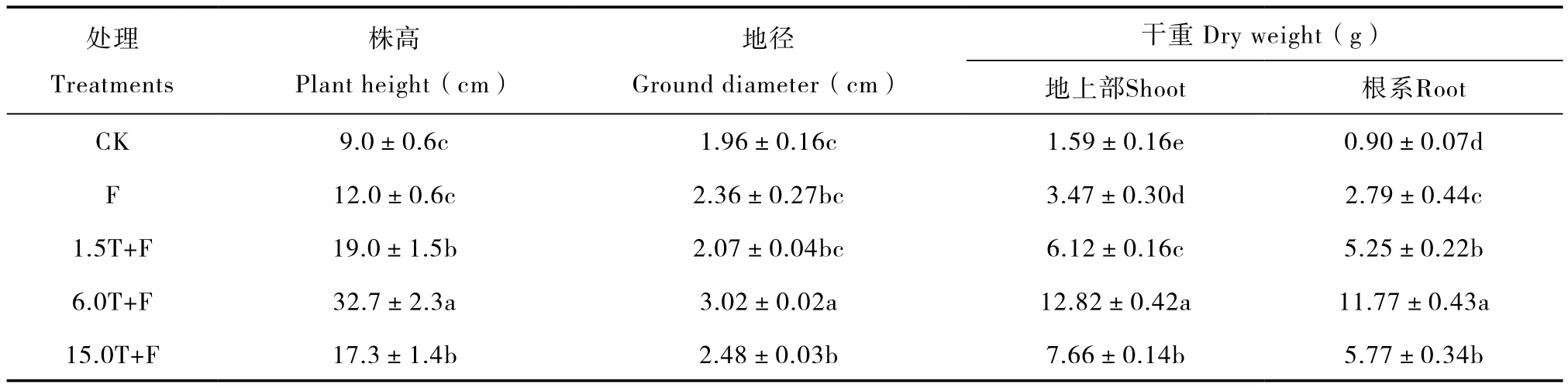
表1 万寿菊生物熏蒸下平邑甜茶幼苗生长指标Table 1 Growth indices of Malus hupehensis Rehd. seedlings in soils biofumigated with Tateges erecta powder
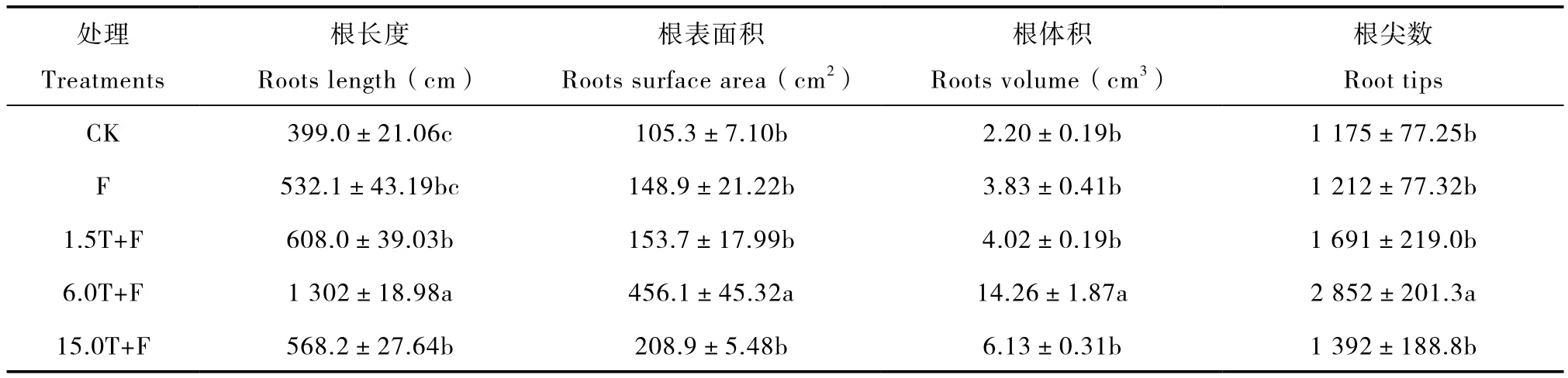
表2 万寿菊生物熏蒸下平邑甜茶单株幼苗根系的生长Table 2 Growth of Malus hupehensis Rehd. seedling roots in soils biofumigated with Tateges erecta powder
2.4 万寿菊生物熏蒸对土壤微生物数量的影响
与对照相比,连作土壤中加入不同量的万寿菊熏蒸后,各处理土壤中的真菌数量明显减少,细菌、放线菌数量显著增加,细菌/真菌比值变大(表3)。以6.0T+F处理的效果最好,细菌/真菌比值为219.9,是对照的5.6倍;其次是15.0T+F处理的(137.0),为对照的3.5倍。说明万寿菊生物熏蒸明显改善了土壤微生物群落结构,使连作土壤真菌减少、细菌增加,向细菌型土壤转化,微生物环境优化,有利于根系生长发育和植株生长。
2.5 不同处理土壤真菌群落结构
通过多样性指数、聚类分析和主成分分析(PCA)比较万寿菊生物熏蒸对土壤真菌多样性的影响,了解连作苹果园土壤真菌的群落结构特征变化。与对照相比,老龄苹果园土壤加入万寿菊生物熏蒸处理后,土壤真菌群落的多样性、均匀度和丰富度指数均有所下降,但优势度指数明显增加(表4)。由此可见,万寿菊生物熏蒸处理改变了土壤真菌的群落结构,使土壤真菌群落的丰富度、多样性和均匀度降低,某种真菌优势度明显增加。
由图2聚类分析可以看出,不同添加量万寿菊生物熏蒸的土壤真菌群落结构与连作土壤完全独立开来,说明万寿菊生物熏蒸处理后明显改变了连作苹果园土壤的真菌群落结构。其中,6.0T+F处理和15.0T+F处理间关系较近,F和1.5T+F间关系较近。
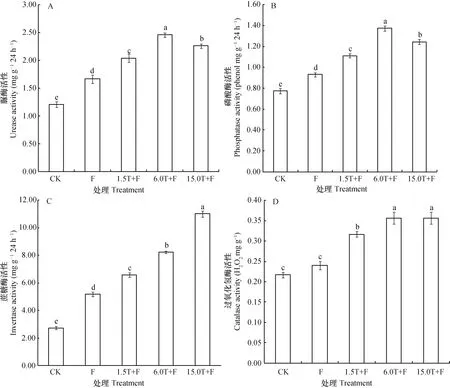
图1 万寿菊生物熏蒸对连作条件下脲酶(A)、磷酸酶(B)、蔗糖酶(C)和过氧化氢酶(D)活性的影响Fig. 1 Effects of biofumigation with Tateges erecta powder on soil enzyme activities(urease activity(A),phosphatase activity(B),invertase activity(C),and catalase activity(D))in soils under continuous cropping
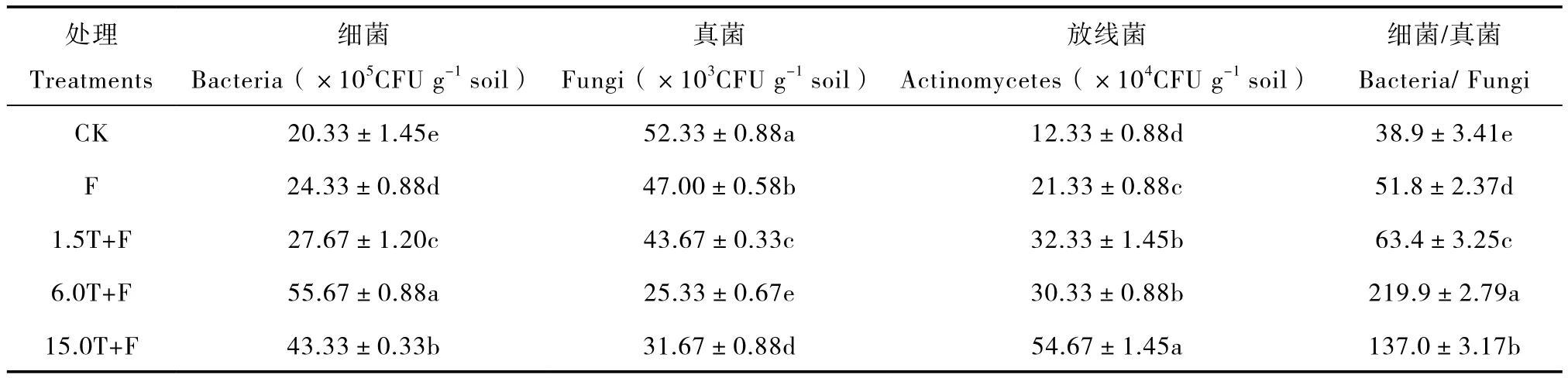
表3 万寿菊生物熏蒸下土壤微生物数量Table 3 Population of soil microorganisms in soils biofumigated with Tateges erecta powder
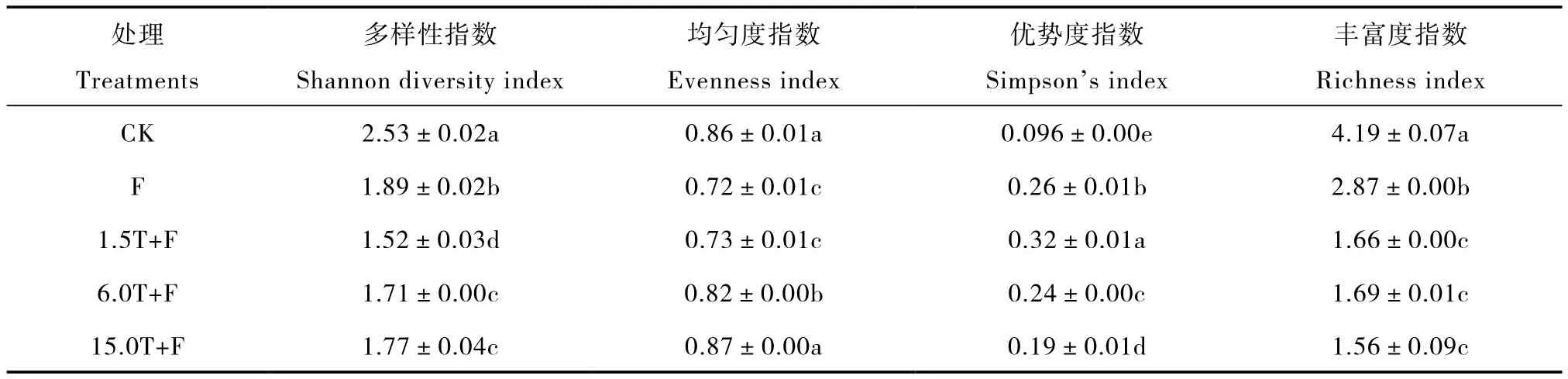
表4 万寿菊生物熏蒸对土壤真菌多样性的影响Table 4 Effects of biofumigation with Tateges erecta powder on the soil fungal diversity
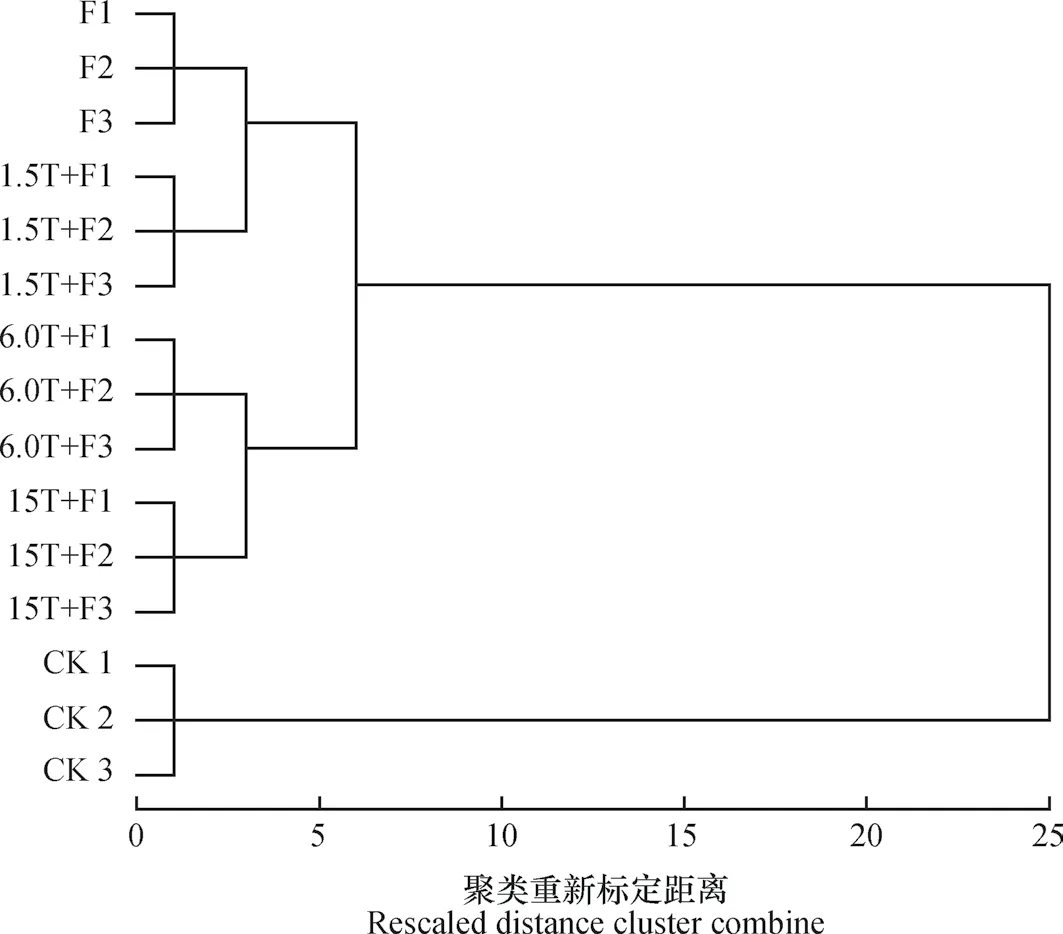
图2 不同处理间真菌末端限制性片段长度多态性(T-RFLP)图谱的聚类分析Fig. 2 Cluster analysis of T-RFLP patterns of fungi in the soil relative to treatment
根据不同处理间的末端限制性片段(T-RFs)在图谱中的分布及丰度进行主成分分析(PCA)。根据主成分的提取原则,被选的主成分所代表的主轴总长度占所有主轴长度之和的大约85%即可,对各样品获得的所有数据进行主成分分析,前2个主成分特征值的贡献率总和为 99.16%,所以选取2个主成分来进行分析。从图3可以看出,万寿菊生物熏蒸处理与老龄苹果园土壤对照完全分开,说明万寿菊生物熏蒸处理明显改变了老龄苹果园土壤的真菌群落结构。
2.6 不同处理土壤层出镰孢菌数量
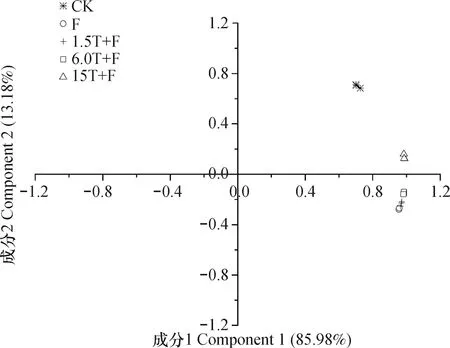
图3 不同处理间真菌T-RFLP 图谱的主成分分析Fig. 3 Principal component analysis of T-RFLP patterns of fungi in the soil relative to treatment
徐文凤[18]在中国环渤海苹果重茬园中分离出大量镰孢属真菌,分别为尖孢镰孢菌(Fusarium oxysporum)、层出镰孢菌(F. proliferatum)、腐皮镰孢菌(F. solani)和串珠镰孢菌(F. moniliforme)。致病性测定结果表明,层出镰孢菌和串珠镰孢菌致病性最强[18]。利用实时荧光定量技术(Real-time PCR)对层出镰孢菌(F. proliferatum)的基因拷贝数进行绝对定量分析(图4)。结果表明,万寿菊生物熏蒸处理的层出镰孢菌基因拷贝数均低于CK,1.5T+F、6.0T+F、15.0T+F处理分别较对照低49.3%、57.9%、50.6%。单独覆膜处理较对照降低了27.2%。说明万寿菊生物熏蒸能够显著减少层出镰孢菌的数量。
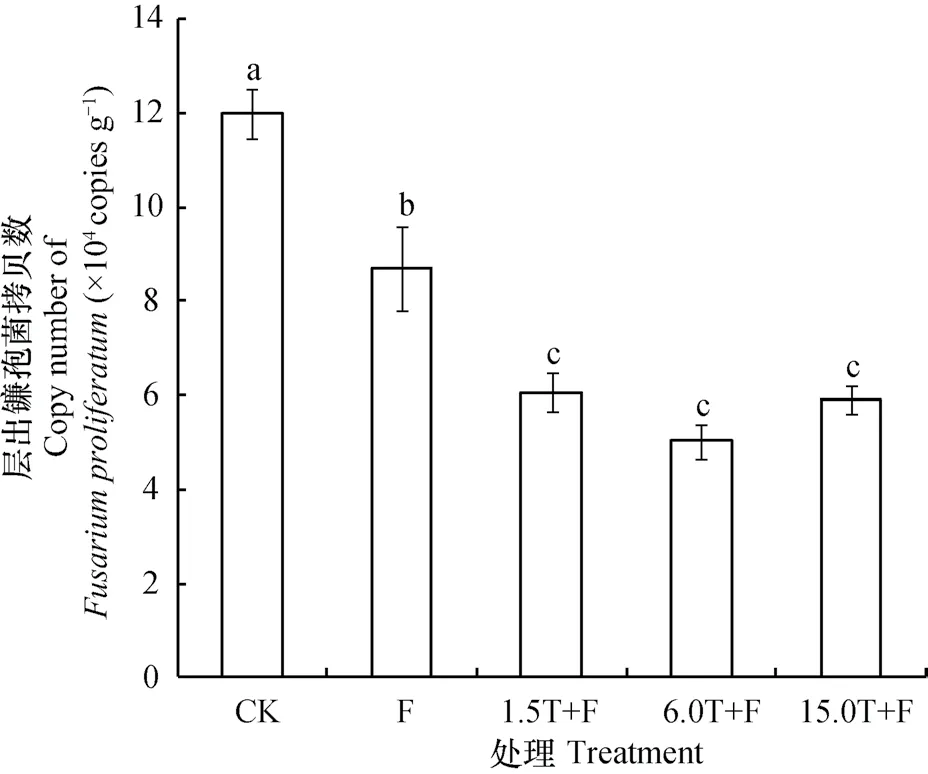
图4 不同处理层出镰孢菌的基因拷贝数Fig. 4 Gene copy number of Fusarium proliferatum in the soil relative to treatment
3 讨 论
土壤添加剂可以改善土壤结构,影响土壤微生物群落,促进植物生长发育,增强植物自身抗性,提高农作物的品质与产量,所以,在农业生产过程中使用土壤添加剂已成为作物土传病虫害生态防治的重要措施之一[19-20]。苹果连作土壤中添加芥菜籽粉和白芥子粉等绿肥后,能明显促进嘎拉/M26幼树生长[21]。本研究发现,添加6.0 g kg-1的万寿菊粉末进行生物熏蒸可显著增加平邑甜茶幼苗的株高及生物量,尤其是对根系生长促进作用明显。Arnault等[22]发现以洋葱和韭菜加工废料作为土壤生物熏蒸剂可明显改善土壤结构,促进草莓和芦笋生长,可使草莓和芦笋增产15%~20%,与芥菜处理的效果相当。研究中发现万寿菊低浓度(1.5 g kg-1)和高浓度(15.0 g kg-1)添加量的促生效果略差,1.5 g kg-1因为添加量不足,熏蒸效果不理想,15.0 g kg-1虽然添加量大,但效果却不是最理想的,室内的抑菌试验发现万寿菊粉末加水后黏性较大,因此,施入土壤的量太大会导致土壤透气性不良,土壤黏结,不利于根系生长。
土壤酶是土壤中动植物残体分解、植物根系分泌和土壤微生物代谢的产物,是一类具有生物化学催化活性的特殊物质,参与土壤中许多重要的生物化学过程,是土壤中最活跃的部分,直接影响着土壤的代谢性能,且能活化土壤有机质,将其转化为植物可吸收的无机物,其活性大小在一定程度上代表土壤肥力的高低,较高的酶活性水平,能在一定程度上保证作物在土壤肥力贫瘠的土地上生长良好[23]。谷岩等[24]研究发现,大豆重茬使土壤脲酶和转化酶活性均显著降低。苹果连作土壤的过氧化氢酶、脲酶、蔗糖酶和中性磷酸酶活性降低,可能是连作使土壤环境恶化的表现之一,而浇灌3%浓度的有机物料发酵液可提高苹果连作土壤的酶活性[25]。本研究中,老龄苹果园土壤中加入万寿菊粉末生物熏蒸后,土壤酶活性显著提高,综合蔗糖酶、脲酶、磷酸酶、过氧化氢酶活性测定结果看,以6.0 g kg-1处理的效果最好,这说明适宜量的万寿菊粉末施入土壤后不仅具有良好的抑菌或灭菌作用,而且其植物组织腐烂分解后可能改良土壤的理化性质特别是持水性、有机质含量、肥力及通透性等,改善土壤的营养条件,促进植物生长和增产。这与王艳芳等[26]在连作土壤中添加适量甲壳素能提高土壤中蔗糖酶、脲酶、磷酸酶和过氧化氢酶活性的研究结果较为一致。
土壤微生物是土壤中活的有机体,是最活跃的土壤肥力因子之一[27]。土壤微生物种群在很大程度上决定着土壤中营养物质的分解、循环和能量流动,通过调节土壤环境可以改变土壤微生物的种群组成和多样性,影响土壤生态系统的功能[28]。植物连作后,由于长期受同一类根系分泌物的影响,土壤微生物群落会发生选择性富集,导致土壤微生物群落数量发生变化,扰乱了土壤微生物生态平衡,连作后土壤中细菌的数量总体下降,真菌的数量显著上升,病原菌数量急剧增加,土壤微生物从细菌主导型向真菌主导型转化,使病原菌更容易侵染植物而引发各种土传病害[29]。因此,寻找适宜的控制土传病虫害措施可有效防控连作障碍。随着环保意识的增强,各国学者致力于研究环保型熏蒸措施对土壤中致病病原菌或线虫的抑制或杀生作用。Lazzeri等[30]研究发现,芥子科植物(芥菜、芝麻菜等)作为杀生性绿肥显著减少了腐霉菌属繁殖体的数目。将高GSLs含量的芸薹属植物组织风干制成杀生小球,施入土壤浇水熏蒸处理后发现,该处理与用纯硫代葡萄糖苷和黑芥子酶处理同样对腐霉菌(Pythiumspp.)和立枯丝核菌(Rhizoctonia solani)有很好的熏蒸效果[31]。
本研究用平板涂布法结合末端限制性片段长度多态性(T-RFLP)技术研究万寿菊生物熏蒸对连作苹果园土壤中微生物数量和真菌群落结构的影响。基于T-RFLP图谱,运用多样性指数和主成分分析比较了不同处理间真菌多样性及群落结构。结果发现,老龄苹果园土壤采取万寿菊生物熏蒸处理后土壤中的真菌数量明显减少而细菌、放线菌数量显著增加,细菌/真菌比值显著增加,以6.0 g kg-1处理的效果最好,细菌/真菌比值为219.9,土壤类型由真菌型向细菌型转变。同时,万寿菊生物熏蒸对连作土壤中真菌种类及丰度均产生了一定的影响,万寿菊生物熏蒸使老龄苹果园土壤中真菌的多样性、均匀度和丰富度降低,优势度增加,这与本实验室以往的研究结果[26]不一致,可能是因为万寿菊生物熏蒸使某些真菌数量明显增加,处于优势地位,也可能是因为万寿菊植株内存在着具有杀菌效果的内生真菌。有研究[32]表明,有些植物内生真菌具有显著的生物熏蒸效果,具体原因有待于进一步深入研究。Hollister等[33]最早利用高通量测序法分析芥菜籽粕(SM,释放烯丙基异硫氰酸酯)对土壤真菌和细菌群落的影响,发现芥菜籽粕显著影响土壤真菌和细菌群落结构,使真菌多样性降低60%,与真菌病害相关的细菌类群丰富度增加(如芽孢杆菌属、假单胞杆菌属和链霉菌属等),有效抑制了真菌病害发生。Hu等[34]研究发现,烯丙基型异硫氰酸酯使真菌数量减少85%,不同类型的异硫氰酸酯使真菌群落组成发生明显改变,如烯丙基型异硫氰酸酯处理土壤后腐质霉属(Humicola)真菌增加,丁基型异硫氰酸酯处理土壤后被孢霉属(Mortierella)真菌增加,但不同的异硫氰酸酯化合物对细菌群落结构影响较小。Weerakoon等[35]研究也发现,芥菜籽粉不仅对连作苹果园土壤中腐霉属(Pythiumspp.)病原菌具有抑制作用,而且改变连作土壤中真菌群落结构,这种土壤中原有真菌群落结构的调整,很可能有助于芥菜籽粉抑制腐霉菌对苹果根系的侵染,进而缓解苹果连作障碍 。Yim等[36]研究发现,芥菜生物熏蒸能够促进连作土壤中苹果树的生长,且改变了土壤微生物群落结构,对真菌的影响较细菌明显。Ascencion等[37]研究发现,在三种试验土壤中施用芜菁、甘蓝型油菜、芥菜熏蒸均能有效抑制白菜立枯丝核菌,抑制率分别为96.7%~100%、86.7%~100%、40%~100%,同时显著改变了土壤中微生物的数量和种群结构,3种物质熏蒸后土壤中的细菌数量明显增加,真菌数量减少。
本研究在设置试验时,同时设置了单独覆膜处理,单独覆膜处理有一定的熏蒸作用,对幼苗及根系生长有促进作用,但促进效果不明显,与对照差异不显著。因此,在生产应用中,连作土壤中添加适量的万寿菊粉浇水覆膜可使连作土壤由真菌型向细菌型转变,而且也有利于维持土壤微生物群落结构的多样性,缓解连作障碍,促进连作条件下苹果幼苗生长发育。
万寿菊风干粉末生物熏蒸对缓解苹果连作障碍有较好的效果,为使生产上操作性更强,应对万寿菊适宜剂型进行试验,并配套相应的技术措施。近年发展起来的高通量测序技术,对深入研究连作对土壤微生物群落组成和功能变化是较好的技术手段,该技术能够分析某些特定的菌群,如细菌、氨氧化细菌、真菌及一些植物病原菌(镰刀菌类、茄科劳尔氏菌)的变化情况,测定的微生物种类和数量更加多样、丰富,结果也会更加可靠[27]。因此,下一步应采用该测定技术深入研究万寿菊生物熏蒸处理后土壤微生物群落结构的变化和万寿菊的抑菌机理。
4 结 论
老龄苹果园土壤中添加适量的万寿菊进行熏蒸有助于增加有益细菌的数量,抑制土壤中病原真菌的繁殖,且有利于维持土壤微生物群落结构的多样性,这些变化有利于连作土壤朝着稳定健康的方向发展,促进连作条件下苹果幼苗生长发育,达到缓解苹果连作障碍的目的。
[1] Weiβ S,Bartsch M,Winkelmann T. Transcriptomic analysis of molecular responses in Malus domestica‘M26’roots affected by apple replant disease. Plant Molecular Biology,2017,94(3):303—318
[2] Mazzola M,Manici L M. Apple replant disease:Role of microbial ecology in cause and control. Annual Review of Phytopathology,2012,50:45—65
[3] Kelderer M M,Manici L,Caputo F,et al. Planting in the‘inter-row’to overcome replant disease in apple orchards:A study on the effectiveness of the practice based on microbial indicators. Plant and Soil,2012,357(1/2):381—393
[4] Tewoldemedhin Y T,Mazzola M,Labuschagne I,et al. A multi-phasic approach reveals that apple replant disease is caused by multiple biological agents,with some agents acting synergistically. Soil Biology and Biochemistry,2011,43(9):1917—1927
[5] Franke-Whittle I H,Manici L M,Insam H,et al.Rhizosphere bacteria and fungi associated with plant growth in soils of three replanted apple orchards. Plant and Soil,2015,395(1/2):317—333
[6] Klose S,Acosta-Martínez A,Ajwa H A. Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides. Soil Biology and Biochemistry,2006,38(6):1243—1254
[7] 刘星,张书乐,刘国锋,等. 土壤生物消毒对甘肃省中部沿黄灌区马铃薯连作障碍的防控效果. 应用生态学报,2015,26(4):1205—1214 Liu X,Zhang S L,Liu G F,et al. Control of continuous potato monoculture barrier via biological soil disinfestation method in Yellow River irrigation areas of central Gansu Province,Northwest China(In Chinese). Chinese Journal of Applied Ecology,2015,26(4):1205—1214
[8] Nicola L,Turco E,Albanese D,et al. Fumigation with dazomet modifies soil microbiota in apple orchards affected by replant disease. Applied Soil Ecology,2017,113:71—79
[9] Smolinska U,Morra M J,Knudsen G R,et al.Isothiocyanates produced by Brassicaceae species as inhibitors ofFusarium oxysporum. Plant Disease,2003,87(4):407—412
[10] 卢志军. 蔬菜根结线虫病生物熏蒸控制作用研究. 北京:中国农业大学,2016 Lu Z J. Control effeciency of biological fumigation against vegetable root-knot nematodes(In Chinese).Beijing:China Agricultural University,2016
[11] 曹坳程,刘晓漫,郭美霞,等. 作物土传病害的危害及防治技术. 植物保护,2017,43(2):6—16 Cao A C,Liu X M,Guo M X,et al. Incidence of soilborne diseases and control measures. (In Chinese)Plant Protection,2017,43(2):6—16
[12] 范志宏,郭春绒,王金胜. 万寿菊根提取物对西瓜枯萎病菌的抑菌活性成分及作用机理研究. 植物病理学报,2010,40(2):195—201 Fan Z H,Guo C R,Wang J S. Active antifungal component of extracts fromTagetes patularoot againstFusarium oxysporumf. sp. niveum and its mechanism(In Chinese). Acta Phytopa Thologica Sinica,2010,40(2):195—201
[13] 秦冲. 万寿菊秸秆制备活性炭及其应用的初步研究. 北京:北京林业大学,2015 Qin C. Preparation and applied research of activated carbon from marigold straw(In Chinese). Beijing:Beijing Forestry University,2015
[14] 关松荫. 土壤酶及其研究法. 北京:农业出版社,1986:274—340 Guan S Y. Soil enzyme and its research methods(In Chinese). Beijing:Agriculture Press,1986:274—340
[15] 程丽娟,薛泉宏. 微生物学实验技术. 西安:世界图书出版公司,2000 Chen L J,Xuan Q H. Microbiology laboratory technology(In Chinese). Xi’an:World Publishing Corporation,2000
[16] 尹承苗,王功帅,李园园,等. 连作苹果园土壤真菌的T-RFLP分析. 生态学报,2014,34(4):837—846 Yin C M,Wang G S,Li Y Y,et al. Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis(In Chinese). Acta Ecologica Sinica,2014,34(4):837—846
[17] 吴涛,冯歌林,曾珍,等. 生物质炭对盆栽黑麦草生长的影响及机理. 土壤学报,2017,54(2):525—534 Wu T,Feng G L,Zeng Z,et al. Effect of biochar addition on ryegrass growth in a pot experiment and its mechanism(In Chinese). Acta Pedologica Sinica,2017,54(2):525—534
[18] 徐文凤. 环渤海湾地区重茬苹果园土壤真菌群落多样性及生防真菌的筛选. 山东泰安:山东农业大学,2011 Xu W F. Diversity analysis of soil fungi from Bohai Bay apple replanted orchard and the screening of the antagonistic fungi(In Chinese). Tai’an,Shandong:Shandong Agricultural University,2011
[19] 王艳芳. 苹果连作土壤中根皮苷含量的年动态及其调控措施研究. 山东泰安:山东农业大学,2015 Wang Y F. Studies on the dynamic changes and regulating measures of phlorizin in replant soil(In Chinese). Tai’an,Shandong:Shandong Agricultural University,2015
[20] 王光飞,马艳,郭德杰. 不同用量秸秆生物炭对辣椒疫病防控效果及土壤性状的影响. 土壤学报,2017,54(1):204—215 Wang G F,Ma Y,Guo D J. Application-rate-dependent effects of straw biochar on control of Phytophthora blight of chilli pepper and soil properties(In Chinese). Acta Pedologica Sinica,2017,54(1):204—215
[21] Mazzola M,Zhao X.Brassica junceaseed meal particle size influences chemistry but not soil biology-based suppression of individual agents inciting apple replant disease. Plant and Soil,2010,337(1):313—324
[22] Arnault I,Fleurance C,Vey F,et al. Use of Alliaceae residues to control soil-borne pathogens. Industrial Crops and Products,2013,49:265—272
[23] 张旭龙,马淼,吴振振,等. 慧油葵与光果甘草间作对根际土壤酶活性及微生物功能多样性的影响. 土壤,2016,48(6):1114—1119 Zhang X L,Ma M,Wu Z Z,et al. Effects ofHelianthus annuusandGlycyrrhiza glabraintercropping on rhizosphere soil enzyme activities and soil microbes functional diversity(In Chinese).Soils,2016,48(6):1114—1119
[24] 谷岩,邱强,王振民,等. 连作大豆根际微生物群落结构及土壤酶活性. 中国农业科学,2012,45(19):3955—3964 Gu Y,Qiu Q,Wang Z M,et al. Effeccts of soybean continuous cropping on microbial and soil enzymes in soybean rhizosphere(In Chinese). Scientia Agricultura Sinica,2012,45(19):3955—3964
[25] 尹承苗,陈学森,沈向,等. 不同浓度有机物料发酵液对连作苹果幼树生物量及土壤环境的影响. 植物营养与肥料学报,2013,19(6):1450—1458 Yin C M,Chen X S,Shen X,et al. Effect of different irrigating concentrations of fermented organic fluid on the young apple tree biomass and the soil properties in replant soil(In Chinese). Journal of Plant Nutrition and Fertilizer,2013,19(6):1450—1458
[26] 王艳芳,付风云,李家家,等. 甲壳素对连作条件下平邑甜茶幼苗生长及土壤环境的影响. 生态学报,2016,36(19):1—8 Wang Y F,Fu F Y,Li J J,et al. Effects of chitin on the growth ofMalus hupehensisRehd. seedlings and soil environment under replant condition(In Chinese).Acta Ecologica Sinica,2016,36(19):1—8
[27] 李鑫,张秀丽,孙冰玉,等. 烤烟连作对耕层土壤酶活性及微生物区系的影响. 土壤,2012,44(3):456—460 Li X,Zhang X L,Sun B Y,et al. Effects of continuous cropping in flue-cured tobacco on soil enzyme activities and microbial flora in arable layers of soils(In Chinese). Soils,2012,44(3):456—460
[28] 张红,吕家珑,曹莹菲,等. 不同植物秸秆腐解特性与土壤微生物功能多样性研究. 土壤学报,2014,51(4):743—752 Zhang H,Lü J L,Cao Y F,et al. Decomposition characteristics of different plant straws and soil microbial functional diversity(In Chinese). Acta Pedologica Sinica,2014,51(4):743—752
[29] 薛超,黄启为,凌宁,等. 连作土壤微生物区系分析、调控及高通量研究方法. 土壤学报,2011,48(3):612—618 Xue C,Huang Q W,Ling N,et al. Analysis,regulation and high-throughput sequencing of soil microflora in mono-cropping system(In Chinese).Acta Pedologica Sinica,2011,48(3):612—618
[30] Lazzeri L,Tacconi R,Palmieri S. In vitro activity of some glucosinolates and their reaction products toward a population of the nematodeHeterodera schachtii.Journal of Agricultural & Food Chemistry,1993,41(5):825—829
[31] Lazzeri L,Manici L M. Allelopathic effect of glucosinolate-contaning plant green manure onPythiumsp. and total fungal population in soil. Hortscience,2001,36(7):1283—1289
[32] 王维华,陈巧,任俊生,等. 一种新的生物熏蒸剂原料—内生真菌Muscodor albus. 江苏农业科学,2012,40(10):19—20,54 Wang W H,Chen Q,Ren J S,et al. A new raw material of biofumigation-Endophytic fungiMuscodor albus(In Chinese). Jiangsu Agricultural Sciences,2012,40(10):19—20,54
[33] Hollister E B,Hu P,Wang A S,et al. Differential impacts of brassicaceous and nonbrassicaceous oilseed meals on soil bacterial and fungal communities. FEMS Microbiology Ecology,2012,83(3):632—641
[34] Hu P,Hollister E B,Somenahally A C,et al. Soil bacterial and fungal communities respond differently to various isothiocyanates added for biofumigation.Frontiers in Microbiology,2015,5:729—738
[35] Weerakoon D M N,Reardon C L,Paulitz T C,et al.Long-term suppression ofPythium abappressoriuminduced byBrassica junceaseed meal amendment is biologically mediated. Soil Biology and Biochemistry,2012,51:44—52
[36] Yim B,Hanschen F S,Wrede A,et al. Effects of biofumigation usingBrassica junceaandRaphanus satiνusin comparison to disinfection using Basamid on apple plant growth and soil microbial communities at three field sites with replant disease. Plant and Soil,2016,406(1/2):389—408
[37] Ascencion L C,Liang W J,Yen T B. Control ofRhizoctonia solanidamping-off disease after soil amendment with dry tissues ofBrassicaresults from increase in Actinomycetes population. Biological Control,2015,82:21—30
