BIOLOG与微量热耦合研究提高红壤微生物代谢活性的碳源因子*
2018-02-28徐江兵王艳玲陈美君林先贵
徐江兵 王艳玲 刘 明 陈美君 林先贵
(1 南京信息工程大学,应用气象学院生态气象环境研究中心,南京 210044)
(2 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
土壤微生物是土壤的重要活性组成部分,它与土壤中营养元素循环、有机物质分解等密切相关。同时,土壤微生物是土壤的敏感指标,可用来表征土壤质量的变化。周围环境、农业管理措施(如施肥、灌溉等)均会对土壤微生物群落活性、结构多样性等产生影响[1-2]。其中,测定土壤微生物活性有很多方法,传统的方法如底物诱导呼吸[3]、酶活性[4]、BIOLOG微平板等[5]。这些方法具有一定的相关性,可从不同角度解释、评价土壤肥力、利用方式和管理措施等对土壤微生物活性的影响。
BIOLOG是20世纪90年代发展起来的一种微平板技术。采用该技术可简单、快速地获知土壤微生物对多种碳源利用能力的差异。例如,采用BIOLOG技术发现添加菇渣肥料可提高土壤微生物对糖类物质的利用能力[6];长期施用有机肥改变了潮土对糖类、氨基酸和羧酸类碳源的利用特征[7]。但BIOLOG方法是一种可培养技术,在实验操作过程中,稀释倍数、培养环境等因素均使样品与原位土壤存在较大差异,进而增加了结果的不确定性[8]。同时有资料[5,8]表明,BIOLOG技术仅能表征土壤中比例较少且代谢较快的微生物活性,无法表征生长缓慢微生物的代谢特征。尽管该技术具有自身的缺点,但不可否认,它对于评价样品对碳源底物利用能力具有优势,借助一些统计分析手段可提供微生物的碳源偏好信息。
恒温微量热技术采用微量热仪灵敏、精确地监控样品的热效应,目前已广泛应用于医药和生化领域[9]。由于热散逸情况与微生物生长代谢过程吻合,因此,近年来它在土壤微生物领域逐渐受到关注[10]。目前,已有很多研究[11-12]采用微量热技术评价了不同重金属、利用方式和管理方式等对土壤微生物热代谢的影响,结果表明,通过微量热法获得的热动力学参数与传统的土壤基质诱导呼吸、土壤微生物生物量、微生物数量、脱氢酶活性等指标密切相关[11,13],可作为微生物活性的重要指标。但需要注意的是,微量热方法主要表征样品的整体活性,其热散逸包含了系统中所有的反应及过程的热量变化,缺乏特异性[14],因此,需要结合一些特异性手段以提供更多生物活性方面的信息。
目前,大部分研究孤立地采用BIOLOG或微量热方法对土壤微生物代谢特征进行研究,鲜有报道涉及两种方法耦合以探索引起土壤微生物代谢变化的原因。由于微量热技术主要通过额外添加碳源及氮源刺激微生物代谢,这与BIOLOG技术具有共性,因此,本文推测,将两种方法耦合可以比较不同碳源的代谢差异,判断样品对不同碳源偏好特征。事实上,本研究的前期工作将这两种方法耦合,研究了潮土(碱性土)及中性偏碱土壤中引起微生物活性变化的关键碳源因子,获得较好的结果[15]。但该方法在酸性土壤中是否适合目前鲜有报道。因此,本研究选取一种典型的酸性土壤——红壤为研究对象,将两种方法耦合研究红壤微生物对碳源的偏好信息。红壤广泛分布我国南方15省(区),总面积218万km2,占我国国土面积1/5,是一种重要的农田土壤[16]。研究影响红壤微生物活性的关键碳源因子,对于该地区的农田管理、政策制定均具有重要的科学意义。
1 材料与方法
1.1 试验区概况
旱地红壤采自于中国科学院鹰潭红壤生态试验站定位试验地(28°15′N,116°55′E)。该地区处于亚热带季风气候区,年平均气温为17.8℃,年均降水量为1 788 mm,年蒸发量1 318 mm,无霜期258 d,成土母质主要为第四纪红黏土,土壤类型为红壤(富铁土),种植的作物为花生(Arachis hypogaea)。定位试验始于2010年,设置三种不同施肥处理:不施肥处理(CK),单施无机肥处理(NPK),有机无机肥配施处理(OM),每处理三个重复。在NPK处理中,氮肥为尿素,磷肥为钙镁磷肥,钾肥为氯化钾,施用量分别为120 kg hm-2(以N计)、170 kg hm-2(以P2O5计)、180 kghm-2(以K2O计)。在OM处理中,腐熟的稻秆堆肥施用量为3 000 kg hm-2,并将N、P、K的施用量调整到与NPK处理一致的水平。所有的磷、钾肥及有机肥均作为基肥一次性施入,氮肥则分成两次施用:基肥40%,追肥60%。
1.2 土壤样品采集
花生收获后,在每个试验小区按S型采集5份表层土壤(0~20 cm)样品,混匀后按四分法取部分土壤装在塑料袋里运至实验室,过2 mm筛置于4℃冷藏。
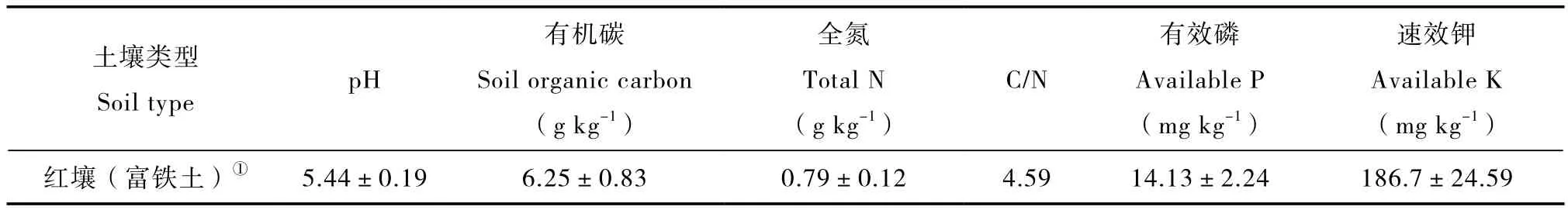
表1 供试土壤基本性质Table 1 Basic properties of the tested soil
1.3 土壤理化性质测定
土壤pH用pH计测定(水土比为2.5∶1)。土壤总有机碳和全氮分别采用重铬酸钾氧化法和凯氏定氮法测定,土壤有效磷采用碳酸氢钠浸提—钼蓝比色法测定,速效钾采用乙酸铵浸提提取—火焰光度法测定,具体步骤参照《土壤农业化学分析方法》[17]。测定结果见表1。
1.4 BIOLOG实验
采用BIOLOG ECO微平板测定红壤的微生物代谢活性,具体方法[18]如下:称取10 g土壤置于90 ml灭菌生理盐水中(0.85%NaCl溶液),以200 r min-1震荡30 min,然后用生理盐水稀释至10-3,采用排孔加样器接种至BIOLOG ECO微平板上,每孔加样150 μl,每板三个重复。在25℃培养箱中培养7 d,每隔12 h在读板仪590 nm下读数。微生物的代谢活性采用每孔颜色平均变化率(Average well color development,AWCD)表示。

式中,ODi为每个孔的吸光值与空白对照孔吸光值之差。
选取微生物对数生长期阶段的AWCD值进行主成分分析(PCA),并选出与主成分相关系数r大于0.5的碳源,该类碳源作为微量热实验中备选碳源。
1.5 微量热实验
采用多通道微量热仪TAM(TA Instrument,Delaware,美国)对土壤样品中微生物热代谢活性进行测定。具体的实验步骤参照文献[9],并略作修改:先将待测样品置于28℃下预培养一天,活化微生物以及恒定样品温度;预培养结束后,取1.2 g土壤样品放入灭菌4 ml玻璃安瓿瓶中,添加0.2 ml含有5.0 mg葡萄糖和5.0 mg硫酸铵的溶液,以刺激和保证微生物生长;安瓿瓶用聚四氟乙烯封口,防止水分挥发和热量丢失,然后将安瓿瓶置于微量热仪中在28℃下培养,土壤微生物代谢活性采用计算机实时监控、记录,待热功率信号平缓后实验停止,获得该样品的功率—时间曲线。
从功率—时间曲线上,可以获得以下参数:功率峰值为最大热功率Pmax,μW;达到最大热功率的时间Tmax,h;整个代谢过程中产生的总热量Q,J g-1;对数生长期的微生物生长速率常数k,h-1。其中,生长速率常数k的计算公式如下:

式中,t为时间;Pt为在时间t时的热功率值,μW;P0为对数生长期时初始的热功率值,μW。
为测定BIOLOG实验中与主成分相关的不同碳源对热代谢的影响,将额外的5.0 mg的碳源加入含有5.0 mg葡萄糖和5.0 mg硫酸铵的溶液中,其余步骤同上。
1.6 数据统计分析
采用Excel 2010和SPSS 18.0软件对数据进行统计分析。采用单因素(one-way ANOVA)和邓肯(Duncan)法进行方差分析和多重比较(p=0.05),利用Origin 8.5软件作图。
2 结 果
2.1 不同施肥处理土壤微生物群落水平生理代谢活性
BIOLOG ECO微平板结果(图1)表明,随着培养时间的延长,AWCD先逐渐上升,而后趋于平缓,整体上呈现与微生物生长相似的特征,即延滞期、对数生长期。施肥引起红壤微生物碳源利用能力变化,其中,OM与其余处理差异达显著水平(p<0.05)。例如,培养84 h时,OM处理AWCD为0.31,显著高于CK、NPK处理的0.19、0.18(p<0.05)。这说明有机无机肥混施能提高红壤微生物的碳源代谢能力,但单施无机肥对AWCD影响不显著。
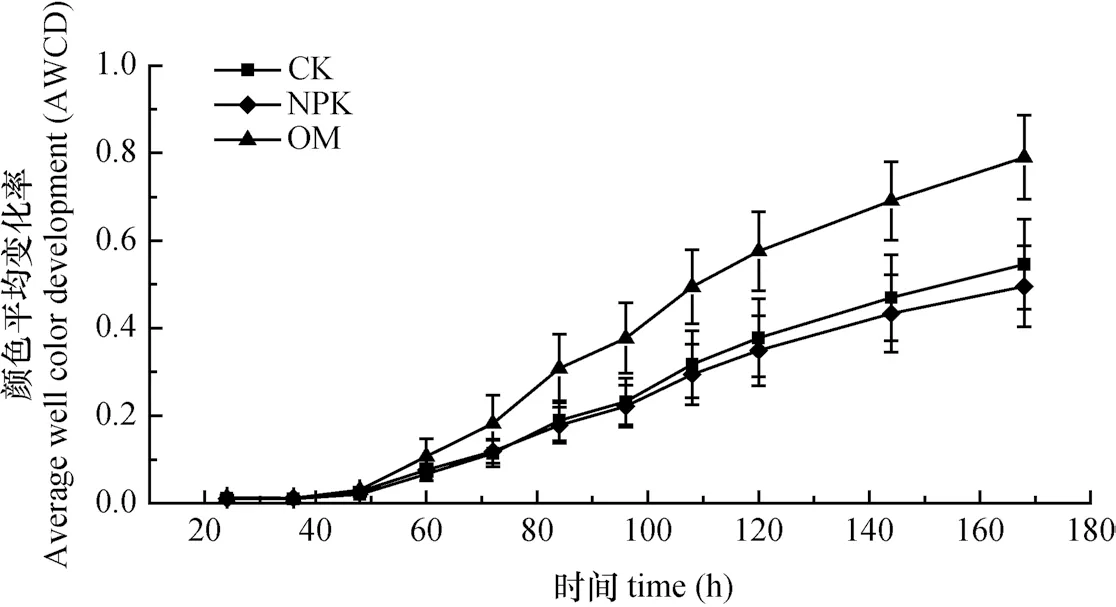
图1 BIOLOG实验中AWCD变化曲线Fig. 1 AWCD curves in BIOLOG assay
选取对数生长期84h的AWCD值进行主成分分析(PCA),结果(图2)表明,主成分1(PC1)、主成分2(PC2)分别解释AWCD的24.6%、19.1%的变异。在PC1、PC2上,不同处理产生明显分异,其中,OM处理处于PC1轴的正端,与CK、NPK处理区分开,说明OM处理中土壤微生物的碳源能力发生改变。在主成分分析中,与PC1密切相关且相关系数r>0.5的碳源列于表2中,碳源包括L-精氨酸、L-苏氨酸、D-甘露醇、糖原和D-纤维二糖,由于这些碳源与PC1相关性较高,推测这些碳源可能是引起土壤微生物群落代谢功能差异的原因。
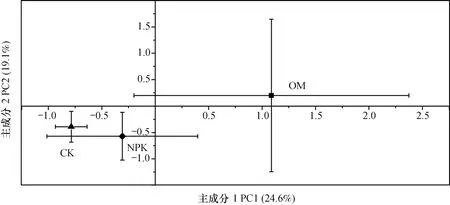
图2 BIOLOG实验中主成分分析图Fig. 2 Plot of principle component analysis(PCA)of carbon source utilization in BIOLOG assay

表2 与主成分1相关的碳源及相关系数(r>0.5)Table 2 Carbon substrates high in Pearson’s correlation coefficient with PC1(r>0.5)
2.2 不同施肥处理红壤热代谢活性
采用微量热法对不同施肥处理中红壤微生物热代谢活性进行研究,获得热功率曲线(图3),并拟合其热动力学参数(表3)。结果表明,热功率曲线存在停滞期、指数生长期及衰亡期。OM处理未显著改变峰值Pmax、生长速率常数k、热量释放量Q(p>0.05),但显著改变了出峰时间Tmax,例如OM处理Tmax为26.07 h,显著低于CK处理的28.78 h及NPK处理的28.04 h(p<0.05),说明OM处理能显著提高红壤热代谢活性。
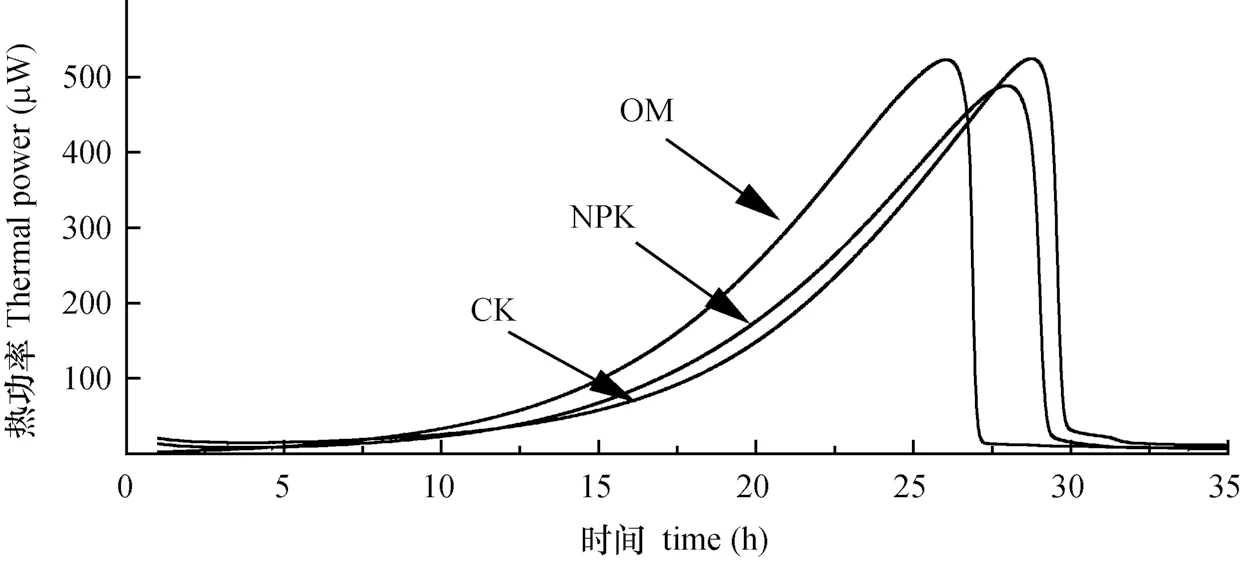
图3 不同施肥处理土壤热功率曲线Fig. 3 Power-time curve of the soil relative to treatment
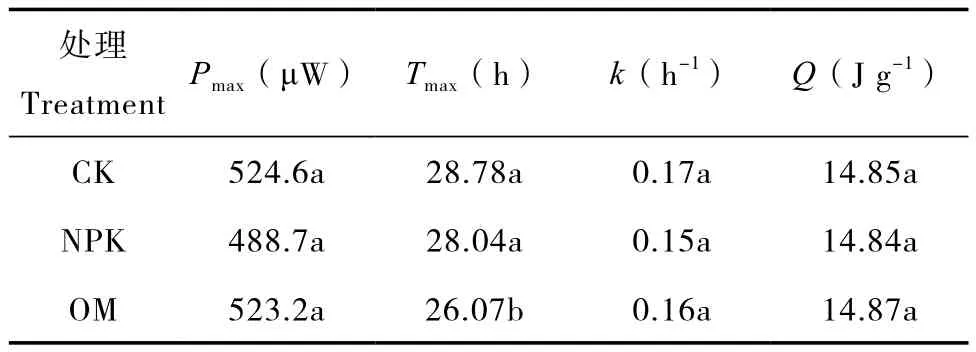
表3 不同施肥处理土壤热动力学参数Table 3 Thermal dynamic parameters of the soil relative to treatment
2.3 添加不同碳源后红壤微生物热代谢活性变化
为探明不同碳源底物对微生物热代谢活性的影响,将BIOLOG实验中与PC1相关性较高的碳源分别加入CK及OM处理的红壤中,测定其对热动力学特征的影响,并甄别BIOLOG结果中的碳源信息。结果(图4和表4)表明,红壤微生物的热功率曲线及热动力学参数因碳源底物而异。从曲线上看,在CK土壤中,添加糖原及L-精氨酸后,热功率曲线变化较大:添加L-精氨酸后,出峰时间Tmax显著缩短,但最大热功率Pmax却降低;添加糖原后,出峰时间Tmax较CK处理短,但较L-精氨酸长;对于最大热功率Pmax,添加糖原后无显著变化。而另外一些碳源底物(如D-纤维二糖、D-甘露醇等)对功率—时间曲线的峰型影响较小,表现为最大热功率Pmax、出峰时间Tmax等参数均与CK处理相近。而对于L-苏氨酸,其对最大热功率Pmax影响较小,与CK差异不显著,但显著延长了出峰时间Tmax,说明它们对微生物热代谢活性可能存在抑制作用。在OM土壤中,添加糖原提高了最大热功率Pmax并降低出峰时间Tmax;尽管添加L-精氨酸降低了最大热功率Pmax,但缩短了出峰时间Tmax;D-纤维二糖、D-甘露醇和L-苏氨酸对最大热功率Pmax无显著影响,但延长了出峰时间Tmax。由此可见,供试红壤对L-精氨酸及糖原响应较为明显,说明该类型红壤偏好此类碳源;而其他与PC1相关性较高的碳源(如D-纤维二糖、D-甘露醇、L-苏氨酸等)未能促进CK及OM处理的热代谢活性,相反,还可能产生抑制效果。

图4 添加不同碳源后土壤热功率曲线Fig. 4 Power-time curves of the soils amended with different C substrates
3 讨 论
施肥是提高作物产量、提升土壤地力的重要途径之一。研究施肥对土壤生态系统的影响,对于探明施肥作用机理、推动农业可持续发展具有积极意义。在土壤生态系统中,微生物是土壤重要组成部分,其代谢活性可用于表征土壤肥力状况[5]。因而,本研究基于长期施肥处理平台,探讨提高土壤微生物代谢活性的碳源因子,可为合理施肥提供理论依据。
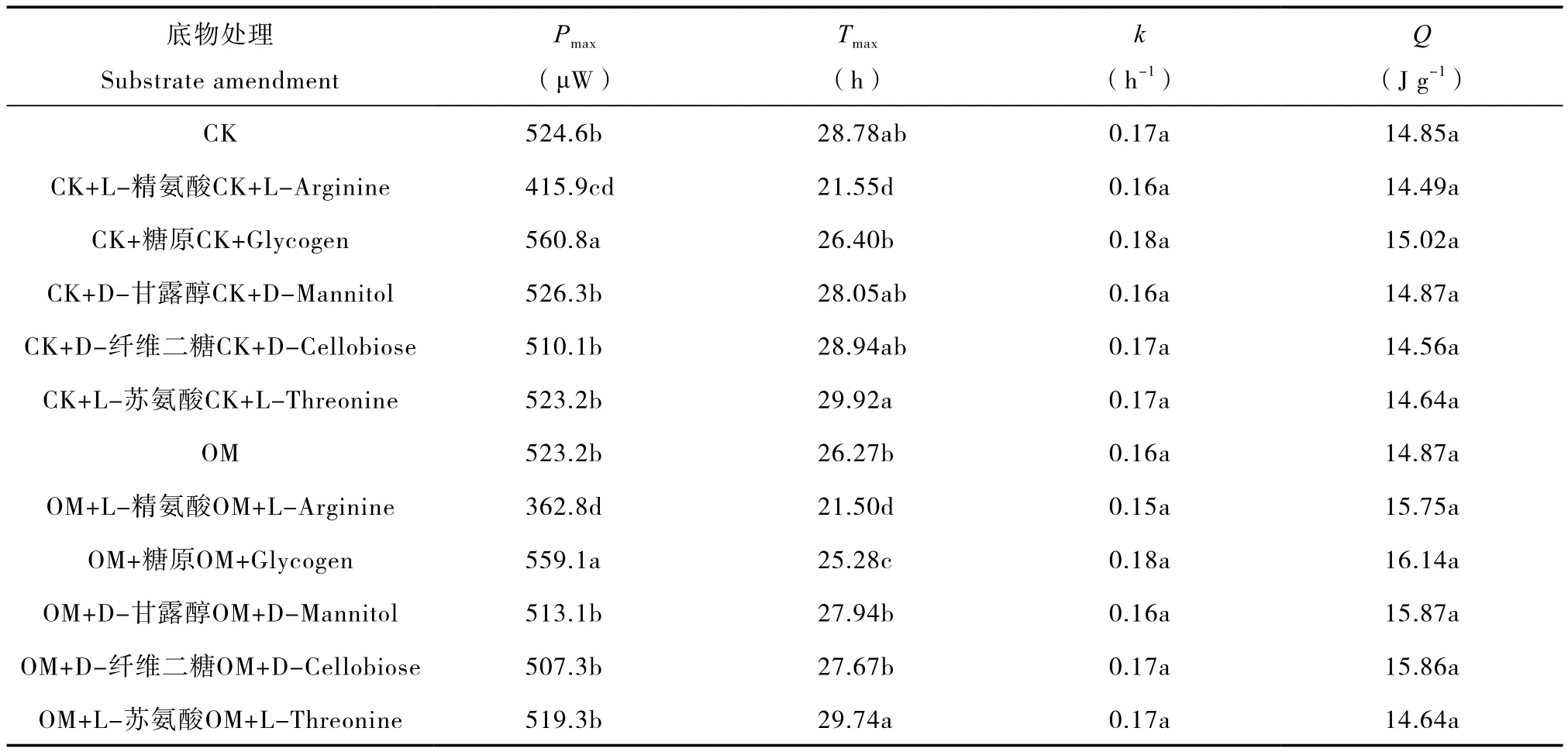
表4 添加不同碳源后土壤热动力学参数Table 4 Thermal dynamic parameters of soils amended with different C substrates
施用有机肥(或有机无机肥配施)是提高土壤养分[19]、增强土壤微生物代谢活性的有效途径之一。有机肥中含有丰富的有机物质,可作为微生物活动的碳源及能源,提高微生物代谢活动。已有研究表明,施用有机肥(或有机无机肥配施)后,土壤呼吸强度、脱氢酶活性[7,20]及土壤碳源底物利用能力[21]显著增强,这与本研究中OM处理显著提高红壤微生物AWCD的结果是一致的。此外,由于微生物活动过程中会产生大量热量,其变化趋势与微生物生长特征类似,因此,可用热动力学特征曲线来表示微生物代谢特征。文献[22]表明,较短的出峰时间Tmax、较高的最大热功率Pmax及较快的生长速率常数k表明土壤的代谢活性较高。由于土壤类型、肥料种类、耕作年限等因素的影响,不同研究中施肥处理对热动力学参数影响存在差异,即会引起Tmax、Pmax及k部分或全部变化,但这些变化均表征了土壤热代谢活性的变化。中国科学院封丘农业生态试验站的长期定位实验研究[15,22]表明,潮土中有机无机肥配施显著降低出峰时间Tmax,提高最大热功率Pmax及生长速率常数k。本研究的红壤中,尽管Pmax及k变化不显著,但Tmax在OM处理中显著降低,说明OM提高红壤微生物代谢活性效果显著。
BIOLOG方法通过测定土壤微生物对不同碳源利用情况表征微生物群落差异,而微量热主要测定土壤微生物的整体活性,因而两种方法在内容涵盖、信息解读上存有差异[15]。与微量热相比,BIOLOG微平板提供的碳源较多,可揭示较多的微生物群落偏好信息;但BIOLOG方法测定的是土壤稀释液中微生物引起的吸光值变化率,这与原位土壤中情况差异较大。相较之下,微量热法对土壤微生物干扰较小,其结果更接近原位土壤环境,它不仅可用于比较不同处理中土壤微生物代谢活性,还可用来甄别碳源偏好信息,但前提是需要以特异性方法(如BIOLOG方法)为先导。以本研究为例,有机无机肥配施提高了红壤碳源代谢能力,使红壤对某些碳源产生偏好(表2),但该结果与实际情况可能存在偏差。事实上,在添加相应碳源的微量热实验中已证实这一点(图4和表4)。例如,D-纤维二糖和D-甘露醇是引起BIOLOG中OM与其余处理分异的碳源因子(表2),但它们却抑制了OM处理中热代谢活性(较长的出峰时间Tmax),这部分说明了BIOLOG的局限性及耦合微量热技术的必要性。
通过微量热技术对BIOLOG中碳源偏好信息进行甄别时发现,无论是CK处理还是OM处理,添加L-精氨酸及糖原均显著改变了红壤的微生物热代谢图谱(图4)。具体而言,添加L-精氨酸在降低CK及OM土壤的峰值Pmax的同时,缩短出峰时间Tmax。这与两方面因素有关:一方面,L-精氨酸中碳(41%)和氮(32%)含量较高,可迅速被微生物利用,促进土壤(尤其酸性土壤)中氮素循环相关的生物化学过程[23-24],提高微生物代谢活性,表现为出峰时间Tmax缩短;另一方面,由于L-精氨酸pH较高(碱性),微量热实验中过量的L-精氨酸可能会改变红壤的性质,对土著微生物产生不利影响,进而表现为添加L-精氨酸后红壤微生物的热代谢图谱峰值Pmax降低。据此,本文推测L-精氨酸可在合适浓度下提高红壤微生物的代谢活性。此外,糖原亦显著缩短了出峰时间Tmax,但对Pmax无显著影响,说明糖原亦能提高红壤代谢活性,其原因可能在于糖原与土壤中磷素循环微生物有关。研究表明,糖原是磷素富集微生物(PAO)好氧合成的细胞内能量贮存物质[25],在缺磷条件下,糖原可作为PAO的碳源及能源物质,提高磷素的供给量[26-27]。在另一种缺磷土壤(潮土)中,也发现添加糖原后,潮土的热代谢图谱与直接添加磷肥的图谱相近[15,22],这从另一个角度说明,糖原可能与提高土壤中磷素周转有关。本研究中,供试红壤属于典型的缺磷土壤[28],因而,糖原可通过促进磷素循环微生物活性而提高热代谢活性。综上,本研究中有机无机肥处理中可能通过有机肥引入一些关键碳源因子(如L-精氨酸及糖原等),促进红壤中氮、磷循环,进而提高红壤代谢活性,但目前其微生物学作用机理尚不明了,需在以后的工作中加强探索。
4 结 论
有机无机肥配施提高了红壤的碳源代谢及热代谢活性。由于BIOLOG的局限性,引起有机无机肥配施处理分异的碳源未对红壤微生物的热代谢活性产生一致的促进作用,某些碳源甚至产生抑制效果。红壤对L-精氨酸及糖原的热代谢响应较为明显,说明这些碳源可能是提高红壤微生物活性的关键碳源因子,施用富含L-精氨酸及糖原的有机肥对提高红壤地力具有积极意义。
[1] Fitter A H,Gilligan C A,Hollingworth K,et al.Biodiversity and ecosystem function in soil. Functional Ecology,2005,19(3):369—377
[2] 林先贵,胡君利. 土壤微生物多样性的科学内涵及其生态服务功能. 土壤学报,2008,45(5):892—900 Lin X G,Hu J L. Scientific connotation and ecological service function of soil microbial diversity(In Chinese). Acta Pedologica Sinica,2008,45(5):892—900
[3] Rousk J,Hill P W,Jones D L. Using the concentrationdependence of respiration arising from glucose addition to estimate in situ concentrations of labile carbon in grassland soil. Soil Biology & Biochemistry,2014,77:81—88
[4] Finkenbein P,Kretschmer K,Kuka K,et al. Soil enzyme activities as bioindicators for substrate quality in revegetation of a subtropical coal mining dump. Soil Biology & Biochemistry,2013,56:87—89
[5] Nannipieri P,Ascher J,Ceccherini M T,et al.Microbial diversity and soil functions. European Journal of Soil Science,2003,54(4):655—670
[6] 徐江兵,林先贵,王一明,等. 施用茶树菇栽培废料对青菜土壤中微生物学特征的影响. 农业环境科学学报,2012,31(1):131—136 Xu J B,Lin X G,Wang Y M,et al. Influence of agrocybe aegerita residue on the characteristics of soil microbe under green vegetables cultivation(In Chinese). Journal of Agro-Environment Science,2012,31(1):131—136
[7] Hu J,Lin X,Wang J,et al. Microbial functional diversity,metabolic quotient,and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer. Journal of Soils and Sediments,2011,11(2):271—280
[8] Gomez E,Garland J L. Effects of tillage and fertilization on physiological profiles of soil microbial communities.Applied Soil Ecology,2012,61:327—332
[9] 冯有智,林先贵. 微量热法在土壤微生物研究中的应用进展. 土壤,2012,44(4):535—540 Feng Y Z,Lin X G. Advances in the application of microcalorimetry in soil microbiology research(In Chinese). Soils,2012,44(4):535—540
[10] Hassan W,Chen W L,Cai P,et al. Estimation of enzymatic,microbial,and chemical properties in brown soil by microcalorimetry. Journal of Thermal Analysis and Calorimetry,2014,116(2):969—988
[11] Braissant O,Wirz D,Gopfert B,et al. Use of isothermal microcalorimetry to monitor microbial activities. FEMS Microbiology Letters,2010,303(1):1—8
[12] Rong XM,Huang QY,Jiang DH,et al. Isothermal microcalorimetry:A review of applications in soil and environmental sciences. Pedosphere,2007,17(2):137—145
[13] Braissant O,Bonkat G,Wirz D,et al. Microbial growth and isothermal microcalorimetry:Growth models and their application to microcalorimetric data.Thermochimica Acta,2013,555:64—71
[14] Wadso I. Isothermal microcalorimetry in applied biology.Thermochimica Acta,2002,394(1/2):305—311
[15] Xu J,Feng Y,Barros N,et al. Exploring the potential of microcalorimetry to study soil microbial metabolic diversity. Journal of Thermal Analysis and Calorimetry,2017,127:1457—1465
[16] 赵其国. 开拓资源优势,创新研发潜力,为我国南方红壤地区社会经济发展作贡献——纪念中国科学院红壤生态实验站建站30周年. 土壤,2015,47(2):197—203 Zhao Q G. Exploiting resource advantage and innovating research and development potential for social and economic development in red soilregion of Southern China——In celebration of the 30th anniversary of the establishment of Ecological Experiment Station of Red Soil,Chineses Academyof Sciences(In Chinese).Soils,2015,47(2):197—203
[17] 鲁如坤. 土壤农业化学分析方法. 北京:中国农业科技出版社,2000 Lu R K. Analytical methods for soil and agro-chemistry(In Chinese). Beijing:China Agricultural Science and Technology Press,2000
[18] Frac M,Oszust K,Lipiec J. Community level physiological profiles(CLPP),characterization and microbial activity of soil amended with dairy sewage sludge. Sensors,2012,12(3):3253—3268
[19] 郑学博,樊剑波,周静,等. 沼液化肥配施对红壤旱地土壤养分和花生产量的影响. 土壤学报,2016,53(3):675—684 Zheng X B,Fan J B,Zhou J,et al. Effects of combined application of biogas slurry and chemical fertilizer on soil nutrients and peanut yield in upland red soil(In Chinese). Acta Pedologica Sinica,2016,53(3):675—684
[20] 李委涛,李忠佩,刘明,等. 红壤水稻土累积酶活性及养分对长期不同施肥处理的响应. 土壤,2016,48(4):686—691 Li W T,Li Z P,Liu M,et al. Activities of extracellular enzymes and nutrients in red paddy soil response to long term fertilizations(In Chinese).Soils,2016,48(4):686—691
[21] Liu B,Gumpertz M L,Hu S,et al. Long-term effects of organic and synthetic soil fertility amendments on soil microbial communities and the development of southern blight. Soil Biology & Biochemistry,2007,39(9):2302—2316
[22] Zheng S,Hu J,Chen K,et al. Soil microbial activity measured by microcalorimetry in response to long-term fertilization regimes and available phosphorous on heat evolution. Soil Biology & Biochemistry,2009,41(10):2094—2099
[23] Singh D K,Kumar S. Nitrate reductase,arginine deaminase,urease and dehydrogenase activities in natural soil(ridges with forest)and in cotton soil after acetamiprid treatments. Chemosphere,2008,71(3):412—418
[24] Wakelin S A,Macdonald L M,Rogers S L,et al.Habitat selective factors influencing the structural composition and functional capacity of microbial communities in agricultural soils. Soil Biology &Biochemistry,2008,40(3):803—813
[25] Seviour R J,Mino T,Onuki M. The microbiology of biological phosphorus removal in activated sludge systems. FEMS Microbiology Reviews,2003,27(1):99—127
[26] Schuler A J,Jenkins D. Enhanced biological phosphorus removal from wastewater by biomass with different phosphorus contents,part I:Experimental results and comparison with metabolic models. Water Environment Research,2003,75(6):485—498
[27] Zhou Y,Yao J,Choi M M,et al. A combination method to study microbial communities and activities in zinc contaminated soil. Journal of Hazardous Materials,2009,169(1/3):875—881
[28] 王经纬,王艳玲,姚怡,等. 长期施肥对旱地红壤团聚体磷素固持与释放能力的影响. 土壤学报,2017,54(5):1240—1250 Wang J W,Wang Y L,Yao Y,et al. Effects of longterm fertilization on phosphorus retention and release of soil aggregates in upland red soils(In Chinese). Acta Pedologica Sinica,2017,54(5):1240—1250
