无定型氧化铁对土壤中阿特拉津吸附-解吸的影响*
2018-02-28黄玉芬刘忠珍李衍亮黄连喜许桂芝
黄玉芬 刘忠珍 魏 岚 李衍亮 黄连喜 黄 庆 许桂芝
(广东省农业科学院农业资源与环境研究所,农业部南方植物营养与肥料重点实验室,广东省农业资源循环利用与耕地保育重点实验室,广州 510640)
阿特拉津(AT)是一种世界范围内长期大面积使用的均三氮苯类除草剂农药。由于其具有较强的滞留性和蓄积性,尽管近年来被欧盟等部分国家严格控制或完全禁用,但其仍是重要的环境污染物之一[1-2]。AT进入土壤后将经历一系列过程,如被土壤吸附-解吸、降解、挥发、扩散、作物吸收、通过地表径流和淋溶作用进入地表水和地下水系统等,其中,吸附-解吸是控制AT在环境中迁移转化、归趋和生物有效性的关键因素,直接影响AT污染的防治和修复效率[3]。
土壤有机质是影响有机污染物在土壤中吸附-解吸的主要因素,但当土壤有机质含量较少或有机污染物本身带有极性功能团时,土壤无机矿物对有机污染物吸附的影响几乎相当于甚至超过有机质的作用[4-5]。目前,关于土壤无机矿物对AT吸附-解吸行为的研究主要集中在蒙脱土和高岭石等结晶硅酸盐黏土矿物上,而对于铁氧化物等土壤金属氧化物方面的研究较少。铁氧化物广泛存在于土壤中(尤其是热带和亚热带土壤),虽然其在土壤中所占比例较小,但其对环境污染物的吸持、迁移等行为均具有极其重要的影响[6-7]。无定型氧化铁(AHOs Fe)是土壤中活性较高的铁氧化物,由于具有较大的比表面积和较多的供质子官能团,其在重金属和有机污染物的治理和环境修复研究方面倍受人们关注。然而,AHOs Fe在自然条件下极不稳定,容易转化为针铁矿和赤铁矿等晶质铁氧化物,从而为研究AHOs Fe对污染物的吸附特性增加困难。此外,我们前期的研究表明[8],土壤对丁草胺的吸附能力与土壤中AHOs Fe含量呈极显著正相关,由于土壤中的AHOs Fe常与有机质复合形成有机-无机复合体[9-10],因此,单纯通过相关分析并不能准确判断有机质和AHOs Fe对有机污染物吸附贡献的大小,而AHOs Fe对有机污染物的吸附机理目前也尚不明确。
鉴于此,本研究采用人工合成的AHOs Fe,以及AHOs Fe包被的典型土壤(黑龙江黑土和广东砖红壤)为材料,采用批量平衡法研究AT在各吸附剂中的吸附-解吸行为,从而揭示AHOs Fe对土壤中AT吸附行为的影响,并进一步探讨AHOs Fe对AT的吸附作用机理。本研究结果有助于深入了解铁氧化物与AT的界面作用,为全面剖析土壤理化性质对AT在土壤中迁移转化规律提供一定的理论基础,并为避免AT的环境风险提供科学依据。
1 材料与方法
1.1 试剂与仪器
AT标准品,纯度≥99.5%,购自国家标准物质标准样品信息中心,AT的基本理化性质如表1所示;乙腈和甲醇(色谱纯);氯化钾(优级纯);叠氮化钠(分析纯);水(Milli-Q超纯水)。主要仪器包括恒温摇床(TS-200B,上海天呈实验仪器制造有限公司)、表面积分析仪(NOVA BET,美国Quantachrome corporation)、X射线衍射仪(D8 ADVANCE,德国Bruker)、场发射扫描电子显微镜(S-4800,日本Hitachi)和高效液相色谱仪(2695型,美国Waters)等。
1.2 供试材料制备及其性质测定
两种供试土壤分别采自我国的黑龙江省(黑土)和广东省(砖红壤),采样深度为0~20 cm。采集的土壤风干后,研磨,过2 mm和 0.25 mm筛备用。AHOs Fe和AHOs Fe包被土壤的制备采用Huang等[11]报道的方法:
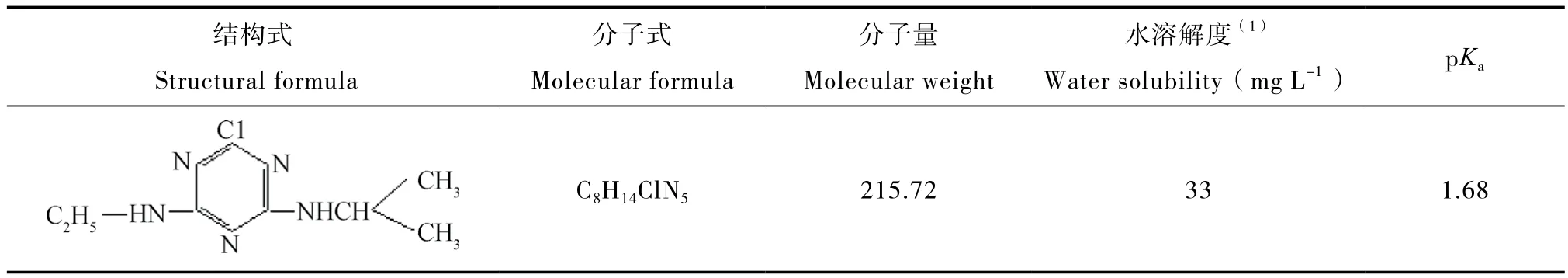
表1 阿特拉津的基本理化性质Table 1 Physico-chemical properties of atrazine
AHOs Fe的制备:用0.1 mol L-1Fe(Cl)3溶液加13 %的氨水至pH为5.0生成沉淀,沉淀用水/甲醇(50/50,V/V)溶液反复清洗至AgNO3检验无Cl-为止。冷冻干燥,过100目筛备用。制备的AHOs Fe经X射线衍射和场发射扫描电子显微镜扫描分析,结果如图1所示。
AHOs Fe包被土壤的制备:两种土壤各取10 g于烧杯中,分别加入300 ml蒸馏水混匀,再加入2 ml 20 %的FeCl3·6H2O溶液,水浴煮沸10 min后离心分离,弃去上清液,再用水/甲醇(50/50,V/V)溶液反复清洗至AgNO3检验无Cl-为止。冷冻干燥,过60目筛备用。同时,另取等量的两种土壤,同样加入300 ml水,在水浴上煮沸10 min,离心分离,弃去上清液后冷冻干燥,过60目筛备用。
各吸附剂的基本理化性质测定方法如下:pH采用1:2.5土-水比测定;总有机碳(TOC)采用常规分析方法测定;比表面积(SSA)采用表面积分析仪测定;游离氧化铁(Fed)和无定型氧化铁(Feo)分别采用DCB和草酸铵法测定[12]。检测结果如表2所示。
1.3 吸附-解吸试验
以0.02 mol L-1KCl溶液为支持电解质溶液(含0.02 %的NaN3作为抑菌剂),并调节电解质溶液的pH至7;配制含AT分别为0.5、1、2、4、8、16、32 mg L-1的标准系列溶液;称0.3~0.5 g(过0.25 mm筛)于25 ml棕色玻璃离心管中,分别加入1.5 ml上述AT标准系列溶液。25±2 ℃恒温振荡48 h(预实验表明,48 h已基本达到表观吸附平衡),10 000 rpm离心分离20 min,采用高效液相色谱仪(HPLC)测定上清液中AT的质量浓度(Ce)。每组设置2个平行,同时做空白试验进行准确度控制。吸附实验结束时,测定其平衡液pH,结果如表3所示。
解吸试验于吸附试验的基础上进行,采用吸附-解吸单循环方法开展研究。弃去吸附平衡上清液(用称重法扣除残留量),加入空白电解质溶液,于吸附试验同样条件下振荡解吸48 h后离心20 min,取上清液进行HPLC测定分析。
HPLC测定条件为:Waters 2489紫外可见光可变波长检测器和色谱工作站;色谱柱:Waters SunFireTMC18,5 μm,4.6×250 mm;保护预柱:SunFireTMC18,5 μm,3.0×20 mm;流动相:乙腈∶水=60:40(V∶V),流动相流速:1 ml min-1,柱温:30 ℃,检测波长:221 nm,进样量:10 μl。前期预实验表明该检测方法的加标回收率为93%~103%,相对标准偏差为1.5%~3.5%。
1.4 数据分析
AT吸附量采用以下方程计算:

式中,Qe为反应达到表观平衡后土壤对AT的吸附量(mg kg-1),Co为溶液中AT的初始浓度(mg L-1),Ce为达到表观吸附平衡时溶液中AT的浓度(mg L-1),V为溶液体积(ml),m为风干土换算为烘干土的质量(g)。
所有吸附实验数据均采用Frundlich吸附模型进行描述:
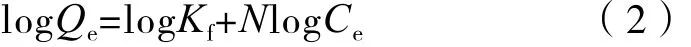
式中,Kf为Freundlich常数,表示吸附作用强度[(mg kg-1)/(mg L-1)n];N为Freundlich指数,表征吸附等温线的非线性程度(无量纲);Qe和Ce的注释同式(1)。
AT在固-液两相中的分配系数(Kd,L kg-1)、有机碳标准化分配系数(Koc,L kg-1)和比表面积标准化分配系数(KSSA,ml m-2)分别采用下列方程计算:


式中,Qe和Ce的注释同式(1),foc为供试样品的有机碳含量(g kg-1),SSA为供试样品的比表面积(m2g-1)。
AT的解吸迟滞系数(Hysteresisi index,HI)采用Huang等[13]的方法进行量化:

式中,分别指在解吸和吸附过程中AT在各种吸附剂上的浓度(mg kg-1);下脚标T(℃)和Ce(mg L-1)分别为各实验条件下,温度以及达到表观吸附或解吸平衡时所对应的液相中AT的浓度。
2 结 果
2.1 供试吸附剂的表征与理化性质
由图1可知,所制备AHOs Fe的XRD谱线显示其在2θ分别为35.1o和62.4o时出现弱的宽峰,与标准衍射卡片对照表明其为2L型水合氧化铁,而场发射扫描电子显微镜扫描结果发现,其矿物表面无固定形态,呈现不规则纳米颗粒状,这与Cornell和Schwertmannt[14]所定义的无定型氧化物相符。
各吸附剂的基本理化性质如表2所示,由表2可知,AHOs Fe包被黑土和砖红壤,两种土壤的pH分别降低了1.56和0.09个pH单位,TOC含量分别降低了8.08%和7.65%,而CEC含量则分别增加了8.53%和20.19%。AHOs Fe的SSA显著高于其它吸附剂,AHOs Fe包被黑土和砖红壤,黑土的SSA降低了19.30%,砖红壤的SSA却略有增大;而两种土壤的Feo分别增加了1.35倍和1.81倍,氧化铁的活化度(Feo/ Fed)则分别降低8.7 %和 52.6 %。
2.2 阿特拉津的等温吸附曲线及方程模型
供试吸附剂对AT的等温吸附曲线如图2所示,由图2可知,各吸附剂对AT的吸附量均随平衡浓度的增加而增加,在实验浓度范围内,AT在各吸附剂固相上的吸附量均未达到饱和状态。采用Freundlich方程模型对AT在不同吸附剂中的吸附进行拟合,拟合参数值如表3所示。由表3可知,Freundlich方程能较好地拟合各吸附剂对AT的吸附作用(r≥ 0.996,p< 0.01)。AHOs Fe包被后黑土和砖红壤的Freundlich拟合参数Kf值分别增加了95.4%和91.9%,然而,由于各吸附剂对AT的吸附均呈现不同程度的非线性(N<1),可见,单纯地分析Kf值并不能真实地反映各吸附剂对AT的吸附能力[15]。AHOs Fe对AT的非线性吸附最强(N=0.697),经AHOs Fe包被的黑土和砖红壤其吸附非线性程度增加(表3)。
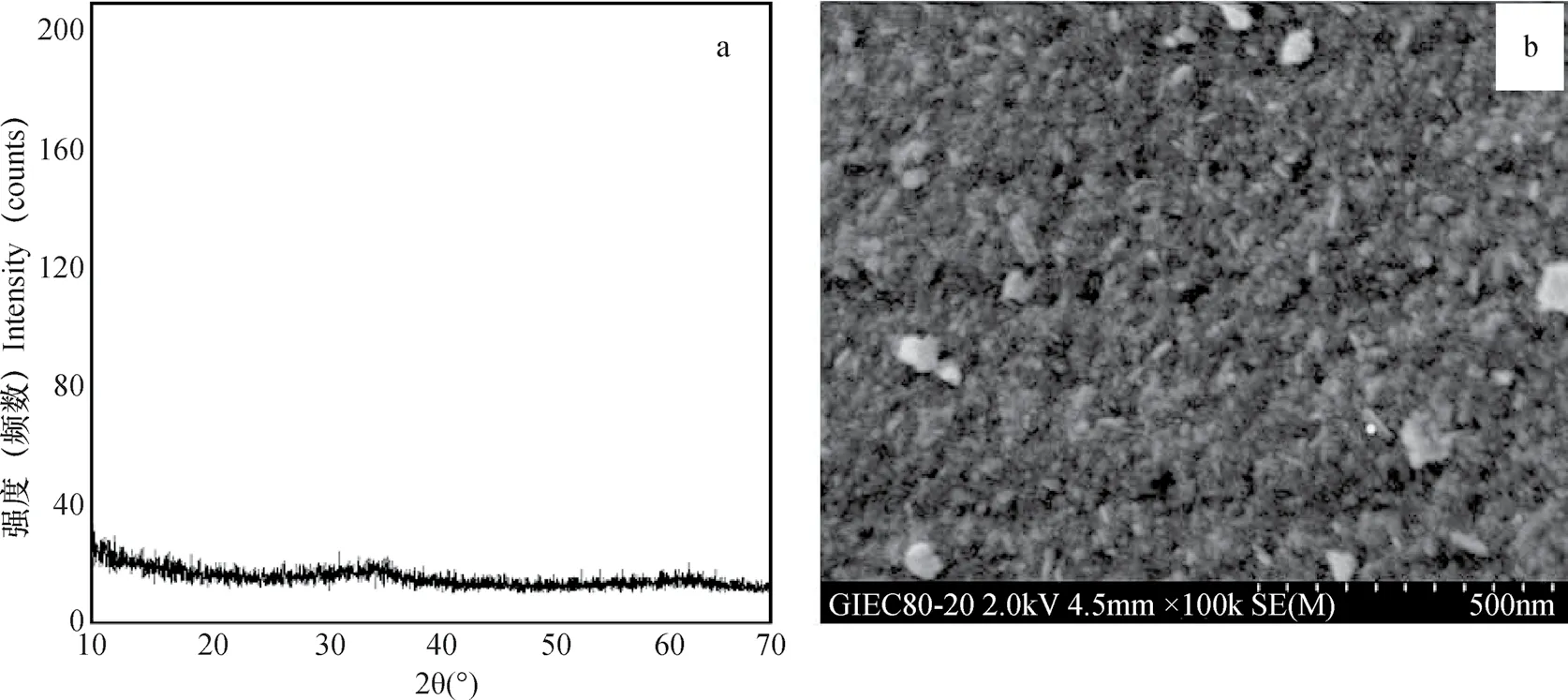
图1 无定型氧化铁的XRD谱图(a)和透射电子显微镜扫描图(b)Fig. 1 XRD(X-ray diffractogram)pattern(a)and TEM(transmission electron microscopy)image(b)of the artificially synthesized amorphous hydrated Fe oxides
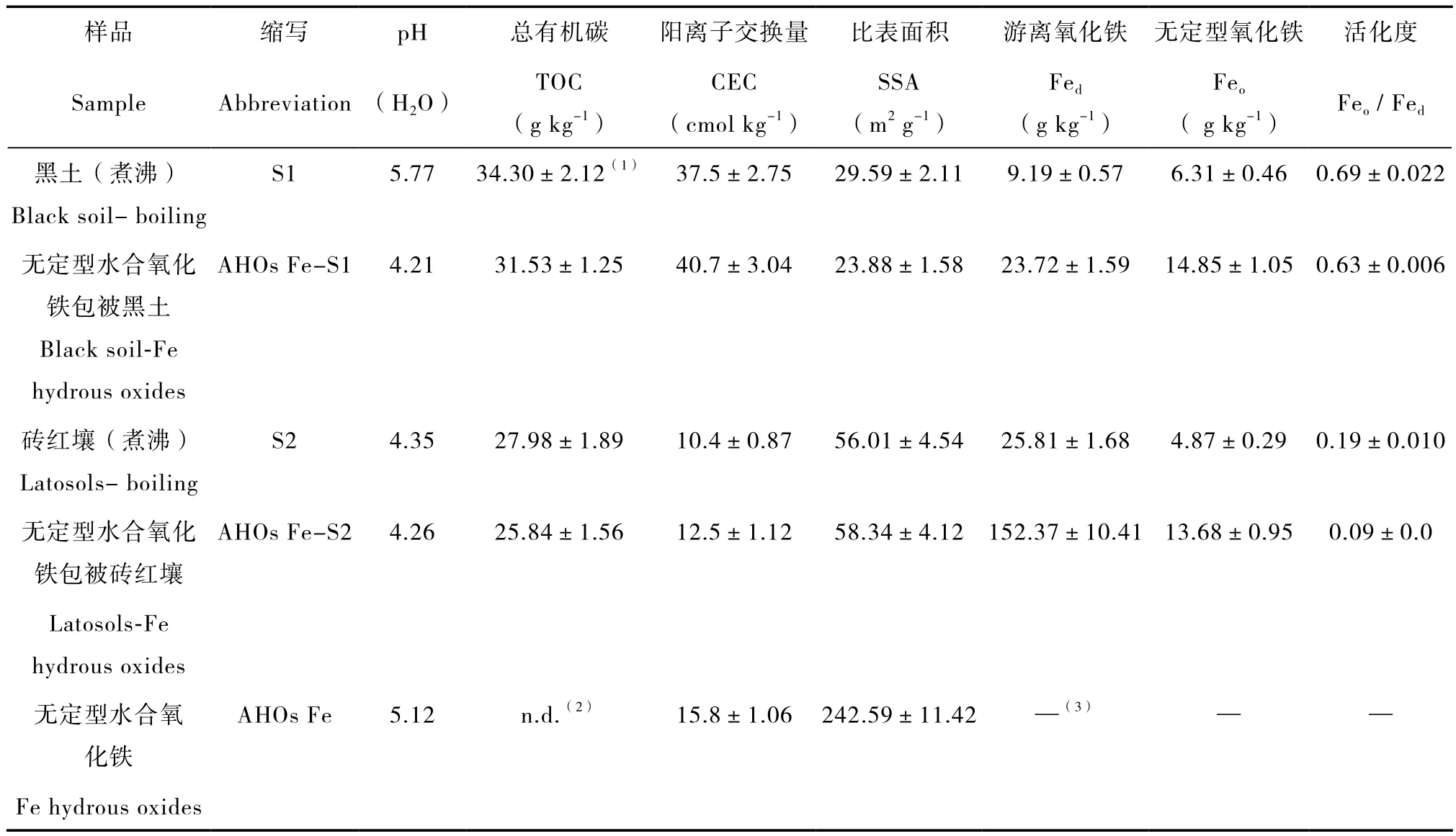
表2 供试吸附剂的基本理化性质Table 2 Basic physic-chemical properties of the sorbents tested
2.3 阿特拉津在不同固-液体系中的分配系数
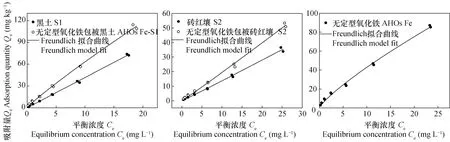
图2 供试吸附剂对阿特拉津的吸附等温图Fig. 2 Sorption isotherms of atrazine on the tested sorbents

表3 供试吸附剂吸附阿特拉津后平衡液的pH、Freundlich方程拟合参数和分配系数Table 3 pH,Freundlich parameters and partition coefficient of the solutions at equilibrium after AT adsorption by the adsorbents tested
不同体系和平衡浓度下,AT在固-液两相中的分配系数Kd值如图3所示。由图3可知,黑土和砖红壤的固-液体系中,Kd均随平衡浓度的增加而逐渐降低,当平衡浓度为2.5 mg L-1时Kd趋于近似恒定。AHOs Fe包被后的黑土和砖红壤,其Kd降低的趋势比较明显,达到恒定状态的平衡液中AT浓度水平稍有增加。AHOs Fe的固-液体系中,Kd随平衡浓度的增加迅速降低,但下降程度逐渐减缓,当平衡浓度为5 mg L-1时Kd达到基本恒定。可见,各吸附剂对AT的吸附在低平衡浓度时表现为非线性吸附,而到达一定浓度后则表现为线性吸附。Chiou等[16]研究表明,线性吸附可采用分配系数Kd来比较各吸附剂对污染物的吸附能力,为此,本文计算了在近似恒定平衡浓度点的Kd平均值(表3)。由表3可知,各吸附剂对AT的吸附分配系数Kd值大小顺序为:AHOs Fe-S1> S1> AHOs Fe>AHOs Fe-S2> S2。AHOs Fe包被黑土和砖红壤,其Kd值分别增加了56.3 %和43.8 %。
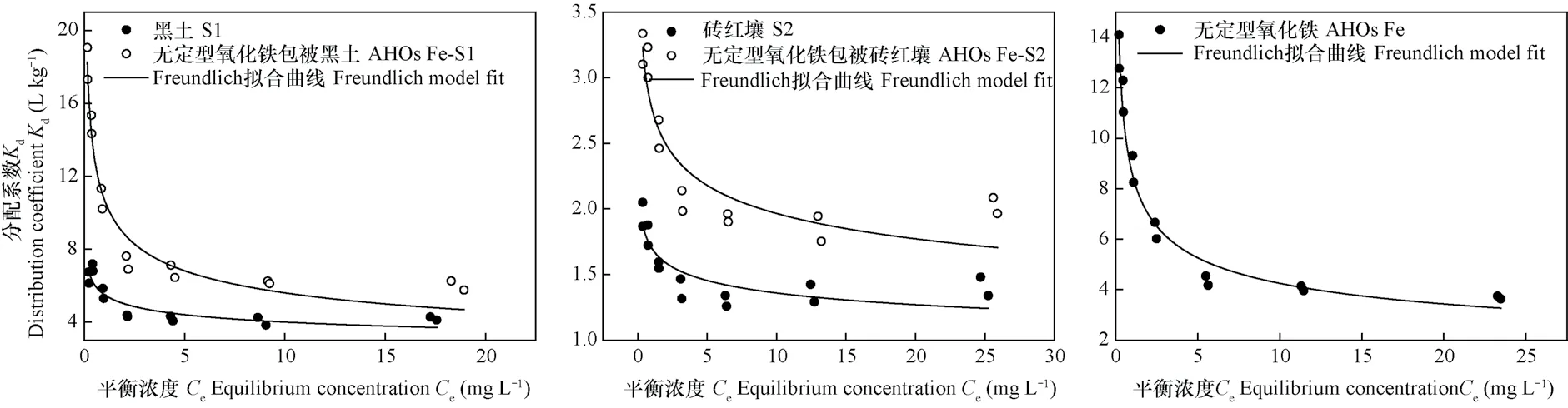
图3 阿特拉津在供试吸附剂/水平衡体系中的分配系数(Kd)Fig. 3 Equilibrium concentration(Ce)vs. distribution coefficients(Kd)for atrazine sorption by the tested sorbents
有机碳标准化分配系数(Koc)和比表面积标准化分配系数(KSSA)分别指达到吸附平衡时有机污染物被吸附剂中有机碳相吸着的浓度及吸附剂表面吸着的浓度与其水相浓度之比,这两个系数常用来表征有机污染物的被吸着性能,是评价有机污染物环境行为的重要参数[17-18]。本文对各吸附剂近似平衡浓度点的Koc平均值进行计算,结果如表3所示。由表3可知,各吸附剂Koc与Kd值的大小顺序基本一致,KSSA的大小顺序则为AHOs Fe-S1> S1>AHOs Fe-S2> S2>AHOs Fe。AHOs Fe包被黑土和砖红壤,其Koc值分别增加了70.1%和55.7%,KSSA值则分别增加了93.0%和41.7%。
2.4 阿特拉津的解吸迟滞效应
吸附-解吸是AT在固相吸附剂中的一个重要转化过程,其中,解吸过程较吸附过程要难得多,并不是被吸附物质均可以被解吸,即反应并不完全可逆,称为“解吸迟滞效应”。本研究采用Huang等[13]所定义的滞后系数(HI)对这种迟滞效应进行量化,从而深入了解供试吸附剂对AT吸附解吸过程中出现的滞后程度(图4)。当HI>0时,表明存在迟滞效应;当HI≤ 0时,表明吸附完全可逆。由图4可知,各吸附剂对AT均存在解吸迟滞效应,黑土对AT的解吸迟滞效应明显低于砖红壤,两种供试土壤及AHOs Fe包被后,在低浓度范围内,迟滞效应(HI)随AT初始浓度(Ci)的增加而降低,而高浓度范围内,迟滞效应则随Ci的增加而略有增强。AHOs Fe对AT的迟滞效应随Ci的增加而逐渐增强,但AHOs Fe包被后的黑土和砖红壤,其迟滞效应却显著降低,其平均HI值分别降低了46.4%和56.0%。
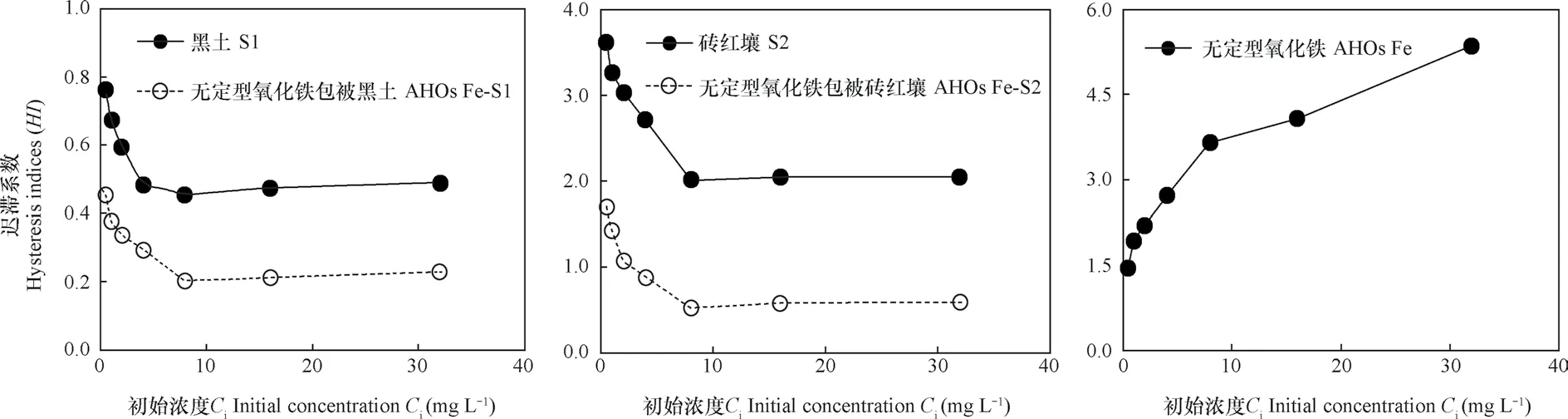
图4 供试吸附剂在不同初始浓度时对阿特拉津的解吸迟滞系数(HI)Fig. 4 Hysteresis index(HI)of atrazine desorption from the tested sorbents relative to initial concentration
3 讨 论
3.1 无定型氧化铁对阿特拉津的吸附作用机制
众多研究表明,Freundlich模型指数N值大小决定了吸附等温线的形状,当N< 1时,吸附等温线呈L型,当N>1时,吸附等温线呈S型,而当N=1时,Freundlich模型可以简化为Linear模型[19]。也有研究证明,当N值越偏离1,其吸附非线性程度越大[20]。本研究结果表明,各吸附剂对AT的吸附等温线均呈L型(N<1)(图2、图3和表3)。这种吸附特征曲线表明:在低平衡浓度下,AT与各吸附剂间存在较高的亲和力,产生较多的吸附,吸附呈非线性;而随着平衡浓度的增大,由于吸附剂中吸附位点逐渐被AT占据而减少,AT在其上的吸附作用也逐渐趋于恒定,吸附呈线性[19,21]。引起低浓度下非线性吸附的原因主要有两个:第一,土壤有机质可能存在一些油页岩、硬煤、干酪根和碳黑等不同于普通腐殖质的含碳物质,这些物质对有机污染物的吸附作用主要是嵌入吸附机制。第二,土壤中的黏土矿物或金属氧化物对有机污染物的表面吸附作用[22]。由表2可知,本研究中AHOs Fe不含碳物质,表明AHOs Fe对AT的吸附非线性,是由于AHOs Fe对AT的表面吸附作用。
铁/铝等金属氧化物的表面吸附作用过程对现代环境污染物(重金属和有机污染物)地球化学循环起着重要的控制作用。表面吸附作用主要是指通过范德华力和氢键等分子间作用力,有机污染物与吸附剂吸附位点作用,进而附着在吸附剂表面,其吸附机理主要是靠金属氧化物和被吸附的物质形成配位络合物或静电吸引作用进行[23-24]。如周敏等[25]研究表明,非晶态的含水氧化铁/铝能有效地吸附恩诺沙星,且吸附表现为以配位反应为主的表面吸附。顾维等[26]研究表明,诺氟沙星(NOR)在针铁矿上的吸附主要是通过离子和配位基交换,同时也可能存在着偶极间作用力和氢键力等吸附机理。Rivoira 等[24]的研究表明铁氧化物与介孔二氧化硅复合材料对草甘磷的表面吸附主要是通过络合反应及阴离子交换作用。由于AHOs Fe对环境中有机污染物具有较强的表面吸附能力,且其吸附反应受pH影响较大。在不同pH条件下,AHOs Fe在水溶液中通过质子化会形成不同功能团的形式存在于水中:当pH<4时,AHOs Fe以FeOH2+官能团的形式存在于水中;当pH为4~9时,AHOs Fe以FeOH官能团的形式存在于水中;当pH>9时,AHOs Fe以FeO官能团的形式存在于水中。由表3可知,本研究中吸附平衡后固-液体系pH均在4~7之间,即固-液体系中AHOs Fe主要以FeOH官能团形式存在,而AT是一种弱碱性有机物,结构中含有的N环和烷基可产生部分自由电子(表1),这些自由电子可与Fe-OH基团进行氢键络合作用[27]。
然而,铁氧化物在土壤或沉积物中很难单独存在,常与有机质通过物理吸附、配位基交换、质子作用、氢键和阳离子桥等方式结合形成铁氧化物-有机质复合物,从而显著改变铁氧化物对污染物的吸持固定特性[9,28]。如梁妮等[9]通过研究溶解性有机质(DOM)与氧化铁复合形成的有机-无机复合体及其对菲(PHE)的吸附特征,结果表明,DOM芳香性组分优先吸附在氧化铁矿物表面,复合在氧化铁表面的有机质对PHE的吸附占主导作用,而氧化铁对PHE的吸附贡献很小。郭学涛[28]的研究表明,针铁矿具有较大的比表面积和表面能,表面有大量的活性官能团,可通过化学键合作用吸附腐殖酸,针铁矿负载腐殖酸后,其对典型抗生素泰乐菌素(TYL)和磺胺二甲基嘧啶(SMT)的吸附能力显著增强,且吸附随着负载腐殖酸的针铁矿中腐殖酸浓度的增加而逐渐增加。此外,铁氧化物-有机质复合物的形成还是有机质在土壤中稳定化的一种重要途径,有机质通过与无定型铁氧化物形成复合物还能抑制其向结晶态的转变,溶解性有机质量增加,从而增强其对污染物的吸附。如林怡英等[29]发现土壤有机质含量与Fed含量的相关性小,而与Feo含量有较大的相关性,推测土壤中有机质稳定化与Feo有着重要关系。Lenone等[10]研究腐殖酸-水铁矿复合物对咪唑啉酮类除草剂吸附时发现,随着复合物中腐殖酸含量的增加,其疏水性增强,进而增加其与除草剂的亲和力,促进其对除草剂的吸附。本研究中,AHOs Fe包被土壤后,显著增加了两种土壤对AT吸附的Kd、Koc和KSSA值,且Feo含量与其KSSA间无显著正相关关系(r=0.475,p>0.05),而Kd值和Koc值间呈显著正相关关系(r=0.993,p<0.01)(表2和表3)。由此表明,AHOs Fe包被土壤后,除AHOs Fe对AT的表面吸附作用外,土壤中部分有机质通过吸附在具有大比表面积的AHOs Fe表面,这些有机质可以更好地发挥其对AT的吸附作用;此外,AHOs Fe的表面羟基还可以与有机质的COO-发生络合,增加有机质在复合物中的溶解度,从而增强其对AT的吸附性能[9-10]。
3.2 无定型氧化铁对阿特拉津的解吸迟滞效应
目前,关于引起有机污染物在吸附剂中解吸迟滞效应的作用机制主要有以下几个方面:1)化学键形成或在特定吸附点位的不可逆结合;2)慢解吸速率;3)吸附质被吸附剂分子捕获,如被无机组分的中孔隙、微孔隙或有机质捕获等;4)结构或空隙变形机制[30-31]。如Laird等[30]的研究表明,AT与土壤中的黏土矿物间的化学键合作用是引起AT在土壤中解吸迟滞效应的主要因素。Weber等[31]研究表明,吸附质不可逆地吸附在矿物的特殊位点上,并且由于矿物的表面存在微孔导致慢解吸速率,从而引起解吸滞后。Xia和Pignatello[32]的研究表明,高浓度范围时,土壤微孔或结构变形程度增加,引起土壤对丁草胺的解吸迟滞效应增强。本研究中不同平衡浓度时土壤对AT的解吸迟滞效应不同(图4)。在低浓度时,随浓度升高,AT在固-液两相中的分配比例逐渐降低(图3),土壤中AHOs Fe表面有机质的分配吸附贡献较大,AT先占据高能吸附位点,随着吸附量的增加,高能点位越来越少,低能点位吸附的AT比例越来越大,故越容易被解吸,即迟滞效应逐渐降低(HI变小);而在高浓度范围内,固液两相中溶质的浓度梯度较大,促使较多的溶质分子进入有机-无机复合体中的有机质矩阵或空隙的内部,进入有机质微孔领域的溶质分子可以和有机质(SOM)形成氢键,从而使迟滞效应略有增强。黑土的吸附能力大于砖红壤,但其对AT的解吸迟滞效应却明显弱于砖红壤(表3,图4),可见,在AT土壤环境风险评价时,不但要考虑土壤的吸附能力,还需考虑所吸附AT的可解吸程度。
AHOs Fe对AT的解吸迟滞系数(HI)明显大于两种土壤(图4),这进一步证明了AHOs Fe表面高吸附位点对AT的表面吸附机制。如He等[33]的研究表明,当黏土矿物和金属氧化铁的微孔未被SOM堵塞时,AHOs Fe有更多的吸附表面暴露,可以减少丁草胺被解吸释放出来。本研究中所提取纯化的AHOs Fe不含有机质,不具有表面疏水分配作用,其对AT的吸附主要是AHOs Fe的Fe-OH基与AT分子形成较稳定的氢键络合作用,从而使AT不容易被解吸出来;而对于黑土和砖红壤,由其吸附非竞争性和较强可逆性可见其除了矿物的表面吸附作用外,还具有由SOM引起的线性分配吸附作用。此外,由图4还可知,AHOs Fe对AT的解吸迟滞系数(HI)随初始浓度的增加而增大。这与Nennenmann等[34]的研究结果一致,他们通过运用电子显微镜研究了异丙甲草胺在黏土矿物上的吸附,结果表明,低浓度时,异丙甲草胺-黏土矿物聚合物为链状结构,而高吸附量时,异丙甲草胺-黏土矿物聚合物变为球状结构,迟滞效应随之增加。Chefetz等[35]的研究也表明,高吸附量时,吸附质与黏土矿物发生聚合作用,迟滞效应增加。本研究中,高吸附量时AT与AHOs Fe发生聚合反应,微孔变形作用增强,有更多的AT分子和Fe-OH发生氢键作用,因此,随着AT浓度的升高,迟滞效应增强。
AHOs Fe的解吸迟滞效应显著强于其他土壤,由此推测AHOs Fe包被土壤可增强土壤对AT的解吸迟滞效应,然而,AHOs Fe包被土壤却降低了土壤对AT的解吸迟滞效应(图4),说明AHOs Fe与土壤中SOM复合后,降低了土壤对AT的固持作用。这可能是由于AHOs Fe包被土壤后,吸附主要是通过AHOs Fe吸附土壤中有机质或增加有机质的溶解度,从而间接影响复合物对AT的吸附,其对AT的吸附主要是疏水性作用主导的线性分配,因此导致解吸迟滞效应减弱。
4 结 论
通过纯矿物和土壤两个途径来研究AHOs Fe对土壤中AT吸附-解吸的影响程度。与土壤相比,AHOs Fe对AT具有较大的吸附性能和较高的吸附非线性,以及较强的解吸迟滞效应,且迟滞效应随AT浓度的升高而增强。然而,在土壤中,AHOs Fe主要是在其表面吸附更多的有机质,或通过与有机质发生表面键合作用,从而间接影响土壤对AT的吸附。AHOs Fe包被土壤后,可提高土壤对AT的吸附性能以及低浓度时的非线性吸附程度,但降低了土壤中AT的解吸迟滞效应。
[1] Nödler K,Licha T,Voutsa D. Twenty years later-Atrazine concentrations in selected coastal waters of the Mediterranean and the Baltic Sea. Marine Pollution Bulletin,2013,70:112—118
[2] Silveira G L,Lima M G F,Reis G B D,et al. Toxic effects of environmental pollutants:Comparative investigation usingAllium cepaL. andLactuca satiνaL.Chemosphere,2017,178:359—367
[3] Katz H,Mishael Y G. Reduced herbicide leaching by in situ adsorption of herbicide-micelle formulations to soils. Journal of Agricultural & Food Chemistry,2014,62:50—57
[4] Dal Bosco T C,Sampaio S C,Coelho S R M,et al.Effects of the organic matter from swine wastewater on the adsorption and desorption of alachlor in soil. Journal of Environmental Science and Health,2012,47(6):485—494
[5] 黄玉芬,刘忠珍,李衍亮,等. 土壤矿物和胡敏酸对阿特拉津的吸附-解吸作用研究. 土壤学报,2016,53(1):155—165 Huang Y F,Liu Z Z,Li Y L,et al. Effects of humic acids and minerals on adsorption-desorption of atrazine in soil(In Chinese). Acta Pedologica Sinica,2016,53(1):155—165
[6] 王玉军,周东美,孙瑞娟,等. 除草剂草甘膦在几种土壤和矿物上的吸附研究. 土壤学报,2006,43(5):780—785 Wang Y J,Zhou D M,Sun R J,et al. Adsorption of glyphosate on soils and minerals(In Chinese). Acta Pedologica Sinica,2006,43(5):780—785
[7] 赵晓丽,毕二平. 水溶性腐植酸对石英砂负载氧化铁吸附苯并三唑的影响. 农业环境科学学报,2015,34(6):1196—1201 Zhao X L,Bi E P. Effect of dissolvable humic acid on benzotriazole sorption by iron oxide coated quartz sands(In Chinese). Journal of Agro-Environment Science,2015,34(6):1196—1201
[8] Liu Z Z,He Y,Xu J M,et al. The ratio of clay content to total organic carbon content is a useful parameter to predict adsorption of the herbicide butachlor in soils.Environmental Pollution,2008,152:163—171
[9] 梁妮,李康,陈炳发,等. 氧化铁上有机无机复合体的形成及其对菲的吸附特征. 环境化学,2013,32(12):2276—2281 Liang N,Li K,Chen B F,et al. Formation of organicmineral complexes on iron oxide and their adsorption characteristics for phenanthrene(In Chinese).Environmental Chemistry,2013,32(12):2276—2281
[10] Lenone P,Negre M,Gennari M,et al. Adsorption of imidazolinone herbicides on ferrihydrite-humic acid associations. Journal of Environmental Science and Health,2001,36:127—142
[11] Huang P M,Wang T S C,Wang M K,et al. Retention of phenolic acids by noncrystalline hydroxyl-aluminum and-iron compounds and clay minerals of soils. Soil Science,1977,123:213—219
[12] Mehra O,Jachson M. Iron oxide removed from soils and clays by a dithionite-citrate system buffered with sodium bicarbonate. Clays & Clay Minerals,1960,7:317—329
[13] Huang W,Yu H,Weber Jr W J. Hysteresis in the sorption and desorption of hydrophobic organic contaminants by soils and sediments:1. A comparative analysis of experimental protocols. Journal of Contaminant Hydrology,1998,31:129—148
[14] Cornell R M,Schwertmann U. The iron oxides:Structure,properties,reactions,occurrence and uses.2nd ed. Germany:VCH-Weinheim,2003:238—265
[15] He Y,Xu J M,Wang H Z,et al. Potential contributions of soil minerals and organic matter to pentachlorophenol retention in soils. Chemosphere,2006,65:497—505
[16] Chiou C T,McGroddy S E,Kile D E. Partition characteristics of polycyclic aromatic hydrocarbons on soils and sediments. Environmental Science and Technology,1998,32:264—269
[17] Wang Y,Chen J W,Yang X H,et al. In silico model for predicting soil organic carbon normalized sorption coefficient(Koc)of organic chemicals. Chemosphere,2015,119:438—444
[18] Liu Z Z,He Y,Xu J M,et al. How do amorphous sesquioxides affect and contribute to butachlor retention in soils? Journal of Soils and Sediments,2013,13:617—628
[19] Alfonso L F,Germán G V,María P C,et al.Adsorption of organophosphorus pesticides in tropical soils:The case of Karst landscape of northwestern Yucatan. Chemosphere,2017,166:292—299
[20] Sadigh M K,Zakerhamidi M S,Rezaei B,et al.Environment effects on the nonlinear absorption properties of Methylene blue under different power of excitation beam. Journal of Molecular Liquids,2017,229:548—554
[21] Narayanan N,Gupta S,Gajbhiye V T,et al.Optimization of isotherm models for pesticide sorption on biopolymer-nanoclay composite by error analysis.Chemosphere,2017,173:502—511
[22] Liu Z Z,Ding N,Hayat T,et al. Butachlor sorption in organically rich soil particles. Soil Science Society of America Journal,2010,74:2032—2038
[23] Yang Q F,Wang J,Zhang W T,et al. Interface engineering of metal organic framework on grapheme oxide with enhanced adsorption capacity for organophosphorus pesticide. Chemical Engineering Journal,2017,313:19—26
[24] Rivoira L,Appendini M,Fiorilli S,et al.Functionalized iron oxide/SBA-15 sorbent:investigation of adsorption performance towards glyphosate herbicide. Environmental Science and Pollution Research,2016,23:21682—21691
[25] 周敏,王树伦,陈俊辉,等. 恩诺沙星在含水氧化铝和含水氧化铁上的配位吸附及配位增溶效应. 环境科学学报,2012,32(2):425—431 Zhou M,Wang S L,Chen J H,et al. Surface complexation sorption and ligand-promoted dissolution of enrofloxacin on aluminum hydroxide and iron hydroxide(In Chinese). Acta Scientiae Circumstantiae,2012,32(2):425—431
[26] 顾维,赵玲,董元华,等. 针铁矿吸附诺氟沙星特征的研究. 中国环境科学,2011,31(8):1314—1320 Gu W,Zhao L,Dong Y H,et al. Characteristics of norfloxacin sorption on goethite(In Chinese). China Environmental Science,2011,31(8):1314—1320
[27] Dong D M,Derry L A,Lion L W. Pb scavenging from a freshwater lake by Mn oxides in heterogeneous surface coating materials. Water Research,2003,37(7):1662—1666
[28] 郭学涛. 针铁矿/腐殖酸对典型抗生素的吸附及光解机理研究. 广州:华南理工大学,2014 Guo X T. Sorption and photolysis of antibiotics by goethite/humic acid(In Chinese). Guangzhou:South China University of Technology,2014
[29] 林怡英,吴宏海,曾丁才,等. 合成铁氧化物矿物对苯酚的吸附实验研究. 矿物岩石,2008,28(4):24—29 Lin Y Y,Wu H H,Zeng D C,et al. Experimental study of phenol adsorption on synthesized iron oxide minerals(In Chinese). Journal of Mineralogy &Petrology,2008,28(4):24—29
[30] Laird D A,Barriuso E,Dowdy R H,et al. Adsorption of atrazine on smectites. Soil Science Society of America Journal,1992,56:62—67
[31] Weber J,Huang W,Yu H. Hysteresis in the sorption and desorption of hydrophobic organic contaminats by soils and sediments. 2. Effects of soil organic matter heterogeneity. Journal of Contaminant Hydrology,1998,31:149—165
[32] Xia G,Pignatello J J. Detailed sorption isotherms of polar and apolar compounds in a high-organic soil.Environmental Science & Technology,2001,35:84—94
[33] He Y,Liu Z Z,Zhang J,et al. Can assessing for potential contribution of soil organic and inorganic components for butachlor sorption be improved? Journal of Environmental Quality,2011,40:1705—1713
[34] Nennenmann A,Kulbach S,Lagaly G. Entrapping pesticides by coagulating smectites. Applied Clay Science,2001,18:285—298
[35] Chefetz B,Bilkis Y I,Polubesova T. Sorptiondesorption behavior of triazine and phenylurea herbicides in Kishon River sediments. Water Research,2004,38:4383—4393
