Cu(II)、Pb(II)和 Cd(II)在红壤胶体和非胶体颗粒上吸附的比较*
2018-02-28徐仁扣
周 琴 姜 军 徐仁扣†
(1 土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008)
(2 中国科学院大学,北京 100049)
我国南方热带和亚热带地区广泛分布着红壤等可变电荷土壤[1]。由于强烈的风化和淋溶作用,这类土壤铁铝氧化物含量较高,黏土矿物以高岭石为主,因此土壤阳离子交换量(CEC)较低[2-3]。土壤颗粒表面带有电荷是土壤具有一系列电化学性质的主要原因。土壤胶体是土壤颗粒中化学活性最高的组分,其数量和矿物组成对土壤的电化学性质有重要影响[4-7]。土壤胶体颗粒对土壤表面电荷的贡献率可高达80%[8]。胶体的黏土矿物组成决定其表面电荷性质,含有较多蛭石和蒙脱石的土壤胶体,其电荷量一般较高;含有较多高岭石和铁铝氧化物的胶体,其电荷量一般比较低[4]。因为蛭石和蒙脱石表面带有较高的电荷,且主要为矿物同晶置换产生的永久电荷[6];高岭石表面所带负电荷很少,且主要来源于矿物外表面的断键和边面羟基的去质子化[7]。由于土壤胶体活性高、对土壤表面电荷的贡献大,通常将土壤胶体从土体分离后研究其对离子的吸附性能[2],但很少将同一土壤的胶体与非胶体的吸附性能及其与表面电荷的关系进行比较,尤其对土壤非胶体颗粒部分对土壤表面电荷及离子吸附的贡献了解很少。
由于城镇化的推进和工业活动的广泛开展,我国土壤重金属污染日趋严重,特别在南方酸性土壤地区[9]。重金属在土壤中积累导致土壤生产力下降,并对生态系统和人类健康造成严重威胁[10-12]。吸附是影响重金属离子在土壤固—液相间分配及其生物活性的重要过程[13],过去用完整土壤和土壤胶体对重金属的吸附行为进行了广泛研究,很少有研究涉及土壤胶体与非胶体对重金属吸附的比较。因此,本文对两种可变电荷土壤胶体和非胶体矿物组分和表面性质进行比较,研究了Cu(II)、Pb(II)和Cd(II)在土壤胶体和非胶体颗粒表面吸附的差异及机制,以为土壤重金属污染控制和污染土壤修复提供参考。
1 材料与方法
1.1 供试土壤
供试2种红壤分别采自湖南长沙和海南昆仑,成土母质分别为第四纪红黏土和花岗岩。两者均为50 cm以下的底层土壤。通过沉降法提取粒径<2 μm的土壤胶体颗粒,剩余部分为非胶体颗粒。将胶体和非胶体用去离子水洗涤至电导率小于4 μS cm-1,然后经过自然风干、磨细过60目筛备用。
1.2 土壤性质测定方法
土壤游离氧化铁和氧化铝用DCB法提取[14],提取液中的铁用原子吸收分光光度法测定,铝用ICP等离子发射光谱法测定;土壤CEC用醋酸铵法测定[14];土壤有机质用重铬酸钾氧化—比色法测定[14]。土壤矿物组成用X射线衍射法测定,使用Cu靶作放射源,管电压为40 kV,管电流为20 mA。不同矿物的相对百分含量根据衍射峰强度求得,选择某一矿物最强的衍射峰与标准矿物最强衍射峰比较,计算比值求得相对百分含量[15]。
1.3 吸附/解吸实验
配制0.1 mol L-1的Cu(NO3)2、Pb(NO3)2和Cd(NO3)2溶液,以此作为母液配制浓度为0.1、0.3、0.5、0.8、1.0、1.5 mmol L-1的Cu(NO3)2、Pb(NO3)2和Cd(NO3)2溶液用于等温吸附实验,支持电解质为1 mmol L-1NaNO3。
称取0.5000 g土壤样品于50 ml离心管中,将瓶和土一起称重记为W1(g)。加入25 ml不同浓度的Cu(NO3)2、Pb(NO3)2和Cd(NO3)2溶液,用NaOH和HNO3将悬液pH调节至目标值4.5,在 25℃恒温箱中震荡1 h,反复3次后,静置24 h,然后以4500 r min-1离心5 min,过滤得吸附平衡液。含有土壤和残留液的瓶子再次称重并记为W2(g),加入25 ml的1 mol L-1NaNO3以解吸吸附的Cu(II)、Cd(II)和Pb(II),将土壤与溶液混合均匀后震荡1h,离心过滤得解吸溶液。用原子吸收分光光度法测定吸附平衡液和解吸液中Cu(II)、Pb(II)和Cd(II)的浓度
当研究pH对Cu(II)、Pb(II)和Cd(II)吸附影响时,Cu(II)、Pb(II)和Cd(II)溶液初始浓度为1.0 mmol L-1,其他实验步骤与研究吸附等温线时相同。用NaOH和HNO3将悬液pH调节至不同目标值,在 25℃恒温箱中震荡1 h,再次测定和调节体系pH,步骤反复3次,静置24 h后将悬液混合,再次测定体系pH作为吸附平衡时的pH,用于作图与结果的讨论,然后以4500 r min-1离心5 min,过滤得吸附平衡液。
1.4 吸附量和解吸量计算与等温线拟合
根据3种重金属离子的初始浓度和吸附平衡浓度,用差减法计算土壤对Cu(II)、Pb(II)和Cd(II)的吸附量。用以下公式计算Cu(II)、Pb(II)和Cd(II)的解吸量R(II)des(mmol kg-1):

式中,R(II)k为解吸液中Cu(II)、Pb(II)和Cd(II)的浓度(mmol L-1),R(II)ad为吸附平衡液中Cu(II)、Pb(II)和Cd(II)的浓度(mmol L-1)。
用Langmuir方程C/Q=1/(KQm)+C/Qm拟合Cu(II)、Pb(II)和Cd(II)的吸附等温线。方程中Qm为Cu(II)、Pb(II)和Cd(II)的最大吸附量(mmol kg-1),C为平衡液中Cu(II)、Pb(II)和Cd(II)的浓度(mmol L-1),K是与吸附强度有关的常数。
2 结果与讨论
2.1 土壤胶体与非胶体的矿物组成与化学性质
土壤胶体颗粒的CEC显著高于非胶体颗粒(表1),湖南红壤胶体的CEC是该土壤非胶体的12.5倍,海南红壤胶体CEC是该土壤非胶体的11.9倍。因此,土壤胶体是土壤表面负电荷的主要贡献者[4]。比较两种土壤的结果,可以发现湖南红壤胶体和非胶体的CEC均高于海南红壤(表1),与土壤的发育程度一致。海南红壤采自热带地区,土壤的风化和发育程度更高。土壤胶体颗粒中游离氧化铁和游离氧化铝含量也明显高于非胶体颗粒(表1),湖南红壤胶体游离氧化铁和游离氧化铝的含量分别为该土壤非胶体的8倍和9倍,海南红壤胶体游离氧化铁和游离氧化铝的含量分别为该土壤非胶体的7倍和10倍。因此,红壤的游离氧化铁和游离氧化铝主要分布在土壤胶体部分。
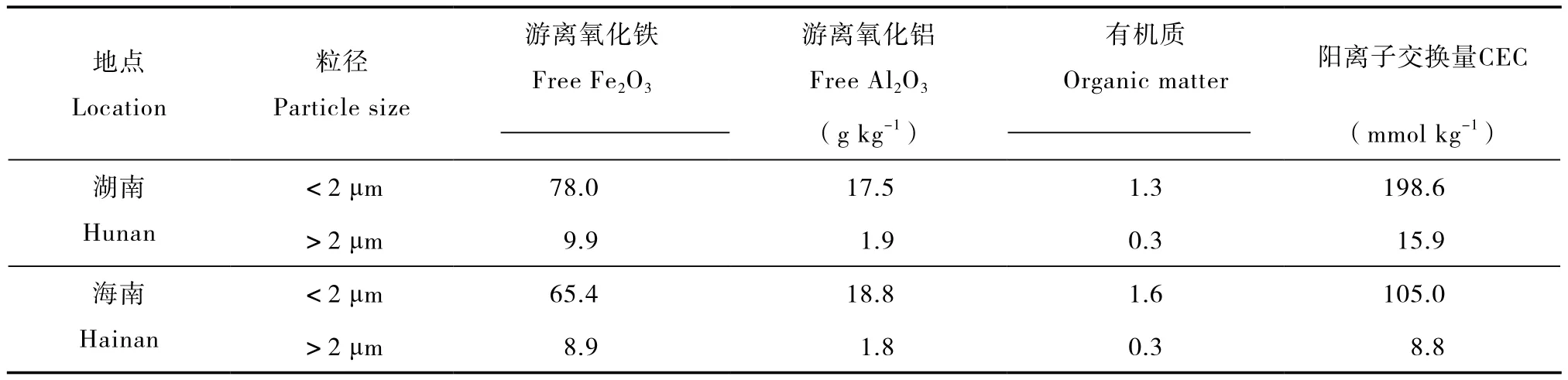
表1 土壤胶体与非胶体颗粒化学性质的比较Table 1 Chemical properties of soil colloids and non-colloids
土壤胶体和非胶体中的矿物组成如表2所示。结果表明,两种土壤胶体的矿物组成均以次生矿物为主,原生矿物石英含量很低,次生矿物又以1∶1型高岭石所占比例最高。湖南红壤胶体除含大量高岭石外,还含较多蛭石和水云母等2∶1型矿物,而海南红壤胶体高岭石含量高达83%,仅含少量2∶1型的水云母。2∶1型矿物所带永久负电荷多于1∶1型高岭石,尤其是蛭石的CEC很高[5-6],这是湖南红壤胶体CEC高于海南红壤胶体的主要原因。湖南红壤的非胶体部分的矿物组成以原生矿物石英为主,其次为次生矿物水云母,高岭石含量不高。海南红壤非胶体部分的矿物组成以高岭石和水云母为主,还含一定量的石英和长石。这些结果进一步证明海南红壤的发育程度高于湖南红壤。两种土壤胶体部分均检测出三水铝石和针铁矿等铁铝氧化物,而非胶体部分,除湖南红壤检测出赤铁矿外,未检测出其他氧化物矿物。这些结果与表1中游离铁铝氧化物的结果一致,说明土壤发育过程中铁铝氧化物主要富集在土壤胶体(黏粒)部分。

表2 红壤胶体和非胶体矿物组成Table 2 Mineral composition of colloids and non-colloids of the two red soils determined with X-ray diffraction(%)
2.2 Cu(II)、Pb(II)和Cd(II)的吸附等温线
2种红壤胶体和非胶体颗粒对Cu(II)、Pb(II)和Cd(II)的吸附等温线如图1所示。结果表明,红壤胶体对Cu(II)、Pb(II)和Cd(II)的吸附量远大于非胶体颗粒,说明土壤胶体(黏粒)是红壤吸附重金属的主要贡献者。比较2种红壤胶体,湖南红壤胶体对3种重金属的吸附量高于海南红壤胶体,与矿物组成和CEC大小一致。本文所用土壤为底层土壤,土壤有机质含量低,因此层状硅酸盐矿物和铁铝氧化物是2种土壤吸附重金属的主要吸附剂。2∶1型矿物对重金属的吸附能力一般大于1∶1型的高岭石,湖南红壤胶体含较多蛭石等2∶1型矿物,且CEC和铁铝氧化物含量也高于海南红壤,这是湖南红壤胶体对重金属吸附量高于海南红壤的主要原因。
用Langmuir方程对吸附等温线进行拟合,所得拟合参数列于表3中。Langmuir方程对吸附数据的拟合较好,R2值在0.84以上,说明可以用Langmuir方程描述3种重金属的吸附行为。红壤胶体对3种重金属的最大吸附量Qm和K值均高于非胶体颗粒,说明红壤胶体不仅对重金属的吸附容量高于非胶体颗粒,对重金属的吸附亲和力也大于非胶体颗粒。2种胶体相比,湖南红壤胶体对3种重金属的最大吸附量Qm和K大于海南红壤胶体,说明湖南红壤胶体对这些重金属有更高的吸附容量和更大的吸附亲和力。湖南红壤胶体含较多2∶1型黏土矿物和较高的CEC也是其对3种重金属具有较高吸附亲和力的主要原因。
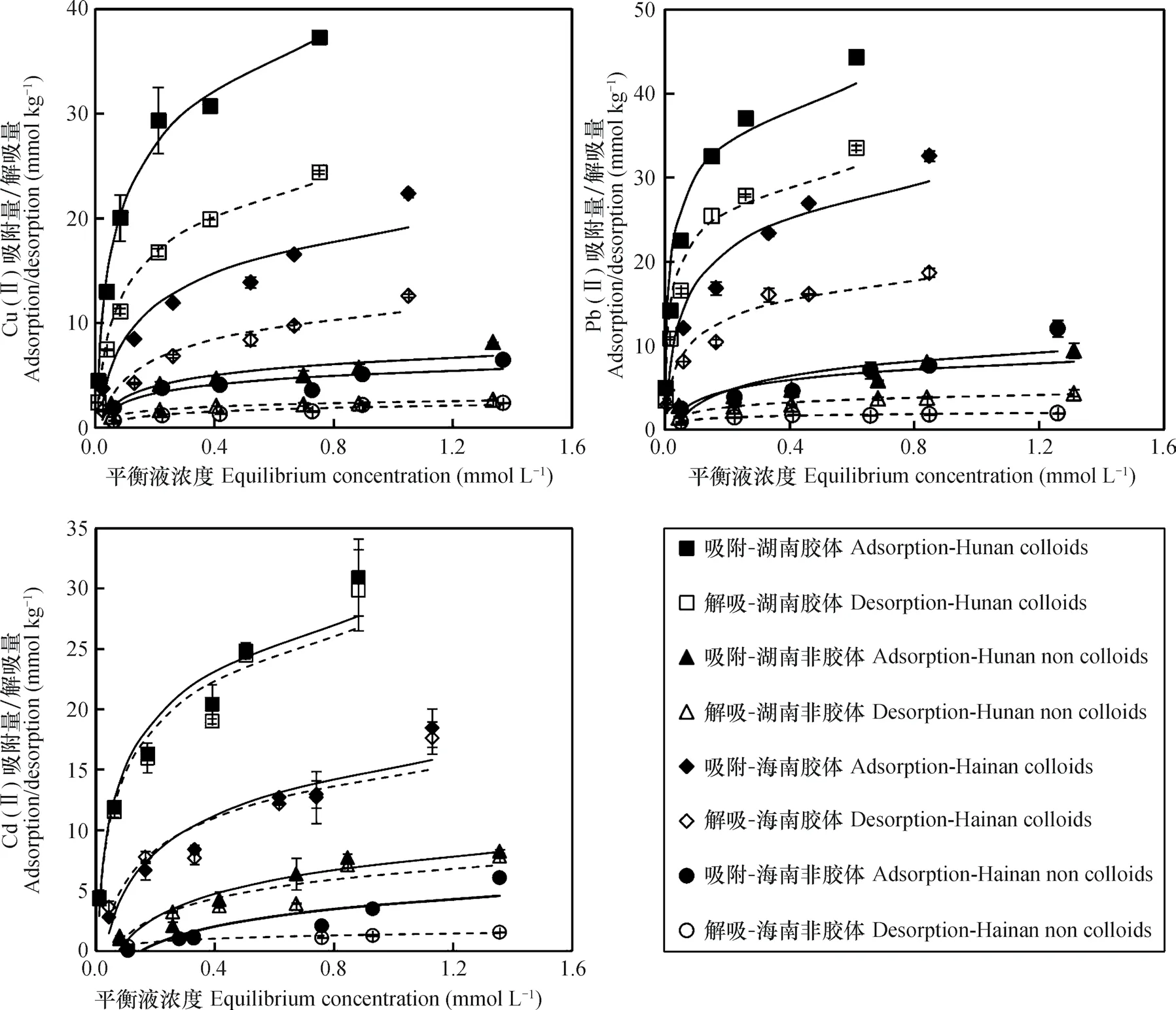
图1 pH4.5条件下红壤胶体和非胶体对Cu(II)、Pb(II)和Cd(II)的吸附等温线及吸附重金属的解吸曲线Fig. 1 Adsorption isotherms of Cu(II),Pb(II)and Cd(II)by colloids and non-colloids of the two red soils at pH4.5 and desorption curves of these pre-adsorbed heavy metals
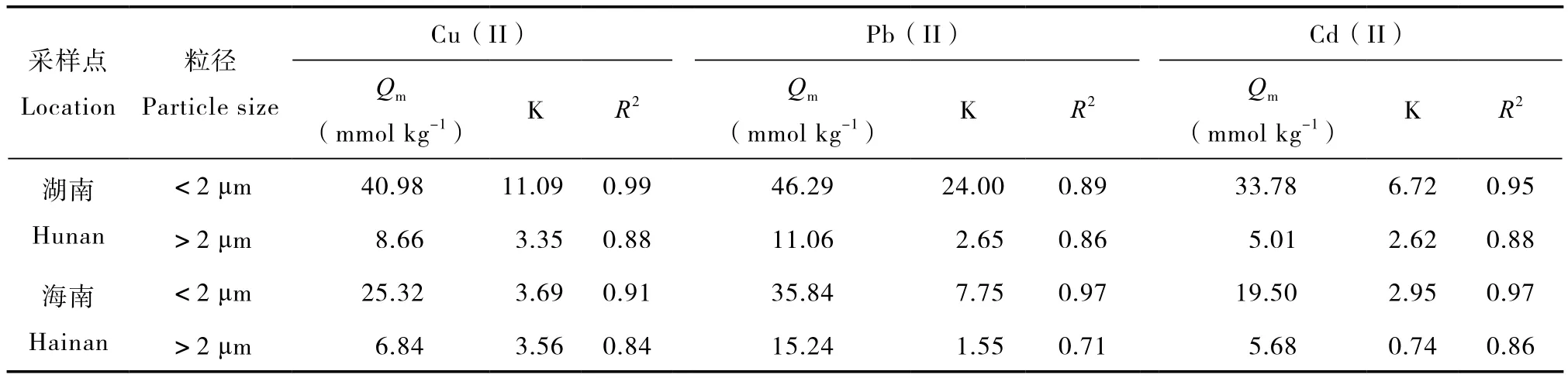
表3 Langmuir方程拟合Cu(II)、Pb(II)和Cd(II)在红壤胶体和非胶体表面吸附的相关参数Table 3 Parameters of Langmuir equation fitting the adsorption of Cu(II),Pb(II)and Cd(II)by colloids and non-colloids of the two red soils
重金属在土壤中的吸附涉及静电吸附和非静电吸附两种机制,通过静电引力吸附于土壤表面的离子位于胶体双电层的扩散层中,以这种机制吸附的重金属阳离子可以与其他阳离子发生离子交换而解吸,因此可以用高浓度中性盐作为解吸剂定量区分重金属的静电吸附和非静电吸附[3,16-17]。图1中解吸曲线代表静电吸附对3种重金属吸附的贡献,可以看出,2种红壤的胶体和非胶体中,Cu(II)和Pb(II)的解吸曲线均显著低于相应的吸附曲线,说明静电吸附和非静电吸附机制均对2种重金属吸附有重要贡献。而Cd(II)在2种红壤胶体中的解吸曲线仅略低于吸附曲线,说明Cd(II)在2种红壤中主要发生静电吸附。为了定量比较2种机制的贡献,根据图1数据计算了静电吸附对红壤胶体吸附3种重金属的贡献率(表4)。结果表明,静电吸附对湖南红壤胶体和海南红壤胶体吸附Cu(II)的贡献率分别在54%和44%以上,静电吸附对湖南红壤胶体和海南红壤胶体吸附Pb(II)的贡献率分别在69%和57%以上,静电吸附对湖南红壤胶体和海南红壤胶体吸附Cd(II)的贡献率分别在97%和90%以上。这与之前的研究一致,即:Cd(II)在土壤中主要发生静电吸附,以交换态存在[17-18]。Cu(II)和Pb(II)可发生明显的专性吸附和表面沉淀[16-17,19]。

表4 静电吸附对2种红壤胶体吸附Cu(II)、Pb(II)和Cd(II)的贡献率Table 4 Relative contribution of electrostatic adsorption to adsorption of Cu(II),Pb(II)and Cd(II)by colloids of the two red soils(%)
2.3 pH对Cu(II)、Pb(II)和Cd(II)的吸附/解吸的影响
图2所示为土壤胶体和非胶体颗粒对C u(II)、Pb(II)和Cd(II)的吸附量随pH的变化趋势以及与不同吸附量相对应的解吸量,3种重金属在土壤胶体和非胶体颗粒表面的吸附量均随着pH的增加而增加。3种重金属离子在胶体颗粒表面的吸附在整个研究的pH范围内均呈显著增加趋势。而在非胶体颗粒中,当pH小于5时,重金属吸附量随pH升高的增加幅度很小,但当pH大于5时,增幅增加。一方面,随着pH增加,可变电荷土壤表面负电荷增加,对阳离子的静电引力作用增强,导致土壤对重金属离子吸附量增加;另一方面,随着pH升高,重金属水解作用增强,形成的羟基金属离子更易被土壤所吸附。
图2中胶体颗粒中吸附的Cu(II)、Pb(II)和Cd(II)的解吸量随着平衡液pH呈现不同的变化趋势,3种重金属的解吸代表静电吸附的贡献。在所研究的pH范围内,Cd(II)的解吸量的变化趋势与其吸附量的变化趋势表现相似,即随着pH的增加,解吸量增加,说明随着pH的增加,胶体表面的负电荷增加,对Cd(II)的静电吸附作用增强。Cu(II)和Pb(II)的解吸量先随着吸附平衡液pH的增加而增加,分别在pH5.0和5.5时达最大,随后逐渐减小。这一现象是表面电荷和水解共同作用的结果。在低pH范围内(pH小于最大解吸量时的pH),由于胶体表面的负电荷随着pH的增加而增加,对Cu(II)和Pb(II)的静电吸附作用增强,其吸附量和解吸量均随着pH的增加而增加,与Cd(II)的吸附行为相似,这时水解作用对吸附的影响很小。但当pH大于最大解吸量时的pH时,由于Cu(II)和Pb(II)的水解作用增强,土壤胶体吸附的Cu(II)和Pb(II)中羟基金属离子所占比例不断增加,由于这些羟基金属离子能形成单基配位或者双基配位的表面络合物,它们不容易被中性盐解吸,导致Cu(II)和Pb(II)的解吸量随着pH的增加而显著减小,与吸附量的变化趋势相反[20]。由于Cd(II)的水解常数pK较Cu(II)和Pb(II)大得多,文献中报道的Cu(II)、Pb(II)和Cd(II)的pK的实测值是6.5、6.7和9.7[17],因此在酸性条件下水解作用对Cd(II)吸附和解吸的影响很小,这是较高pH下Cd(II)的吸附和解吸行为与Cu(II)和Pb(II)明显不同的主要原因。
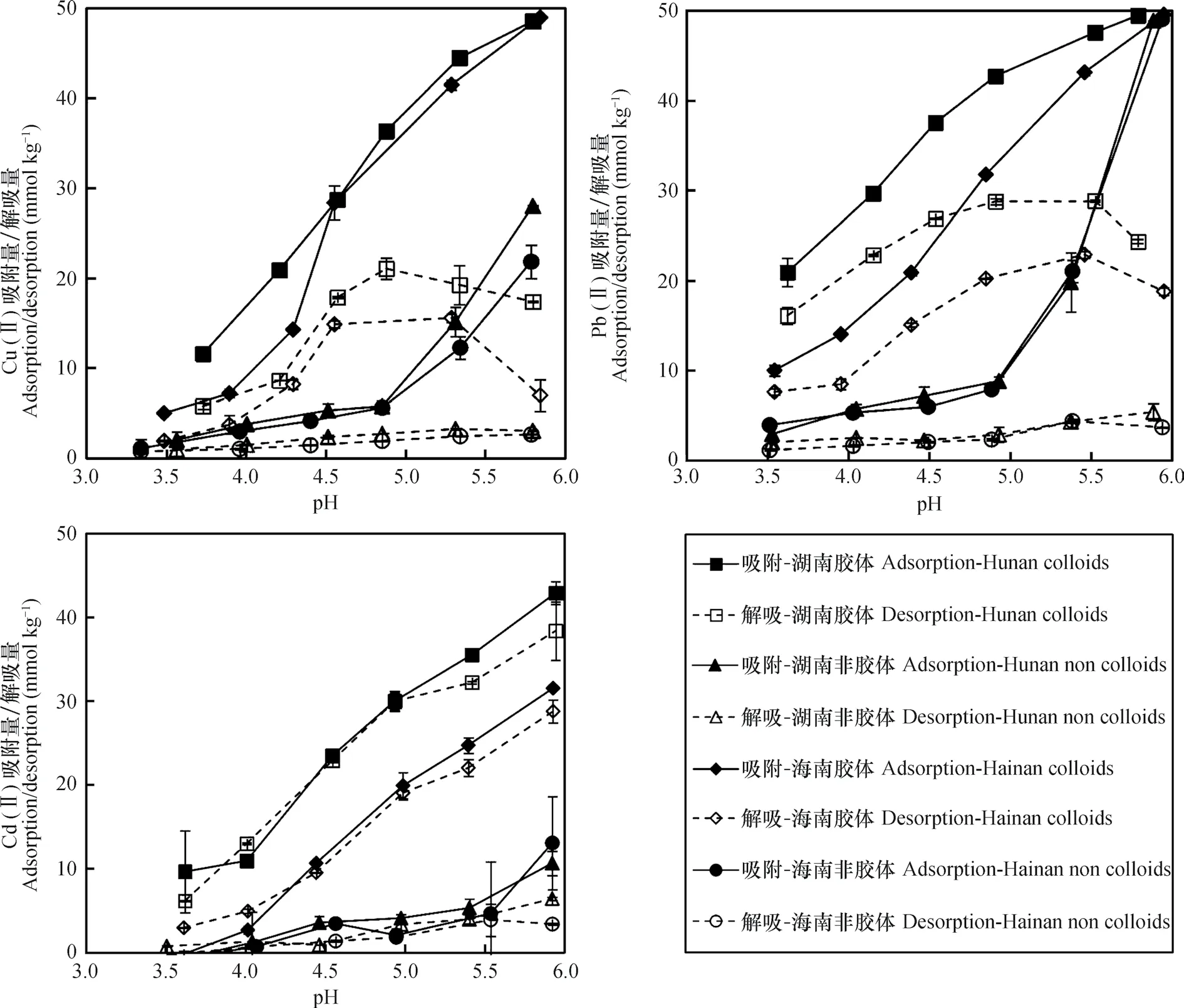
图2 pH对Cu(II)、Pb(II)和Cd(II)在红壤胶体和非胶体颗粒表面吸附/解吸的影响Fig. 2 Effect of pH on adsorption and desorption of Cu(II),Pb(II)and Cd(II)on and from colloids and non-colloids of the two red soils
土壤非胶体部分有机质和游离铁铝氧化物含量均很低(表1),因此其表面负电荷随pH的变化比较小,这是pH<5时3种重金属在土壤非胶体表面吸附量和解吸量随pH变化很小的主要原因。因为土壤可变电荷负电荷主要来源于土壤有机质表面弱酸性官能团的离解和铁铝氧化物表面羟基的去质子化。pH>5时土壤非胶体对Cu(II)和Pb(II)吸附量随pH升高而显著增加,主要归因于这2种金属阳离子在土壤颗粒表面的水解和沉淀作用。
本文及之前的研究结果表明,Cu(II)、Pb(II)和Cd(II)等3种重金属在可变电荷土壤及土壤胶体表面的吸附机制存在明显差异[16-20],Cd(II)主要发生静电吸附,而Cu(II)和Pb(II)既可发生静电电吸附,同时会发生明显的专性吸附并形成表面沉淀。这是Cd(II)在酸性土壤中活性高、且不易累积,而Cu(II)和Pb(II)在土壤中容易累积的主要原因。
3 结 论
两种红壤胶体的矿物组成均以次生矿物为主,原生矿物石英含量很低,次生矿物又以1∶1型高岭石所占比例最高。随着土壤发育程度增加,土壤胶体中2∶1型的蛭石和水云母含量减少,高岭石含量增加。土壤非胶体颗粒中石英等原生矿物含量较高。风化和成土过程中,铁铝氧化物主要富集在土壤胶体部分。红壤的表面电荷性质主要决定于土壤胶体的电荷性质,土壤胶体的CEC约为非胶体的12倍。红壤胶体对Cu(II)、Cd(II)和Pb(II)的吸附容量和吸附亲和力均显著大于非胶体颗粒,因此红壤胶体(黏粒)含量是影响土壤对重金属吸附能力的主要因素。Cd(II)在红壤胶体和非胶体颗粒表面主要发生静电吸附,而静电吸附和非静电吸附两种机制均对Cu(II)和Pb(II)的吸附有重要贡献。
[1] 熊毅,李庆逵. 中国土壤. 北京:科学出版社,1990 Xiong Y,Li Q K. Soils of China(In Chinese).Beijing:Science Press,1990
[2] 于天仁,季国亮,丁昌璞,等. 可变电荷土壤的电化学. 北京:科学出版社,1996 Yu T R,Ji G L,Ding C P,et al. Electrochemistry of variable charge soils(In Chinese). Beijing:Science Press,1996
[3] Xu R K,Qafoku N P,van Ranst E,et al. Adsorption properties of subtropical and tropical variable charge soils:Implications from climate change and biochar amendment. Advances in Agronomy,2016,135:1—58
[4] Kimpe C R D,Laverdiere M R,Martel Y A. Surface area and exchange capacity of clay in relation to the mineralogical composition of gleysolic soils. Canadian Journal of Soil Science,1979,59(4):341—347
[5] Klages M G,Hopper R W. Clay-minerals in northern plants coal overburden as measured by X-ray-diffraction.Soil Science Society of America Journal,1982,46(2):415—419
[6] Guo X,Inoue K. Elution of copper from vermiculite with environmentally benign reagents. Hydrometallurgy,2003,70(1):9—21
[7] Bhattacharyya K G,Gupta S S. Adsorption of a few heavy metals on natural and modified kaolinite and montmorillonite:A review. Advances in Colloid &Interface Science,2008,140(2):114—131
[8] Bolan N S,Naidu R,Syers J K,et al. Surface charge and solute interactions in soils. Advances in Agronomy,1999,67:87—140
[9] 周建军,周桔,冯仁国. 我国土壤重金属污染现状与治理战略. 中国科学院院刊,2014,29(3):315—320,350 Zhou J J,Zhou J,Feng R G. Status of China’s heavy metal contamination in soil and its remediation strategy(In Chinese). Bulletin of Chinese Academy of Sciences,2014,29(3):315—320,350
[10] Toppi L S D,Gabbrielli R. Response to cadmium in higher plants. Environmental and Experimental Botany,1999,41(2):105—130
[11] 曾希柏,徐建明,黄巧云,等. 中国农田重金属问题的若干思考. 土壤学报,2013,50(1):186—194 Zeng X B,Xu J M,Huang Q Y,et al. Some deliberations on the issues of heavy metals in farmland of China(In Chinese).Acta Pedologica Sinica,2013,50(1):186—194
[12] 张晗,靳青文,黄仁龙,等. 大宝山矿区农田土壤重金属污染及其植物累积特征. 土壤,2017,49(1):141—149 Zhang H,Jin Q W,Huang R L,et al. Characteristics of heavy metal pollution in agricultural soils and bioaccumulation in plants in Dabaoshan mine(In Chinese). Soils,2017,49(1):141—149
[13] McBride M B. Environmental chemistry of soils. New York:Oxford University Press,1994.
[14] 鲁如坤. 土壤农业化学分析方法. 北京:中国农业科学技术出版社,1999 Lu R K. Analytical methods for soil and agro-chemistry(In Chinese). Beijing:China Agricultural Science and Technology Press,1999
[15] Laajeb A,Addaou A,Lahsini A,et al. Clay mineral characterization and effect of the particle size onto zinc adsorption kinetic studies. Asian Journal of Chemistry,2012,24(11):4851—4854
[16] Jiang T Y,Jiang J,Xu R K,et al. Adsorption of Pb(II)on variable charge soils amended with rice-straw derived biochar. Chemosphere,2012,89(3):249—256
[17] Xu R K. Interaction between heavy metals and variable charge soils//Xu J M,Sparks D L. Molecular environmental soil science. Dordrecht:Springer,2013
[18] Hickey M G,Kittrick J A. Chemical partitioning of cadmium,copper,nickel and zinc in soils and sediments containing high levels of heavy metals.Journal of Environmental Quality,1984,13(3):372—376
[19] Mclaren R G,Crawford D V. Studies on soil copper.Journal of Soil Science,1973,24(1):443—452
[20] 梁晶,徐仁扣,蒋新,等. 不同pH下两种可变电荷土壤中Cu(II)、Pb(II)和Cd(II)吸附与解吸的比较研究. 土壤,2007,39(6):992—995 Liang J,Xu R K,Jiang X,et al. Adsorption and desorption of Cu(II),Pb(II)and Cd(II)in two variable charge soils different in pH(In Chinese).Soils,2007,39(6):992-995
