干旱胁迫对油松和柴松钾钙离子流的影响
2018-02-27王树源唐佳琪鲁彦君
王树源,王 富,唐佳琪,鲁彦君
(西北农林科技大学 林学院,陕西 杨凌 712100)
干旱胁迫是世界性的非生物胁迫类型之一,常伴随着高温、盐碱、土壤贫瘠等问题,严重影响植物的生长发育[1]。钾(K)是植物体数量次丰富的矿质营养元素,维持细胞K+平衡对于植物抵御各种非生物胁迫非常重要[1]。一般逆境胁迫会引起植物细胞K+流失,胞质“K+库”迅速下降,随即关闭下游耗能大的生理生化过程(如结构蛋白合成),开启耗能相对少的防御反应(如清除活性氧、生成相应分子伴侣等);若胁迫加剧,K+信号将激活分解代谢酶(如类-caspase蛋白酶、核酸内切酶等),诱发细胞程序性死亡[2]。因此,细胞K+平衡被认为是逆境胁迫刺激植物产生的“调控开关”[3]。拟南芥通过保卫细胞质膜Shaker-去极化激活的外向整流型K+通道活性,来调节气孔运动,抵御干旱胁迫[4]。植物PM H+-ATPase活性升高能够减少盐胁迫下植物细胞质膜的去极化程度,从而减少K+通过去极化激活的阳离子通道流失[5]。但是,有关植物在干旱胁迫下根系的K+转运模式却鲜有报道。在干旱胁迫中,Ca2+同K+一样,也可有效调节细胞渗透势以帮助植物吸收水分[6];此外,还通过稳定细胞壁结构、激活细胞质膜ATP酶为阳离子进入细胞提供驱动力,通过钙调素调控下游生理生化反应来抵御水分亏缺对植物造成的影响[7]。其中,作为重要第二信使的Ca2+可将水分亏缺信息从根传导向地上部分[8],如干旱胁迫诱导Ca2+通过Ca2+通道或非选择性阳离子通道由质外体向胞质转运,诱导气孔关闭减少水分散失[9]。但是,细胞Ca2+浓度过高会导致蛋白质与核酸降解、沉淀或磷酸化[10],同时激活Ca2+/H+转运体和Ca2+-ATPase将胞质Ca2+转运到细胞壁或其他细胞器,从而维持胞质Ca2+处于稳定水平[7]。在模式植物中的研究结果显示,在PEG与Mannitol胁迫下,抗旱型大麦品种XZ5积累的K+浓度大于敏感型品种ZJU9,同时不同抗旱型大麦品种根、叶细胞Ca2+内流明显增加,且抗旱型品种内流更多[11]。对大豆叶肉细胞与气孔Ca2+、K+流的测试结果也显示,抗旱型比不抗旱型大豆品种维持Ca2+、K+平衡的能力强[12]。但目前还缺乏干旱胁迫诱导木本植物组织Ca2+、K+流模式以及平衡机制的研究。
油松(PinustabulaeformisCarriere)是黄土高原水土保持、荒山绿化和用材林的主要树种,耐旱性强[13];而柴松(Pinustabulaeformisf.shekanensisyao et Hsu)是新发现的分布于陕西富县大麦秸沟地区及附近的特有分类单元,面积仅300多hm2,Liu等[14-15]将其确定为油松变种,其树体高大、干形通直,单株及林分高、径、蓄积生长都高于油松,被誉为黄土高原又一珍贵优良的造林树种且具有重要的保护价值。目前对柴松的研究主要集中在分类地位、群落学特性及遗传多样性上[14,16-19],但其抗旱生理特性研究数据缺乏。因此,本研究以1年生油松与柴松幼苗为试验材料,比较研究干旱胁迫对2种松树根和叶中K+、Ca2+积累及根系表皮细胞K+、Ca2+流模式的影响,拟从K+、Ca2+平衡的角度揭示2种松树幼苗对干旱胁迫的响应差异,并为柴松的培育与造林提供理论指导。
1 材料与方法
1.1 植物材料培养与胁迫处理
2015年1月初,将采自延安油松基地的油松(P.tabuliformis)与陕西延安桥北林业局和尚塬林场大麦秸沟的柴松(P.tabulaeformisf.shekanensis)饱满种子置于育苗钵(7 cm×7 cm×5 cm)里促萌,每个育苗钵播种5粒种子,基质为V(河沙)∶V(蛭石)=1∶2。育苗在西北农林科技大学温室内进行,定期浇水以保持土壤湿度,待幼苗发芽生根后,每周浇2次1/2Hoagland完全营养液,每营养钵每次浇20 mL,采用自然光照,温度控制在23~25 ℃,空气相对湿度35%~45%,共培育5个月。选长势均一的植株分为3组,第1组每周浇2次水(20 mL/钵)(对照组),第2组从第15天开始不浇水(短期干旱胁迫),第3组从第1天开始不浇水(长期干旱胁迫)。参照Gao等[20]的方法对幼苗进行自然干燥控水处理(06-01-06-22),3个组均在第21天上午09:00统一采样。在自然干旱胁迫处理期间,每隔7 d分别从3个组的育苗钵中各采5个土壤基质样品(对于第1组和第2组,每次土壤基质取样均在浇水后),测定其土壤含水量,结果显示,对照组在试验期间的平均土壤含水量为34.17%,第2组和第3组在试验结束时的土壤含水量分别为22.69%和10.84%。
1.2 试验方法
1.2.1 根、叶组织K+、Ca2+含量测定 K+、Ca2+含量测定参照Chen等[21]的方法,将根、叶在80 ℃烘箱中烘干后过1 mm筛,精确称量0.1~0.2 g样品,用浓H2SO4-H2O2溶解,定容至50 mL,再用原子吸收分光光度计(Perkin-Elmer 2280,USA)测定组织K+、Ca2+含量。
1.2.2 根尖离子流测定 利用非损伤微测技术(non-invasive micro-testtechnique,NMT;NMT-YG-100,Younger USALLC,Amherst,MA01002,USA)测试根尖K+、Ca2+流。
(1)测试样品准备。取20 mm长根段,用蒸馏水冲洗表面后在基本测试液中平衡20 min。K+基本测试液含0.1 mmol/L NaCl、0.1 mmol/L MgCl2、0.1 mmol/L CaCl2和0.5 mmol/L KCl,用HCl和NaOH调节pH至5.7;Ca2+测试液含0.1 mmol/L NaCl、0.1 mmol/L MgCl2、0.2 mmol/L CaCl2和0.5 mmol/L KCl,用HCl和KOH或胆碱调节pH至6.0。离子选择性电极的制备与校准参照Sun等[22]的方法。
(2)稳态离子流测定。平衡之后,将根段浸于10 mL新鲜测试液中,并固定于培养皿底部,用相应的离子选择性微电极沿着根轴测量根尖区域的离子流变化。在离根冠200~2 000 μm处,每200 μm设1个测量点,共9个测量点,每个测量点实时记录离子流时间为2~3 min,直至获得稳定的离子流速。数据为每个测定位置的离子流速平均值,样品重复5~7个。用ASET软件(ASET 2.0 Sciencewares,Falmouth,MA 02540,USA)和iFluxes软件(Younger USALLC,Amherst,MA 01002,USA)进行数据获取、预处理、电极三维位置控制及显微镜精细聚焦的步进控制。
1.2.3 离子转运抑制剂处理下根尖离子流的测定 在短期与长期干旱胁迫后,对油松和柴松根尖分别采用500 μmol/L质膜H+-ATP酶抑制剂原钒酸钠(sodium orthovanadate,Vanadate)预处理50 min、用20 mmol/L质膜K+通道抑制剂氯化四乙胺(tetraethylammonium,TEA)预处理30 min、用1 mmol/L质膜Ca2+通道抑制剂三氯化钆(Gadolinium chloride,GdCl3)预处理1 h、用5 μmol/L质膜Ca2+-ATP酶抑制剂(Eosin-Y)预处理1 h,之后检测K+流与Ca2+流。
1.3 数据分析
采用北京旭月公司提供的MageFlux软件(http://xuyue.net/mageflux)计算离子流的测试数据,其中正值表示阳离子外流,负值表示阳离子内流,本试验最终测得的离子流速是净离子流速,即内流与外流之和。
试验数据分析采用SPSS 13.0统计软件处理,用单因素方差分析(oneway-ANOVA)方法检验不同处理下各指标的差异显著性,用Duncan’s法进行差异显著性(P<0.05)多重比较,用Origin 9软件绘图。
2 结果与分析
2.1 干旱胁迫对油松与柴松根、叶组织K+、Ca2+积累的影响
加强对K+、Ca2+的吸收、积累与转运能力,被认为是植物抵抗干旱胁迫的有效策略之一[6]。表1显示,在未进行干旱胁迫处理的对照条件下,油松与柴松根、叶组织中的K+含量和叶中Ca2+含量无显著差异;短期干旱胁迫处理对2种松树根、叶组织的K+、Ca2+含量影响不显著;但是经过长期干旱胁迫处理后,2种松树根、叶组织的K+、Ca2+含量较对照和短期干旱胁迫处理显著减少,且柴松减少幅度较油松更大,油松根、叶中K+含量为对照的71.4%和45.8%,柴松为对照的57.1%和42.2%;油松根、叶中Ca2+含量为对照的71.0%和69.7%,柴松为对照的37.8%和51.6%。上述结果表明,在长时间干旱胁迫下,油松对K+、Ca2+的积累能力明显大于柴松,尤其是根。
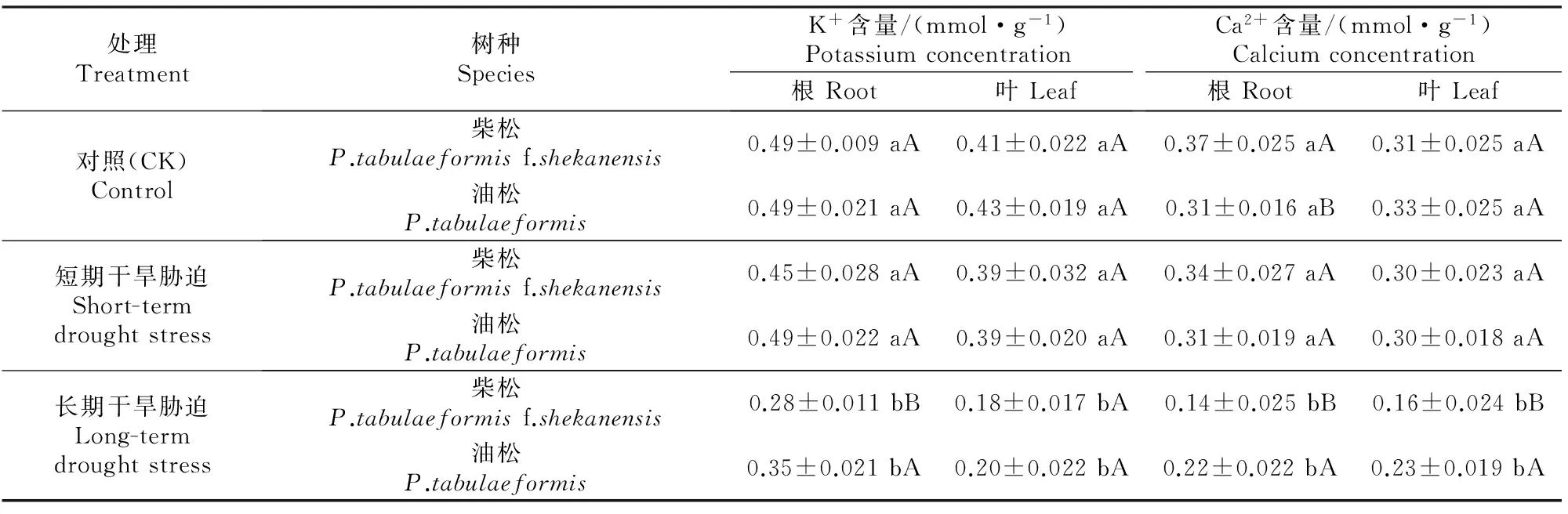
表1 干旱胁迫对油松与柴松根、叶组织中K+、Ca2+含量的影响Table 1 Effect of drought stress on concentrations of K+ and Ca2+ in root and leaf tissues of Pinus tabulaeformis and Pinus tabulaeformis f.shekanensis
注:同列数据后标不同小写字母表示同种幼苗不同处理间差异显著(P<0.05),标不同大写字母表示不同种幼苗在相同处理中差异显著(P<0.05)。
Note:Lowercase letters in each column represent significant difference among treatments (P<0.05),while capital letters represent significant difference among species in same treatment(P<0.05).
2.2 干旱胁迫对油松与柴松根尖K+、Ca2+流的影响
维持胞质足够的K+浓度对植物抵抗干旱胁迫很重要[23]。采用非损伤微测技术检测2种松树根尖表皮细胞的K+流速,结果(图1)显示,在对照条件下,油松根尖的平均流速为17.18 pmol/(cm2·s);短期干旱胁迫诱导K+从对照的轻微外排转为内流,平均流速是对照的5.01倍(图1-A);长期干旱胁迫则增强K+外排流速,尤其在距离根冠400,800,1 600与1 800 μm处显著增加,总平均流速是对照的5.59倍(图1-A)。柴松在对照条件下,K+总平均流速为50.67 pmol/(cm2·s),短期与长期干旱胁迫下,K+外排均加强,分别是对照的3.13与6.78倍(图1-B)。可见,无论在短期还是长期干旱胁迫下,油松的K+内流程度始终大于柴松。
干旱胁迫对2种松树Ca2+流的影响也不同(图1-C,D),在对照条件下,油松Ca2+内、外流基本平衡,总平均流速为17.65 pmol/(cm2·s);在短期干旱胁迫下,Ca2+内流加强,在距离根尖200~400,800 和1 800 μm处与对照差异显著,总平均流速为-70.43 pmol/ (cm2·s);在长期干旱胁迫下,根尖伸长区(距离根冠1 600~2 000 μm处)显示强烈Ca2+外排,平均流速是对照的4.98倍(图1-C)。柴松在对照条件下,总平均流速为-9.82 pmol/(cm2·s),短期与长期干旱胁迫不同程度地加强了Ca2+外排,总平均流速分别是对照的9.09倍与24.52倍(图1-D)。因此,短期与长期干旱胁迫对柴松根尖Ca2+外排的诱导均显著大于油松。
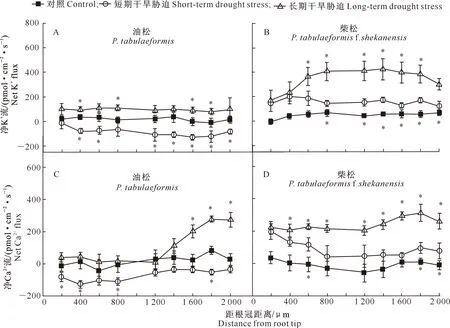
*表示处理与对照间差异显著(P<0.05)。图2与3同*represents significant difference between treatments and the control (P<0.05).The same for Fig.2 and Fig.3
2.3 离子转运抑制剂对干旱胁迫诱导的2种松树根尖K+、Ca2+流的作用
离子转运抑制剂处理试验可间接揭示干旱胁迫引起的K+、Ca2+跨膜转运机制[24]。图2显示,TEA可有效抑制干旱胁迫诱导的2种松树K+的外排,抑制作用在分生区(距离根冠200~600 μm)与伸长区(距离根冠600~1 400 μm)与对照相比均差异显著,对油松的平均抑制程度达96.22%(长期干旱胁迫),对柴松的平均抑制程度达65.73%(短期干旱胁迫)和44.28%(长期干旱胁迫)。短期干旱胁迫下,油松显示K+内流,平均流速为-87.32 pmol/(cm2·s),TEA处理并未显著改变K+流速(-109.14 pmol/(cm2·s))(图2-A)。
Vanadate可加强2种松树在短期与长期干旱胁迫下的K+外排流速(图2),说明K+外排可能是由去极化激活的K+通道(DA-KORCs)或非选择性阳离子通道(DA-NSCCs)介导[25],而外向K+通道活性受H+-ATP酶活性调控。采用同样剂量的Vanadate处理使油松根尖K+外排幅度大于柴松,其中油松外排幅度是对照的179.61%(短期干旱胁迫,图2-A)和256.82%(长期干旱胁迫,图2-B),柴松外排幅度是对照的51.03%(短期干旱胁迫,图2-C)和19.48%(长期干旱胁迫,图2-D),由此推测,干旱胁迫诱导的油松根尖表皮细胞质膜H+-ATP酶活性大于柴松。
质膜Ca2+-ATP酶的作用是将胞质钙转运到内膜系统与质外体,终止钙信号来维持Ca2+平衡[26],这一过程与多种逆境胁迫密切相关[27]。如图3所示,对于油松,Ca2+-ATP酶抑制剂(Eosin-Y)对短期干旱胁迫诱导的Ca2+内流影响不显著(图3-A),对长期干旱胁迫诱导的Ca2+外排有抑制作用(距离根冠1 400~2 000 μm),抑制程度是对照的16.43%(图3-B);对于柴松,Eosin-Y有效抑制了干旱胁迫诱导的Ca2+外排,Eosin-Y处理后的Ca2+外排流速为对照的21.2%(短期干旱胁迫,图3-C)与73.89%(长期干旱胁迫,图3-D);说明干旱胁迫激活了2种松树质膜的Ca2+-ATP酶,引起胞质Ca2+向质外体转运。此外,质膜Ca2+通道抑制剂GdCl3可以促进长期干旱胁迫诱导的油松根尖Ca2+外排,并逆转短期干旱胁迫诱导的Ca2+内流(距离根冠200~800 μm),但GdCl3对干旱胁迫诱导柴松的Ca2+流影响并不显著。

图2 氯化四乙胺与原钒酸钠对短期与长期干旱胁迫下油松和柴松根尖K+流的影响Fig.2 Effect of TEA and Sodium orthavanadium on K+ fluxes of Pinus tabulaeformis and Pinus tabulaeformis f.shekanensis in short-term and long-term drought stresses

图3 氯化轧与Eosin yellow对短期与长期干旱胁迫下油松和柴松根尖Ca2+流的影响Fig.3 Effect of Gadolinium chloride and Eosin yellow on Ca2+ fluxes of Pinus tabulaeformis and Pinus tabulaeformis f.shekanensis in short-term and long-term drought stresses
3 讨 论
本试验结果显示,2种松树根、叶组织K+、Ca2+含量在长期干旱胁迫下有不同程度下降,但柴松下降幅度明显大于油松,尤其是根。水分亏缺会引起植物各器官K+、Ca2+浓度下降并限制木质部与韧皮部的K+、Ca2+运输,影响光合、呼吸与各种酶活性的代谢过程[6],随着胁迫程度加剧,植物需积累更多K+以维持光合作用,避免引起叶绿体的氧化损伤[28]。由此分析,油松根、叶对K+、Ca2+的高积累有助于其更好地抵御干旱胁迫。
植物组织离子积累能力依赖于根系对离子的吸收与转运,干旱胁迫一方面限制土壤K+向根系转移,降低根系对K+的吸收,另一方面还影响水分吸收[13,24]。本试验结果显示,长期干旱胁迫诱导2种松树K+明显外排(尤其是柴松),且K+外排可被TEA抑制,但可被原钒酸钠加强。由此可见,2种松树在干旱胁迫下对K+的吸收能力降低(柴松降低程度更大),可能造成了其组织K+积累的降低;并且推测K+外排由外向整流型K+通道和非选择性阳离子通道介导,且由H+-ATPase调控。一般逆境胁迫容易引起根尖表皮细胞质膜去极化,增强依赖去极化激活的质膜外向整流型K+通道和非选择性阳离子通道活性介导K+外排[25],但H+-ATPase活性的提高有助于恢复膜电位[22,24],降低外向K+通道与非选择性阳离子通道(KORCs或NSCCs)的活性,从而减少K+外流[29]。由于油松质膜H+-ATP酶活性大于柴松,故依赖于去极化激活的外向K+通道活性小于柴松,从而限制K+外流,故柴松K+外流大于油松。K+持续外排可激活分解代谢酶(如类-caspase蛋白酶、核酸内切酶等),最终诱发细胞程序性死亡[24,29],因此维持一定的细胞K+浓度对于植物抵御干旱胁迫非常重要[26]。但值得注意的是,短期干旱胁迫下,油松K+显著内流,但柴松却显示K+轻微外流。草本植物大麦在PEG与Mannitol胁迫下,抗旱型品种Z25、ZJU9的根尖K+内流大于水分敏感型品种Tamor,推测干旱胁迫可激活内向整流型K+通道(KIR)与HAK/KUP/KT转运蛋白活性,并限制质膜外向整流型K+通道(KOR)活性,从而引起K+内流[11]。植物在渗透胁迫下通常先积累K+(耗能较小)调节渗透势维持细胞膨压,之后才合成有机渗调物质(耗能较大)进行渗透调节[26]。由此说明油松在短期干旱胁迫下可通过根尖吸收K+进行渗透调节,而柴松在短期干旱胁迫下却开始损失少部分K+,表明其抗旱性不及油松。
Ca2+是植物体内最普遍的胁迫信使,本试验结果显示,长期干旱胁迫诱导2种松树根尖Ca2+外排,且柴松外排趋势大于油松。Mak等[12]监测抗旱型与水分亏缺敏感型大豆叶肉细胞Ca2+流发现,敏感型大豆Ca2+外排强烈;Feng等[11]也发现,敏感型大麦根系Ca2+外排明显大于抗旱型大麦,均与本试验结果相似。Ca2+的大量外排不利于钙信号转导,影响植物对逆境的正常响应[11]。本试验中,油松在短期干旱胁迫下呈现显著Ca2+内流,推测干旱胁迫迅速诱导油松产生钙信号,可有效对下游信号与生理响应过程进行调控。但植物细胞钙浓度持续升高对植物正常细胞也有害,一般钙信号产生后,植物细胞将迅速通过膜Ca2+-ATP酶以及Ca2+/H+转运体将细胞内多余的Ca2+转移向质外体或内膜系统,以维持胞质Ca2+平衡[26-27]。本试验结果还显示,Ca2+-ATP酶抑制剂Eosin-Y可有效抑制2种松树的Ca2+外排,但对短期干旱胁迫下油松的Ca2+内流影响不明显,而质膜Ca2+通道抑制剂GdCl3可以促进长期干旱胁迫诱导的油松根尖Ca2+外排,并逆转短期干旱胁迫诱导的Ca2+内流,但对柴松的Ca2+外流影响并不显著,说明短期干旱胁迫诱导油松Ca2+内流由Ca2+通道介导,而长期干旱胁迫诱导2种松树的Ca2+外排是由Ca2+-ATP酶被激活引起的。柴松Ca2+转运系统在调节胞内Ca2+浓度时与油松存在一定差异,持续的Ca2+外排不利于柴松响应干旱胁迫,柴松在短期与长期干旱胁迫下显示持续Ca2+外排,一方面是由Ca2+-ATP酶活性增强引起,另一方面还可能启动了其他Ca2+转运系统,这有待深入探讨。
综上,相较柴松,油松在响应干旱胁迫时诱导了较强的质膜H+-ATP酶活性,恢复膜电位来降低依赖去极化激活的外向K+通道与非选择性阳离子通道活性,减少K+损失;同时激活质膜Ca2+通道介导Ca2+内流产生钙信号响应干旱胁迫,并通过质膜Ca2+-ATP酶将过量胞质Ca2+向外转运以维持细胞Ca2+平衡。降低细胞K+损失并建立细胞Ca2+平衡可能促进油松根、叶组织K+、Ca2+积累,促进渗透调节以及其他代谢过程,因而油松比柴松具有更强的抗旱性。柴松虽生长于黄土高原,但其集中分布区(陕西省富县大麦秸沟地区以及附近的松树沟、大南沟)水分条件良好,为柴松幼苗的生长发育提供了适宜的更新条件,因此柴松在水分亏缺状态下显示了较弱的离子积累能力与K+、Ca2+平衡能力。
[1] Wilkinson S,Davies W J.Drought,ozone,ABA and ethylene:new insights from cell to plant to community [J].Plant Cell and Environment,2009,33(4):510-525.
[2] Anschütz U,Becker D,Shabala S.Going beyond nutrition:regulation of potassium homoeostasis as a common denominator of plant adaptive responses to environment [J].Journal of Plant Physiology,2014,171(9):670-687.
[3] Shabala S,Pottosin I.Regulation of potassium transport in plants under hostile conditions:implications for abiotic and biotic stress tolerance [J].Physiologia Plantarum,2014,151(3):257-279.
[4] Hosy E,Vavasseur A,Mouline K,et al.TheArabidopsisoutward K+channel GORK is involved in regulation of stomatal movements and plant transpiration [J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(9):5549-5554.
[5] Chen Z,Pottosin I I,Cuin T A,et al.Root plasma membrane transporters controlling K+/Na+homeostasis in salt stressed barley [J].Plant Physiology,2007,145(4):1714-1725.
[6] Kusvuran S.Influence of drought stress on growth,ion accumulation and antioxidative enzymes in Okra genotypes [J].International Journal of Biochemistry,2012,14(3):401-406.
[7] Bose J,Pottosin I I,Shabala S S,et al.Calcium efflux systems in stress signaling and adaptation in plants [J].Frontiers in Plant Science,2011,2(12):85.
[8] Schachtman D P,Goodger J Q D.Chemical root to shoot signaling under drought [J].Trends in Plant Science,2008,13(6):281-287.
[9] Blatt M R.Cellular signaling and volume control in stomatal movements in plants [J].Annual Review of Cell and Developmental Biology,2000,16(4):221-241.
[10] Case R M,Eisner D,Gurney A,et al.Evolution of calcium homeostasis:from-birth of the first cell to an omnipresent signalling system [J].Cell Calcium,2007,42(4/5):345-350.
[11] Feng X,Liu W,Zeng F,et al.K+uptake,H+-atpase pumping activity and Ca2+efflux mechanism are involved in drought tolerance of barley [J].Environmental and Experimental Botany,2015,129:57-66.
[12] Mak M,Babla M,Xu S C,et al.Leaf mesophyll K+,H+,and Ca2+fluxes are involved in drought-induced decrease in photosynthesis and stomatal closure in soybean [J].Environmental and Experimental Botany,2014,98(98):1-12.
[13] 王 凯,郭晶晶,刘 爽,等.樟子松和油松根叶对春季干旱胁迫的响应 [J].生态学杂志,2015,34(11):3132-3138.
Wang K,Guo J J,Liu S,et al.Responses of roots and needles ofPinussylvestrisvar.mongolicaandPinustabulaeformisto spring drought stress [J].Chinese Journal of Ecology,2015,34(11):3132-3138.
[14] Liu Z H,Xie Q,Li Z Q.Genetic diversity and taxonomic status ofPinustabulaeformisf.shekanensisrevealed by ISSR markers [J].Genetics and Molecular Research,2015,14(1):1034-1043.
[15] 刘志红.基于分子标记与微形态的柴松分类地位研究 [D].陕西杨凌:西北农林科技大学,2014.
Liu Z H.A taxonomic study onPinustabulaeformisf.shekanensisusing molecular markers and micromorphological traits [D].Yangling,Shaanxi:Northwest A&F University,2014.
[16] 李 龙.柴松与油松形态解剖学和细胞学比较研究 [D].陕西杨凌:西北农林科技大学, 2013.
Li L.Comparison in morphology anatomy and karyotype betweenPinustabulaeformisf.shekanensisandP.abulaeformis[D].Yangling,Shaanxi:Northwest A&F University,2013.
[17] 刘政鸿.黄土高原天然柴松林群落学特性的初步研究 [J].西北植物学报,2003,23(9):1486-1490.
Liu Z H.A preliminary study on community characteristics ofPinustabulaeformisf.shekanensison Loess Plateau [J].Acta Botanica Boreali-Occidentalia Sinica,2003,23(9):1486-1490.
[18] 韦兰英,上官周平.黄土高原子午岭天然柴松林细根垂直分布特征 [J].西北农林科技大学学报(自然科学版),2005,35(7):69-74.
Wei L Y,Shangguan Z P.Vertical distribut ion of the fine root of the naturalPinustabulaeformisf.shekanensisforest in Ziwuling Loess Plateau [J].Journal of Northwest A&F University(Natural Science Edition),2005,35(7):69-74.
[19] 解 庆,刘志红,李周岐.柴松遗传多样性的RAPD分析 [J].西北林学院学报,2011,26(4):112-116.
Xie Q,liu Z H,Li Z Q,et al.Analysis of genetic diversity ofPinustabulaeformisf.shekanensisby RAPD [J].Journal of Northwest Forestry University,2011,26(4):112-116.
[20] Gao D,Qian G,Xu H Y,et al.Physiological responses to gradual drought stress in the diploid hybridPinusdensataand its two parental species [J].Trees-structure and Function,2009,23(4):717-728.
[21] Chen S,Li J,Wang S,et al.Salt,nutrient uptake and transport,and ABA ofPopuluseuphraticaahybrid in response to increasing soil NaCl [J].Trees-structure and Function,2001,15(3):186-194.
[22] Sun J,Wang M J,Ding M Q,et al.H2O2,and cytosolic Ca2+,signals triggered by the PM H+-coupled transport system mediate K+/Na+,homeostasis in NaCl-stressedPopuluseuphratica[J].Plant Cell and Environment,2010,33(6):943-958.
[23] Demidchik V,Cuin T D,Smith S J,et al.Arabidopsisroot K+-efflux conductance activated by hydroxyl radicals:single-channel properties,genetic basis and involvement in stress-induced cell death [J].Journal of Cell Science,2010,123(9):1468-1479.
[24] Sun J,Dai S,Wang R,et al.Calcium mediates root K+/Na+homeostasis in poplar species differing in salt tolerance [J]. Tree Physiol,2009,29(9):1175-1186.
[25] Shabala S,Shabala L,Van V E,et al.Effect of divalent cations on ion fluxes and leaf photochemistry in salinized barley leaves [J].Journal of Experimental Botany,2005,56(415):1369-1378.
[26] Yu Y,Li X,Sun J,et al.Heat shock responses inPopuluseuphratica,cell cultures:important role of crosstalk among hydrogen peroxide,calcium and potassium [J].Plant Cell Tissue and Organ Culture,2016,125(2):1-16.
[27] Huda K M K,Banu M S A,Garg B,et al.OsACA6,a P-type IIB Ca2+ATPase promotes salinity and drought stress tolerance in tobacco by ROS scavenging and enhancing the expression of stress-responsive genes [J].The Plant Journal,2013,76(6):997-1015.
[28] Cakmak I.The role of potassium in alleviating detrimental effects of abiotic stresses in plants [J].Journal of Plant Nutrition and Soil Science,2005,168(4):521-530.
[29] Cuin T A,Shabala S.Amino acids regulate salinity-induced potassium efflux in barley root epidermis [J].Planta,2007,225(3):753-761.
