兔源产ESBLs大肠杆菌耐药性与优势基因型研究
2018-02-27坤清芳余泽辉汪开毓李亚军牟维豪邓钊宾张雨薇
坤清芳,耿 毅,余泽辉,汪开毓,李亚军,牟维豪,邓钊宾,张雨薇
(1四川农业大学 动物医学院,四川 成都 611130;2阿坝州中等职业技术学校,四川 茂县 623200)
β-内酰胺类药物是医学临床抗感染治疗中使用最广的抗生素之一,在兽医临床上也发挥着极其重要的作用,但随着药物的广泛使用,细菌耐药现象日益严重。目前,细菌对该类药物耐药的一个重要机制是产生超广谱 β-内酰胺酶(Extended-spectrum β-lactamases, ESBLs),ESBLs多数是由质粒介导的能水解氧亚氨基β-内酰胺类药物的一类水解酶,伴随着β-内酰胺类药物的广泛应用以及不合理的使用,产ESBLs的菌株也变得越来越常见,并在选择和进化压力下产生多种不同的ESBLs基因型和基因亚型菌株[1]。编码ESBLs的基因还往往与其他耐药基因共存于同一质粒中,导致细菌产生多重耐药性[2]。产ESBLs的菌株可通过动物饲养、肉制品加工及食用过程传递给人,目前国外已有关于产ESBLs菌株引起疾病暴发流行的报道[3]。ESBLs 型别众多,其中主要流行TEM型、SHV型、CTX-M型和OXA型ESBLs。
TEM-ESBLs来源于TEM-1和TEM-2基因序列发生突变造成1~5个氨基酸改变而形成的一系列酶,目前已发现200多种亚型;SHV-ESBLs主要来自肺炎克雷伯菌,该类型酶对头孢噻吩的巯基具有水解作用; CTX-M-ESBLs属于一类很特别的A类活性位点丝氨酸β-内酰胺酶,近年来CTX-M-ESBLs在全球范围内快速传播,已经替代TEM型和SHV 型成为全球最流行的ESBLs;OXA-ESBLs 是近年来数量迅速增加的一类ESBLs,多数是由OXA-1、OXA-2和OXA-10基因序列发生突变造成1个或数个氨基酸改变而形成的一系列酶,目前已发现100多种亚型。ESBLs不仅型别众多,且不同国家或地区流行的基因型和基因亚型都存在差异。大肠杆菌既是临床产ESBLs的代表性菌属,又是重要的人畜致病菌,因此国内外对产ESBLs大肠杆菌开展了大量研究,目前已有鸡源、鸭源、猪源和牛羊源产ESBLs大肠杆菌的相关研究报道[4-6],而有关兔源产ESBLs大肠杆菌的研究却鲜有报道。本研究以四川省兔源大肠杆菌为研究对象,对其产 ESBLs大肠杆菌耐药性及优势基因型进行研究,以初步了解四川地区产ESBLs大肠杆菌菌株的耐药情况,及ESBLs的优势基因型和基因亚型,为指导临床合理使用抗菌药物,以及进一步探讨大肠杆菌ESBLs耐药基因的进化机制提供参考。
1 材料与方法
1.1 材 料
1.1.1 菌 株 2014-2015年,从四川省雅安、自贡、绵阳、德阳和成都等地区不同家兔养殖场分离鉴定出大肠杆菌共97株,其中雅安20株、自贡26株、绵阳11株、德阳15株、成都25株,菌株均由四川农业大学动物医学院病理室保存;大肠埃希菌 ATCC25922购自中国普通微生物菌种保存中心。
1.1.2 主要试剂 MH培养基和LB肉汤培养基,购自北京奥博星生物有限公司;药敏纸片,购自杭州天和微生物试剂有限公司;2×startTaqMix、细菌质粒小提试剂盒,购自天根生化科技有限公司;DNA Marker DL2000 、琼脂糖,购自TaKaRa公司。
1.2 方 法
1.2.1 产ESBLs菌株筛选 表型检测采用CLSI推荐的双纸片法[7]进行操作和判读。初筛试验:将受试菌均匀涂布于 MH 琼脂平板,贴头孢他啶(CAZ)、头孢噻肟(CTX)药敏纸片,37 ℃培养16 h,观测抑菌圈直径,满足CAZ抑菌圈直径≤22 mm 或CTX抑菌圈直径≤27 mm的菌株可能为产ESBLs 菌株。确证试验:将受试菌均匀涂布于 MH 琼脂平板,贴头孢他啶(CAZ)、头孢他啶/克拉维酸(CAZ/Clav)和头孢噻肟(CTX)、头孢噻肟/克拉维酸(CTX/Clav)2组药敏纸片,37 ℃培养16 h,若任一组药物的抑菌圈直径差≥5 mm,则可判定相应菌株为产ESBLs菌株。
1.2.2 药敏试验 采用K-B纸片扩散法进行药物敏感性试验。将97株大肠杆菌接种于LB肉汤培养基,37 ℃振荡培养18 h,麦氏比浊法调整菌液细菌含量为1.0×108CFU/mL,将菌液均匀涂布于MH琼脂平板,贴药敏纸片,37 ℃培养16~18 h,参照CLSI[7]的标准进行结果判断。数据统计时,将中介菌株直接归于耐药菌株。
1.2.3 ESBLs基因型和基因亚型的检测 采用PCR反应检测ESBLs的基因型和基因亚型,参照文献[8-10]设计引物(表1),交由成都擎科梓熙生物技术有限公司合成。使用细菌质粒小提试剂盒提取产ESBLs菌株DNA模板。PCR反应体系为25 μL:DNA模板2 μL,上下游引物各1 μL,2×TapPCR Master Mix 12.5 μL,加ddH2O至25 μL。TEM、SHV、OXA基因PCR程序:94 ℃预变性 5 min;94 ℃变性40 s,60 ℃退火40 s,72 ℃延伸1 min,共35个循环;72 ℃延伸 7 min。CTX-M基因PCR程序为:94 ℃预变性4 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸 7 min。CTX-M-1、CTX-M-2、CTX-M-9基因组PCR程序:94 ℃预变性4 min;94 ℃变性45 s,52 ℃/55 ℃/50 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃延伸7 min。反应结束后取5 μL扩增产物经1%琼脂糖凝胶电泳检测,并将阳性产物送至成都擎科梓熙生物技术有限公司进行测序,将获得的基因序列用NCBI中的Blast、DNA Star软件和 MEGA5.1 软件进行序列对比分析,确定基因型和基因亚型。

表1 ESBLs基因的引物序列Table 1 Primers sequences of ESBLs genes
2 结果与分析
2.1 ESBLs检测结果
97株兔源大肠杆菌在初筛试验中,有76株为疑似产ESBLs菌;经确证试验,76株疑似菌株中有69株被确认为产ESBLs菌,占总菌株数的71.13%(69/97),非产ESBLs菌有28株,占总菌株数的28.87%(28/97)。
2.2 产ESBLs和非产ESBLs菌株耐药情况比较
产ESBLs和非产ESBLs兔源大肠杆菌菌株的耐药性比较见表2。

表2 产ESBLs和非产ESBLs兔源大肠杆菌菌株的耐药性比较Table 2 Comparison of drug-resistance between producing and non-producing ESBLs Escherichia coli strains isolated from rabbits
注:同行数据后标不同小写字母表示差异显著(P<0.05)。
Note:Different lowercase letters in each row indicate significant difference (P<0.05).
由表2可知,产ESBLs菌对12种药物的耐药率均高于非产ESBLs菌株,其中头孢西丁、头孢唑啉、头孢他啶、阿米卡星和诺氟沙星的耐药率显著高于非产ESBLs菌(P<0.05)。产ESBLs菌多重耐药率极显著高于非产ESBLs菌,其多重耐药率分别为100%(69/69)和85.71%(24/28)。
2.3 ESBLs基因型和基因亚型的检测
2.3.1 基因型检测 对产ESBLs菌的基因型进行检测,结果表明,未检出SHV基因;TEM、CTX-M和OXA基因片段大小分别为861,593和564 bp,与预期结果一致(图1)。将PCR产物测序结果在NCBI上进行Blast比对,TEM阳性产物序列与GenBank上收录的基因(登录号:KT956435.1)相似性介于99%~100%,CTX-M阳性产物序列与GenBank上收录的基因(登录号:LC091534.1)相似性介于99%~100%,OXA阳性产物序列与GenBank上收录的基因(登录号:KR780477.1)相似性介于99%~100%,表明所扩增的片段为对应的基因。由表3可知,69株产ESBLs菌中检出TEM基因型43株(占62.32%)、CTX-M基因型44株(占63.77%)和OXA基因型16株(占23.19%);在69株产ESBLs菌中,44.93%的菌株只携带1个ESBLs基因,55.07%的菌株携带2个或2个以上的ESBLs基因。
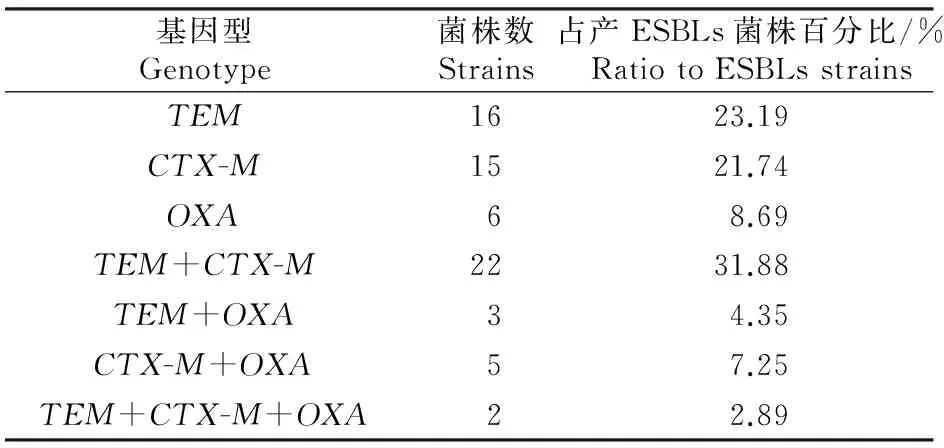
表3 69株产ESBLs兔源大肠杆菌菌株基因型检出情况Table 3 Detection of genotypes of 69 ESBLs-producing Escherichia coli strains isolated from rabbits

M.DNA Marker;+.阳性对照;-.阴性对照;1~6.分离株M.DNA Marker;+.Positive control;-.Negative control;1-6.Isolated strains
2.3.2 基因亚型检测TEM亚型:将43株TEM型阳性菌株进行测序,菌株分属于TEM-57(1株)、TEM-116(2株)和TEM-1(40株)等3种基因亚型,检出率分别为2.33%,4.65%和93.02%。
CTX-M亚型:对44株CTX-M型阳性菌株进行基因亚型组检测,检测到CTX-M-1组阳性菌株9株和CTX-M-9组阳性菌株36株,检出率分别为20.45%和81.82%,其中1株分离菌同时为CTX-M-1组和CTX-M-9组阳性菌株,未检测到CTX-M-2组阳性菌株。CTX-M-1亚型组中较流行的基因亚型包括CTX-M-1、CTX-M-2、CTX-M-3、CTX-M-15和CTX-M-55等;CTX-M-9亚型组中较流行的基因亚型包括CTX-M-9、CTX-M-14、CTX-M-17、CTX-M-24、CTX-M-27和CTX-M-65等。本研究中,CTX-M-1组阳性菌株分属于CTX-M-15 (1株)和CTX-M-55 (8株) 2种基因亚型,检出率分别为2.27%和18.18%;CTX-M-9组阳性菌株分属于CTX-M-17(1株)、CTX-M-65(6株)和CTX-M-14(29株) 3种基因亚型,检出率分别为2.27%,13.64%和65.91%。
OXA亚型:将16株OXA型阳性菌株进行测序,菌株分属于OXA-10(1株)和OXA-1(15株) 2种基因亚型,检出率分别为6.25%和93.75%。
综上可知,产ESBLs大肠杆菌菌株分属于TEM-57、TEM-116、TEM-1、CTX-M-15、CTX-M-55、CTX-M-17、CTX-M-65、CTX-M-14、OXA-10、OXA-1等10个基因亚型,其中TEM-1 亚型、CTX-M-14亚型和OXA-1亚型分别是各基因型的优势基因亚型。
3 讨 论
自1983年德国首次发现产ESBLs菌株以来,世界各地产ESBLs菌株的检出率呈现逐年上升趋势,分布范围不断扩大,尤其值得注意的是编码这些酶的基因不仅可通过接合、转化以及转导等方式在细菌间快速扩散,还常常与其他非ESBLs酶耐药基因整合于同一质粒,导致多种耐药基因同时随质粒广泛传播,给临床治疗带来困难,因此开展ESBLs监测对指导临床有效用药是非常必要的[11-13]。本研究采用CLSI推荐的标准方法对分离自四川省各地区97株兔源大肠杆菌进行ESBLs表型检测,检出率为71.13%,该结果高于西藏地区鸡源大肠杆菌的检出率25%[14],广东省食品动物源大肠杆菌的检出率19.37%[15],四川省畜禽源大肠杆菌的检出率36.83%[5],而低于青岛地区鸡源大肠杆菌的检出率83.13%[3]的检测结果,说明不同来源、不同地区的产ESBLs菌株流行分布存在差异,且此次较高的检出率提示产ESBLs菌株在四川地区家兔养殖场中普遍流行。刘保光等[16]发现,产ESBLs菌株不仅对青霉素类、头孢菌素类药物表现出耐药性,而且还同时对多类药物表现出较高的交叉耐药性和多重耐药性;Yuan等[17]研究表明,80.6%的产 ESBLs 菌株表现多重耐药现象;曲志娜等[3]研究表明,产ESBLs菌株对多类药物的耐药率在80%以上,且产ESBLs 菌的多重耐药程度显著高于非产ESBLs 菌。本试验中产ESBLs菌株对12种药物的耐药率均高于非产ESBLs菌株,其中对头孢西丁、头孢唑啉、头孢他啶、阿米卡星和诺氟沙星的耐药率在产ESBLs菌和非产ESBLs菌中差异显著(P<0.05);产ESBLs菌多重耐药程度显著高于非产ESBLs菌,该结果与上述研究结果一致,进一步证实了ESBLs基因可能会与其他非ESBLs酶基因整合,导致多药耐药的发生。
ESBLs基因型众多,其中主要流行的基因型有TEM、SHV、CTX-M和OXA。本试验中TEM、CTX-M和OXA型基因的检出率分别为62.32%(43/69),63.77%(44/69)和23.19%(16/69),未检测到SHV基因,该结果与国内其他动物源产ESBLs菌株基因型[3,5,15,17]基本一致,以TEM和CTX-M基因为主要流行基因型。此外,尽管OXA基因的检出率低于TEM和CTX-M基因的检出率,但该基因的检出说明四川地区兔源大肠杆菌中流行ESBLs基因的多样性。
TEM-1基因是目前革兰氏阴性菌中流行范围最广、检出率最高的TEM基因亚型。Paterson等[18]在调查意大利境内某医院22株产TEM-ESBLs大肠杆菌时发现,所有菌株携带的TEM基因亚型均为TEM-1亚型;Kiratisin等[19]报道,泰国境内产TEM-ESBLs大肠杆菌和肺炎克雷伯菌的基因亚型均为TEM-1亚型;Ahmed等[20]检测了日本广岛区零售鸡肉的69株大肠杆菌,发现产TEM- ESBLs菌株的基因亚型均为TEM-1亚型;苑丽等[21]检测河南地区鸡源大肠杆菌时发现,产TEM-ESBLs菌株的基因亚型均为TEM-1亚型;曲志娜等[3]研究表明,TEM-1亚型是青岛地区鸡源大肠杆菌携带的主要TEM基因亚型。本试验中TEM-1基因的检出率为93.02%(40/43),表明TEM-1亚型是四川地区兔源大肠杆菌产TEM-ESBLs菌株携带的主要基因亚型。
CTX-M-ESBLs根据其氨基酸同源性分为6 个亚型组:CTX-M-1、CTX-M-2、CTX-M-8、CTX-M-9、CTX-M-25 和CTX-M-45[22],其中CTX-M-1和CTX-M-9组是研究报道最多的酶类[23]。该类ESBLs在全球不同国家和地区之间呈现不同的流行趋势,且不同国家和地区流行亚型具有很大差异,即使同一国家的不同地区流行的亚型也复杂多变。据资料显示,法国和葡萄牙流行CTX-M-1亚型,西班牙流行CTX-M-14亚型,日本流行CTX-M-18亚型,而中国同时流行CTX-M-14、CTX-M-24、CTX-M-27和CTX-M-65[6]等亚型。本试验结果显示,基因亚型组CTX-M-1 组(20.45%,9/44)和CTX-M-9组(81.82%,36/44)同时流行于四川地区兔源大肠杆菌中,但以CTX-M-9 亚型组为主。苑丽等[21]报道,河南地区流行的基因亚型为CTX-M-14和CTX-M-65;曲志娜等[3]报道,青岛地区流行的基因亚型为CTX-M-65和CTX-M-55;佟盼盼[9]研究发现,东北三省和江苏省流行的基因亚型为CTX-M-15和CTX-M-55。本试验结果表明,四川地区最流行的CTX-M基因亚型为CTX-M-14亚型(65.91%,29/44),其次为CTX-M-55亚型(18.18%,8/44)和CTX-M-65亚型(13.64%,6/44),该结果与其他地区报道流行的CTX-M基因亚型不同,进一步说明CTX-M基因亚型的流行分布存在地区差异。
OXA-ESBLs 对头孢菌素的水解能力不一,其水解头孢菌素的能力低于水解青霉素类,是近年来数量迅速增加的一类 ESBLs。目前研究发现,国外人源大肠杆菌OXA基因亚型以OXA-2亚型和OXA-10亚型为主,国内则以OXA-1、OXA-2和OXA-10亚型为主[9]。苑丽等[24]报道,河南省鸡源大肠杆菌OXA-1亚型的检出率为22.45%;曲志娜等[3]报道,青岛地区鸡源大肠杆菌中OXA-1亚型的检出率高达47.83%;佟盼盼[9]研究发现,东三省和江苏省OXA型基因中以OXA-1亚型为主要基因亚型。本试验结果显示,OXA基因的检出率为23.19%(16/69),其中OXA-1为主要的OXA基因亚型(93.75%,15/16)。
4 结 论
四川地区兔源产ESBLs大肠杆菌多重耐药性显著高于非产ESBLs大肠杆菌;TEM、CTX-M和OXA基因型的检出率分别为62.32%,63.77%和23.19%,未检测到SHV基因型,其中TEM和CTX-M基因型是产 ESBLs大肠杆菌中主要流行的ESBLs基因型,与国内其他地区流行的基因型一致,但基因亚型存在差异,TEM-1亚型、CTX-M-14亚型和OXA-1亚型分别是各基因型的优势基因亚型。
[1] 谭文彬.细菌耐药的基因机理研究进展 [J].中国病原生物学杂志,2009(7):543-544,555.
Tan W B.Research advances in genetic mechanisms of bacterial antibiotic resistance [J].Journal of Pathogen Biology,2009(7):543-544,555.
[2] Nikaido H.Multidrug resistance in bacteria [J].Annual Review of Biochemistry,2009,78:119-146.
[3] 曲志娜,刘红玉,王 娟,等.青岛地区产ESBLs鸡源大肠杆菌耐药性调查与优势基因型分析 [J].中国农业科学,2015,48(10):2058-2066.
Qu Z N,Liu H Y,Wang J,et al.Antimicrobial resistance investigation and dominant denotype analysis of ESBLs-producingEscherichiacoilstrains from chicken in Qingdao [J].Scientia Agricultura Sinica,2015,48(10):2058-2066.
[4] 曲志娜,张 颖,李玉清,等.鸡、猪大肠杆菌ESBLs基因型检测及耐药性分析 [J].中国农学通报,2013,29(8):50-54.
Qu Z N,Zhang Y,Li Y Q,et al.Genotype detection of ESBLs and antibiotic resistance analysis inE.colistrains from chickens and pigs [J].Chinese Agricultural Science Bulletin,2013,29(8):50-54.
[5] 舒 刚,侯 蓉,林居纯,等.畜禽源大肠杆菌质粒介导β-内酰胺酶检测及其耐药基因特性研究 [J].中国农业大学学报,2016,21(8):92-97.
Shu G,Hou R,Lin J C,et al.Detection ofEscherichiacoliplasmid-mediated β-lactamases genotype from livestock and poultry and characterization of antimicrobial resistance [J].Journal of China Agricultural University,2016,21(8):92-97.
[6] Randall L P,Clouting C,Horton R A,et al.Prevalence ofEscherichiacolicarrying extended-spectrum beta-lactamases (CTX-M and TEM-52) from broiler chickens and turkeys in Great Britain between 2006 and 2009 [J].The Journal of Antimicrobial Chemotherapy,2011,66(1):86-95.
[7] M100-S22 Performance standarda for antimicrobial susceptility testing:twentieth information supplements [S].Pennsylvania 19087 USA:Clinical and Laboratory Standards Institute,2012.
[8] 高彤彤.大熊猫粪便及环境中大肠杆菌耐药性和质粒介导ESBLs酶耐药基因检测 [D].四川雅安:四川农业大学,2014.
Gao T T.The detection of resistance and plasmid-mediated ESBLs inEscherichiacoilstrains from feces of pandas and living environment [D].Ya’an,Sichuan:Sichuan Agricultural University,2014.
[9] 佟盼盼.鸡粪便菌耐药基因及其产ESBLs大肠杆菌耐药性的研究 [D].吉林长春:吉林大学,2015.
Tong P P.Study on fecal microbiota resistant gene and antibiotics resistance of ESBLs-producingEscherichiacolichicken origin [D].Changchun,Jilin:Jilin University,2015.
[10] Lucia P,Monica M,Antonia M,et al.Detection of CTX-M type β-lactamase genes in fecalEscherichiacoliisolates from healthy children in bolivia and peru [J].Antimicrobial Ggents and Chemotherapy,2004,48(12):4556-4561.
[11] Jacob S,Shiri N V,Inna C,et al.Extended-spectrum beta-lacta-mases among enterobacter isolates obtained in Tel Aviv,Israel [J].Antimicrobial Agents and Chemotherapy,2005,49(3):1150-1156.
[12] Lahlaouia M H,Ben Haj Khalifab A,Ben Moussa M.Epidemiology of enterobacteriaceae producing CTX-M type extendedspectrum β-lactamase (ESBL) [J].Medecine et Maladies Infectieuses,2004,44(9):400-404.
[13] Trott D.β-lactam resistance in gramnegatuve pathogens isolated from animals [J].Current Pharmaceutical Design,2013,9(2):4239-4249.
[14] 刘保光,世洪勋,格桑顿旦,等.西藏地区藏鸡大肠杆菌超广谱 β-内酰胺酶检测及药物敏感性分析 [J].家畜生态学报,2013,34(3):5-8.
Liu B G,Shi H X,Ge S D D,et al.Deternimation of ESBLs and antibiotics susceptibility test analysis forEscherichiacolifrom the chickens in Xizang [J].Acta Ecologiae Animalis Domastici,2013,34(3):5-8.
[15] 汤 电,张浩吉,纪雪筱,等.广东地区患病食品动物源大肠杆菌ESBLs和AmpC酶流行分布调查 [J].中国兽医学报,2012,32(2):242-248.
Tang D,Zhang H J,Ji X X,et al.Prevalence of plasmid mediated ESBLs and AmpC-type β-lactamases amongE.coliisolated from sick food-producing animals in Guangdong [J].Chinese Journal of Veterinary Science,2012,32(2):242-248.
[16] 刘保光,刘建华,吴 华,等.舒巴坦钠和EDTA使产ESBLs鸡大肠杆菌恢复对抗菌药物敏感性 [J].湖南农业大学学报(自然科学版),2010,32(2):242-248.
Liu B G,Liu J H,Wu H,et al.Recovery of antibacterial sensitivity of ESBLs-producing fowlE.coliby sulbactam and EDTA [J].Journal of Hunan Agricultural University(Nat Sci),2010,32(2):242-248.
[17] Yuan L,Liu J H,Hu G Z,et al.Molecular characterization of extended-spectrum β-lactamase-producingEscherichiacoliisolates from chickens in Henan Province,China [J].Journal of Medical Microbiology,2009,58(11):1449-1453.
[18] Paterson D L,Bonomo R A.Extended-spectrum beta-lactamases:a clinical update [J].Clinical Microbiology Reviews,2005,18(4):657-686.
[19] Kiratisin P,Apisarnthanarak A,Laesripa C,et al.Molecular characterization and epidemiology of extended-spectrum-β-lactamase-producingEscherichiacoliandKlebsiellapneumoniaeisolates causing health care-associated infection in Thailand,where the CTX-M family is endemic [J].Antimicrobial Agents and Chemotherapy,2008,52(8):2818-2824.
[20] Ahmed A M,Shimabukuro H,Shimamoto T.Isolation and molecular characterization of multidrug-resistant strains ofEscherichiacoliandSalmonellafrom retail chicken meat in Japan [J].Journal of Food Science,2009,74(7):405-410.
[21] 苑 丽,刘建华,胡功政,等.鸡大肠杆菌TEM和CTX-M型超广谱β-内酰胺酶基因分型研究 [J].中国农业科学,2010,43(20):4310-4316.
Yuan L,Liu J H,Hu G Z,et al.Genotypes of TEM-type and CTX-M-type extended-spectrum β-lactamases produced byEscherichiacoliisolated from the fowl [J].Scientia Agricultura Sinica,2010,43(20):4310-4316.
[22] Zhao W H,Hu Z Q.Epidemiology and genetics of CTX-M extended-spectrum β-lactamases in gram-negative bacteria [J].Critical Reviews in Microbiology,2013,39(1):79-101.
[23] Lahlaour H,Ben Haj Khalifa A,Ben Moussa M.Epidemiology of enterobacteriaceae producing CTX-M type extended spectrum β-lactamase(ESBLs) [J].Medecine et Maladies Infectieuses,2014,44(9):400-404.
[24] 苑 丽,莫 娟,胡功政,等.49 株鸡大肠杆菌 OXA 型β-内酰胺酶的检测 [J].江西农业学报,2009,21(8):1-3.
Yuan L,Mo J,Hu G Z,et al.Detection of OXA-type β-lactamases among 49 strains ofEscherichiacoliisolated from chickens [J].Acta Agriculturae Jiangxi,2009,21(8):1-3.
