杂色云芝酸溶性多糖对H22荷瘤小鼠的抗肿瘤作用
2018-02-27葛唯佳图力古尔郜玉钢祝洪艳包海鹰
葛唯佳,赵 岩,图力古尔,李 伟,郜玉钢,祝洪艳,李 玉,包海鹰,
(吉林农业大学a中药材学院,b食药用菌教育部工程研究中心,吉林 长春 130118)
杂色云芝(Trametesversicolor(L.) Lloyd),又称彩云革盖菌或瓦菌,是多孔菌科云芝的子实体或菌丝体[1],发源于我国的原始森林,我国东南西北均有分布,多寄生于阔叶树倒木和朽木上[2];体积较小,无柄,呈覆瓦状或莲座状。云芝是一种大型药用真菌,常用于癌症的辅助治疗,商业化产品如云芝肝泰。现代研究表明,云芝属真菌具有很多生物活性,如抗肿瘤[3]、调节免疫[4]、抗氧化[5]、抗衰老[6]、消炎保肝[7]、镇痛、降血脂[8]及抗动脉粥样硬化[9]等。但未见有关杂色云芝抗肿瘤活性的报道,为此,本试验以肝癌H22移植瘤小鼠为模型,研究杂色云芝酸溶性多糖在小鼠模型上的抗肿瘤活性及免疫活性表现,以期为其开发利用提供依据。
1 材料与方法
1.1 材 料
1.1.1 试验动物 雄性ICR小鼠,质量18~20 g/只,SPF级,动物合格证号:SCXK(吉)2011-0004,购自长春亿斯实验动物技术有限公司。
1.1.2 样品、试剂和仪器 杂色云芝(野生品,采集于吉林省长白山区,由包海鹰教授鉴定);葡萄糖、葡萄糖醛酸(购于上海源叶),咔唑(购于阿拉丁),H22小鼠肝癌细胞株(购自中国科学院上海细胞所),注射用环磷酰胺(CTX)(购于上海活乐生物科技有限公司),小鼠白细胞介素-6 (IL-6)、γ-干扰素(IFN-γ)、肿瘤坏死因子-α (TNF-α) ELISA试剂盒(购于美国R&D公司),谷丙转氨酶(ALT)、尿素氮(BUN)和肌酐(CRE)测试盒(购于南京建成生物技术研究所),其他试剂均为分析纯;超净工作台(美国BEKMAN公司),电子分析天平(购于常熟市百灵天平仪器有限公司),酶标仪(美国Bio-Tek公司),UV-6100双光束紫外可见分光光度计(购于上海美普达公司)。
1.2 方 法
1.2.1 杂色云芝酸溶性多糖的制备 将干燥的杂色云芝用体积分数95%乙醇脱脂后,用6倍体积的盐酸(pH=2)室温浸泡过夜,超声处理3次,每次3 h,过滤,合并滤液,3 500 r/min离心10 min,上清液加NaOH中和,透析,减压浓缩,浓缩液加入3倍体积的体积分数95%乙醇醇析,沉淀反复用无水乙醇清洗,即得杂色云芝酸溶性多糖(以下简称“CL-A多糖”)。
1.2.2 酸溶性多糖内中性糖、葡萄糖醛酸及蛋白含量的测定 采用苯酚-浓硫酸法测定杂色云芝酸溶性多糖中的中性糖含量,硫酸-咔唑法测定葡萄糖醛酸含量[10],考马斯亮蓝法测定蛋白含量[11]。
1.2.3 H22皮下移植瘤小鼠模型的建立 常规方法复苏H22小鼠肝癌细胞,取0.2 mL细胞悬液注射到小鼠腹腔内,连续传2代。于无菌条件下抽取H22腹水瘤小鼠的腹水,用无菌生理盐水稀释后,1 000 r/min 离心5 min,再用生理盐水洗涤2次,调整细胞密度为1×107个/mL,取0.2 mL瘤细胞悬液接种到健康小鼠的右腋窝皮下,3 d后长出瘤块即为造模成功。
1.2.4 动物分组及处理 小鼠适应性饲养1周,于接种瘤细胞悬液后第2天,把小鼠随机分成空白对照组、模型组、治疗组和CTX组,每组10只。其中,CTX组小鼠于腹腔注射环磷酰胺30 mg/kg;治疗组分为高、中、低3个剂量组,分别灌胃CL-A多糖280,140和70 mg/kg;模型组灌胃等量生理盐水;空白对照组不接种瘤细胞悬液,仅灌胃等量生理盐水;每天给药1次。各组连续给药10 d,末次给药后禁食不禁水,16 h后采血断颈处死,收集肿瘤块及各组织。
1.2.5 小鼠抑瘤率、脏器指数以及血清指标的测定 分别称肿瘤块、肝、脾和胸腺的质量,计算抑瘤率、肝指数、脾指数和胸腺指数。从血液中分离出血清,用ELISA法测IL-6、TNF-α、IFN-γ含量,比色法检测ALT、BUN和CRE水平。
抑瘤率=(模型组瘤质量-药物组瘤质量)/模型组瘤质量×100%。
脏器指数=脏器质量/体质量。
1.2.6 肿瘤组织H&E染色 取肿瘤组织用体积分数10%的多聚甲醛溶液固定,梯度酒精脱水、浸蜡、石蜡包埋、切片和苏木素-伊红(H&E)染色,光镜观察肿瘤组织的形态结构。
1.2.7 肿瘤组织凋亡细胞检测 采用TUNEL标记法,在光镜下观察肿瘤组织中细胞的凋亡情况。
2 结果与分析
2.1 CL-A多糖及蛋白含量
通过测定,得出CL-A多糖内中性糖含量为656 mg/g,葡萄糖醛酸含量为38 mg/g,蛋白含量为18 mg/g。
2.2 CL-A多糖对小鼠肿瘤生长的影响
由表1可见,CL-A多糖高、中、低剂量组能不同程度抑制小鼠H22肝癌移植瘤的生长;同模型组相比,高、中剂量组和CTX组荷瘤小鼠瘤质量显著降低(P<0.05),且呈剂量依赖性。CL-A多糖高、中、低剂量组和CTX组的抑瘤率分别是55.56%,47.01%,37.52%和68.14%。
2.3 CL-A多糖对小鼠体质量和脏器指数的影响
CL-A多糖对肝癌H22移植瘤小鼠体质量及脏器指数的影响见表2。
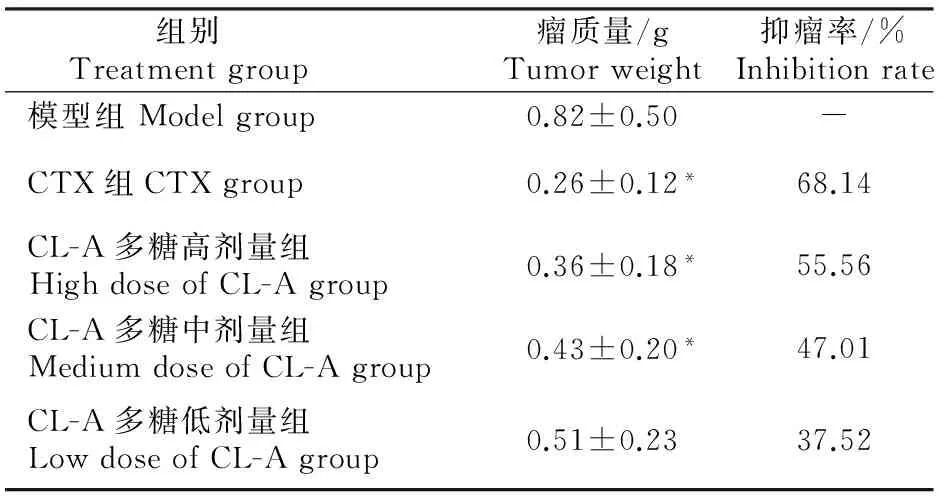
表1 CL-A多糖对H22肝癌移植瘤小鼠肿瘤生长的影响Table 1 Effect of acid-soluble polysaccharides from Trametes versicolor(L.) Lloyd (CL-A) on tumor growth of H22-bearing mice(n=10)
注:与模型组相比,*表示差异显著(P<0.05),**表示差异极显著。下表同。
Note:Compared with the model group, *indicates significant difference (P<0.05),**indicates remarkable difference (P<0.01).The same below.
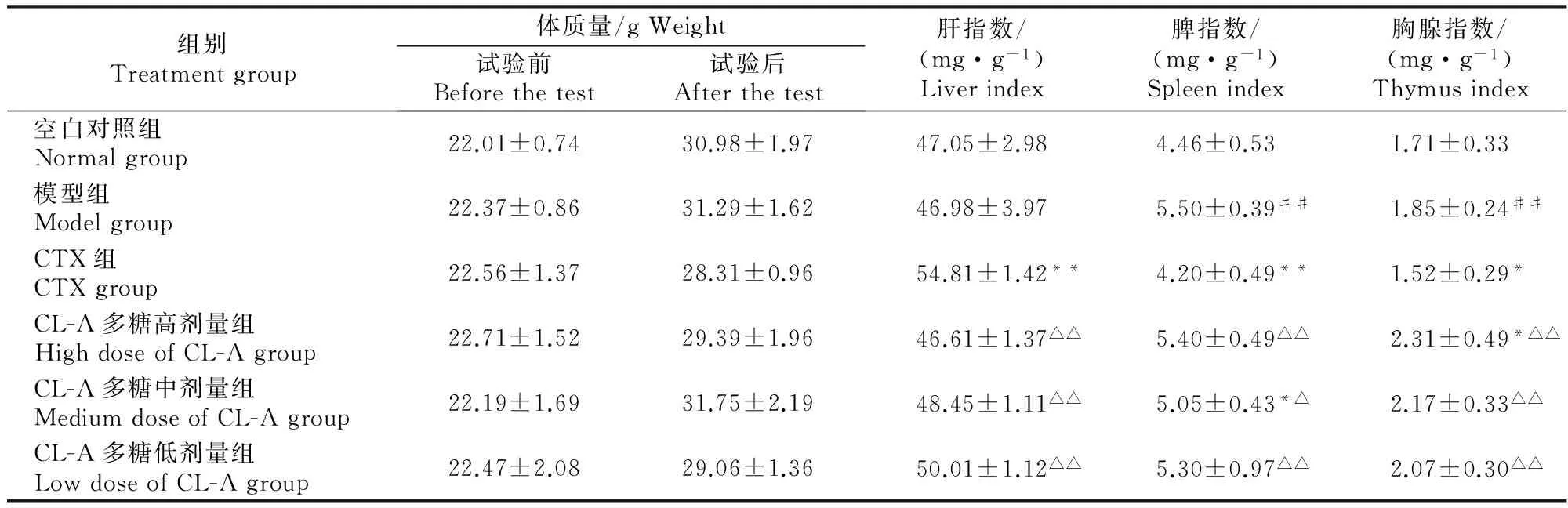
表2 CL-A多糖对肝癌H22移植瘤小鼠体质量及脏器指数的影响Table 2 Effect of acid-soluble polysaccharides from Trametes versicolor(L.) Lloyd (CL-A) on body weight and immune organ index of H22-bearing mice (n=10)
注:与CTX组比,△表示差异显著(P<0.05),△△表示差异极显著(P<0.01);与空白对照组比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01)。下表同。
Note:Compared with the CTX group,△ indicates significant difference (P<0.05),△△ indicates remarkable difference (P<0.01).Compared with the normal group,# indicates significant difference (P<0.05),and ## indicates remarkable difference (P<0.01).The same below.
由表2可见,给药10 d后,荷瘤小鼠试验前后的体质量和各脏器指数均发生变化,与空白对照组相比,模型组小鼠脾指数、胸腺指数极显著升高(P<0.01)。CTX作为免疫抑制剂,同模型组相比,CTX组小鼠脾指数极显著降低(P<0.01),胸腺指数显著降低(P<0.05)。与CTX组相比,CL-A多糖3个剂量组脾指数显著或极显著升高,胸腺指数极显著升高,而肝指数极显著降低,说明CL-A多糖对免疫器官有保护作用。与模型组相比,CL-A多糖高、中、低剂量组肝指数无明显差异;脾指数仅中剂量组显著降低(P<0.05);胸腺指数仅高剂量组显著升高。
2.4 CL-A多糖对小鼠血清指标的影响
由表3可见,与空白对照组相比,模型组小鼠ALT、BUN和CRE水平极显著升高(P<0.01),表明在肿瘤生长过程中肝功能和肾功能受损。与模型组相比,CL-A多糖高、中、低剂量组ALT、BUN、CRE水平均极显著降低(P<0.01),说明CL-A多糖对荷瘤小鼠的肝脏和肾脏有保护作用。

表3 CL-A多糖对肝癌H22移植瘤小鼠ALT、BUN、CRE的影响Table 3 Effect of acid-soluble polysaccharides from Trametes versicolor(L.) Lloyd (CL-A) on H22-bearing mice serum factor cells ALT,BUN,CRE(n=10)
由表4可见,与空白对照组相比,模型组小鼠IL-6水平极显著升高(P<0.01),IFN-γ、TNF-α水平极显著降低(P<0.01)。与模型组相比,CL-A多糖3个剂量组和CTX组IL-6水平极显著降低(P<0.01),IFN-γ和TNF-α水平极显著升高(P<0.01)。
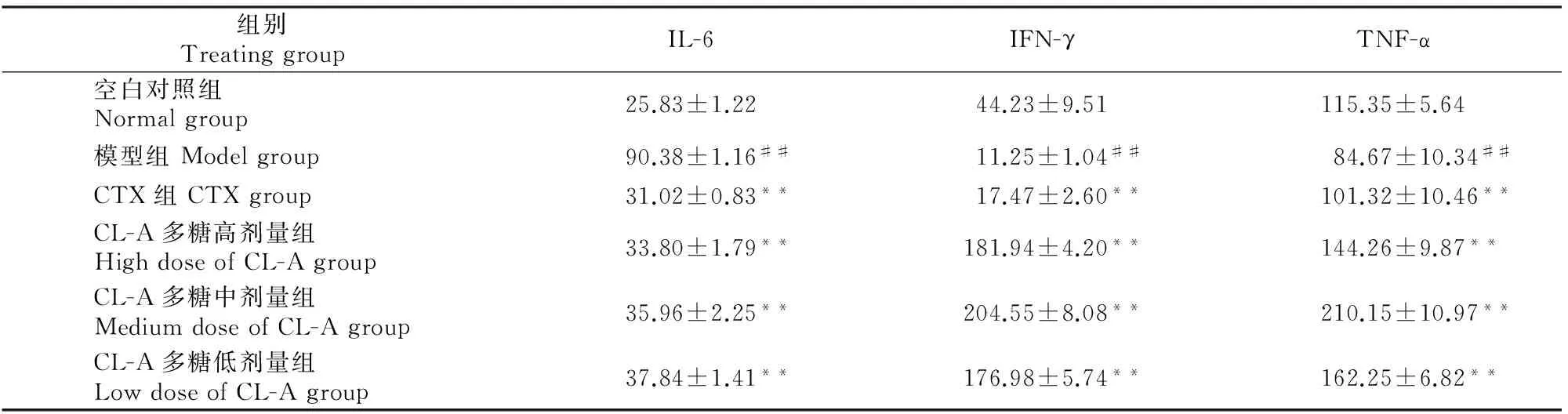
表4 CL-A多糖对肝癌H22移植瘤小鼠IL-6、IFN-γ、TNF-α的影响Table 4 Effect of acid-soluble polysaccharides from Trametes versicolor(L.) Lloyd (CL-A) on H22-bearing mice serum factor cells IL-6,IFN-γ,TNF-α(n=10) ng/L
2.5 H22荷瘤小鼠肿瘤组织的H&E染色
对小鼠肿瘤组织进行H&E染色,观察肿瘤细胞的生长状态,进一步判断CL-A的抗肿瘤效果。结果表明,给药10 d后,模型组小鼠肿瘤细胞生长状态良好,细胞核清晰可见,呈深色(图1-A1)。与模型组相比,CTX组肿瘤组织有大面积坏死区域,细胞数量明显减少且排列不规则,肿瘤组织松散(图1-A2)。CL-A多糖3个剂量组也有一定的坏死区域(图1-A3-A5),以高剂量组最为明显,说明CL-A多糖有一定的促进肿瘤细胞凋亡的作用。
2.6 H22荷瘤小鼠肿瘤组织的凋亡细胞检测
通过TUNEL法检测肿瘤组织中的细胞凋亡情况,证实CL-A多糖可促使肿瘤细胞凋亡。由图1可见,与模型组比较,CTX组存在大量凋亡细胞(图1-a2),CL-A多糖高、中、低3个剂量组都存在不同数量的凋亡细胞(图1-a3-a5)。其中高剂量组肿瘤细胞凋亡最为明显。
3 讨 论
我国有着丰富的真菌资源,但对其认识命名的仅占3.9%[12],药典中记载的药用真菌所占比重也很低,而近年来含药用真菌的处方正逐年增加[13],因此药用真菌的开发越来越成为主流。本试验通过建立H22小鼠移植瘤模型,证明CL-A多糖具有很好的抗肿瘤作用。给药10 d后,CL-A多糖高、中、低剂量组均有一定的抗肿瘤作用,可抑制荷瘤小鼠肿瘤组织的生长,且呈现一定的剂量依赖性,抑瘤率分别为55.56%,47.01%和37.52%。
免疫器官在机体发生疾病时会调节机体以对抗疾病。CTX对肿瘤细胞有很好的杀伤作用,但对机体免疫器官也会造成一定的损伤[14-16]。从荷瘤小鼠试验前后的肝指数、脾指数和胸腺指数可看出,CTX对机体的免疫器官确有损伤。与CTX组相比,CL-A多糖高、中、低剂量组对肝、脾和胸腺均有保护作用,说明CL-A多糖对荷瘤小鼠的免疫器官有一定的保护作用。与模型组相比,CL-A多糖高、中、低剂量组ALT、BUN、CRE水平均显著降低(P<0.01),说明CL-A多糖对荷瘤小鼠的肝脏和肾脏也有保护作用。
肿瘤发生和发展过程中,机体免疫机制会受到严重损伤。IL-6、IFN-γ和TNF-α等血清因子与肿瘤的生长息息相关。IL-6是一种多效能细胞因子[17],在肿瘤微环境模式中,IL-6被证明能启动肿瘤细胞发生上皮间质转化(epithelial mesenchymal transition, EMT)[18]。IFN-γ由T细胞产生,能直接抑制肿瘤细胞增殖,增加表面主要组织相容性复合体( major histocompatibility complex, MHC)抗原和肿瘤坏死因子的表达,促进抗肿瘤血管生成等[19]。TNF-α是迄今为止发现的抗癌活性最强的细胞因子,关于其抗肿瘤机制,目前发现的主要有诱导凋亡、干扰肿瘤血管系统和增强宿主机体免疫力3个方面[20]。且TNF-α与IFN-γ联合应用时抗肿瘤活性更强,可引起同源性肿瘤消退[21]。本试验中,同模型组相比,给药10 d后,CL-A多糖高、中、低3个剂量组可极显著降低荷瘤小鼠血清中的IL-6水平,极显著升高IFN-γ和TNF-α水平;CL-A多糖组小鼠血清IFN-γ和TNF-α水平较CTX组均有提高,说明杂色云芝多糖能通过调节IFN-γ和TNF-α细胞因子水平而发挥抗肿瘤作用。
H&E染色结果表明,CTX组和CL-A多糖组组织均出现一定的坏死区域,而CTX组坏死区域较大,CL-A多糖组坏死区域较小。同时TUNEL结果表明,CTX组和CL-A多糖组存在不同数量的凋亡细胞,且CTX组较CL-A多糖多。结合H&E染色和TUNEL结果表明,环磷酰胺与CL-A多糖可以通过诱导肿瘤细胞凋亡而抑制肿瘤细胞的生长,但其机理需进一步探究。
综上所述,CL-A多糖具有一定的抗肿瘤活性,其作用机制可能与免疫调节、促肿瘤细胞凋亡有关,但是否存在其他途径和通道须进一步深入研究。
[1] 吴兴亮,卯晓兰,图力古尔.中国药用真菌 [M].北京:科学出版社,2013:695-726.
Wu X L,Mao X L,Bau T.Medicinal fungi of China [M].Beijing:Science Press,2013:695-726.
[2] 赵新湖,包海鹰.青芝的本草考证 [J].菌物研究, 2015(1):59-62.
Zhao X H,Bao H Y.Textural research of Qingzhi [J].Journal of Fungal Research,2015(1):59-62.
[3] 梁语丝,邹华伟,谭永刚.云芝多糖的抗肿瘤作用研究进展 [J].中国实用医药,2014(13):259-262.
Liang Y S,Zou H W,Tan Y G.Study advance of anti-tumor activity ofCoriolusversicolorpolysaccharide [J].China Practical Medicine,2014(13):259-262.
[4] 张立显,李亚玲,邓维秀,等.口服云芝多糖对小鼠免疫器官影响的结果及意义 [J].中国民族民间医药,2010,19(15):88.
Zhang L X,Li Y L,Deng W X,et al.Effects ofCoriolusversicolorpolysaccharide on immune organs in mice with oral administration [J].Chinese Journal of Ethnomedicine and Ethnopharmacy,2010,19(15):88.
[5] 王菲菲,郝利民,王宗臻,等.云芝总发酵物及其多糖抗氧化活性比较研究 [J].食品工业科技,2013,34(13):109-112.
Wang F F,Hao L M,Wang Z Z,et al.Comparison of antioxidation activities of the fermentation products ofCoriolusversicolorand its polysaccharide [J].Technology of Food Industry,2013,34(13):109-112.
[6] 南凤仙,邵 伟.云芝多糖对小鼠抗衰老作用的研究 [J].宁夏大学学报(自然科学版),2005,26(3):264-267.
Nan F X,Shao W.Study on anti-aging effect ofCoriolusversicolorpolysaccharide [J].Journal of Ningxia University(Natural Science Edition),2005,26(3):264-267.
[7] 钟 萍,王云甫,李 萍.云芝多糖对小鼠免疫性肝损伤保护作用及机制的研究 [J].中国现代医学杂志,2011,21(31):3881-3883.
Zhong P,Wang Y F,Li P.Protective action and its mechanism of polysaccharides on immunological liver injury [J].China Journal of Modern Medicine,2011,21(31):3881-3883.
[8] 李玲艳,包海鹰.云芝的化学成分及药理活性研究概况 [J].菌物研究,2011,9(3):180-186.
Li L Y,Bao H Y.Summarization of researches on chemical compositions and pharmacological activities ofCoriolusversicolor[J].Journal of Fungal Research,2011,9(3):180-186.
[9] 娄 宁,陈 瑗,周 玫,等.云芝多糖对实验性动脉粥样硬化家兔的治疗作用 [J].南方医科大学学报,1995(3):185-187.
Lou N,Chen Y,Zhou M,et al.Therapeutic effect of polysaccharide fromCoriolusversicoloron experimental atherosclerotic rabbits [J].Journal of Southern Medical University,1995 (3):185-187.
[10] 焦连庆,于 敏,刘 辉,等.树舌多糖中中性糖及糖醛酸的含量测定 [J].中华中医药学刊,2005,23(9):1583-1584.
Jiao L Q,Yu M,Liu H,et al.Determination of neutral saccharide and uronic acid in polysaccharides ofGanodermaapplanatum[J].Chinese Archives of Traditional Chinese Medicine,2005,23(9):1583-1584.
[11] 王艾平,周丽明.考马斯亮蓝法测定茶籽多糖中蛋白质含量条件的优化 [J].河南农业科学,2014,43(3):150-153.
Wang A P,Zhou L M.Determination of protein content inCamelliaoleiferaseed polysaccharides by coomassie brilliant blue method [J].Journal of Henan Agricultural Sciences,2014,43(3):150-153.
[12] 魏江春.菌物生物多样性及其资源研发前景:献给《菌物研究》创刊10周年 [J].菌物研究,2012,10(3):125-129.
Wei J C.Fungal biodiversity resources and development prospects for 10 anniversaries of Journal of Fungal Research [J].Journal of Fungal Research,2012,10(3):125-129.
[13] 张静潮,李荣春.中国药用真菌研究概述 [J].安徽农业科学,2014,42(18):6118-6120.
Zhang J C,Li R C.Overview of Chinese medicinal fungi research [J].Journal of Anhui Agricultural Sciences,2014,42(18):6118-6120.
[14] 张云波.环磷酰胺对免疫系统的影响 [J].安徽农业科学,2013,20(30):12040-12042.
Zhang Y B.Effect of cyclophosphamide on immune system [J].Journal of Anhui Agricultural Sciences,2013,20(30):12040-12042.
[15] 何雅馨.环磷酰胺对小鼠脾脏的病理学影响 [D].四川雅安:四川农业大学,2015.
He Y X.The pathological effects of cyclophosphamide on spleen in mice [D].Ya’an,Sichuan:Sichuan Agricultural University,2015.
[16] 胡 东.环磷酰胺对小鼠胸腺病理学影响的研究 [D].四川雅安:四川农业大学,2015.
Hu D.The pathological effects of cyclophosphamide on thymus in mice [D].Ya’an,Sichuan:Sichuan Agricultural University,2015.
[17] Hirano T.Revisiting the 1986 molecular cloning of interleukin 6 [J].Front Immunol,2014,23(5):456-458.
[18] Sansone P,Bromberg J.Targeting the interleukin-6/Jak/STAT pathway in human malignancies [J].J Clin Oncol,2012,30(9):1005-1014.
[19] 卢 琳,王占聚,崔为发.IFN-γ与肿瘤免疫逃避的研究进展 [J].临床与病理杂志,2004,24(5):419-422.
Lu L,Wang Z J,Cui W F.Advances in IFN-γ and tumor immune evasion [J].Journal of Clinical and Pathological Research,2004,24(5):419-422.
[20] 向春艳,何小燕,李逐波,等.TNF-α在癌症中的作用研究进展 [J].生命科学,2012(3):250-254.
Xiang C Y,He X Y,Li Z B,et al.Recent advance in the role of TNF-α in cancer [J].Chinese Bulletin of Life Sciences,2012(3):250-254.
[21] 金 玲,刘菊妍,孙升云,等.灵芝孢子油软胶囊对H22肝癌小鼠抑瘤作用及免疫功能的影响 [J].中华中医药杂志,2011,26(4):715-718.
Jin L,Liu J Y,Sun S Y,et al.Antitumor and immunoregulation effects of Ganoderma spore oil soft capsule on mice of hepatocarcinoma H22cells-derived tumor [J].China Journal of Traditional Chinese Medicine and Pharmacy,2011,26(4):715-718.
