滇重楼根水浸液对四种园林植物的化感作用研究
2018-02-27毛美琴魏玉兰马明东
毛美琴,赵 燕,魏玉兰,马明东
(四川农业大学 风景园林学院,四川 成都 611130)
化感作用(allelopathy)是指植物(包括微生物)向周围环境中释放自身代谢合成的化学物质(即化感物质),进而直接或间接对自身及其他生物的生长发育产生的抑制或促进作用[1],植物化感物质进入到环境的主要方式有地上部的雨雾淋溶、根系分泌和残根分解、自然挥发和植株残体分解4种途径。有研究表明,植物根系是化感物质的主要来源器官之一[2],根系浸提液影响植物的生长发育[3]、抗氧化系统[4]、根系活力[5]、基因表达[6]等。植物化感作用研究作为一门新兴的交叉学科,已成为国内外学者的研究热点,在农业增产[7-8]、防控杂草[9]、生物入侵[10]、抑藻[11]等方面取得不少成果,但关于园林植物配置中的化感作用研究尚不多见。常见的园林植物配置大多是借鉴生产生活经验而来,缺乏一定的科学依据。园林植物化感作用的研究对于园林植物配置的科学性和植物群落演替有着直接影响,同时也影响园林人工生态系统的稳定和功能发挥[12]。因此,基于化感作用原理进行园林植物配置,有助于构建更自然更健康的人居环境。
滇重楼[Parispolyphyllavar.Yunnanensis(Fr.)Hand]是百合科(Liliaceae)重楼属(ParisL.)多年生草本植物,其根茎有着悠久的药用历史[13]。重楼皂苷是滇重楼的主要活性成分,具有止血、抗菌、抗肿瘤、免疫调节、镇痛和镇静等作用[14]。此外,滇重楼还具有一定的观赏价值,是很好的观茎、观花材料。目前,关于滇重楼的研究主要集中于栽培[15]、化学成分[16]以及组织培养[17]等方面,对其化感效应少有涉及,仅见研究其种子对油菜和白菜的化感抑制作用[18],但对于滇重楼主要入药部位根的化感作用研究尚无报道,显然不利于滇重楼在保健园林中的科学合理运用。
本试验选取了两种保健型园林中较为常见的药用观赏植物孔雀草(Tagetespatula)、鼠尾草(Salviajaponica)和两种园林地被植物白车轴草(Trifoliumrepens)、高羊茅(Festucaarundinacea)作为受体植物,利用滇重楼根水浸液分别处理4种受体植物的种子及幼苗,研究其对受体植物种子萌发、幼苗生长及生理特性的影响,并利用化感效应指数(RI)综合评价滇重楼根水浸液对四种植物化感作用效应的差异,探讨其化感作用机制,旨在为滇重楼及其他4种植物在保健型园林中的合理运用提供一定的科学依据。
1 材料与方法
1.1 试验材料
该试验所用滇重楼采自云南省大理市弥渡县弥渡镇上庄中药材种植基地,该地区海拔1 672 m,气候温和,冬无严寒,夏无酷暑,年均温17.3 ℃,年降水量824.2 mm。供试植物采集于2016年9月,生长3年以上且处于果实成熟期。受体植物分别为孔雀草、鼠尾草、白车轴草、高羊茅,种子均购于北京博芳流花卉有限公司。
1.2 试验方法
1.2.1 水浸液的制备
取新鲜的滇重楼根(根茎),流水冲洗2 h,蒸馏水冲洗3遍,阴干,待干燥后,用超高速万能粉碎机粉碎,粉末过100目筛,装袋密封,贮藏备用。称取一定量并加入10倍蒸馏水,室温条件下浸提48 h,期间置于100 r·min-1摇床上振荡。4层纱布过滤后,再经4 000 r·min-1离心10 min,取上清液,然后过玻璃滤膜(0.22 μm)除菌,得浓度为0.1 g·mL-1的浸提液母液,将母液分别用无菌蒸馏水稀释为0.02、0.04、0.06、0.08 g·mL-1,置于4 ℃冰箱中保存备用。
1.2.2 种子萌发试验
采用培养皿滤纸法,选取饱满、状态一致的种子,用75%乙醇浸泡1 min,2%次氯酸钠溶液消毒3 min,然后用无菌蒸馏水清洗5~6次,吹干备用。取直径为9 cm,铺有两层定性滤纸(灭菌)的培养皿(灭菌),分别加入10 mL处理液,对照加等量无菌蒸馏水。每个培养皿中播种30粒种子,各处理均设置3 次重复,置于25 ℃恒温光照培养箱中黑暗培养,每天加入3 mL对应的处理液,对照加等量蒸馏水,保持滤纸湿润。播种24 h后开始记录发芽数(以胚根冲破种皮1~2 mm为发芽标准),每天定时观察并记录发芽种子的数量,直至对照组种子的发芽数不再变化为止,计算此时的发芽率、发芽指数。
1.2.3 幼苗生长试验
采用砂培法进行培养,选用直径11 cm、深度12 cm的塑料盆,每盆装入用无菌Hoagland营养液浸透的已灭菌石英砂550 g,然后分别挑选30粒已露白、大小一致、饱满的种子播于盆内,每隔1 d补充浇灌50 mL处理液,以无菌蒸馏水浇灌为对照,每个处理重复3 次,随机区组排列,常规管理。培养20 d后,分别随机抽取各处理10株幼苗,采用游标卡尺测量苗高与根长,用电子天平称量幼苗总质量。参照李合生等[19]方法测定叶绿素含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性、过氧化物酶(POD)活性等生理特性。
1.2.4 数据处理
发芽率(GP)=(规定时间内种子发芽数/供试种子总数)×100%
发芽指数(Gi)=∑Gt/Dt。其中,Gt为在第t天的发芽数,Dt为相应的天数。
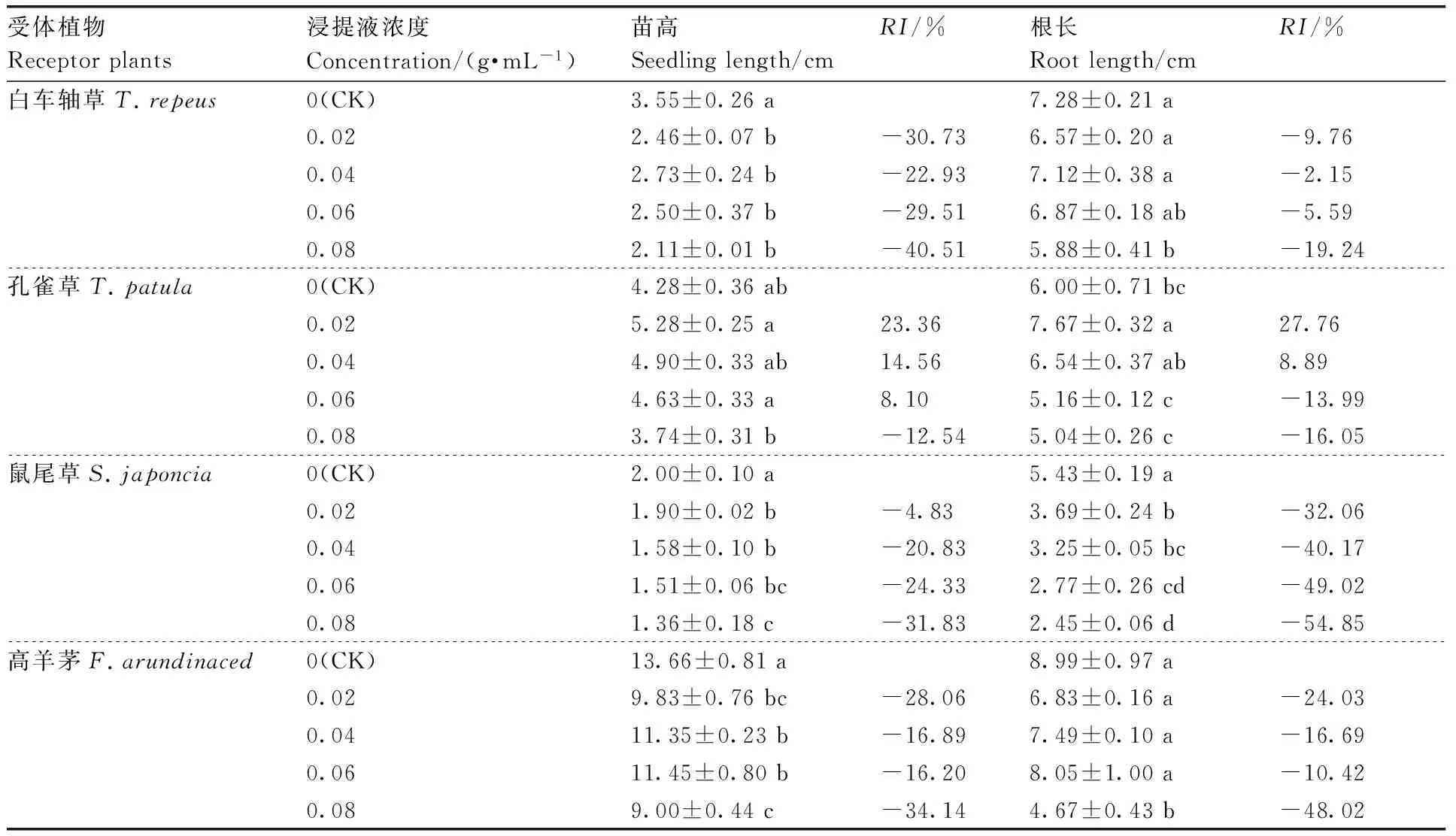
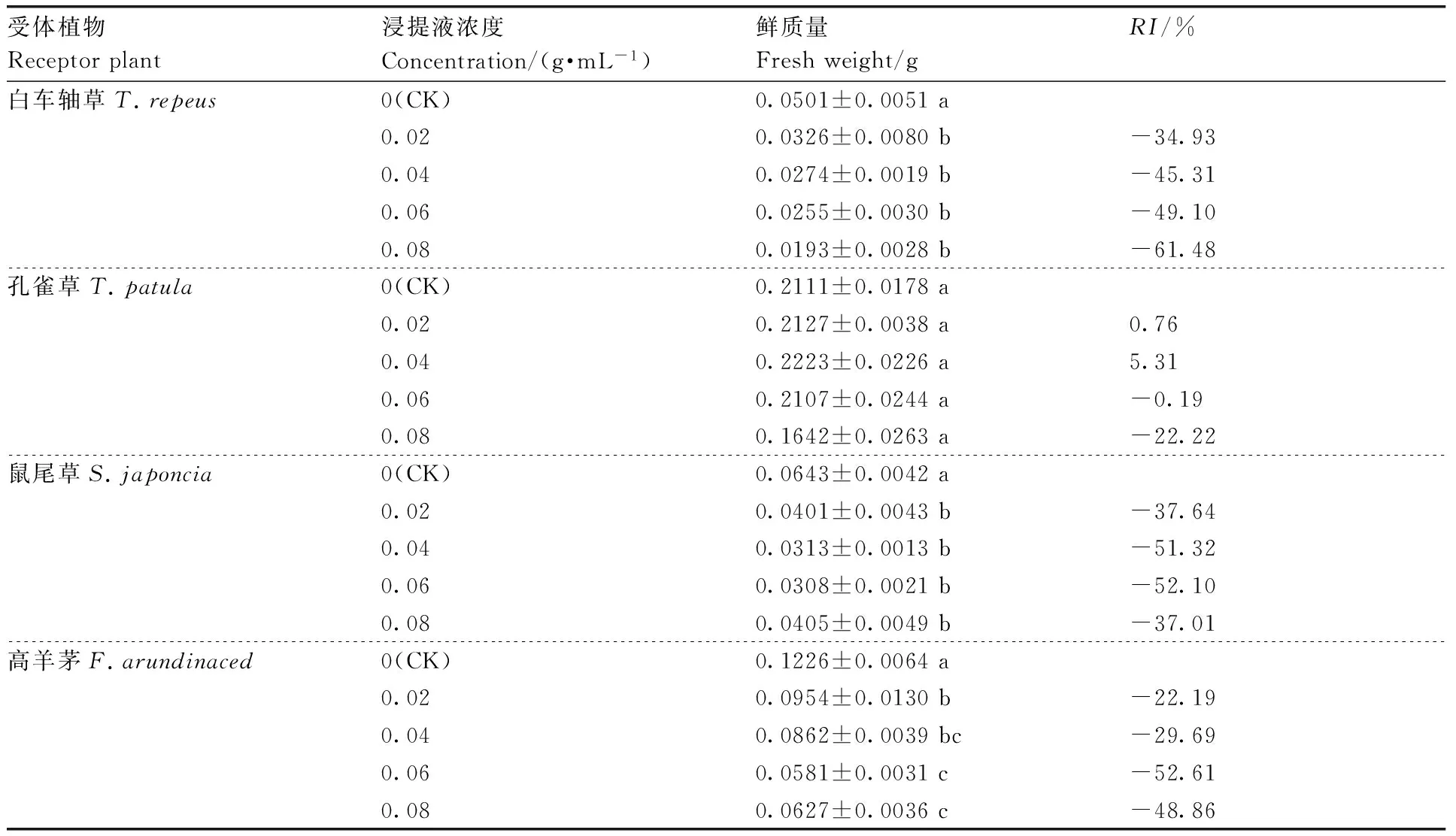
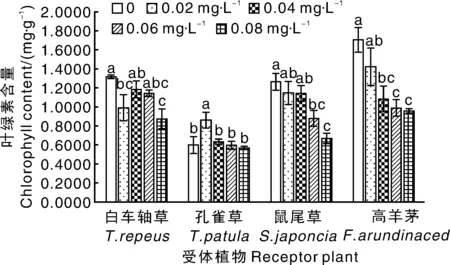
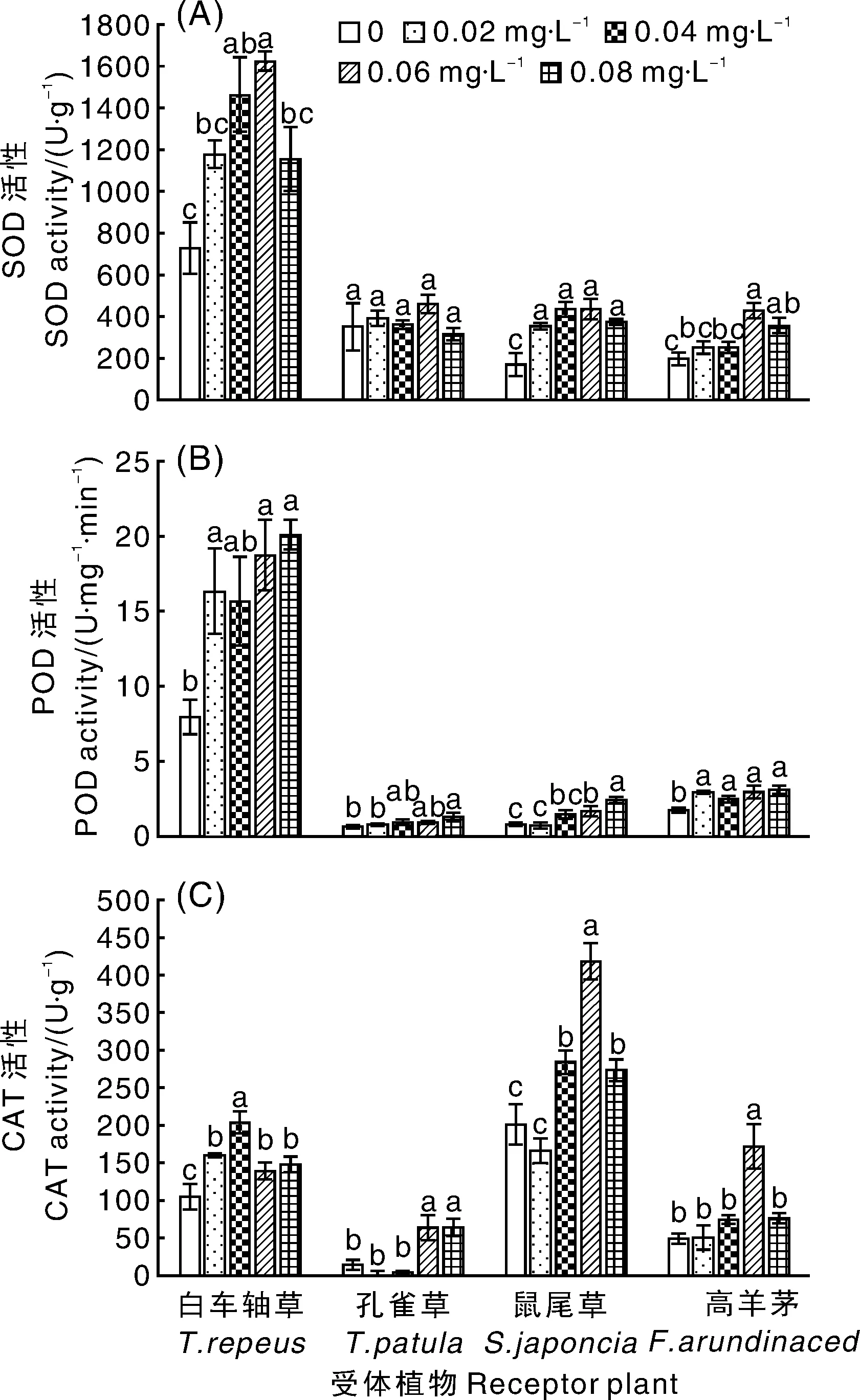
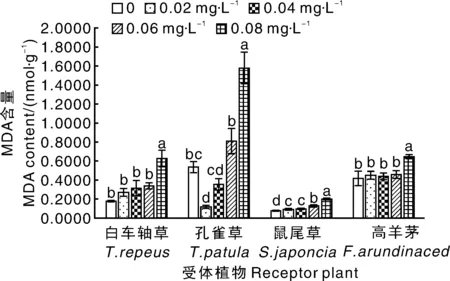
RI=1-C/T(T≥C)或RI=T/C—1(T SE:供体植物对同一受体植物的各个测试指标的RI的算术平均值。 采用DPS7.05软件进行统计分析,并用 Duncan新复极差法进行差异显著性检验,Microsoft Excel 2013 制表作图。所有数据均为3次独立试验的平均值。 由表1可知,滇重楼根水浸液对4种受体植物种子萌发有着不同的影响。白车轴草、鼠尾草、高羊茅的发芽率和发芽指数与对照相比均有所减少,且随着浸提液浓度升高,抑制作用逐渐增强,但不同受体植物对浸提液的响应不同。与对照相比,浸提液对白车轴草、鼠尾草和高羊茅发芽率的抑制作用均达到显著水平,发芽率RI值分别为-88.89%、-62.71%、-47.62%。同时,作为发芽率指标细化和深化的发芽指数,其大小随着浸提液浓度的增大而降低,并与发芽率保持基本一致的变化规律,发芽指数RI值分别为-91.25%、-73.25%-61.01%。而孔雀草发芽试验结果表明,在0.02~0.04 g·mL-1处理下,发芽率和发芽指数高于对照,在0.06~0.08 g·mL-1处理下则低于对照,但与对照差异不显著(表1)。 2.2.1 滇重楼根水浸液对幼苗苗高的影响 滇重楼根水浸液对4种受体植物幼苗苗高的影响存在一定差异(表2)。孔雀草苗高随浸提液浓度的增加表现出先增高后降低的趋势,即浸提液对孔雀草幼苗苗高的影响表现为低浓度促进而高浓度抑制的规律,但与对照差异均不显著。浸提液对其他3种受体植物幼苗的苗高均有较为显著的抑制作用,且表现出剂量效应,即随着浸提液浓度的增加,其对幼苗苗高的抑制作用有统计学意义上的增强,但不同受体植物对浸提液的响应不同。低浓度(0.02 g·mL-1)处理下的白车轴草、鼠尾草与高羊茅幼苗苗高与对照相比差异显著;中浓度(0.04~0.06 g·mL-1)处理下的白车轴草与高羊茅幼苗苗高有微弱的增加,但与低浓度相比差异不显著且低于对照;高浓度处理下的3种受体植物幼苗苗高均受到显著的抑制作用,此时白车轴草、鼠尾草和高羊茅的苗高RI值分别为-40.51%、-31.83%、-34.14%。 表1滇重楼根水浸液对四种受体植物种子萌发的影响 Table1Effect of aqueous extracts fromParispolyphyllavar.Yunnanensisroots on seed germination of four plants 受体植物Receptorplants浸提液浓度Concentration/(g·mL-1)发芽率Germinationrate/%RI/%发芽指数GerminationindexRI/%白车轴草T.repeus0(CK)80.00±5.09a10.75±1.17a0.0267.78±4.01b-15.287.02±0.42b-34.680.0441.11±2.94c-48.613.53±0.20c-67.120.0618.89±2.22d-76.391.66±0.06d-84.550.088.89±1.11d-88.890.94±0.14d-91.25孔雀草T.patula0(CK)53.33±3.85a5.62±0.67a0.0257.78±3.85a8.346.72±1.25a19.570.0456.67±4.84a6.255.80±0.72a3.200.0652.22±2.94a-2.085.18±0.90a-7.830.0851.11±4.45a-4.165.18±0.77a-7.83鼠尾草S.japoncia0(CK)65.55±2.22a7.14±0.14a0.0247.78±2.22b-27.114.95±1.38b-30.670.0441.11±4.84bc-37.294.58±0.22b-35.850.0633.34±3.33cd-49.153.01±0.43bc-57.840.0824.44±1.11d-62.711.91±0.08c-73.25高羊茅F.arundinaced0(CK)93.33±1.93a5.54±0.22a0.0260.00±2.22b-35.712.83±0.08b-48.920.0457.78±1.92b-38.092.71±0.14b-51.080.0654.45±1.11bc-41.662.46±0.55b-55.600.0848.89±4.01c-47.622.16±0.20b-61.01 表中数值为平均值±标准误;同列不同行之间没有相同小写字母表示在0.05水平差异显著,下同。 Data in table are means±SE. Different lowercase letters mean significant differences at 0.05 level. The same as below. 表2滇重楼根水浸液对4种受体植物苗高、根长的影响 Table2Effect of aqueous extracts fromParispolyphyllavar.Yunnanensisroots on root length and seedling height of four plants 受体植物Receptorplants浸提液浓度Concentration/(g·mL-1)苗高Seedlinglength/cmRI/%根长Rootlength/cmRI/%白车轴草T.repeus0(CK)3.55±0.26a7.28±0.21a0.022.46±0.07b-30.736.57±0.20a-9.760.042.73±0.24b-22.937.12±0.38a-2.150.062.50±0.37b-29.516.87±0.18ab-5.590.082.11±0.01b-40.515.88±0.41b-19.24孔雀草T.patula0(CK)4.28±0.36ab6.00±0.71bc0.025.28±0.25a23.367.67±0.32a27.760.044.90±0.33ab14.566.54±0.37ab8.890.064.63±0.33a8.105.16±0.12c-13.990.083.74±0.31b-12.545.04±0.26c-16.05鼠尾草S.japoncia0(CK)2.00±0.10a5.43±0.19a0.021.90±0.02b-4.833.69±0.24b-32.060.041.58±0.10b-20.833.25±0.05bc-40.170.061.51±0.06bc-24.332.77±0.26cd-49.020.081.36±0.18c-31.832.45±0.06d-54.85高羊茅F.arundinaced0(CK)13.66±0.81a8.99±0.97a0.029.83±0.76bc-28.066.83±0.16a-24.030.0411.35±0.23b-16.897.49±0.10a-16.690.0611.45±0.80b-16.208.05±1.00a-10.420.089.00±0.44c-34.144.67±0.43b-48.02 2.2.2 滇重楼根水浸液对幼苗根长的影响 滇重楼根水浸液对4种受体植物幼苗根长的影响表现出很大的差异(表2)。浸提液对孔雀草幼苗根长的影响表现为“低促高抑”,0.02~0.04 g·mL-1处理下幼苗根长显著高于对照,在浓度为0.06~0.08 g·mL-1时,幼苗根长呈现下降趋势且与对照差异不显著。浸提液对其他3种植物均有较为显著的抑制作用和剂量效应。随着浸提液浓度的增加,鼠尾草、白车轴草、高羊茅幼苗根长均呈下降趋势,但下降幅度不一致。低浓度(0.02 g·mL-1)处理下的白车轴草、鼠尾草与高羊茅幼苗根长与对照相比差异显著;中浓度(0.04~0.06 g·mL-1)处理下的白车轴草与高羊茅幼苗苗高有微弱的增加,但与低浓度相比差异不显著且低于对照;高浓度处理下的3种受体植物幼苗苗高均受到显著的抑制作用,此时白车轴草、鼠尾草和高羊茅的苗高RI值分别为-19.24%、-54.85%、-48.02%。 2.2.3 滇重楼根水浸液对幼苗鲜质量的影响 由表3可知,滇重楼根水浸液对4种受体植物幼苗鲜质量的化感作用,除孔雀草外整体上表现为抑制作用。浸提液对孔雀草幼苗鲜质量的影响表现为低浓度有促进作用,而在高浓度时则为抑制作用,但与对照差异均不显著。而对于白车轴草、鼠尾草、高羊茅而言,随着浸提液浓度的增加,幼苗鲜质量总体上呈下降趋势,但下降幅度不一致。前者表现为持续下降,后两者在0.06 g·mL-1处理下,鲜质量有微弱的增加,但与高浓度相比差异不显著。浸提液浓度为0.02 g·mL-1时,白车轴草鲜质量受抑制程度不显著,鼠尾草和高羊茅表现为显著的抑制作用。当浸提液浓度增加到0.08 g·mL-1时,3种植物幼苗鲜质量受抑制程度均达到了显著水平,此时白车轴草、鼠尾草、高羊茅的鲜质量RI值分别为-61.48%、-37.01%、-48.86%(表3)。 2.2.4 滇重楼根水浸液的综合化感效应 为综合分析滇重楼根水浸液对4种受体植物的化感效应,采用种子发芽率、发芽指数、幼苗根长、苗高、鲜质量5个指标的RI值计算出综合化感效应指数(SE)。如图1所示,浸提液对4种受体植物均具有较高的化感作用。白车轴草、鼠尾草、高羊茅所受到化感抑制作用大体上随浸提液浓度增加而逐渐增强,但增强幅度不一致。而孔雀草受到的化感效应表现为“低促高抑”。在浸提液浓度低于0.04 g·mL-1时,孔雀草表现为促进作用,其他3种植物则表现为抑制作用,其中高羊茅受抑制作用最弱,白车轴草与鼠尾草受抑制作用相近。在0.06 g·mL-1浸提液作用下,4种受体植物均表现为抑制作用,其中,白车轴草受抑制作用最强,孔雀草受抑制作用最弱。当浸提液浓度为0.08 g·mL-1时,4种受体植物受抑制作用均达到最大值。总的来看,白车轴草比孔雀草、鼠尾草、高羊茅对浸提液具有更强的敏感性,化感综合效应敏感性的大小为:白车轴草>鼠尾草>高羊茅>孔雀草。 表3滇重楼根水浸液对4种受体植物鲜质量的影响 Table3Effect of aqueous extracts fromParispolyphyllavar.Yunnanensisroots on fresh weight height of four plants 受体植物Receptorplant浸提液浓度Concentration/(g·mL-1)鲜质量Freshweight/gRI/%白车轴草T.repeus0(CK)0.0501±0.0051a0.020.0326±0.0080b-34.930.040.0274±0.0019b-45.310.060.0255±0.0030b-49.100.080.0193±0.0028b-61.48孔雀草T.patula0(CK)0.2111±0.0178a0.020.2127±0.0038a0.760.040.2223±0.0226a5.310.060.2107±0.0244a-0.190.080.1642±0.0263a-22.22鼠尾草S.japoncia0(CK)0.0643±0.0042a0.020.0401±0.0043b-37.640.040.0313±0.0013b-51.320.060.0308±0.0021b-52.100.080.0405±0.0049b-37.01高羊茅F.arundinaced0(CK)0.1226±0.0064a0.020.0954±0.0130b-22.190.040.0862±0.0039bc-29.690.060.0581±0.0031c-52.610.080.0627±0.0036c-48.86 图1 滇重楼根水浸液对4种受体植物的综合化感效应Fig.1 Comprehensive allelopathy effects of aqueous extracts from Paris polyphylla var. Yunnanensis roots on four plants 总体来看,滇重楼根水浸液显著降低了白车轴草、鼠尾草、高羊茅幼苗的叶绿素含量,而孔雀草幼苗中的叶绿素含量随着浸提液浓度的升高呈现先升高后降低的趋势。低浓度时,白车轴草与对照差异显著,鼠尾草、高羊茅与对照差异不显著,而高浓度时,白车轴草、鼠尾草、高羊茅幼苗叶绿素含量较对照差异均显著,分别下降33.86%、47.10%、44.11%。孔雀草幼苗叶绿素含量表现为一定的“低促高抑”,0.02 g·mL-1时,显著高于对照,但其他各处理与对照差异均不显著。 由图3可知,随着浸提液浓度的升高,4种受体植物幼苗SOD、CAT活性均呈先增高后降低的趋势,但存在一定差异。对于SOD活性而言,在0.04 g·mL-1浓度下,鼠尾草幼苗SOD活性较对照显著地升高了152.3%。而在0.06 g·mL-1浓度下,白车轴草、孔雀草、高羊茅幼苗的SOD活性均达到最大值。在此浓度下,除孔雀草外,其他两种植物均显著地高于对照,分别升高了121.6%、116.9%。当浓度升高至0.08 g·mL-1时,除孔雀草以外,其他3种植物均高于对照但低于最大值。对于CAT活性而言,在0.04 g·mL-1浓度下,白车轴草幼苗CAT活性较对照显著地升高了95.36%。而在0.06 g·mL-1浓度下,孔雀草、鼠尾草、高羊茅幼苗的CAT活性均达到最大值。在此浓度下,3种植物均显著地高于对照,分别升高了318.8%、 107.1%、244.9%。当浓度升高至0.08 g·mL-1时,除孔雀草以外,其他3种植物均显著高于对照但显著低于最大值。此外,孔雀草、鼠尾草幼苗CAT活性分别在≤0.04 g·mL-1、0.02 g·mL-1时低于对照但差异均不显著。而4种植物幼苗POD活性随着浸提液浓度的升高均呈上升趋势,但变化幅度不一致。孔雀草、鼠尾草POD活性随浓度增加而持续升高,低浓度处理下,与对照差异均不显著;当浓度升高到0.08 g·mL-1时,显著高于对照,升高了123.5%、226.4%。在白车轴草和高羊茅中,与0.02 g·mL-1相比,0.04 g·mL-1处理下幼苗POD活性微弱下降但差异不显著。当浓度升高到0.08 g·mL-1时,两者POD活性均显著高于对照,分别升高了154.1%、80.9%。 图中数值为平均值±标准误;不同小写字母表示处理间差异显著(P<0.05)。下同。Data in picture are means±SE. Different lowercase letters mean significant differences at 0.05 level. The same as below.图2 滇重楼根水浸液对4种受体植物幼苗叶绿素含量的影响Fig.2 Effect of aqueous extracts from Paris polyphylla var. Yunnanensis roots on chlorophyll content of four plants 图3 滇重楼根水浸液对4种受体植物幼苗抗氧化酶活性的影响Fig.3 Effect of aqueous extracts from Paris polyphylla var. Yunnanensis roots on antioxidant enzyme activity of four plants 随着浸提液浓度的升高,白车轴草、鼠尾草、高羊茅幼苗MDA含量持续升高。低浓度时,白车轴草与高羊茅幼苗MDA含量与对照相比差异不显著,而鼠尾草显著高于对照。当浓度升高至0.08 g·mL-1时,三者均显著高于对照,分别升高252.0%、159.4%、55.2%。孔雀草MDA含量随浸提液浓度增大呈现先下降后升高的趋势。0.02 g·mL-1时,达到最低值,较对照下降了78.4%,差异显著;之后持续升高,0.08 g·mL-1时,MDA含量显著高于对照,上升了193.1%(图4)。 图4 滇重楼根水浸液对4种受体植物丙二醛含量的影响Fig.4 Effect of aqueous extracts from Paris polyphylla var. Yunnanensis roots on MDA content of four plants 植物的种子萌发和幼苗生长是其生活史的重要发展阶段,种子萌发影响植物在群落中的多度与竞争力,而幼苗阶段对于植物的形态建成有着直接的影响[20]。植物通过向环境释放化感物质抑制或促进种子萌发及幼苗生长进而影响植物种群的建立与更新。因此,种子萌发和幼苗生长状况常作为物种间化感作用的评价指标[21]。本试验中,滇重楼根水浸液对4种园林植物种子萌发及幼苗生长有显著影响。已有研究表明,化感物质可以通过改变酶合成而改变代谢途径、改变膜透性、影响呼吸作用、抑制细胞分裂或伸长、影响蛋白质的合成和基因表达等途径影响种子萌发和幼苗生长[22]。不过,另有一些研究指出,植物的浸提液能够增加离子的渗出,改变溶液的渗透压,使植物毒性试验结果偏大[23]。具体而言,滇重楼根水浸液在一定程度上抑制了白车轴草、鼠尾草、高羊茅的种子萌发和幼苗生长,但对孔雀草表现为“低促高抑”,这说明不同受体植物的种子萌发与幼苗生长对滇重楼根水浸液有不同的敏感性,与大多数的研究相同[24-25]。究其原因,可能是由于化感物质具有选择性和专一性,也可能与受体植物物种进化有关,确切原因需要进一步研究。 另一方面,化感作用的重要研究内容是化感物质的浓度效应。有研究发现植物化感作用对种子萌发的效果与化感物质的质量浓度有关,主要有“剂量效应”“低促高抑”效应以及“低浓度无影响、高浓度抑制”效应[26]。在本试验中,白车轴草、鼠尾草、高羊茅种子萌发与幼苗生长对滇重楼根水浸液的化感效应表现为“剂量抑制”效应,这可能和试验选择的浸提液浓度范围有关,在低于0.02 g·mL-1时是否存在“低促高抑”效应或“低浓度无影响、高浓度抑制”效应尚有待进一步研究。而对孔雀草表现为“低促高抑”效应,化感胁迫程度超出其承受阈值(0.02 g·mL-1)时化感抑制作用增强。 叶绿素(Chl)作为光合色素,参与光合作用中光能的吸收、传递和转化,其含量直接影响植株对光能的利用,在很大程度上反映了植物的生长状况[27]。Hejl等[28]发现,化感物质对植物光合作用的影响主要表现为叶绿素含量和光合速率的下降。本试验中,白车轴草、鼠尾草、高羊茅幼苗叶绿素含量均随水浸液浓度升高而下降,孔雀草幼苗叶绿素含量在浸提液浓度为0.08 g·mL-1时也显著下降,表明滇重楼根水浸液通过降低幼苗叶绿素含量,影响四种受体植物的光合效率,降低其净同化量。许多研究结果与本研究相似,随着胁迫程度的加剧,叶绿素含量逐渐下降[29-30]。这可能有两方面的原因,其一是化感物质进入受体植物幼苗体内抑制了ATP酶的活性,使叶绿素合成的酶系统受到影响;其二,化感物质引起植物体内活性氧的增加,致使叶绿素结构遭到破坏而趋向分解[31]。最终导致叶绿素含量降低,光合能力减弱,从而进一步抑制受体植物的生长。 正常情况下植物体内活性氧的产生与清除维持动态平衡[32],但化感物质能引发植物体内活性氧的增加,此时植物会启动自身的抗氧化系统对活性氧进行清除,SOD、POD、CAT作为酶保护系统的重要组分,只有三者协同作用才能有效清除植物体内活性氧与自由基,在一定程度上保护植物在逆境条件下免受伤害[33]。而前人在研究不同植物化感作用时,受体植物抗氧化酶活性的变化趋势具有差异性,这可能与受体植物、化感物质种类和含量以及作用时间长短不同有关。许可成等[34]在研究麻花秦艽叶和根的水浸液处理紫花苜蓿和小麦种子时,发现随着浸提液浓度的升高,紫花苜蓿和小麦幼苗叶片中 SOD、POD、CAT活性和 MDA含量显著提高。而廖梦雨等[35]的研究结果则表明3个树种凋落叶浸提液对三叶鬼针草 POD、SOD活性具有促进作用,而对其CAT活性具有抑制作用。本研究中,滇重楼根水浸液对4种园林植物的抗氧化酶SOD、POD、CAT活性均具有浓度效应。其中,与对照相比,浸提液虽然刺激了受体植物SOD和CAT活性升高,但随浸提液浓度升高,化感作用抑制程度加剧,细胞内活性氧自由基浓度进一步升高,当超出受体植物所能耐受的范围时,酶系统受损,抗氧化酶活性降低。SOD与CAT活性的下降说明化感胁迫打破了活性氧的产生与清除的动态平衡,造成活性氧大量积累, 引起氧化胁迫,进而引起膜质过氧化反应,导致膜结构的完整性被破坏,使膜脂过氧化终产物即MDA含量逐渐增加,进而导致植物代谢紊乱[36],这与Zhao[37]和De la Haba等[38]的研究结果基本一致。而POD活性随浸提液浓度增大而升高,说明滇重楼根水浸液对POD较SOD和CAT敏感。当质量浓度为0.08 g·mL-1时,4种植物的MDA含量与对照相比极显著地增加,说明该浓度下,化感胁迫已经超出一定的范围,对抗氧化酶系统造成了伤害,使膜脂过氧化程度增强。然而,化感作用机理复杂多样,关于4种园林植物对滇重楼根水浸液化感作用的应答反应还有待进一步研究。 综上所述,滇重楼根水浸液使得受体植物遭受氧化胁迫,进而影响植物生长相关的生理过程,最终对4种园林植物均表现出较强的化感抑制作用,但化感效应存在差异。综合各项指标,滇重楼根水浸液对园林植物种子萌发和幼苗生长化感作用综合效应的强度大小为白车轴草>鼠尾草>高羊茅>孔雀草。因此,在将滇重楼应用于园林绿化时,应根据其化感作用特点选择搭配植物种类、配置方式以及栽植密度等,为滇重楼在保健型园林中的合理运用提供一定的科学依据。此外,室内试验避免了自然条件下各种因素的干扰,结果虽然能较好地反映化感作用强弱,但是,在自然条件下,化感作用是极为复杂的,除了要受温度、水分、养分和太阳辐射等环境因子的影响外,植株间竞争效应也会对化感作用的表现产生重要影响[39]。因此,化感作用特点和自然条件对其他植物的影响是否和本研究所得结果一致,还需进一步研究。 [1] RICE E L. Allelopathy (Second Edition)[M]. New York: Academic Press, 1983. [2] GATTI A B, FERREIRA A G, ARDUIN M, et al. Allelopathic effects of aqueous extracts ofArtistolochiaesperanzaeO. Kuntze on development ofSesamumindicumL. seedlings[J].ActaBotanicaBrasilica, 2010, 24(2):454-461. [3] 张权, 姚小华, 滕建华, 等. 薄壳山核桃根系水浸提液对2种作物种子萌发及幼苗生长的影响[J]. 植物研究, 2016, 36(2):204-210. ZHANG Q, YAO X H, TENG J H, et al. Effects of water extraction from roots ofCaryaillnoensison seed germination and growth of two crops[J].BulletinofBotanicalResearch, 2016, 36(2):204-210. (in Chinese with English abstract) [4] QIAN H, XU X, CHEN W, et al. Allelochemical stress causes oxidative damage and inhibition of photosynthesis inChlorellavulgaris[J].Chemosphere, 2009, 75(3):368-375. [5] 王宁, 田晓莉, 段留生, 等. 缩节胺浸种提高棉花幼苗根系活力中的活性氧代谢[J]. 作物学报, 2014, 40(7):1220-1226. WANG N, TIAN X L, DUAN L S, et al. Metabolism of reactive oxygen species involved in increasing root vigour of cotton seedlings by soaking seeds with mepiquat chloride[J].ActaAgronomicaSinica, 2014, 40(7):1220-1226. (in Chinese with English abstract) [6] BOESCH-SAADATMANDI C, LOBODA A, WAGNER A E, et al. Effect of quercetin and its metabolites isorhamnetin and quercetin-3-glucuronide on inflammatory gene expression: role of miR-155[J].JournalofNutritionalBiochemistry, 2011, 22(3):293. [7] DADKHAH A. Allelopathic effect of sugar beet (Betavulgaris) and eucalyptus (Eucalyptuscamaldulensis) on seed germination and growth ofPortulacaoleracea[J].RussianAgriculturalSciences, 2013, 39(2):117-123. [8] RAOOF K M A, SIDDIQUI M B. Allelotoxic effect of parthenin on cytomorphology of broad bean (Viciafaba, L.)[J].JournaloftheSaudiSocietyofAgriculturalSciences, 2013, 12(2):143-146. [9] 邬彩霞, 刘苏娇, 赵国琦, 等. 黄花草木樨对杂草的化感作用研究[J]. 草地学报, 2015, 23(1):82-88. WU C X, LIU S J, ZHAO G Q, et al. The allelopathy of yellow sweet clover on weeds[J].ActaAgrectirSinica, 2015, 23(1):82-88. (in Chinese with English abstract) [10] 侯玉平, 柳林, 初航, 等. 外来植物火炬树(RhustyphinaL.)入侵对不同林型土壤性质的影响[J]. 生态学报, 2015, 35(16):5324-5330. HOU Y P, LIU L, CHU H, et al. Effects of exotic plantRhustyphinainvasion on soil properties in different forest types[J].ActaEcologicaSinica, 2015, 35(16):5324-5330. (in Chinese with English abstract) [11] ROJO C, SEGURA M, RODRIGO M A. The allelopathic capacity of submerged macrophytes shapes the microalgal assemblages from a recently restored coastal wetland[J].EcologicalEngineering, 2013, 58(10):149-155. [12] 张岚, 高素萍. 园林植物化感作用研究现状与问题探讨[J]. 浙江林学院学报, 2007, 24(4):497-503. ZHANG L, GAO S P. Researches on allelopathy of ornamental plants[J].JournalofZhejiangForestryCollege, 2007, 24(4):497-503. (in Chinese with English abstract) [13] 国家药典委员会. 中华人民共和国药典:2010年一部[M]. 北京:中国医药科技出版社, 2010. [15] 杨永红, 戴丽君, 何昆鸿, 等. 土壤营养与人工栽培滇重楼品质相关性评价[J]. 中药材, 2012, 35(10):1557-1561. YANG Y H, DAI L J, HE K H, et al. Relation between soil nutrient of artificially cultivated area and rhizome quality ofParispolyphyllavar.Yunnanensis[J].JournalofChineseMedicinalMaterials, 2012, 35(10):1557-1561. (in Chinese with English abstract) [16] 周浓, 张德全, 孙琴, 等. 真菌诱导子对滇重楼中次生代谢产物甾体皂苷的影响[J]. 药学学报, 2012(9):1237-1242. ZHOU N, ZHANG D Q, SUN Q, et al. Effects of fungal elicitors on the secondary metabolite steroidal saponin inParispolyphyllavar. Yunnanensis[J].ActaPharmaceuticaSinica, 2012(9):1237-1242. (in Chinese with English abstract) [17] 熊海浪, 易继财, 张宗申. 滇重楼种子萌发及组织培养研究[J]. 广东农业科学, 2011, 38(21):47-49. XIONG H L, YI J C, ZHANG Z S. Studies on the seed germination and tissue culture ofParispolyphyllavar.yunnanensis[J].GuangdongAgriculturalSciences, 2011, 38(21):47-49. (in Chinese with English abstract) [18] 古今, 吴梅, 李文春, 等. 滇重楼种子中萌发抑制物质活性的研究[J]. 现代中药研究与实践, 2013(1):10-12. GU J, WU M, LI W C, et al. Effect of germination inhibitor activity ofParispolyphyllavar. yunnanensis (Fr.)Hand[J].ResearchandPracticeonChineseMedicines, 2013(1):10-12. (in Chinese with English abstract) [19] 李合生, 孙群, 赵世杰. 植物生理生化实验原理与技术[M]. 北京:高等教育出版社, 2000. [20] 罗通, 黄鹤平, 李凤姣, 等. 麻疯树叶水浸提液对4种农作物的化感作用[J]. 四川大学学报(自然科学版), 2014, 51(6):1325-1329. LUO T, HUANG H P, LI F J, et al. Allelopathy ofJatrophacurcasaqueous extract on four crops[J].JournalofSichuanUniversity(NaturalScienceEdition), 2014, 51(6):1325-1329. (in Chinese with English abstract) [21] 任元丁, 尚占环, 龙瑞军. 中国草地生态系统中的化感作用研究进展[J]. 草业科学, 2014, 31(5):993-1002. REN Y D, SHANG Z H, LONG R J. Progress of allelopathy in grassland ecosystem of China[J].PrataculturalScience, 2014, 31(5):993-1002. (in Chinese with English abstract) [22] 杨期和, 叶万辉, 廖富林,等. 植物化感物质对种子萌发的影响[J].生态学杂志,2005, 24(12):1459-1465. YANG Q H, YE W H, LIAO F L, et al. Effects of allelochemical on seed germination[J].ChineseJournalofEcology, 2005, 24(12):1459-1465. (in Chinese with English abstract) [23] 侯永侠, 周宝利, 吴晓玲. 不同作物秸秆对辣椒的化感效应[J]. 生态学杂志, 2009, 28(6):1107-1111. HOU Y X, ZHOU B L, WU X L. Allelopathic effects of different crop stalks on pepper growth[J].ChineseJournalofEcology, 2009, 28(6):1107-1111. (in Chinese with English abstract) [24] 黄玉梅, 张杨雪, 刘庆林, 等. 孔雀草水浸提液对4种园林植物化感作用的研究[J]. 草业学报, 2015, 24(6):150-158. HUANG Y M, ZHANG Y X, LIU Q L, et al. Research on allelopathy of aqueous extract fromTagetespatulato four garden plants[J].ActaPrataculturaeSinica, 2015, 24(6):150-158. (in Chinese with English abstract) [25] 陈林, 杨新国, 宋乃平,等. 中间锦鸡儿根水浸提液对7种灌草的化感作用及其化学成分分析[J]. 浙江大学学报(农业与生命科学版), 2016, 42(2):150-162. CHEN L, YANG X G, SONG N P, et al. Allelopathy of aqueous extract fromCaraganaintermediaroot on seven kinds of shrubs and its chemical component analysis[J].JournalofZhejiangUniversity(AgricultureandLifeSciences), 2016, 42(2):150-162. (in Chinese with English abstract) [26] 李雪枫, 王坚, 许文博, 等. 冷蒿对三种禾本科植物种子萌发和幼苗生长的化感作用[J]. 应用生态学报, 2010, 21(7):1702-1708. LI X F, WANG J, XU W B, et al. Allelopathic effects ofArtemisiafrigidaon three Poaceae plants seed germination and seedling growth[J].ChineseJournalofAppliedEcology, 2010, 21(7):1702-1708. (in Chinese with English abstract) [27] MAXWELL K, JOHNSON G N. Chlorophyll fluorescence: a practical guide[J].JournalofExperimentalBotany, 2000, 51(345):659-668. [28] HEJL A A M, EINHELLIG F A, RASMUSSEN J A. Effects of juglone on growth, photosynthesis, and respiration[J].JournalofChemicalEcology, 1993, 19(3):559-568. [29] 姚丹丹, 王婧怡, 周倩,等. 香豆素对多花黑麦草种子萌发和幼苗生长化感作用的机理研究[J]. 草业学报, 2017, 26(2):136-145. YAO D D, WANG J Y, ZHOU Q, et al. Effect of coumarin onItalianryegrassseed germination and seedling growth[J].ActaPrataculturaeSinica, 2017, 26(2):136-145. (in Chinese with English abstract) [30] 姚晓华, 吴昆仑. PEG预处理对青稞种子萌发和幼苗生理特性的影响[J]. 西北植物学报, 2012, 32(7):1403-1411. YAO X H, WU K L. Effect of PEG pretreatment on germination and growth physiology of hulless barley[J].ActaBotanicaBoreali-OccidentaliaSinica, 2012, 32(7):1403-1411. (in Chinese with English abstract) [31] 刘成, 陈晓德, 吴明, 等. 芦苇叶片化感作用对加拿大一枝黄花生长及生理生化特性的影响[J]. 草业学报, 2014, 23(3):182-190. LIU C, CHEN X D, WU M, et al. Allelopathic effects ofPhragmitescommunisleaves on the growth and physiobiochemical characteristics ofSolidagocanadensis[J].ActaPrataculturaeSinica, 2014, 23(3):182-190. (in Chinese with English abstract) [32] ZHANG L P, MEHTA S K, LIU Z P, et al. Copper-induced proline synthesis is associated with nitric oxide generation inChlamydomonasreinhardtii[J].Plant&CellPhysiology, 2008, 49(3):411-419. [33] 孙海燕, 王炎. 辣椒根系分泌的潜力化感物质对生菜幼苗抗氧化代谢的影响[J]. 植物生理学报, 2012, 48(9):887-894. SUN H Y, WANG Y. Effect of root exudated potential allelochemicals in hot pepper (CapsicumannummL.) on antioxidative metabolism for lettuce (LactucasativaL.)[J].PlantPhysiologyJournal, 2012, 48 (9): 887-894. (in Chinese with English abstract) [34] 许可成, 魏小红, 赵萌, 等. 麻花秦艽水浸提液对紫花苜蓿和小麦种子萌发和幼苗生长的影响[J]. 草业科学, 2015, 32(3):413-420. XU K C, WEI X H, ZHAO M, et al. Effects of aqueous extracts ofGentianastramineon seed germination and seedling growth ofMedicagosativaandTriticumaestivum[J].PrataculturalScience, 2015, 32(3):413-420. (in Chinese with English abstract) [35] 廖梦雨, 胡庭兴, 邓承敏, 等. 3个树种凋落叶水浸提液对三叶鬼针草生长及抗性生理的影响[J]. 生态与农村环境学报, 2014, 30(6):724-730. LIAO M Y, HU T X, DENG C M, et al. Effect of leaf litter water extract of three species on growth and resistance physiology ofBidenspilosa[J].JournalofEcologyandRuralEnvironment, 2014, 30(6):724-730. (in Chinese with English abstract) [36] 贾双双, 高青海, 刘国祥, 等. 短期极端高温对鸡冠花种子活力及早期幼苗生理特性的影响[J]. 热带亚热带植物学报, 2017, 25(2):141-148 JIA S S, GAO Q H, LIU G X, et al. Effect of Short-term extreme high temperature on seed vigor ofCelosiacristataand physiological characteristics of early seedlings[J].JournalofTropicalandSubtropicalBotany, 2017, 25(2):141-148. (in Chinese with English abstract) [37] ZHAO H, DAI T, JING Q, et al. Leaf senescence and grain filling affected by post-anthesis high temperatures in two different wheat cultivars[J].PlantGrowthRegulation, 2007, 51(2):149-158. [38] DE LA HABA P, DE LA MATAL, MOLINA E, et al. High temperature promotes early senescence in primary leaves of sunflower (Helianthus annuus L.) plants[J].CanadianJournalofPlantScience, 2014, 94(4):659-669. [39] 柴强, 黄高宝. 植物化感作用的机理、影响因素及应用潜力[J]. 西北植物学报, 2003, 23(3):509-515. CHAI Q, HUANG G B. Review on action mechanism affecting factors and applied potential of allelopathy[J].ActaBotanicaBoreali-OccidentaliaSinica, 2003, 23(3):509-515. (in Chinese with English abstract)1.3 数据统计分析
2 结果与分析
2.1 滇重楼根水浸液对种子萌发的影响
2.2 滇重楼根水浸液对幼苗生长的影响


2.3 滇重楼根水浸液对幼苗叶绿素含量的影响
2.4 滇重楼根水浸液对幼苗抗氧化酶活性的影响
2.5 滇重楼根水浸液对幼苗丙二醛(MDA)含量的影响
3 结论与讨论
3.1 滇重楼根水浸液对4种园林植物的化感效应
3.2 滇重楼根水浸液对4种园林植物叶绿素含量的影响
3.3 四种园林植物对滇重楼根水浸液化感作用的应答反应