归纳配平方法 提高配平效率
2018-02-24吴倩
吴倩
[摘要]化学方程式的配平问题是初中化学的重要知识点,因此,能够快速准确地配平方程式是每个学生需要拥有的技能。对组合比法、数学归一法、最小公倍数法等方程式的配平技巧进行归纳,是教师应具备的教学能力。
[关键词]方程式;配平;初中化学
[中图分类号]G633.8 [文献标识码]A [文章编号]1674-6058(2017)23-0062-01
化学方程式贯穿整个初中化学,而方程式的配平又是书写化学方程式的基础。化学方程式的配平方法有很多,但是学生在平时的解题过程中并不能根据不同的題型,选择合适的配平方法。那么,应采用什么样的配平方法,提高学生配平化学方程式的效率呢?
一、组合比法
运用组合比法配平化学方程式的根据是,物质被破坏后形成的原子,按照一定的比例重新组合成新的物质。此配平法的步骤是:首先,根据生成的物质的结构,确定新物质的原子组合比;其次,根据物质之间的组合比例,找出反应物质之间的系数关系;最后,化简生成物与反应物的系数。
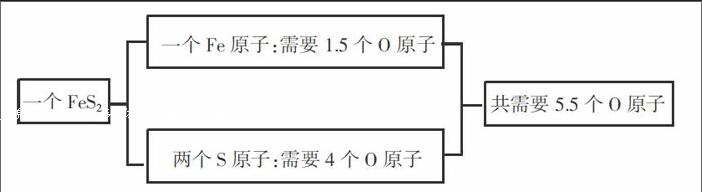
[例1]FeS2在空气中燃烧产生Fe2O3和SO2,根据反应物与生成物,请配平下列化学反应方程式:FeS2+O2→Fe2O3+SO2。
分析:反应生成的产物为FezO3和SO2,在Fe2O3中铁和氧的原子组合比为2:3,在SO2中硫和氧的原子组合比为1:2;在此化学反应中FeS2被破坏,生成原子铁和原子硫,分子氧被破坏成为原子氧。
解:经过对方程式中的物质进行分析,本题确定各物质之间的系数比如下:
因此,FeS2与O原子的比为1:11/2,那么FeS2:O2=1:11/4,化简后为4:11,最后根据反应前后总的原子数不变可知,生成的Fe2O3为2个,SO2为8个,所以有4FeS2+11O2=2FeaO3+8SO2。
评注:使用组合比的方法配平方程式,有利于化学反应过程的再现,让学生深入理解化学反应的实质,即原子的重新组合,同时还有助于学生对原子守恒定律的理解。
二、数学归一法
采用数学归一法配平方程式,可以有效解决各种不同水平的配平难题。此方法的配平思路为:首先,单个原子或分子的系数不变;其次,配平反应前后有较大原子数变化的物质;最后,将系数比化为简单整数比的形式。
[例2]将一氧化碳气体通人含有Fe2O3的试管中,经加热可以得到产物Fe和CO2,化学反应式如下:Fe2O3+CO→Fe+CO2,试配平此方程式。
分析:经过观察反应物前后的分子式,发现Fe为单原子分子,符合数学归一法的要求,因此,对此题目中的方程式进行配平时,首先考虑数学归一法。
解:Fe前的系数暂时不变,同时忽略Fe原子反应前后的个数差。经观察发现,反应前O的个数为4,反应后为2,因此CO2前的系数变为2。根据碳原子守恒可知,反应前CO的系数变为2。方程式右边有4个O原子,左边CO占有2个O原子,因此Fe2O3前的系数为2/3,可得:2/3Fe2O3+2CO=4/3Fe+2CO2,最后经过化简得:Fe2O3+3CO=2Fe+3CO2。
评注:数学归一法在化学方程式的配平问题中实用性较强。在使用此方法时,只要严格按照规则解题,就能快速准确地配平方程式,因此本方法有助于学生解题效率的提高,而且可以培养学生的化学学习兴趣。
三、最小公倍数法
化学方程式的配平方法有很多,而最基本的方法是最小公倍数法。使用此方法的关键是,找出各原子数的最小公倍数中最大的一个。
[例3]甲醇在氧气中燃烧生成CO2和HVO,请配平下面的方程式:CH3OH+O2→CO2+H2O。
分析:采用最小公倍数法配平时,首先需找出方程式中各原子数的最小公倍数,然后通过对公倍数的比较,选出拥有较大公倍数的原子,依据此原子进行方程式的配平,最后将方程式化简为最简单的整数比的形式。
解:左右两端O的最小公倍数为3,C原子的为1,而H原子的为4,因此首先对H原子进行配平,则HaO前面的系数为2。此时,左右两边的C和H原子数相同,而右边0的原子数为4,除去CH3OH中的氧,则O2前的系数应为2/3。此时的方程式为:CH3OH+3/2O2→CO2+2H2O,最终经化简得:2CH3OH+3O2=2CO2+4O2。
评注:此方法的最大优势是,充分考虑到学生的理解水平,使用了分数化的配平技巧,而且适用范围较广。教师在讲解方程式配平问题时,需充分考虑题目的特点及学生的接受能力,尽可能地“授之以渔”。
综上所述,有关化学方程式的配平问题是有一定解题技巧的。教师在教学过程中需根据不同化学方程式的不同特点,引导学生选择合适的配平方法,从而使学生的配平效率得以提高。
(责任编辑罗艳)endprint