一种重组人溶菌酶的纯化工艺研究
2018-02-23邓晗,史瑾,王维,郝东,王俊,杨小琳
邓晗,史瑾,王维,郝东,王俊,杨小琳

摘 要:目的:以毕赤酵母表达的重组人溶菌酶(hLYZ,以下简称hLYZ)发酵液为原料,建立一种hLYZ纯化方法。方法:高速离心技术、膜过滤技术,超滤技术为主的粗纯工艺;应用离子交换色谱的精细纯化工艺。结果:以该纯化工艺可生产获得单一组分的hLYZ,经SDS聚丙烯酰胺凝胶电泳及反相高效液相色谱C18柱检测其纯度可达98%以上。结论:本工艺得到的hLYZ纯度大于98%、可用于进一步工业化研究。
关键词:hLYZ;超滤浓缩;离子交换层析;纯化
中图分类号:Q55 文献标志码:A 文章编号:2095-2945(2018)06-0176-03
Abstract: Objective: to establish a method for purification of human lysozyme (hLYZ) from the fermentation broth of recombinant human lysozyme (hLYZ) expressed by Pichia pastoris. Methods: high speed centrifugation, membrane filtration and ultrafiltration were used for crude purification, and ion exchange chromatography was used for fine purification. Results: a single component of hLYZ could be obtained by this purification process. The purity of hLYZ could reach more than 98% by SDS polyacrylamide gel electrophoresis and RP-HPLC C18 column. Conclusion: the purity of hLYZ obtained by this process is more than 98%, which can be used for further industrial research.
Keywords: hLYZ; ultrafiltration concentration; ion exchange chromatography; purification
引言
溶菌酶(lysozyme)是一种专门作用于微生物细胞壁的水解酶,又称胞壁质酶,溶菌酶广泛的存在于高等动物组织及分泌物、鸟类和家禽的蛋清中也含有此酶、其中以鸡蛋清中含量最高[1-2]。它是一种无毒、无副作用的蛋白质,具有一定的溶菌作用,可作为食品防腐剂。同时它具有抗菌、抗病毒等多种作用[3]。溶菌酶还具有破坏细胞壁结构的功能,因此溶菌酶成为基因工程及细胞工程必不可少的工具酶[4]。随着生物工程的迅速发展,溶菌酶应用价值将会越来越重要。目前用于溶菌酶分离纯化的方法主要有结晶法[5-6]、离子交换法[7-8],特别是现在采用的新技术如膜分离技术[9-10]、超滤法、亲和-膜过滤技术等[11-12]。
与其他来源溶菌酶相比,人溶菌酶具有其优越性和多种药理作用,在临床上也具有重要价值。 因此分离纯化得到高纯度hLYZ,产品用于进一步科学研究就显得尤为重要。但天然溶菌酶来源及其困难,DNA重组技术进行生产是解决这一困难的有效途径,现已利用化学合成或从人细胞组织中制备cDNA等途径获取人溶菌酶基因,并在大肠杆菌,酵母菌等表达系统进行了表达,由于其表达水平不高,再加上后期纯化工艺损失,总体收益较低, 因此目前国内外对于hLYZ纯化工艺研究相对较少,本工艺运用固液分离技术,超滤技术、离子交换层析技术得到纯度大于98%的hLYZ产品,符合工业化生产要求,且工艺相对简单易操,可用于进一步的工业化研究。
1 材料和方法
1.1 仪器
辽阳阳光三足式离心机(SSC600-NG)、0.22um除菌滤器、天津膜天膜中空纤维膜组件、武汉新力协力超滤膜组件、AKTA purifiers 100、北京六一电泳仪、日立HPLC 、C18层析柱(中科院大连化学物理研究所)。
1.2 试剂及材料
(1)试剂。十二水合磷酸氢二钠、二水合磷酸二氢钠、氯化钠、氢氧化钠、盐酸以及电泳相关试剂均为国产分析纯;去离子水;超纯水;乙腈及三氟乙酸均为色谱纯;CM Sepharose Fast Flow(保赛恒成生产,批号:20131120)。对照品LYZ:sigma Lysozme hunman(L1667)。(2)材料。本公司201705003-50L批hLYZ發酵液。
1.3 方法
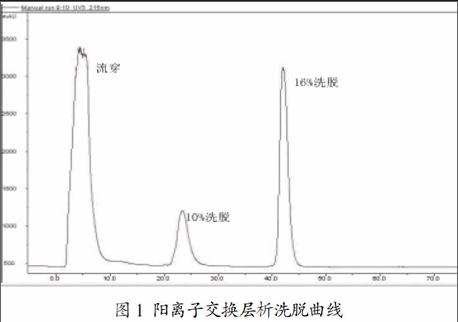
(1)hLYZ粗纯。发酵液经沉降式离心机转速2000转/分钟,离心60分钟进行固液分离;收集上清,上清经0.22um中空纤维膜过滤系统,去除残余菌体、细胞碎片以及部分杂质;收集0.22um滤出液用5k卷式超滤膜超滤浓缩脱盐。(2)hLYZ阳离子交换层析。a. 样品处理:最终收集收集的浓缩液中加入0.05M磷酸二氢钠溶液,调节pH7.5-8.0,电导6.0-7.0 mS/cm,配成上样溶液备用。b. CM阳离子交换层析纯化:配制流动相A:pH7.6 50mM磷酸盐缓冲液,pH7.5-8.0之间,电导6.0-7.0 mS/cm;B:pH7.6 50mM磷酸盐缓冲液,1M NaCl,pH7.5-8.0之间。将a中的hLYZ样品上CM FF层析柱,样品上样完成后,用A相平衡,10%B相洗脱为杂质,16%B洗脱液为hLYZ。
1.4 分析检测
(1) Tricine-SDS-PAGE电泳检测。hLYZ分子量为14.7Kd,故采用15%的分离胶分别对粗纯样品以及离子交换层析样品进行分析检测,先60v电压 60min,再120v电压150min。电泳完成后用固定液固定30min,再用R250染色30min,最后用脱色液脱色。(2)HPLC对hLYZ纯度分析。采用HPLC对纯化后hLYZ进行纯度分析,色谱柱为C18柱,流动相A:生理盐水+0.1%TFA;B相为60%已腈+40%生理盐水,色谱分析程序为40B-70B 30min。检测波长为215nm。
2 结果
2.1 hLYZ纯化
hLYZ发酵液先进行固液分离;去除酵母细胞以及不溶性杂质,在过0.22um中空纤维膜过滤系统,进一步去除残余菌体、细胞碎片以及部分大分子物质等;最后用5k卷式超滤膜超滤浓缩脱盐出去部分小分析物质。
将5k脱盐浓缩后的hLYZ加入0.05M磷酸二氢钠溶液,调节pH7.5-8.0,电导6.0-7.0 mS/cm,分別用10%,16%的B相进行阶梯洗脱,16B洗脱为目标蛋白,见图1。
2.2 Tricine-SDS-PAGE电泳检测
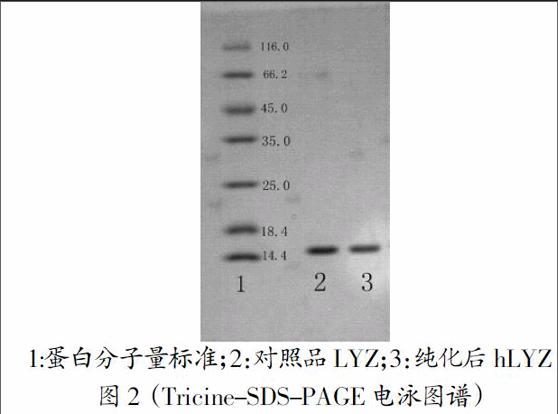
对分离纯化得到的hLYZ采用Tricine-SDS-PAGE电泳分分析检测其纯度,检测结果如图2所示,分离得到的hLYZ分子量在14.4kd,与对照品LYZ电泳迁移位置一致,且整个电泳条带中杂带较少,纯度较高。
1:蛋白分子量标准;2:对照品LYZ;3:纯化后hLYZ
2.3.HPLC纯度分析
经高效液相色谱分析表明:纯化后hLYZ出峰时间为16.03min,对照品hLYZ出峰时间为15.96min。纯化后hLYZ与对照品hLYZ出峰时间基本一致,采用面积归依法计算峰面积,得到hLYZ产品纯度98.3%,hLYZ产品检测色谱图如图3 ,hLYZ对照品出峰时间如图4。
3.结束语
本方法采用传统的固液分离技术、过滤技术以及超滤技术得到hLYZ粗品,经一部阳离子交换层析得到纯度位98.3%的hLYZ产品。目前国内外对于hLYZ的研究较少,且大部分集中在对蛋清等其他来源的溶菌酶的研究,而对人溶菌酶的研究相对较少,分离纯化方面的研究鲜有报道,本工作初步建立了一种以超滤过滤技术粗纯,阳离子交换层析技术精纯的hLYZ高纯度分离纯化工艺,工艺进一步优化后,有望进行高纯度大规模的生产。
参考文献:
[1]凤权,汤斌.溶菌酶分离纯化方法的研究进展[J].生物学杂志,2006,23(1).
[2]宋娟.溶菌酶分离方法及进展[J].河南化工,2017,34:16-17.
[3]林立.溶菌酶分离方法综述及进展[J].广州化工,2012,40(7): 53-56.
[4]Paola A,Joseph H.H.Immobilization of lysozyme on food contact polymers as potential antimicrobial films[M].Packaging Technology and Science, 1997,10:271-279.
[5]Alderton G,Ward W,Fevold H.Isolation fo lysozyme from egg white[J].Journal of Biological Chemistry,1945,157:43-58.
[6]杨景芝,孙衍华,白吉刚,等.鸡蛋清溶菌酶提取工艺的改进[J].食品与发酵工业,2004,30(5):85-87.
[7]余海芬,马美湖,刘岩.阳离子交换法提取蛋清溶菌酶的研究[J].中国家禽, 2008,30(24):22-25.
[8]宋宏新,薛海燕,杨芳.鸡蛋壳溶菌酶分离纯化工艺研究[J].食品工业科技, 2003,9:60-63.
[9]李静,陈欢林,柴红.金属螯合亲和膜吸附分离与纯化溶菌酶的研究[J].膜科学与技术,2001.21(4):5-9.
[10]Raja. G Protein purification by ultrafiltration with pretreated mem -brane[J].Journal of membrane Science,2000,49-54.
[11]李存芝,李琳,胡松青,等.亲和膜过滤技术及其应用[J].现代化工,2004, 1(24):64-66.
[12]陈萍,赵玮,李琳,等.水溶性葡聚糖亲和超滤载体对溶菌酶吸附分离特性的研究[J].食品工业科技,2011,32(8):84-86.
