中药太灵丹对STZ诱导糖尿病肾病大鼠肾脏保护作用的影响*
2018-02-22李敏州张瑞霞赵凯莹
李敏州,武 忠,张瑞霞,高 巍,赵凯莹
内蒙古自治区人民医院中医科,内蒙古 呼和浩特 010017
糖尿病肾病(diabetic nephropathy,DN)是临床常见而难治的糖尿病微血管并发症,是导致终末期肾病的首位病因(约占35%)[1]。由于该病的发病机制尚未完全阐明,故无理想的防治药物,因此探讨DN的发病机制、研究有效的防治药物,已成为该研究领域的热点。近年来的研究发现,肾间质纤维化(renal interstitial fibrosis,RIF)是各种肾脏疾病发展至终末期的必经阶段,其病变程度更能体现肾功能的恶化程度[2-3]。肾小管上皮细胞转分化(tubular epithelialmesenchymal transdifferentiation,TEMT)被认为是肾间质纤维化发生的重要机制[4],故对TEMT进行干预治疗可能成为防治DN的有效措施。本研究拟通过建立链脲佐菌素(STZ)诱导的糖尿病肾病大鼠模型,采用中药太灵丹治疗,并与缬沙坦进行对照,观察中药太灵丹对糖尿病大鼠肾小管上皮细胞转分化的影响,为临床防治糖尿病肾病肾间质纤维化提供新途径。
1 材料与方法
1.1 动物 8周龄SPF级雄性Wistar大鼠70只,购自中国医学科学院动物中心,实验动物合格证号:SCXK(京)2009-0004。饲养于内蒙古医科大学基础医学院动物实验室,温度控制在22℃左右,湿度60%,12小时明暗交替照明。
1.2 药物与试剂 太灵丹,主要药物组成:太子参,灵芝,丹参,牡丹皮,赤芍,桃仁,红花,生黄芪,当归,熟大黄,枳实,甘草等(由内蒙古自治区人民医院制剂室制备)。缬沙坦胶囊(商品名代文,北京诺华制药有限公司,批号:X1006)。尿素氮试剂盒(批号:C013-1)、血肌酐试剂盒(批号:C011-1)、尿蛋白定量测试盒(批号:C035-2)、糖化血红蛋白测定试剂盒(批号:A056-1)、甘油三酯测定试剂盒(批号:A110-2)(以上药物均购自南京建成生物工程研究所)。TGF-β1抗体(美国Abcam公司,批号:ab92486),E-cadherin抗体(美国 CST公司,批号:3195S),α-SMA 抗体(美国 Abcam公司,批号:ab32575),生物素标记的羊抗兔IgG(美国Jackson公司,批号:111065003)及辣根过氧化物酶标记链霉亲和素(美国Jackson公司,批号:016030084),DAB显色液(北京华肽先锋生物科技有限公司,批号:41207-1)。
1.3 仪器 WL9-ONETOUCH Ultra稳豪血糖仪(美国强生);7160全自动生化分析仪(日本日立);奔腾MMX多媒体微机(MIAS2000型图像分析系统);6500i光学显微镜(中国重光)。
1.4 方法
1.4.1 造模与分组 大鼠适应性喂养1周后按体质量随机分成正常对照组10只,喂食普通饲料(12%脂肪,60%碳水化合物,28%蛋白质)。其余60只Wistar大鼠饲以高糖高脂饲料(58%脂肪,25.6%碳水化合物,16.4%蛋白质),自由摄食、饮水,并腹腔注射STZ 30 mg/kg,72小时后测血糖和尿糖,血糖≥16.7 mmol/L,尿糖4+以上者为模型成功,并按大鼠体质量随机分为造模组、太灵丹低、中、高剂量组、缬沙坦组,每组12只。
1.4.2 给药 太灵丹低、中、高剂量组分别以生药 5、10、20 g/kg·d 灌胃,缬沙坦组按 10 mg/kg·d灌胃,1次/d,正常对照组和模型组大鼠给予等量去离子水灌胃。定期测体质量与血糖,连续14周。
1.5 观察指标
1.5.1 生化检测 处死前,大鼠禁食水24小时,剪尾用葡萄糖氧化酶法测定血糖水平;代谢笼收集大鼠24小时尿液,CBB法测定24小时尿蛋白定量;10%水合氯醛麻醉下腹主动脉取血致死,比色法检测全血糖化血红蛋白(HAb1c);分离血清,用苦味酸法测定血肌酐(Scr)水平、二乙酰肟比色法测定血尿素氮(BUN)、单试剂GPO-PAP法测定甘油三酯(TG)水平。
1.5.2 肾脏病理检查 大鼠处死后立即摘取左侧肾脏,剥去包膜,10%中性福尔马林固定,石蜡包埋,制成 2 μm 连续切片,经HE、PAS 和 Masson 染色后,在中国重光6500i光学显微镜下观察肾组织的病理形态学改变。双盲给予HE染色下肾间质损伤病变计分,小管间质损害的特征按Banff分级[5]进行0~3+半定量计分:无变化评0分;轻度改变评1分(病变范围<25%);中度评2分(病变范围26%~50%);严重评3分(病变范围>50%)。记录连续不重叠的15个200倍视野的数值,取其平均值来比较每例切片的肾小管间质区域病变的程度。
1.5.3 免疫组化 石蜡包埋的4 μm连续切片,按说明书步骤进行α-SMA、E-cadherin及TGF-β1染色,DAB显色,脱水,透明封固。结果判断:PBS替代一抗作为阴性对照组。以胞浆内出现棕黄色或黄色颗粒为阳性结果,表示有标记蛋白的表达。根据肾小管上皮细胞的染色范围判断阳性表达强度。IHC半定量结果评定:根据染色程度和范围进行分析评定。每例切片200倍下观察20个互补重叠肾间质视野,根据染色程度和着色范围[6]进行分析评定。将每张切片的染色程度和范围得分相乘即为其最后得分。分别由2名医师双盲进行积分,取其平均值。见表1。

表1 IHC着色程度及范围评分标准
1.6 统计学方法 利用SPSS 13.0软件进行统计学分析,计量资料以(χ±s)表示,采用单因素方差分析及LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 体质量及血糖 正常对照组大鼠体质量、肾脏质量、空腹血糖及HAb1c均明显低于模型组(P<0.01或0.05),太灵丹高、中、低剂量组及缬沙坦组以上指标亦低于模型组,但差异无统计学意义(P>0.05)。模型组大鼠的相对肾重较正常对照组大鼠有所增加,但差异无统计学意义(P>0.05)。见表2。
2.2 24小时尿蛋白定量及血生化水平 正常对照组大鼠24小时尿蛋白定量明显低于模型组(P<0.01),各治疗组尿蛋白定量均低于模型组,且太灵丹组各剂量与模型组24小时尿蛋白定量比较差异有统计学意义(P<0.05)。对照组TG明显低于模型组(P<0.01),太灵丹各剂量组及缬沙坦组的TG水平均较模型组有所下降,且差异有统计学意义(P<0.05)。见表3。
表2 各组小鼠体质量及血糖的变化(χ±s)

表2 各组小鼠体质量及血糖的变化(χ±s)
注:*与表示正常对照组比较,P<0.01
组别 只数 体质量/g 体质量/肾质量(×10-3)空腹血糖/(mmol·L-1) HAb1c/%正常对照组 10 236.71±8.44 5.57±0.43 4.87±0.24 4.40±0.20模型组 12 279.88±16.06* 6.37±1.85 23.4±4.31* 12.6±0.98*太灵丹中剂量组 12 236.84±17.39* 5.93±0.30 18.1±3.95* 11.5±2.57*太灵丹低剂量组 12 241.99±18.30* 5.92±0.65 18.0±1.88* 12.0±0.98*太灵丹高剂量组 12 238.48±16.64* 5.83±0.45 17.9±2.12* 11.8±1.63*缬沙坦组 12 254.68±18.54* 5.52±0.53 19.2±3.02* 12.3±2.31*
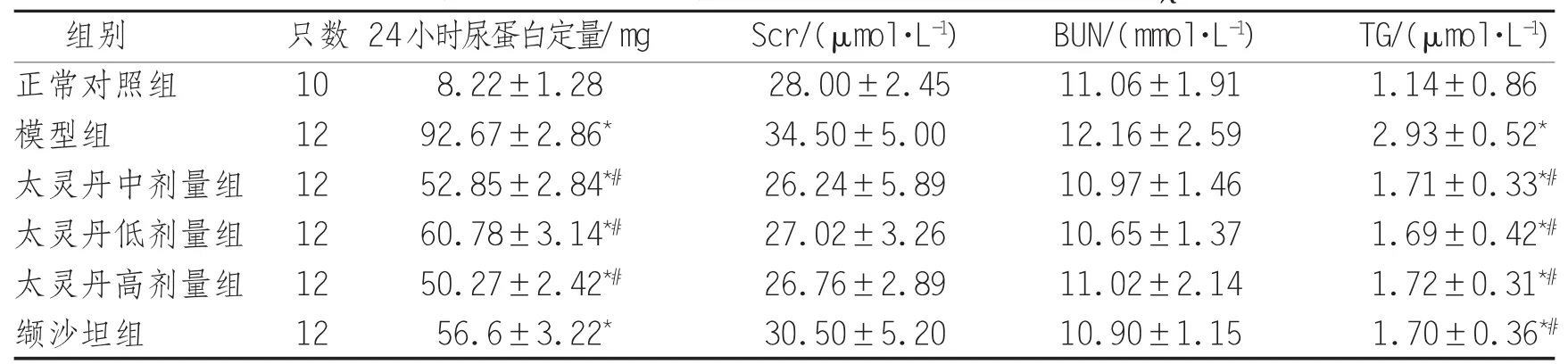
表3 各组大鼠24小时尿蛋白定量及血生化水平的变化(χ±s)
2.3 肾脏病理改变 正常对照组:肾小球、肾小管及肾间质结构清楚,肾小管上皮细胞呈方形,大小一致,排列整齐,基底膜完整,间质中未见炎症细胞浸润和纤维组织增生,肾间质损伤评分为0分;模型组:肾小球肥大,基底膜增厚,细胞外基质增多及肾小管上皮细胞大量萎缩、空泡变性,间质内炎性细胞浸润,肾间质损伤评分为(2.78±0.33)分。而太灵丹各剂量组和缬沙坦组相似,间质内炎性细胞呈小灶性浸润,少许上皮细胞肿胀,少部分肾小管轻度扩张,肾间质未见明显纤维化,肾间质损伤评分分别为(2.34±0.31)分、(2.23±0.22)分,与模型组比较差异有统计学意义(P<0.05)。
2.4 E-cadherin、α-SMA 及 TGF-β1表达 E-cadherin:正常对照组小鼠肾小管上皮细胞有较强的不均匀棕黄色细颗粒表达,且明显高于其余各组小鼠(P<0.05),与模型组相比,太灵丹各剂量组及缬沙坦组E-cadherin表达增加(P<0.01),但各组间差异无统计学意义(P>0.05)。
α-SMA及TGF-β1:其余各组与正常对照组比较,小鼠肾小管上皮细胞中α-SMA及TGF-β1表达明显增强(P<0.01),经太灵丹各剂量组及缬沙坦组,上诉指标的表达较模型组明显减弱(P<0.01),但各组间差异无统计学意义(P>0.05),见表3。
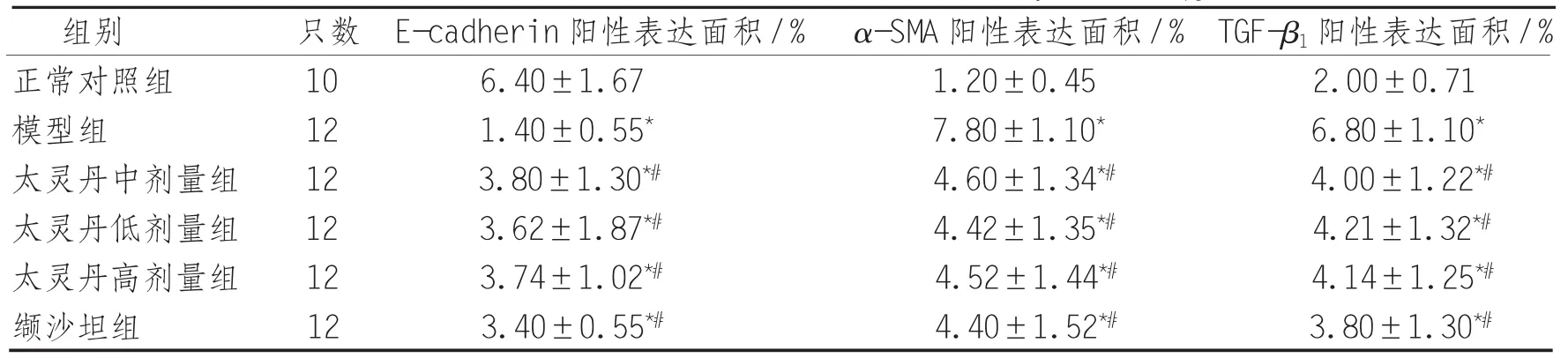
表3 各组肾小管上皮细胞E-cadherin、α-SMA及TGF-β1的表达(χ±s)
3 讨论
RIF受多种因素的影响,其中TEMT在肾间质纤维化中起到关键作用[7-8]。肾间质纤维化的一个重要机制就是肌成纤维细胞(Myof)增多与活化,Myof是间质中分泌合成Ⅳ型胶原(ColⅣ)、纤维连接蛋白(FN)、层黏连蛋白(LN)等细胞外基质(ECM)成分的主要细胞,而ECM的过度积聚是RIF发生的主要病理改变,在肾间质纤维化发生发展过程中起重要作用。近年研究发现,肌成纤维细胞除了由成纤维细胞活化而来,还有约36%的新增纤维细胞来源于肾小管上皮细胞转分化[9]。正常的肾小管上皮细胞具有旺盛的代谢活性和潜在的生殖能力,并能分泌多种细胞因子,在糖尿病肾病状态下,由于肾小管和尿液经常接触,尿液中的尿糖、蛋白、细胞因子等有害物质可直接引起肾小管上皮细胞损伤、活化及表型转化。EMT的发生包括4个关键步骤[10]:1)肾小管上皮细胞间黏附丢失,即E-cadherin减少;2)α-SMA的表达增多;3)肾小管基底膜的破坏;4)细胞的移动和浸润增加。转化生长因子β1(TGF-β1)是目前公认的最重要的促纤维化细胞因子,它通过刺激相关细胞产生 ECM,最终导致纤维化的发生[11]。TGF-β1诱导的EMT最早期改变就是抑制E-cadherin的表达,E-cadherin表达减少则上皮细胞细胞间的极性和完整性遭到破坏[12]。受损的肾小管上皮细胞又可以分泌TGF-β1,刺激肾小管上皮细胞向肌成纤维细胞表型转化,并获得肌成纤维细胞的表型—α-SMA[13-14]。故 E-cadherin、α-SMA 及 TGF-β1被认为是反映肾小管上皮细胞转分化和肾间质纤维化程度的重要指标。
本研究采用STZ诱导的Wistar糖尿病肾病大鼠作为模型,采用高糖高脂饲料配合低剂量腹腔注射STZ(30 mg/kg)的方法进行造模,模拟2型糖尿病患者的发病方式。该造模方法具有简单易行、重复性好、接近2型糖尿病患者的发病原因等特点[15]。实验表明,STZ诱导的糖尿病肾病大鼠体质量、血糖、糖化血红蛋白、24小时尿蛋白定量均较正常对照组大鼠明显升高,病理显示肾小球肥大,基底膜增厚,细胞外基质增多及肾小管上皮细胞大量萎缩、空泡变性,间质内炎性细胞浸润,故STZ诱导糖尿病大鼠具有糖尿病肾病间质纤维化的表现。太灵丹各剂量组及缬沙坦组,上述改变较模型组明显减轻(P<0.05),但各组间差异无统计学意义。提示太灵丹具有较强的降糖、减少尿蛋白及保护肾功能的作用。此外,通过免疫组化检测到STZ诱导的糖尿病肾病大鼠肾脏中E-cadherin表达减弱、TGF-β1及α-SMA表达增强,说明STZ诱导的糖尿病肾病大鼠肾脏内存在EMT过程。经太灵丹及缬沙坦处理后,上述改变较模型组明显减轻(P<0.05),但各治疗组之间各指标差异无统计学意义(P>0.05)。说明太灵丹可增强肾小管上皮细胞E-cadherin的表达,减少TGF-β1及α-SMA的表达,减缓肾小管上皮细胞的转分化过程,延缓肾间质纤维化的发展。
糖尿病属于中医学“消渴”范畴,目前认为其病机以阴虚为本、燥热为标;后期则气阴两虚,阴阳俱衰;正气不足,瘀血内生。但糖尿病肾病后期患者因蛋白丢失过多,以及瘀血形成,因此正虚及瘀血表现得较重,而属于邪实的血热表现得不突出。太灵丹药物组成中太子参补中益气,灵芝补气安神;“一味丹参,功同四物”,丹参养血活血,不燥不热,与牡丹皮、赤芍共用凉血活血;桃仁、红花活血化瘀;生黄芪,当归取当归补血汤之义,补气以生血;熟大黄、枳实行气降气使补而不滞,甘草补气解毒,调和诸药,诸药合用共奏益气养阴,凉血活血之功。临床用于治疗早期及临床期糖尿病肾病,有明显的减少尿蛋白、改善肾功能的作用,安全有效。现代药理学研究表明,太子参多糖可以提高血清超氧化物歧化酶水平,降低丙二醛含量,保护胰腺,降低血糖,还能降低甘油三酯和胆固醇[16];灵芝能够减少糖尿病肾病大鼠IGF-1在DN的表达,从而保护肾脏的作用[17];黄芪具有降血糖、下调TGF-β1的表达,减轻肾脏病组织病理损害,修复肾组织结构的作用[18];大黄可通过抑制细胞增殖,促进细胞凋亡,抑制细胞因子及ECM的合成,起到抗肾间质纤维化的作用[19-20]。
本研究结果表明,太灵丹可能是通过减缓EMT的进展,从而保护STZ诱导糖尿病肾病大鼠肾脏功能和组织结构,延缓肾间质纤维化的发展,本研究为糖尿病肾病的治疗提供新思路,为糖尿病肾病临床防治用药提供实验依据。
