树鼩胸主动脉血管内皮细胞的分离培养与鉴定*
2018-02-21宋庆凯尹博文陈玲霞李晓飞苗雨润代解杰孙晓梅
宋庆凯 尹博文 陈玲霞 李晓飞 苗雨润 代解杰 孙晓梅
(中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心,云南省重大传染病疫苗研发重点实验室,实验树鼩标准化与应用研究省创新团队,昆明 650118)
血管内皮细胞(vascular endothelial cells, VECs)是存在于血管内侧的单层扁平上皮细胞。它将血管内外分开,起着屏障作用。除此之外,血管内皮细胞还起着其他重要的生理功能,如:血管调节、物质转运、凝血、免疫等。在病毒感染实验中,血管内皮细胞也是很好的模型,如曾有学者利用人血管内皮细胞开展登革病毒、流感病毒等病毒感染机制研究。目前已有人[1]、大鼠[2]、兔[3]、犬[4]等的血管内皮细胞获得了体外原代培养。树鼩作为人类近亲,是建立病毒感染模型很好的材料。关于树鼩主动脉血管内皮细胞分离培养尚未见到相关报道。而由于树鼩体型小,对于分离血管内皮细胞有一定的难度,所以,探索一种操作简便、经济可行的分离、原代培养方法十分必要。
1 材料
1.1 实验动物
新生两日龄树鼩,饲养环境:温度22~28 ℃,相对湿度30%~60%,噪声 ≤ 60 dB,光照强度1001x~1501x。实验动物来源于医学生物学研究所树鼩种质资源中心,生产许可证号SCXK(滇)K2013-0001,实验操作在医学生物学研究所树鼩种质资源中心实验设施进行,使用许可证号SYXK(滇)K2013-0001。
1.2 实验设备和试剂耗材
Forma A/B3(6Ft)生物安全柜,Forma CO2T/C 恒温培养箱,尼康Ti倒置显微镜,HDR-PJ10E 摄像机,L8-80 M 超速离心机,ZD-85 双功能气浴振荡器, BS100S 电子天平,TOMY-SS-325 高压灭菌锅;PBS(购自Thermo),DMEM/F12 培养基(购自Gibco),FBS(购自Hyclone),胰蛋白酶(购自Gibco),抗Ⅷ因子抗体(购自Millipore),胶原酶XI,中性蛋白酶II,BSA(购自BIOSHARP),NunclonTMSpheraTMT25培养瓶(购自Thermo)。
1.3 方法
1.3.1树鼩主动脉血管内皮细胞的分离
1.3.1.1 组织块培养法:取新生两日龄树鼩,注射过量2% 戊巴比妥钠处以安乐死,用无菌剪取胸主动脉,在显微操作台下仔细去除血管外结缔组织和脂肪,用眼科剪将血管延纵向剪开;在超净工作台上用含2% 双抗的HBSS溶液清洗血管3次;无菌剪将血管剪碎,约1 mm3大小;用眼科镊将组织块夹入T25 培养瓶中;组织块均匀放好后将瓶底朝上,向瓶内注入适量含10%新生牛血清的DMEM/F12完全培养基;放置1 h,待组织小块贴附后,将培养瓶慢慢翻转平放,37 ℃、5% CO2培养箱培养。
1.3.1.2 胰蛋白酶、胶原酶连续消化法:主动脉组织碎块获得过程参照1.3.1.1,组织块中加入5 mL 0.125%胰蛋白酶消化液,置于气浴振荡器37 ℃消化 15 min;消化产物中加入等体积的含10%新生牛血清的DMEM/F12完全培养基终止消化;1 200 r/min 离心5 min;弃上清;加入5 mL含75 U/mL胶原酶XI、20 μg/mL中性蛋白酶II、0.5 m mol/L二硫苏糖醇(DTT)的DMEM/F12消化液;置于孵箱 37 ℃ 180 r/min 摇动消化1 h;1 200 r/min离心5 min;弃上清;加入4 mL 完全培养基重悬接种于T25细胞瓶,置37 ℃、5% CO2培养箱培养;每隔2 d换一次液。
1.3.2细胞形态学观察:用倒置显微镜对培养的原代VECs进行观察,并拍照记录。
1.3.3细胞传代培养:原代培养约 10~12 d,显微镜观察到细胞覆盖培养瓶面积的 2/3 以上,约80% 的细胞汇合即可传代。弃去培养基,PBS清洗2~3次,加入1 mL 0.125% 胰蛋白酶消化,约1 min,见内皮细胞收缩变圆,立即加入等体积的含10% 新生牛血清的 DMEM/F12 培养液终止消化,轻轻吹打混匀,1 500 r/min 离心 5 min,弃上清,加入2 mL含10% 新生牛血清的DMEM/F12培养液,制成细胞悬液,依照细胞的量按1∶2或1∶3传代培养,隔天换液 1次。
1.3.4Ⅷ因子免疫荧光染色:取24孔板,在中间8个孔中加入细胞爬片,并将第2代细胞接种于孔中;将孔板中已爬好细胞的爬片用PBS浸洗3次,每次3 min;用4%的多聚甲醛固定爬片15 min, PBS浸洗玻片3次,每次3 min;0.5%Triton X-100室温通透20 min;PBS浸洗玻片3次,每次3 min;吸干PBS,在玻片上滴加1% BSA,室温封闭30 min;吸掉封闭液,滴加按1∶500稀释的抗Ⅷ因子一抗,对照孔加PBS代替一抗,4 ℃过夜孵育;PBS浸洗爬片3次,每次3 min;避光加入荧光二抗,37 ℃孵育箱1 h;PBS浸洗爬片3次,每次3 min;吸干爬片上多余液体后,滴加DAPI避光孵育3 min,对标本进行染核,PBS清洗3次,每次3 min,洗去多余的4′,6-二脒基-2-苯基吲哚(DAPI);吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,然后在荧光显微镜下观察采集图像。
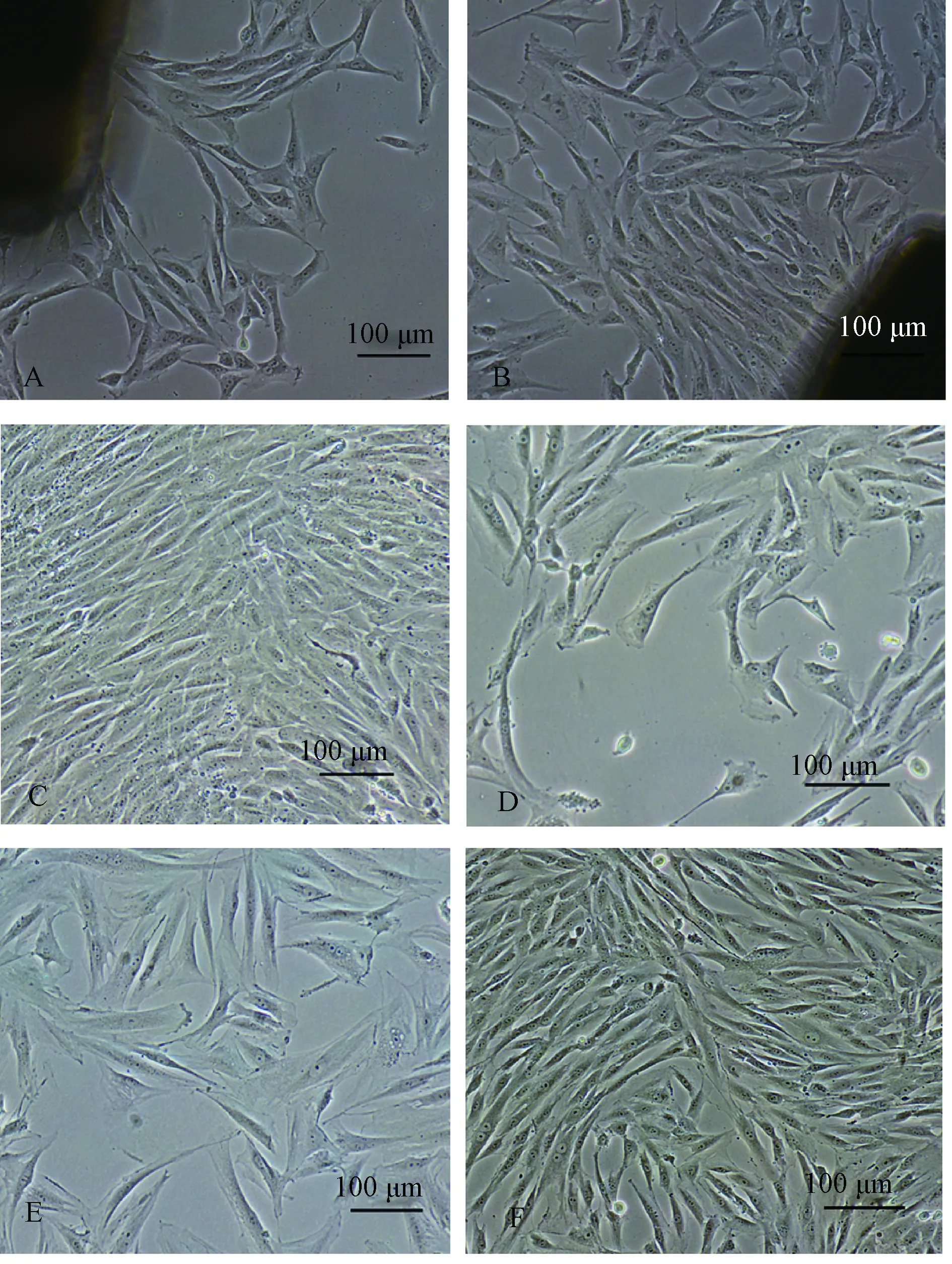
图1 分离得到的树鼩血管内皮细胞注:A、B中黑色团块为贴壁的血管组织块。A: 组织块培养法培养3 d,部分细胞贴壁生长(×100); B: 组织块培养法培养6 d(×100);C:组织块培养法培养15 d,细胞汇合 (×100);D:酶消化法所得VECs培养第3 d(×100);E:酶消化法所得VECs培养第6 d(×100);F:酶消化法所得VECs培养第12 d,细胞汇合成单层(×100)。(标尺:100 μm)Fig.1 Isolated VECs from tree shrewNote: The black clumps in Figures A and B represent adherent vascular tissue blocks.A: Tissue culture was cultured for 3 days,and some cells adhered to the wall (×100). B: Tissue culture method for 6 days (×100); C: Tissue culture method for 15 days,cell confluence (×100); D: VECs were obtained by enzymatic digestion for 3 days (×100); E: VECs were obtained by enzymatic digestion for 6 days (×100);F: VECs were obtained by enzymatic digestion for 12 days, cells are aggregated into monolayers (×100).(Scale:100 μm)
2 结果
2.1 形态学观察
组织块培养法培养1周内细胞贴壁较少,生长缓慢,7 d后细胞从团块中大量长出且细胞生长状况良好。酶消化法所得细胞12 h即贴壁,3~7 d生长较快。倒置显微镜下可见细胞贴壁生长,呈短梭形或多角形,12~15 d汇至成单层细胞,密度不匀,胞核清晰,胞浆丰富,呈现VECs典型的“铺路石”状(图 1)。
2.2 免疫荧光染色
Ⅷ因子是血管内皮细胞的标志性抗原,用抗Ⅷ因子的一抗进行免疫荧光染色后,两种方法所得细胞均可被染成绿色,细胞核被DAPI染成蓝色,而阴性对照无特异性染色(图 2)

图2 血管内皮细胞VIII因子荧光染色结果注:A:Ⅷ因子阳性表达(×100); B:DAPI染核(×100); C:合并A、B(×100)。(标尺:100 μm)Fig.2 Vascular endothelial cell factor VIII staining resultNote:A:Factor Ⅷ positive expression (×100); B: Nucleus stained by DAPI(×100); C: Merge A and B(×100).(Scale:100 μm)
3 讨论
目前,实验动物主动脉血管内皮细胞的体外培养多为组织块贴壁法[5-6]和酶消化法[7],此外,还见到有关文献报道将血管内壁外翻法[8]进行贴壁培养。血管内壁外翻法有一个很大的优势,即减少了平滑肌细胞和成纤维细胞的污染,这对于本身材料有限的情况下,确保了能够获得高纯度的细胞分离产物;但不利之处是由于细胞长时间暴露在环境中,最终活力可能会受到影响。由于本实验材料来自于幼龄树鼩,体型十分小,其主动脉管径也相当小,给血管内壁外翻法分离培养带来了很大的困难,同时需要在显微操作台下进行操作,技术要求高。
实验前期,我们曾尝试采用血管内壁外翻法来进行细胞分离,可最终未能成功。最终选择组织块培养法和酶消化法来进行实验,结果显示,两种方法均可获得原代血管内皮细胞。取材后只需要在显微镜下仔细去除血管外部多余组织,然后马上进入消化步骤,节省了时间。而且最终分离获得的细胞受成纤维细胞等的污染很小,完全可以考虑后期用差速贴壁和差速消化法甚至是密度梯度离心来去除污染。组织块培养法分离获得单层细胞周期较酶消化法长,且存在部分成纤维细胞。酶消化法消化下的细胞少,但贴壁快,汇合为单层周期短,且细胞均一。所以从实验操作来看,采用酶消化法来分离细胞既简便又高效。
本研究中动物是出生两日龄树鼩,相比于成年树鼩,分离得到的血管内皮细胞活力应该更好,传代次数也应该更高。这对于本实验室后期将要进行的病毒感染性实验带来了很大的优势。树鼩作为人类近亲,相比其他非人灵长类动物体型更小,繁殖周期更短等优点。此前李晓飞等[9]和王文广等[10]已利用树鼩开展了病毒相关性实验。所以,建立其血管内皮细胞的体外分离培养方法,为该细胞相关的病毒感染[11-13]、信号通路、代谢、肿瘤[14]等研究带来了便利。
