结核分枝杆菌耐丙硫异烟胺相关基因研究进展
2018-02-15谭旎张泓
谭旎,张泓
结核病是结核分枝杆菌感染引起的一种“古老”传染病,而目前结核病仍是全球范围内最常见的传染病[1]。尽管过去20年间人们为遏制结核病流行做出了巨大努力,但耐药结核病尤其是耐多药结核病(MDR-TB)、广泛耐药结核病(XDR-TB)的出现为全球范围内结核病防控带来了巨大挑战。2018年世界卫生组织(WHO)全球结核病调查报告显示,2017年全球范围内新发结核病患者数量约为1 010万,其中我国新发结核病患者数量约占8.9%;2017年全球估算新发利福平耐药结核病(RR-TB)患者数量约为55.8万例,其中82%为MDR-TB,而印度(24%)、中国(13%)和俄罗斯(10%)3个国家新发MDR-TB/RR-TB患者数量约占全球新发MDR-TB/RR-TB患者总数的47%;耐药结核病治疗成功率较低,全球平均耐药结核病治疗成功率约为55%[2]。
《2010年全国第五次结核病流行病学抽样调查报告》[3]显示,我国结核病患者对异烟肼(INH)耐药率最高,为28.6%,对丙硫异烟胺(Pto)耐药率为12.9%;肺结核患者耐药率前5位药物依次为INH、链霉素(SM)、对氨基水杨酸(PAS)、Pto、氧氟沙星(Ofx),其中初治肺结核患者耐药率前5位药物依次为INH、SM、PAS、Pto、Ofx,复治肺结核患者耐药率前5位药物依次为INH、利福平(RFP)、SM、PAS、Pto;由于初治肺结核患者耐药率前5位药物中包括3种二线抗结核药物,因此我国肺结核患者耐药形势较严峻,需引起重视。
Pto是二线抗结核药物之一,口服进入人体后会被迅速吸收并广泛分布于全身组织、体液,且各组织、脑脊液、血液药物浓度较为接近。近年来,随着结核分枝杆菌对Pto耐药率升高,Pto耐药机制研究尤其是耐药基因研究备受关注。本文通过检索国内外参考文献,综述了结核分枝杆菌耐Pto相关基因,旨在为结核分枝杆菌对Pto的耐药机制研究提供参考。
1 作用机制
MDR-TB指同时对INH和RFP耐药的结核病,Pto、乙硫异烟胺(Eto)结构与INH类似,均属INH硫代酰胺类似物,可导致结核分枝杆菌失去耐酸性及合成霉菌酸的能力,因此治疗MDR-TB时Pto与Eto可以互换[4];此外,由于Pto与Eto具有良好的脑脊液渗透作用,因此二者常用于治疗药物敏感性结核性脑膜炎、粟粒状结核病等[4-5]。
Pto是一种前体药物,在结核分枝杆菌内被单加氧酶ethA活化后与烟酰胺腺嘌呤二核苷酸(NAD)结合形成Pto-NAD并抑制参与霉菌酸合成途径的烯酰基载体蛋白(ACP)还原酶、中断蛋白质合成途径,继而阻断霉菌酸生物合成并扰乱结核分枝杆菌细胞膜,最终达到抗结核分枝杆菌的目的[4]。
研究表明,ethA-ethR基因座编码单加氧酶,其中ethR属转录调节因子TetR/CamR家族阻遏物,是一种转录调节因子,ethR的结合域通过与ethA启动子区域结合而负调节ethA的表达,因此ethA-ethR基因座涉及Pto的活化并调控Pto的抗酸能力[6-7]。mshA基因编码的糖基转移酶参与霉菌生物合成及N-乙酰半胱氨酸葡糖胺肌醇(MSH)合成,而MSH可通过ethA促进Pto活化并抑制结核分枝杆菌[4,8]。Ndh基因通过编码还原型烟酰胺腺嘌呤二核苷酸脱氢酶而调节还原型烟酰胺腺嘌呤二核苷酸(NADH)/氧化型烟酰胺腺嘌呤二核苷酸(NAD+)比例,在NAD+与Pto形成Pto-NAD过程中具有重要作用[9-11]。因此,调节单加氧酶的ethR基因、mshA基因、ndh基因对结核分枝杆菌耐Pto至关重要。此外,还有研究发现结核分枝杆菌中存在Pto生物活化的其他不依赖ethR基因的替代途径如含黄素腺嘌呤二核苷酸(FAD)的单加氧酶mymA以剂量依赖方式保留结核分枝杆菌对Pto的敏感性[12]。
2 耐药机制
目前,结核分枝杆菌的耐药机制研究主要包括靶基因突变、细胞壁通透性变化、外排泵机制、药物降解及失活酶等,其中靶基因突变是结核分枝杆菌对Pto耐药的主要分子作用机制。由于过去几十年多数研究集中于探讨Eto而非Pto的耐药机制,因此目前报道Pto耐药相关的具有硫代酰胺抗性的基因仅有几个[4],而由于Eto与Pto显示出高度交叉耐药性,因此既往关于Eto的耐药机制研究成为分析Pto耐药机制研究的主要依据。目前,多数学者认为,结核分枝杆菌对Pto耐药主要与inhA基因、ethA基因、ethR基因、mshA基因、ndh基因、mymA基因突变有关[9,12-13],其中ethA基因突变是结核分枝杆菌对Pto 耐药的主要基因突变类型[14]。
3 耐药基因
3.1 inhA基因 既往研究发现,Pto对INH高度耐药的结核分枝杆菌有效,但对INH轻度耐药的结核分枝杆菌的效果则较差。INH是治疗结核病的有效药物之一,而Pto是治疗MDR-TB的二线抗结核药物,INH与Pto均属前体药物,需不同的酶进行活化,由于存在共同作用机制而导致二者交叉耐药。MACHADO等[15]研究表明,inhA基因调控区域的突变组合效应导致MDR-TB患者结核分枝杆菌对INH、Pto 均产生耐药性;近期研究表明,INH耐药通常是由katG基因、inhA基因、inhA基因启动子区域突变导致的[16]。katG基因突变常与INH高度耐药有关,katG基因编码的过氧化氢酶可将INH转化为其活性形式,但由于katG基因不参与Pto的活化,因此Pto的作用不受katG基因突变影响,而由于Pto与INH具有相同的最终靶点,因此inhA基因突变可导致inhA基因编码产物过表达或修饰而造成INH与Pto交叉耐药[15,17]。inhA基因突变所致INH耐药通常为低水平耐药并可通过加大INH剂量而减轻INH耐药,因此临床常经验性使用大剂量INH联合Pto治疗MDR-TB,而对大剂量INH耐药且无inhA基因突变患者可选择Pto代替INH[18-20]。除inhA基因突变外,Pto还与inhA基因启动子区域、inhA基因开放阅读框突变[21](见表1)有关,其可通过降低Pto与NAD的亲和力而导致结核分枝杆菌对Pto耐药[15]。
3.2 ethA基因与ethR基因 ethA基因也称etaA基因(Rv3854c),其编码的单加氧酶ethA是一种含FAD的NADPH特异性酶,能够进行Baeyer-Villiger氧化反应[4,22-24]。Pto经单加氧酶ethA激活后作用方式与INH非常相似,其活性形式与NAD+反应产生Pto-NAD,进而抑制inhA基因及霉菌酸生物合成[22-23,25-26]。TAN等[14]研究发现,对Pto耐药的结核分枝杆菌ethA基因突变频率为51.4%(19/37),其中ethA基因第798位AGCAGG突变(丝氨酸266精氨酸)突变频率为18.9%(7/37),被认为是与结核分枝杆菌对Pto耐药有关的最普遍的基因突变类型(见表1)。ethR基因是ethA基因表达的负转录调节因子,ethR基因突变导致ethA基因过度表达时可导致结核分枝杆菌对Pto耐药[6]。此外,ethA基因启动子区域或其负转录调节因子ethR基因结合域内出现突变时可通过以下方式导致ethA基因表达下调:(1)独立于ethR基因调节而直接降低ethA基因转录;(2)增加ethR基因转录而导致ethA基因表达受抑;(3)影响ethA基因与ethA基因启动子区域的结合[27]。
另有研究表明,ethA基因还可能通过不稳定的氧化亚磺酸中间体活化硫代苯甲酰胺、硫代卡巴肽、硫代乙酰胺、硫代乙酮及其他硫代酰胺药物,这可能是INH与Pto交叉耐药的重要原因[28-29]。
3.3 mshA基因(Rv0486) 研究表明,对INH和Pto耐药的结核分枝杆菌突变体均存在mshA基因突变,mshA基因编码产物糖基转移酶参与MSH的生物合成[8]。VILCHÈZE等[30]研究发现,含有单个碱基对修饰的mshA基因突变体并导致氨基酸改变的8株结核分枝杆菌MSH含量从99.9%下降至83.0%,而对Pto的耐药率升高4~8倍;此外,笔者还发现mshA基因的7个独立的错义及移码突变,其中4个mshA基因突变体具有单个氨基酸突变,即精氨酸273半胱氨酸、甘氨酸299半胱氨酸、甘氨酸356天冬氨酸、谷氨酸361丙氨酸[8](见表1)。因此,mshA基因缺失、错义及移码将导致结核分枝杆菌产生MSH减少及MSH通过ethA基因促进Pto的活化减少,继而造成结核分枝杆菌对Pto 耐药。
ANG等[12]研究发现,单独的mshA基因缺失所致Pto对结核分枝杆菌的半数最低抑菌浓度(MIC50)较ethA/ethR基因突变高,提示对于Pto杀灭作用的影响,mshA基因突变至少与ethA/ethR基因突变一样。此外,mshA基因突变可导致敲除ethA/ethR基因的结核分枝杆菌对Pto完全耐药,提示Pto杀灭作用中的MSH作用可以是独立的,或者至少不限于其与ethA基因的相互作用,可能参与Pto生物激活的替代途径,但仍需进一步研究证实[12]。
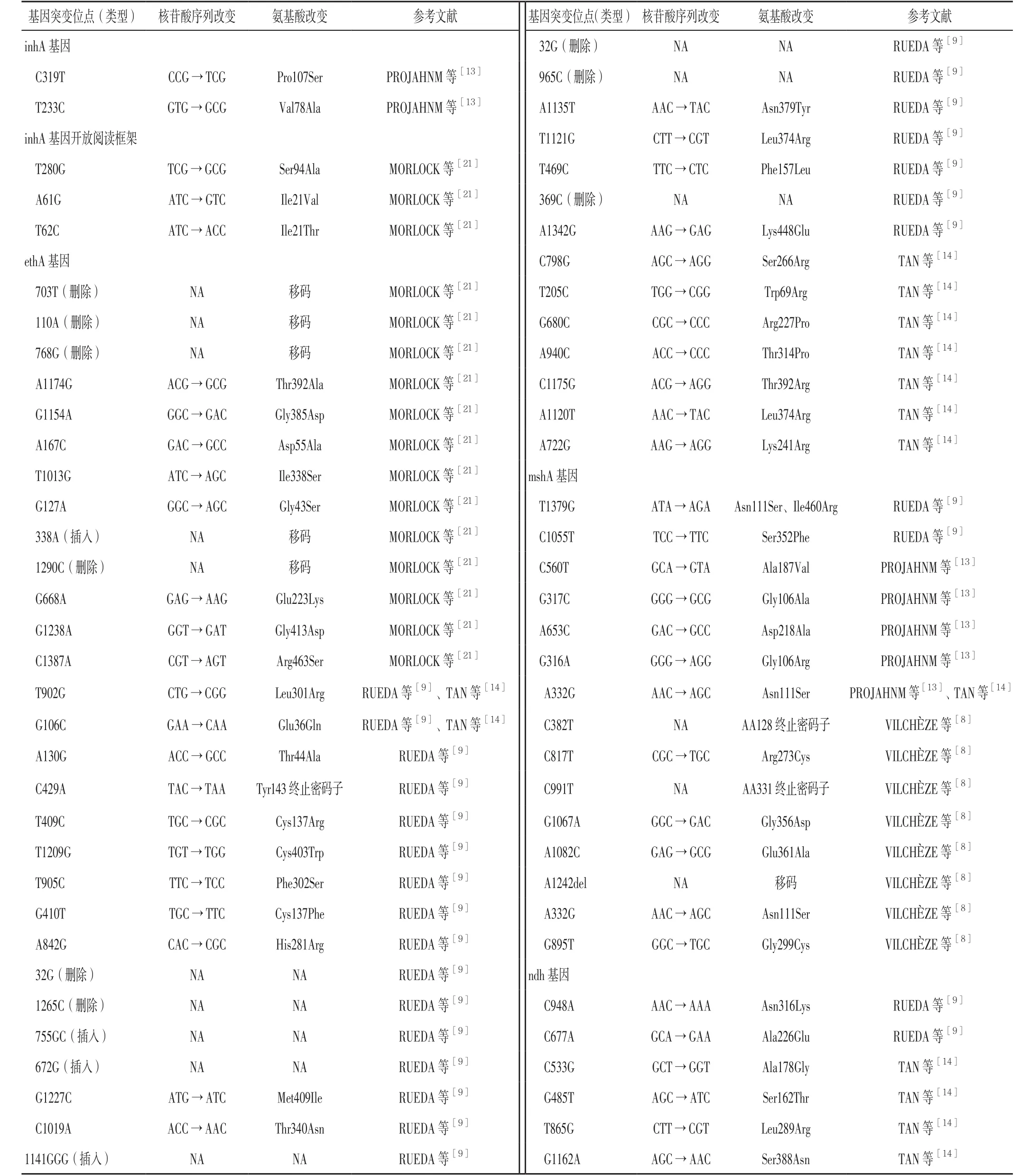
表1 已知的Pto耐药基因突变位点(类型)、核苷酸序列改变及氨基酸改变Table 1 Known drug resistance related gene mutation site(types)to prothionamide,changes of nucleotide sequences and amino acids
3.4 ndh基因(Rv1854c) ndh基因编码产物为Ⅱ型还原型烟酰胺腺嘌呤二核苷酸脱氢酶,而Ⅱ型还原型烟酰胺腺嘌呤二核苷酸脱氢酶可通过将NADH氧化成NAD+而调节NADH/NAD比值。研究表明,ndh基因突变可导致细胞内NADH含量增加并竞争性地抑制INH-NAD或Pto-NAD及INH或Pto的结合,继而导致INH与Pto交叉耐药[10-11]。TAN等[14]在46株对Pto耐药的结核分枝杆菌中发现37株(80.4%)存在基因突变,基因突变类别包括19种,其中27株为单核苷酸突变,10株为双核苷酸突变,而27株单核苷酸突变菌株中4株为ndh基因非同义突变,分别为S162T、L289R、G339A、S388N(见表1),证实ndh基因突变可导致结核分枝杆菌对Pto耐药。
3.5 mymA基因 既往研究表明,结核分枝杆菌存在6种Baeyer-Villiger单加氧酶,而在这6种单加氧酶中ethA特征最为明显,而mymA、ethA则具有最大的序列同源[26,31]。GRANT等[24]研究发现,单独的mymA基因突变可导致结核分枝杆菌对Pto低度耐药,而mymA基因与ethA基因可通过加成方式活化Pto,这可能是Pto活化及抗性的新分子作用机制。ANG等[12]研究发现,ethA/ethR基因删除仅导致结核分枝杆菌对Pto耐药性轻微升高,这可能与结核分枝杆菌存在mymA基因而保留其对Pto的易感性、剂量依赖性药物反应有关。
4 小结与展望
耐药结核病为全球结核病防控工作带来重大挑战,鉴于新型抗结核药物的研发及应用所需时间较长,因此提高现有药物疗效是一种不应忽视的替代策略。目前,基于Pto耐药机制研发的具有抗结核分枝杆菌作用的单加氧酶inhA、ethR抑制剂等Pto增效剂研究已取得一定成果,并有望为抗结核治疗方案提供新的选择[32-34];Pto耐药机制及相关基因突变研究已取得一定进展,已发现多种耐药遗传机制,包括靶基因机构改变、激活前体药物所需酶功能丧失等,证实基因突变及基因转录改变是结核分枝杆菌对Pto耐药的重要机制,但由于缺乏系统的全基因组转录对照,因此部分基因转录异常导致结核分枝杆菌对Pto耐药的机制仍需进一步深入研究。此外,目前已知的结核分枝杆菌对Pto耐药相关突变基因及突变位点仍十分有限,可能还存在尚未发现的基因突变,相信随着不断的探索及新技术的应用,必将逐步发现可能存在的基因突变及基因转录改变对结核分枝杆菌耐药性的影响,继而指导临床制定科学、有效的抗结核治疗方案。
