二吲哚吡啶基吡咯烷通过抑制AKT-mTOR阻滞MDA-MB231乳腺癌细胞周期
2018-02-15昝嘉伟冯遵永马金珠
颜 亮,昝嘉伟,冯遵永,马金珠,徐 蕾,王 毅
(1皖南医学院活性生物大分子安徽省重点实验室,芜湖 241002;2安徽师范大学生命科学学院,芜湖 241002;3南京大学化工学院江苏省先进有机材料重点实验室,南京 210023)
乳腺癌为女性高发、生存率低、预后差的恶性肿瘤[1],随着国内乳腺癌筛查的普及,其病死率得到较为有效的控制[2]。然而对于治疗而言,乳腺癌的高复发率和高转移率仍然十分棘手[3]。MDA-MB231是高侵袭能力的肿瘤细胞模型,AKT-mTOR信号通路在MDA-MB231细胞中高度活化[4],且AKT-mTOR信号抑制剂(如雷帕霉素)可以有效抑制MDA-MB231增殖[5-6]。针对抑制AKT-mTOR信号通路的化合物被不断开发出来且被用于抑制MDA-MB231细胞增殖的研究[7-8]。因此,针对AKT-mTOR信号的新型抑制剂的开发对于乳腺癌的治疗显得十分重要和迫切。
吡咯烷衍生物由前体吡啶基-吲哚化合物在甲醇的回流混合物中与氨基酸和靛红衍生物反应形成的螺环氧基吲哚产物[9-10],当取代氨基酸为肌氨酸时,产物即为二吲哚吡啶基吡咯烷。到目前为止,关于吡咯烷的生物功能的研究还较少,如两性吡咯烷衍生物通过上调Bcl-X的表达来诱导胰腺癌细胞死亡和自噬[11],吡咯烷二硫代氨基甲酸酯(pyrrolidinodithiocarbamic acid allyl ester,PDTC)作为强抗氧化剂,广泛用于NF-κB信号的特异性阻断研究[12-13]。在本实验中,经肌氨酸和靛红衍生的螺环氧基吲哚产物表现出强烈的细胞毒性表型。本研究就这一现象展开研究,探索二吲哚吡啶基吡咯烷是否具备抗肿瘤活性能否成为潜在的化疗药物。
1 材 料
人乳腺癌细胞系MDA-MB231购自中科院上海细胞库。二吲哚酮吡啶基吡咯烷(DIPRO)由南京大学化工学院合成(见路线1)。DMEM完全培养基、胎牛血清(美国Gibco公司);CCK-8试剂盒(北京凯基生物科技有限公司);EdU试剂盒(广州锐博生物科技有限公司);anti-BrdU、细胞凋亡试剂盒(美国BD公司);LY294002(美国Medchemexpress公司);p-AKT(Ser473)、p-AKT(Thr308)、p-p53、p-MOTR及PARP抗体(美国Cell Signal Technology公司);GAPDH单克隆抗体及二抗(美国Santa Crus公司)。
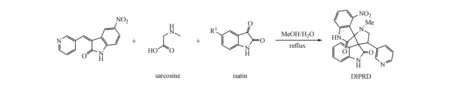
Scheme1 Synthesis of Di-indolyl pyrrolidine (DIPRD)
2 方 法
2.1 细胞培养
人乳腺癌细胞MDA-MB231用含10%胎牛血清的DMEM培养基(100 U/mL青霉素和100 mg/L链霉素),在37 ℃、5% CO2培养箱中培养。
2.2 CCK-8法检测细胞活力值
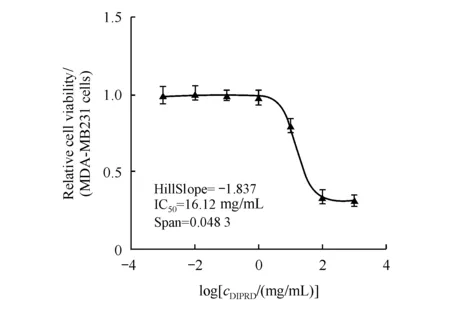
细胞增殖情况用细胞将CCK-8试剂还原成黄色的甲瓒的能力来衡量。将人乳腺癌细胞株MDA-MB231按照每孔1×104个细胞的密度接种于96孔板中。用不同质量浓度(0.001,0.01,0.1,1,10,100,1 000 mg/mL)的DIPRD处理细胞24 h后,每孔加入CCK-8试剂(2.5 mg/mL)10 μL,继续培养2 h,用酶标仪在450 nm波长下测定每孔的吸收度(A),根据A计算出IC50。
2.3 DAPI/EdU检测S期细胞数量
使用12.5,25,50 mg/mL DIPRD以及10 μmol/L LY294002孵育MDA-MB231细胞16 h后,按照每孔2×104个细胞(200 μL)接种到48孔板中,每孔加入50 μmol/L EdU培养基150 μL,37 ℃孵育2 h;PBS清洗细胞3次后,每孔加入含4%多聚甲醛的PBS 200 μL,室温下孵育40 min;每孔加入2 mg/mL 甘氨酸200 μL,在脱色摇床上孵育5 min;弃溶液后,每孔加入PBS 300 μL,在脱色摇床上清洗5 min;弃PBS,每孔加入含0.5%TritonX-100的PBS 200 μL清洗1次;每孔加入Apollo染色反应液200 μL避光孵育30 min后,再每孔加入DAPI 200 μL避光孵育30 min,使用荧光倒置显微镜观察MDA-MB231细胞核形态,并对EdU阳性细胞进行计数。
2.4 流式细胞术检测G1/S/G2期细胞占比
使用12.5,25,50 mg/mL DIPRD以及10 μmol/L LY294002孵育MDA-MB231细胞16 h后,按照每孔细胞数量为每毫升2×106个接种到6孔板中。使用终浓度为10 μmol/L的BrdU 37 ℃温育30 min。以洗涤缓冲液500 μL洗涤2次。将细胞悬液重悬于含4 mol/L HCl的洗涤缓冲液0.5 mL中,室温下孵育30 min。将细胞悬液重悬于洗涤缓冲液200 mL中并用mAb anti-BrdU 5 mL标记。在4 ℃黑暗中孵育1 h。在缓冲液200 mL中重悬并用山羊抗小鼠FITC标记的抗体4 mL孵育30 min。重悬于洗涤缓冲液200 mL和PI缓冲液200 mL后在4 ℃黑暗中孵育15~30 min。488 nm处进行流式细胞仪分析。
2.5 流式细胞术检测细胞凋亡
细胞分组及处理同“2.4”项,收集各组细胞,用预冷的PBS清洗2次,1 000 r/min收集各组细胞。加入结合缓冲液400 μL重悬细胞,分别加入PI 5 μL和Annexin V-FITC 5 μL染色,避光室温孵育15 min。流式细胞术检测4个象限细胞数,分析细胞凋亡率,每次计数1×104个细胞。
2.6 Western blot检测
使用12.5、25、50 mg/mL DIPRD孵育MDA-MB231细胞2 h,收集各组细胞裂解物。4 ℃,10 000 r/min离心5 min,取上清液。BCA法测定每个样品的蛋白浓度,加入5×上样缓冲液,煮沸5 min,冷却后,按照定量浓度,每孔上样量为60 μg进行上样。经SDS-PAGE(10%)电泳后,将蛋白全部转移至PVDF膜上。将膜放入用TBST配制的5%脱脂奶封闭液中,室温封闭1 h。然后加入按照1∶1 000稀释的一抗,4 ℃孵育过夜。在用TBST清洗6次,每次5 min。加入稀释好的二抗,室温孵育1 h,TBST清洗6次,每次5 min。清洗好的膜放入暗盒上,正面朝上,加入显影液,检测蛋白条带。
3 结 果
3.1 DIPRD对MDA-MB231细胞活力值的影响
DIPRD由南京大学化工学院合成。首先在一个大浓度范围探索DIPRD对MDA-MB231细胞的毒性范围,使用0.001,0.01,0.1,1,10,100,1 000 mg/mL的DIPRD孵育MDA-MB231细胞24 h,CCK-8法检测细胞活力,实验结果见图1,DIPRD对MDA-MB231细胞活力的半数抑制量(IC50)为16.12 mg/mL。此外,进一步探索DIPRD对MDA-MB231细胞活力抑制的剂量,如图2-A所示,DIPRD在12.5,25,50 mg/mL可以剂量依赖性抑制MDA-MB231细胞活力,因而将12.5,25,50 mg/mL 设置为后续实验的低、中、高剂量组。
3.2 DIPRD对MDA-MB231细胞周期的影响
使用12.5,25,50 mg/mL DIPRD孵育MDA-MB231细胞16 h,使用DAPI/EdU对细胞进行染色,使用荧光倒置显微镜观察MDA-MB231细胞核形态。实验结果如图2-B和2-C所示,在未处理的MDA-MB231细胞组,有近50%细胞处于EdU阳性状态,而当使用不同浓度DIPRD处理细胞后,EdU阳性细胞所占比例被显著下调,且呈现剂量依赖性。这表明DIPRD减少S期细胞数量,阻滞了MDA-MB231细胞的细胞周期。使用BrdU-FITC和PI对细胞进行孵育,使用流式细胞术检测G1/S/G2期细胞比例。实验结果如图2-D所示,G1/G2期的细胞没有新合成DNA其BrdU信号为阴性,而PI的荧光强度是G2期的二分之一。S期是正在合成DNA其BrdU为阳性。DIPRD可以剂量依赖性的增加G1期并减少G2/S期细胞数量,表明DIPRD将MDA-MB231细胞阻滞在G1期。此外,AKT激酶特异性抑制剂LY294002同样可以将MDA-MB231细胞阻滞在G1期,这表明AKT信号在DIPRD诱导细胞周期阻滞中起重要作用。
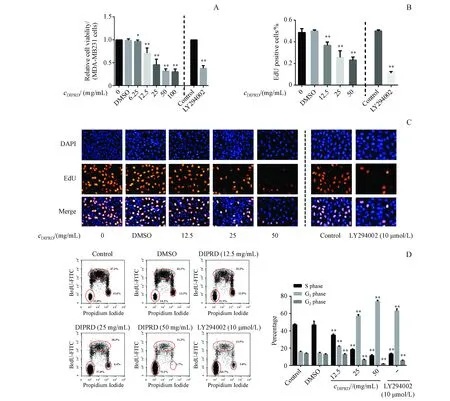
A and B:Quantitative analysis;C:Representative images;D:Flow cytometry**P<0.01vscontrol group
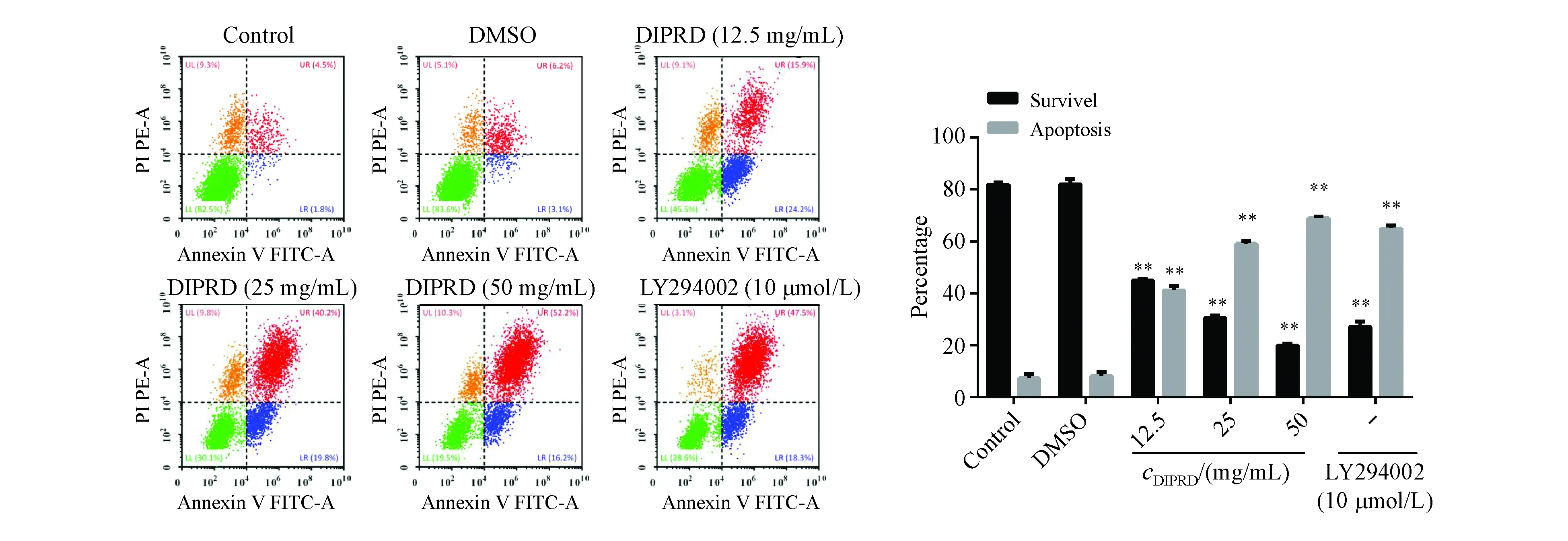
3.3 DIPRD对MDA-MB231细胞凋亡影响
使用12.5,25,50 mg/mL DIPRD孵育MDA-MB231细胞16 h。使用Annexin V-FITC和PI对细胞进行孵育,使用流式细胞术检测细胞情况。结果如图3所示,在空白对照组和AKT激酶特异性抑制剂LY294002对照组,细胞凋亡率分别为6.3%和65.8%,而用12.5 mg/mL DIPRD处理16 h 后,细胞凋亡率增加到40.1%,随着DIPRD浓度的升高,50 mg/mL 组细胞凋亡率为68.4%。以上结果表明,DIPRD诱导了乳腺癌细胞MDA-MB231的凋亡。
3.4 DIPRD对MDA-MB231细胞AKT-mTOR信号及MDM2/p53活性的影响
使用12.5、25、50 mg/mL DIPRD孵育MDA-MB231细胞2 h,提取细胞总蛋白,Western blot检测磷酸化AKT和磷酸化mTOR的水平,实验结果如图4-A所示,随着DIPRD浓度的升高,mTOR和AKT(S473)的磷酸化水平被显著抑制,而AKT(T308)的磷酸化水平却提高,且总AKT表达量并没有发生变化。此外,使用AKT抑制剂可以抑制mTOR和AKT(S473 和Thr308)的磷酸化水平。使用12.5、25、50 mg/mL DIPRD孵育MDA-MB231细胞16 h,提取细胞总蛋白,Western blot检测磷酸化MDM2和磷酸化p53以及DNA修复酶PARP的表达水平,实验结果如图4-B所示,可以诱导MDM2磷酸化水平升高,MDM2依赖性的p53磷酸化水平被抑制,以及切割失活的PARP表达增多;本研究也检测了细胞周期蛋白D1及细胞周期蛋白激酶CDK4的表达水平,实验结果如图4-C所示,Cyclin D1及CDK4的表达水平被抑制。这些实验表明,DIPRD可以抑制调控生存的AKT-mTOR信号并激活MDM2/p53介导的细胞凋亡途径。
**P<0.01vscontrol group
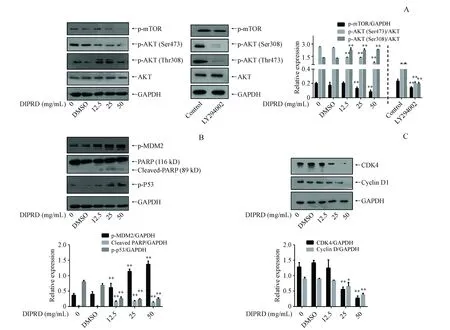
A:Effect of DIPRD on the AKT-mTOR signaling pathway;B:Effect of DIPRD on the expression of p53 of MDA-MB231 cells;C:Effect of DIPRD on the expression of Cyclin D1 of MDA-MB231 cells**P<0.01vscontrol group
4 讨 论
PI3K-AKT信号转导途径在调控生理性[14]和病理性[15]细胞增殖和存活过程中至关重要。激素[16]、生长因子[17]和有丝分裂原(mitogen)[18]通过结合细胞表面G蛋白耦联受体(G protein-coupled receptor,GPCR)[19],细胞因子受体[17]或者受体酪氨酸激酶受体[20]触发质膜内侧的磷脂酰肌醇激酶(PI3K-phosphoinositide 3-kinase,PI3K)产生PIP3,PIP3通过PH结构域招募Aak,使其双重磷酸化[21]。活化的AKT为丝氨酸/苏氨酸激酶[22],具有广泛的的生理学效应,调控诸如细胞存活、增殖、生长和糖原代谢等重要的生理功能[23]。因此,开发出特异性的针对PI3K-AKT的信号靶点抑制剂,抑制PI3K-AKT介导的肿瘤细胞生长的化合物的研究策略对于肿瘤的治疗具有广阔前景。邹雪玲等[7]研究发现,草酸青霉菌的次级代谢产物中分离并人工合成了一个结构新颖的噻唑化合物,能够通过调控PI3K/AKT/mTOR信号通路抑制MDA-MB231乳腺癌细胞的增殖。而吡咯烷衍生物在乳腺癌细胞中的生物功能的研究还未见报道。本实验中,发现人工合成的吡咯烷衍生物DIPRD具有直接的AKT磷酸化调控作用,具体表现为AKT的473丝氨酸残基位点的抑制作用和308苏氨酸残基位点的激活作用。有研究表明,在调控细胞生存的过程中,T308的磷酸化可使AKT的活性增大100倍,但AKT的完全活化还需要疏水性的S473位点磷酸化,相对于AKT活性的提高而言,S473是T308磷酸化的5倍[14]。因此,对S473磷酸化位点的抑制可以有效抑制AKT激酶的活性。
虽然DIPRD可以激活T308的水平,然而MDA-MB231细胞的最终表型仍然表现为活力下降和凋亡,这表明T308的磷酸化很可能由于细胞的应激压力导致的反馈调节。AKT可以通过mTOR介导蛋白质合成,并通过p70 S6激酶的信号传导和4E-BP1的抑制启动G1细胞周期进程来促进细胞生长与增殖[24-25]。此外,AKT也可以通过抑制MDM2信号依赖性p53介导细胞凋亡而促进细胞生存。MDM2是p53泛素化连接酶[26-27],由AKT活化的MDM2会促使p53泛素化降解,从而抑制了p53依赖性的细胞凋亡[28-29]。在本项研究中,吡咯烷衍生物DIPRD对细胞MDA-MB231乳腺癌细胞具有直接的抑制作用,表现为细胞活力的直接抑制。通过EdU染色及流式细胞术的实验结果显示,在DIPRD的诱导下,S期细胞显著减少,进一步表明DIPRD抑制了MDA-MB231细胞G1/S期转化。此外,DIPRD可以抑制cyclin D1和CDK4的表达;并下调MDM2的磷酸化水平并使p53磷酸化释放出来,转位入核执行诱导凋亡的功能。
总之,吡咯烷衍生物DIPRD具有良好的体外乳腺癌细胞抑制活性。此外还可作为AKT的丝氨酸残基位点473的特异性抑制剂。
