TNF-α对肿瘤微环境中BMSCs生物学特性的影响
2018-02-14向中平崔向荣谭彬田杰朱静
向中平,崔向荣,谭彬,田杰,朱静
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有易于体外扩增、低免疫源性、肿瘤趋化性等优势,已成为肿瘤治疗的研究热点[1-3],然而间充质干细胞在肿瘤治疗中的安全问题目前尚未解决[4]。研究报道,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)是由巨噬细胞、NK细胞、肿瘤细胞等产生的促炎因子[5],其作用具有剂量依赖性,低浓度的TNF-α能够导致细胞DNA损坏、活化核转录因子κB(nuclear factor-κB,NF-κB)信号通路,进而促进肿瘤的发生发展[6-7]。本研究通过BMSCs与C6脑胶质瘤细胞间接共培养以模拟体外BMSCs肿瘤生长的微环境,进一步探讨共培养后BMSCs TNF-α表达的变化情况,以明确TNF-α与BMSCs生物学特性改变之间的关系,进而为BMSCs临床安全应用奠定理论及实验基础。
1 材料与方法
1.1 实验动物及材料 30只清洁级SD雄性大鼠,3~4周龄,体重30~50g,购自重庆医科大学实验动物中心。大鼠C6脑胶质瘤细胞系由重庆医科大学附属儿童医院肿瘤实验室惠赠。DMEM/F12培养基、胎牛血清、TrypLE Express细胞消化液购自美国Gibco公司,0.4μm Transwell小室购自美国Millipore公司,大鼠TNF-α ELISA试剂盒购自中国四正柏公司,快速RNA提取试剂盒购自中国百泰克公司,反转录以及荧光定量PCR试剂盒购自日本TaKaRa公司,CCK8细胞活力检测试剂盒购自中国ATGene公司,PI染液、CD90购自美国BD公司,CD29购自美国Biolegend公司,CD34、CD45购自美国Origene公司,c-Myc、NF-κB/P65、CyclinD1抗体购自英国Abcam公司。引物由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 原代细胞获取、鉴定 分离大鼠的股骨和胫骨,用无血清培养基冲洗骨髓腔,1000r/min离心5min,10%胎牛血清的DMEM/F12培养基重悬以获取大鼠BMSCs。48h后换液,当细胞融合至80%~90%时传代,当细胞传至第3代时备用。取第3代BMSCs,向其中加入CD90、CD29、CD34、CD45抗体(1:100),室温避光孵育30min,同时设立同型阴性对照。PBS洗2次去除残余抗体后,采用流式细胞仪检测。
1.2.2 细胞培养 BMSCs、C6脑胶质瘤细胞均采用含10%胎牛血清的DMEM/F12培养基,于37℃、5%CO2的孵育箱中培养。BMSCs间接共培养模型的建立采用0.4μm悬挂式小室结合6孔板的方式,培养至第3代的BMSCs以1×105/ml的密度铺入6孔板,过夜后插入Transwell小室,小室上铺入C6脑胶质瘤细胞,两种细胞的比例调整为1:1,每天换液,共培养7d。
1.2.3 ELISA检测BMSCs及共培养细胞上清中游离TNF-α的表达 当细胞融合度为70%~80%时,更换新鲜培养基,24h后收取细胞上清,1000r/min离心10min,保存至–80℃备用。向包被孔中加入100μl上清,37℃孵育90min;洗板4次后,加入100μl生物素化抗体,37℃孵育60min;同样洗板4次后,加入100μl酶标结合物,37℃孵育30min;再次洗板后加入100μl显色剂,37℃孵育15min,加入100μl终止液,于酶标仪上读取450nm吸光度(OD)值,然后将OD值进一步换算成相应上清中TNF-α的表达浓度。每组设4个复孔。
1.2.4 细胞分组及形态观察 在共培养体系中加入不同浓度的TNF-α。实验分为4组:BMSCs组、共培养组、共培养+0.5ng/ml TNF-α组、共培养+5ng/ml TNF-α组。采用倒置显微镜观察各组细胞形态变化,拍照,观察并记录细胞形态。
1.2.5 CCK8法检测细胞活力 取各组对数期生长的细胞,消化离心重悬,调整细胞密度为2.5×104/ml,种入96孔板,共设置5个时间点,每个时间点设5个复孔。每天给对应孔中更换10% CCK8工作液,换液后放入孵育箱继续培养2h,然后于酶标仪上读取450nm处OD值。根据每天OD值的变化绘制相应的活力曲线。
1.2.6 流式细胞术检测细胞周期 各组细胞消化后离心重悬,PBS洗2次,弃上清,70%的乙醇4℃固定过夜,PBS洗2次去除乙醇,37℃孵育30min,10μl RNase37℃孵育20min,PI染液染色后用流式细胞仪进行检测。
1.2.7 Transwell检测细胞迁移能力 Transwell上室加入200μl细胞数为2×104个的无血清培养基细胞悬液,下室加入500μl含10%胎牛血清的培养基,于5%CO2孵育箱中培养24h,擦拭掉上室的细胞,100%浓度甲醇固定,结晶紫染色,倒置显微镜下观察5个视野的细胞迁移数。
1.2.8 Real-time PCR检测各组细胞c-Myc、CyclinD1 mRNA的表达水平 根据试剂盒说明书的操作步骤提取各组细胞的RNA,然后反转录为DNA,以其为模板进行下一步qPCR的扩增。每组设3个复孔,β-actin为内参照,通过2–ΔΔCt计算相对表达量。引物序列如下:c-Myc,正义5'-TGGAACGTCAGAGGAGAAACGA-3',反义5'-CTTGAACGGACAGGAT GTAGGC-3';CyclinD1,正义5'-GCATCTACACTGACAACTCTATC-3',反义5'-TTGTTC TCATCCGCCTCTG-3';β-actin,正义5'-TGTCACCAACTGGGACGATA-3',反义5'-GGGG TGTTGAAGGTCTCAAA-3'。
1.2.9 Western blotting检测NF-κB/P65、CyclinD1、c-Myc蛋白表达水平 将各组细胞消化离心,PBS清洗2次后加入适量的蛋白裂解液(裂解液:蛋白酶抑制剂:磷酸酶抑制剂:PMSF=1000:1:10:5),冰上裂解10min左右,然后160W功率的低档超声5min,14 000r/min离心15min,收集上清。BCA法测定蛋白浓度,以蛋白﹕SDS=4:1比例加入SDS上样缓冲液,煮沸3~5min使其变性,–80℃保存备用。蛋白上样量为40μg,经电泳后湿转入PVDF膜,5% BSA室温封闭2h,一抗[NF-κB/P65(1:2000)、CyclinD1(1:1000)、c-Myc(1:8000)、GAPDH(1:5000)]4℃孵育过夜,TBST洗膜,二抗(辣根过氧化物酶标记的山羊抗兔IgG 1:3000)室温孵育1h,TBST再次洗膜,采用凝胶成像发光系统显影。
1.3 统计学处理 采用SPSS 17.0进行统计分析。计量资料以表示,BMSCs与共培养细胞上清中TNF-α表达比较采用独立样本t检验;其余多组间的比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 BMSCs表面标志物的鉴定 流式细胞仪检测结果显示,CD90表达率为99.6%,CD29表达率为100.0%,CD45表达率为0.1%,CD34表达率为1.7%(图1)。本实验提取细胞的CD29、CD90呈阳性表达,CD34、CD45呈阴性表达,表明该细胞为间充质干细胞,可用于后续研究。

图1 BMSCs表面标志物表达Fig.1 Expressions of the surface marker of BMSCs
2.2 细胞上清中游离TNF-α的表达 BMSCs细胞上清中游离TNF-α的表达量为(467.90±150.98)pg/ml,共培养细胞上清中游离TNF-α表达量为(162.45±31.82)pg/ml,共培养细胞上清中TNF-α表达量明显低于BMSCs细胞上清(P<0.05)。
2.3 各组细胞的形态特征 倒置显微镜下观察结果显示,细胞培养至第3代时,BMSCs组细胞排列整齐、成纤维状样生长、胞质丰富;共培养组的BMSCs细胞体积变小、形态细长、核质比增大;共培养+0.5ng/ml TNF-α组细胞排列紊乱,集落样生长;共培养+5ng/ml TNF-α组细胞形态与BMSCs组基本一致,但凋亡细胞增多(图2)。
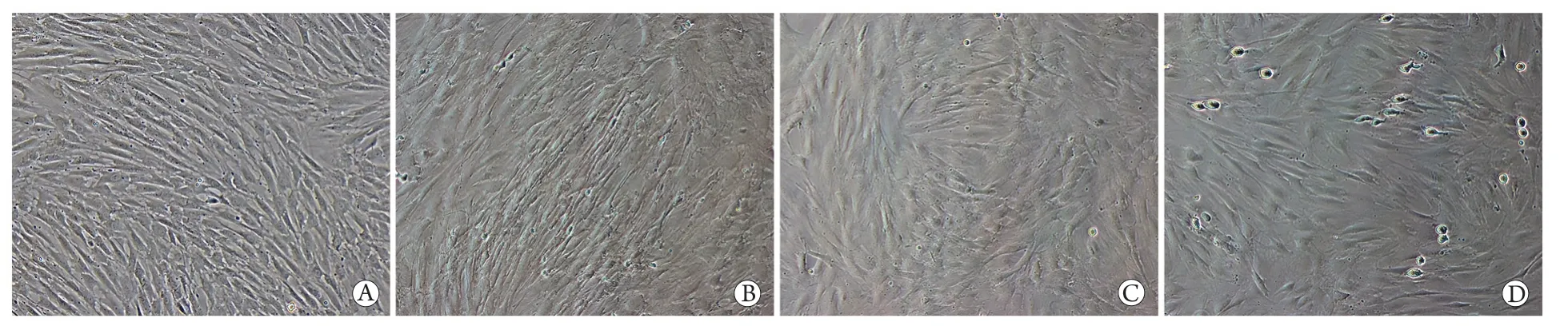
图2 倒置显微镜下观察各组细胞形态(×100)Fig.2 Morphology of each group of cells (Inverted microscopy,×100)
2.4 各组细胞增殖能力的变化 CCK8检测结果显示,自第2天开始,共培养组增殖能力即明显高于BMSCs组(P<0.05),而共培养+5ng/ml TNF-α组的增殖能力与共培养+0.5ng/ml TNF-α组及共培养组比较明显降低(P<0.05,图3)。

图3 CCK8法检测各组生长速率的变化Fig.3 Cell proliferation of each group detected by CCK8
2.5 各组细胞周期的改变 流式细胞仪检测结果显示,共培养组中G2+S期比例明显高于BMSCs组(P<0.05),共培养+5ng/ml TNF-α组G2+S期比例与共培养+0.5ng/ml TNF-α组及共培养组比较明显降低(P<0.05,表1)。
表1 流式细胞术检测各组细胞周期时相的变化(±s,n=3)Tab.1 Distribution of cell cycle phase of each group detected by flow cytometry (±s, n=3)
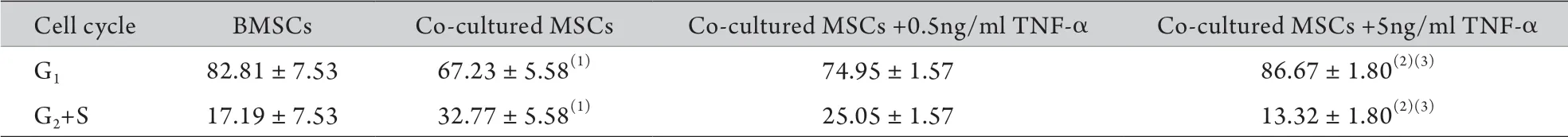
表1 流式细胞术检测各组细胞周期时相的变化(±s,n=3)Tab.1 Distribution of cell cycle phase of each group detected by flow cytometry (±s, n=3)
(1)P<0.05 compared with BMSCs; (2)P<0.05 compared with co-cultured MSCs; (3)P<0.05 compared with co-cultured MSCs+0.5ng/ml TNF-α
Cell cycle BMSCs Co-cultured MSCs Co-cultured MSCs +0.5ng/ml TNF-α Co-cultured MSCs +5ng/ml TNF-α G1 82.81±7.53 67.23±5.58(1) 74.95±1.57 86.67±1.80(2)(3)G2+S 17.19±7.53 32.77±5.58(1) 25.05±1.57 13.32±1.80(2)(3)
2.6 各组细胞迁移能力的变化 Transwell检测结果显示,BMSCs组细胞迁移数为21.67±3.79,共培养组细胞迁移数为66.33±6.03,共培养+0.5ng/ml TNF-α组细胞迁移数为59.00±3.61,共培养+5ng/ml TNF-α组细胞迁移数为20.67±5.13,共培养组细胞迁移能力高于BMSCs组(P<0.05),而共培养+5ng/ml TNF-α组细胞迁移能力与共培养+0.5ng/ml TNF-α组及共培养组比较明显降低(P<0.05,图4)。

图4 Transwell检测细胞迁移能力改变(×100)Fig.4 Migration ability of each group detected by Transwell
2.7 各组CyclinD1、c-Myc mRNA的表达 Realtime PCR检测结果显示,共培养组中CyclinD1、c-Myc mRNA的表达高于BMSCs组(P<0.05)。而共培养+5ng/ml TNF-α组CyclinD1、c-Myc mRNA表达水平与共培养+0.5ng/ml TNF-α组及共培养组比较均明显降低(P<0.05,图5)。

图5 Real-time PCR检测c-Myc、CyclinD1 mRNA的表达Fig.5 The mRNA expressions of c-Myc and CyclinD1 (Real-time PCR)
2.8 各组NF-κB/P65、CyclinD1、c-Myc蛋白的表达 Western blotting检测结果显示,共培养组中NFκB/P65、CyclinD1、c-Myc蛋白的表达高于BMSCs组(P<0.05)。而共培养+5ng/ml TNF-α组NF-κB/P65、CyclinD1、c-Myc蛋白表达与共培养+0.5ng/ml TNF-α组及共培养组比较均明显降低(P<0.05,图6)。
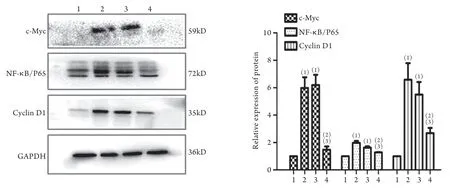
图6 Western blotting检测各组c-Myc、NF-κB/P65、CyclinD1蛋白的表达Fig.6 Protein expressions of c-Myc, NF-κB/P65 and CyclinD1 (Western blotting)
3 讨 论
脑胶质瘤恶性程度高、复发率高、平均生存率低,而传统治疗手段如手术、放疗、化疗未能达到满意治疗效果,寻找更为有效的治疗方法迫在眉睫[8]。间充质干细胞具有低免疫源性、易于体外扩增,并能作为载体携带化疗药物、细胞因子、溶瘤病毒等生物活性成分对肿瘤进行靶向治疗而成为当前肿瘤治疗的研究热点[1]。然而,间充质干细胞在肿瘤治疗中存在风险,长期体外培养、基因编辑、进入体内受微环境复杂因素的影响等均可使间充质干细胞发生恶性转变[9]。课题组前期研究结果表明,BMSCs在C6脑胶质瘤微环境中可发生恶性转化[10],可能的机制涉及白介素-6/信号转导与转录活化因子3(interleukin-6/signal transducer and activator of transcription 3,IL-6/STAT3)、NF-κB、S100B/晚期糖基化终产物受体(S100B/the receptor of advanced glycation end products,S100B/RAGE)等的表达升高[11-13],那么此过程是否还有其他相关因素参与,目前尚未见文献报道。
TNF-α是由巨噬细胞、NK细胞、中性粒细胞等产生的促炎因子,其对肿瘤的作用具备双向性,既拥有抗瘤能力也具备促瘤特性,浓度至关重要,高浓度TNF-α可选择性破坏肿瘤血管系统、产生特异性T细胞而发挥抗瘤效应,而低浓度TNF-α与受体结合,可活化NF-κB信号通路[6-7]。NF-κB信号通路的高表达及活化能促进细胞增殖,抑制细胞凋亡,从而促进肿瘤的发展[14],同时,活化的NF-κB能进一步诱导IL-6的表达上调,进而引发STAT3磷酸化,STAT3的表达升高与肿瘤的发生发展密切相关[15-17]。在课题组前期研究基础上,本研究从TNF-α的角度出发,探讨不同浓度状态下的TNF-α对肿瘤微环境中BMSCs生物学特性的影响。
Ganapathi等[18]报道,肿瘤细胞中TNF-α DNA甲基化水平的升高导致TNF-α分泌降低,低表达的TNF-α使得肿瘤细胞恶性程度增强。本研究发现,共培养后BMSCs TNF-α表达明显降低,因此我们推测低表达的TNF-α可能是引发BMSCs恶性转化的重要因素。故笔者在间接共培养基础上分别加入高低浓度的TNF-α,结果发现,与共培养组、共培养+0.5ng/ml TNF-α组相比,共培养+5ng/ml TNF-α组细胞生长速度减慢、G2+S期比例降低、迁移能力降低,NF-κB、CyclinD1、c-Myc等的表达均明显降低。生长速度快、G2+S期比例低、迁移能力强等均为肿瘤细胞较为重要的生物学特性[19],而CyclinD1是由CCND1基因编码的蛋白,是细胞周期中的一个重要启动子,在肿瘤中多高表达[20]。c-Myc原癌基因的激活与大多数肿瘤发生密切相关,参与肿瘤细胞增殖、凋亡、衰老、分化等过程[21]。共培养组中加入较高浓度的TNF-α对维持BMSCs生物学特性的稳定有重要作用。因此笔者认为,共培养后BMSCs TNF-α的表达降低可能会诱导NF-κB表达增加,进而引发下游增殖、周期等相关蛋白表达,从而导致BMSCs产生肿瘤相关生物学行为。
综上所述,C6脑胶质瘤微环境能使BMSCs产生部分肿瘤相关生物学特性改变,共培养后BMSCs中TNF-α表达降低可能是导致上述改变的重要因素,而维持适宜浓度的TNF-α对间充质干细胞起保护作用。本研究为间充质干细胞的临床安全应用提供了理论依据,但其具体机制尚需进一步探讨。
