大孔树脂固定化磷脂酶A1及其用于菜籽油脱胶工艺的优化
2018-02-09水龙龙操丽丽潘丽军李进红姜绍通
水龙龙,操丽丽,庞 敏,潘丽军,鲍 赛,李进红,姜绍通*
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
菜籽经过压榨得到菜籽毛油,毛油中杂质较多,易氧化变质,甚至含有农药残留、重金属等有害物质,故需要对毛油进行精炼。精炼工艺主要为脱胶、脱酸、脱色和脱臭。脱胶是油脂精炼过程中的关键步骤之一,脱胶效果的优劣,对后续的精炼工艺以及成品油的品质有重大影响[1]。脱胶是脱除胶质物质的过程,磷脂是胶质物质的主要成分,有水化磷脂和非水化磷脂之分。酸法脱胶和水化脱胶是油脂工厂常用的脱胶方法。水化脱胶工艺只能去除油脂中的水化磷脂,无法脱除非水化磷脂。酸法脱胶只可以脱除水化磷脂和少量的非水化磷脂,仍会残留大部分的非水化磷脂,并且会消耗较多的碱,产生较多的废水[2]。
酶法脱胶利用磷脂酶将非水化磷脂水解为溶血磷脂,可以将非水化磷脂从油脂中除去[3]。与酸法脱胶和水化脱胶相比,酶法脱胶具有反应条件温和、化学试剂用量少、环境污染小等优势[4]。然而,游离酶用于油脂脱胶存在着易失活、无法重复使用、价格高等劣势[5]。通过将磷脂酶固定在载体上,制得固定化酶可以在很大程度上弥补这种劣势。固定化酶依然保留着游离酶对底物的特异性和高效性,还可以提高酶的稳定性,实现酶的重复使用,有效降低了酶的使用成本[6]。
常见酶的固定化方法有物理吸附法、交联法、共价偶联法和包埋法[7]。将磷脂酶固定在大孔树脂上的操作过程简单,对酶分子结构影响小,作为载体的树脂还可以回收重复使用,但同时也存在着酶较易脱落的缺点[8]。大孔树脂固定化脂肪酶和磷脂酶已有较多研究[7-13],但将大孔树脂固定化磷脂酶用于菜籽油脱胶的研究鲜见报道。本实验以廉价易得的大孔树脂为磷脂酶固定化材料,优化大孔树脂固定化磷脂酶的最佳条件,并将固定化酶用于菜籽油脱胶实验。
1 材料与方法
1.1 材料与试剂
磷脂酶A1(Lecitase® Ultra,酶活力5 000 U/mL) 丹麦诺维信公司;大孔树脂(型号D001、D113、D1400、D201、D301、D314、DA201和SA-2) 安徽三星树脂科技有限公司;大豆卵磷脂 上海蓝季科技发展有限公司;菜籽毛油(实测初始磷含量为72.6 mg/kg) 安徽合肥市售;乙醇、氢氧化钠、氢氧化钾、磷酸氢二钠、柠檬酸、硫酸联胺、钼酸钠、氧化锌、浓盐酸、浓硫酸均为分析纯。
1.2 仪器与设备
NSKY-110WX型水浴摇床 上海苏坤实业有限公司;FA25型高剪切分散乳化机 上海弗鲁克流体机械制造有限公司;T6新世纪型双光束紫外-可见光分光光度计 北京普析通用仪器有限责任公司;ZDJ-4B型自动电位滴定仪 上海仪电科学仪器股份有限公司;DZF-6053型真空干燥箱 上海一恒科学仪器有限公司:SX2-4-10型箱式电阻炉 黄石市恒丰医疗器械有限公司。
1.3 方法
1.3.1 固定化酶的制备
取100 g树脂于500 mL烧杯中,加入300 mL无水乙醇浸泡24 h后抽滤,用去离子水将乙醇洗净,依次将树脂用5% HCl和5% NaOH溶液浸泡3 h后抽滤,然后用去离子水冲洗直至中性。取一定量大孔树脂、缓冲液(0.02 mol/L磷酸氢二钠溶液与0.01 mol/L柠檬酸溶液按不同比例混调)和磷脂酶A1于锥形瓶中,水浴摇床室温振荡吸附一定时间,过滤分离载体和上清液,并用缓冲液清洗载体,将固定化酶于30 ℃真空干燥后保存于4 ℃冰箱中[7-9]。
1.3.2 载体树脂的蛋白吸附量测定
蛋白含量测定采用Bradford法[14],载体的蛋白吸附率按公式(1)计算:
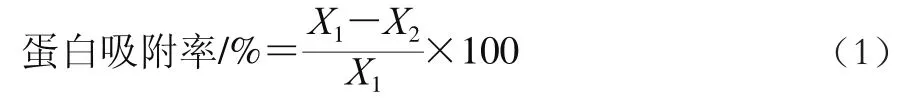
式中:X1为固定化前酶液的蛋白质量/mg;X2为固定化后上清液的蛋白质量/mg。
1.3.3 固定化磷脂酶A1活力的测定
参照占剑锋等[15]方法,稍作更改:将4%的无油大豆卵磷脂和0.5%的聚乙烯醇溶于一定pH值的缓冲液中,用高剪切分散乳化机将混合液10 000 r/min均质10 min,获得底物溶液。取30 mL底物溶液于100 mL锥形瓶中,50 ℃水浴摇床预热10 min后加入预定量的固定化酶,同时作空白对照。180 r/min反应10 min后,立即加入15 mL 95%乙醇溶液终止酶解反应,使用自动电位滴定仪,以0.1 mol/L NaOH溶液为滴定剂滴定底物溶液,计算NaOH溶液的平均消耗量。
定义在特定的条件下1 min水解磷脂产生1 μmol游离脂肪酸所需的酶量为1 个磷脂酶活力单位(U)。固定化磷脂酶A1活力为每克固定化酶含有的磷脂酶活力单位(U/g)。固定化磷脂酶A1活力按公式(2)计算:
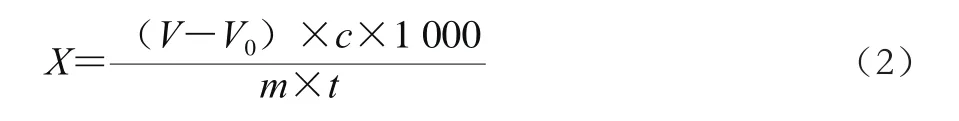
式中:X为样品酶活力/(U/g);V为滴定实验组时消耗NaOH溶液的体积/mL;V0为滴定空白组时消耗NaOH溶液的体积/mL;c为NaOH溶液的浓度/(mol/L);m为加入固定化酶的质量/g;t为酶解反应时间/min。
1.3.4 pH值和反应温度对固定化酶与游离酶活力的影响
将固定化酶和游离酶分别在不同pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5)、不同反应温度(30、35、40、45、50、55、60、65 ℃)条件下,按1.3.3节方法测定酶活力,定义不同pH值和反应温度条件下所测得的酶活力中最高者为100%。
1.3.5 酶法脱胶实验
参照文献[16],稍作改动:取200 g菜籽毛油于锥形瓶中,水浴加热至80 ℃,加入45%的柠檬酸0.24 mL,10 000 r/min均质1 min,置于80 ℃水浴锅中500 r/min搅拌20 min。再加入一定量的4% NaOH溶液调节到预定pH值。再加入4 mL蒸馏水和一定量的固定化酶,在50 ℃、180 r/min条件下,水浴摇床酶解反应一段时间。将所得的脱胶油5 000 r/min离心20 min,取上层油样测定磷含量。磷含量的检测方法参照GB/T 5537—2008《粮油检验 磷脂含量的测定》。
1.3.6 酶法脱胶工艺条件优化
1.3.6.1 单因素试验
按1.3.5节方法,进行脱胶试验,分别考察固定化酶添加量(0.5、1.0、1.5、2.0、2.5 g/kg)、反应pH值(4.5、5.0、5.5、6.0、6.5、7.0)、反应温度(35、40、45、50、55、60 ℃)、反应时间(1、2、3、4、5 h)对脱胶效果的影响,每组试验重复3 次。
1.3.6.2 响应面试验
在单因素试验结果的基础上,进行响应面试验设计,确定最佳的脱胶条件,每组试验重复3 次。响应面试验因素与水平如表1所示。
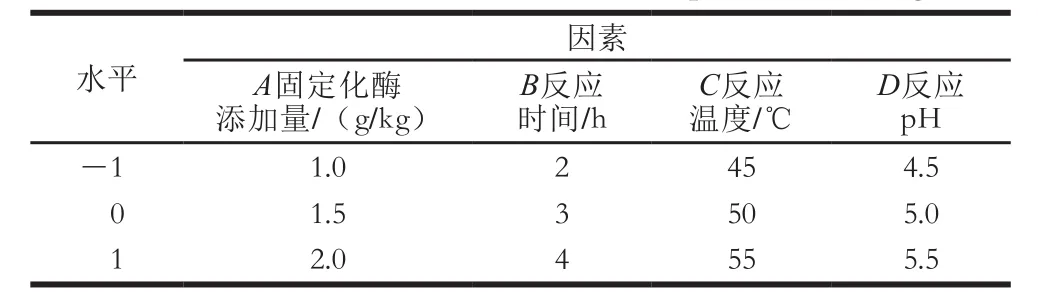
表1 响应面试验因素与水平Table1 Variables and their levels used for response surface design
1.3.7 固定化酶重复使用性实验
将固定化酶在响应面法获得的最佳条件下进行菜籽毛油脱胶实验。固定化酶重复使用5 次,每次脱胶实验后,回收固定化酶,并用pH 5.0的缓冲液冲洗干净,并测定酶活力及脱胶油中的磷含量,规定固定化酶原来的酶活力为100%。
2 结果与分析
2.1 固定化载体的选择
选取8 种不同的大孔树脂作为磷脂酶A1的固定化载体。固定化条件为缓冲液pH 5.0,酶添加量2 mL/g(磷脂酶A1的蛋白质量浓度为16.65 mg/mL),室温振荡吸附6 h,收集上清液并将所得的固定化酶真空干燥,测定各种树脂的蛋白吸附率和固定化酶活力,结果如表2所示。

表2 不同树脂的物化性质及固定化效果Table2 Physical properties and enzyme immobilization capacity of resins
大孔树脂主要借助氢键、范德华力或者是某些功能基团将酶固定在其周围,树脂的理化性质对固定化效率和固定化酶活力有至关重要的影响[9,11]。离子交换树脂表面的带电基团与酶分子表面特殊官能团可以形成离子键,通过范德华力和离子键的作用,离子交换树脂可以将酶吸附在其表面,大孔吸附树脂则通过范德华力和氢键将酶吸附在其周围。从表2可以看出,蛋白吸附率越大,固定化酶活力越高,在选择的8 种大孔树脂中,阳离子交换树脂D001的固定化效果最好,酶活力最高。因此选择D001树脂作为固定化磷脂酶A1的最适载体。
2.2 固定化反应条件优化
2.2.1 最适固定化pH值的确定
取2 g D001型大孔树脂,加入3 mL磷脂酶,20 mL pH值分别为4.0、5.0、6.0、7.0、8.0的缓冲液,置于水浴摇床中,室温振荡4 h后过滤,收集上清液和固定化酶,将固定化酶于30 ℃真空干燥箱中干燥,测定各条件下固定化酶活力,结果如图1所示。
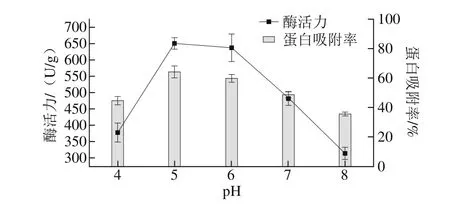
图1 pH值对固定化酶活力和蛋白吸附率的影响Fig. 1 Effect of pH on the activity of immobilized phospholipase and immobilization efficiency
由图1可知,固定化酶活力和蛋白吸附率均随pH值的增加而先增大后减小,在pH 5.0时,酶活力和蛋白吸附率同时达到最大值。pH值的改变会影响酶活性中心上必需基团的解离程度以及底物的解离状态。只有在最合适的
pH值条件下,酶和底物才会达到最佳的结合状态,从而表现最大的酶活力[19]。固定化酶活力与游离酶活力相比要低很多,可能是因为固定化酶被大量吸附在载体的表面,在反应时无法与底物进行充分的接触,从而表现出较低的酶活力。
2.2.2 最适酶添加量的确定
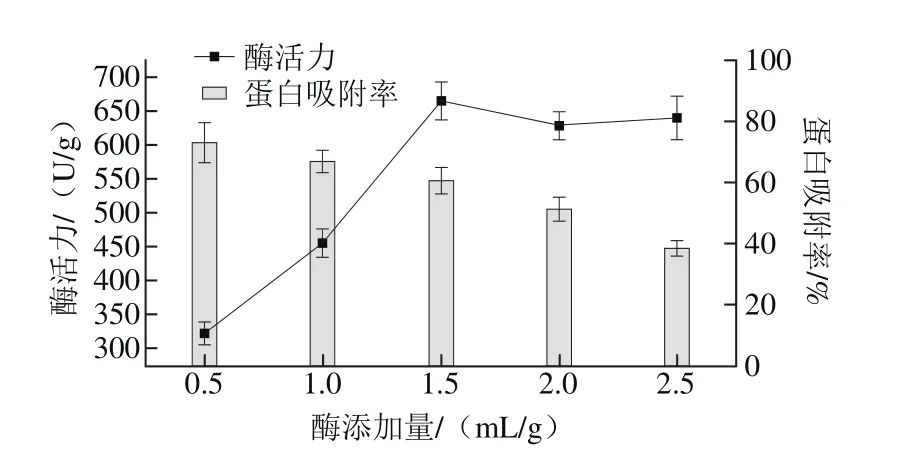
图2 酶添加量对固定化酶活力和蛋白吸附率的影响Fig. 2 Effect of phospholipase amount on the activity of immobilized phospholipase and immobilization efficiency
取2 g D001型大孔树脂,分别加入1.0、2.0、3.0、4.0、5.0 mL的磷脂酶,pH 5.0的缓冲液20 mL,置于水浴摇床中,室温振荡4 h后过滤,收集上清液和固定化酶,将固定化酶于30 ℃真空干燥箱中干燥,测定各条件下固定化酶活力,结果如图2所示。
由图2可知,当酶添加量少于1.5 mL/g时,固定化酶活力随酶添加量的增加而逐渐增加,当酶添加量超过1.5 mL/g后,酶活力不再增加,而是趋于稳定。蛋白吸附率则随着酶添加量的增大而逐渐减小。可能的原因是当酶添加量较少时,树脂可以尽可能多地吸附溶液中的酶蛋白,故固定化效率较高,但是酶活力较低;随着酶添加量继续增加,树脂逐渐达到饱和状态,无法吸附更多的酶蛋白,酶活力也不再增加,固定化效率也逐渐减小[7]。
2.2.3 最适固定化时间的确定
取2 g D001型大孔树脂,加入3.0 mL磷脂酶,pH 5.0缓冲液20 mL,置于水浴摇床中,室温振荡吸附1、2、4、6、8 h后过滤,收集上清液和固定化酶,将固定化酶于30 ℃真空干燥箱中干燥,测定各条件下固定化酶活力,结果如图3所示。
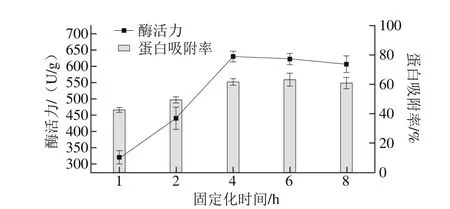
图3 固定化时间对固定化酶活力和蛋白吸附率的影响Fig. 3 Effects of reaction time on the activity of immobilized phospholipase and immobilization efficiency
由图3可知,固定化酶活力和蛋白吸附率随固定化时间的变化趋势为逐渐增加,在4 h以后几乎保持不变。因为树脂的吸附量是固定的,故随着时间的延长,树脂逐渐达到饱和吸附状态,无法继续吸附更多的酶蛋白,酶活力和蛋白吸附率也不再发生变化。
综上所述,大孔树脂D001固定化磷脂酶A1的最佳条件为pH 5.0、酶添加量1.5 mL/g、固定化时间4 h。在此条件下固定化磷脂酶A1活力为665.8 U/g,蛋白吸附率为62.3%。
2.3 温度和pH值对固定化酶和游离酶活力的影响
由图4A可知,固定化酶和游离酶的最适温度基本保持一致,均在50 ℃左右。当温度在40~65 ℃之间时,固定化酶的相对酶活力均比游离酶高,这说明固定化酶比较稳定,酶活力变化较小。由图4B可知,固定化酶和游离酶最适pH值均在5.0附近。当pH值超过6.0之后,相对酶活力均呈直线下降趋势,但固定化酶能在更广的pH值范围内保持较高的相对酶活力。许多研究表明[20-23],将酶固定在适合的载体上,可以降低酶对温度和pH值的敏感性。由于载体将酶固定在其周围,减小了pH值和温度对酶活性中心的影响,因此固定化酶在较广的温度和pH值范围内均能保持较高酶活力[24-25]。
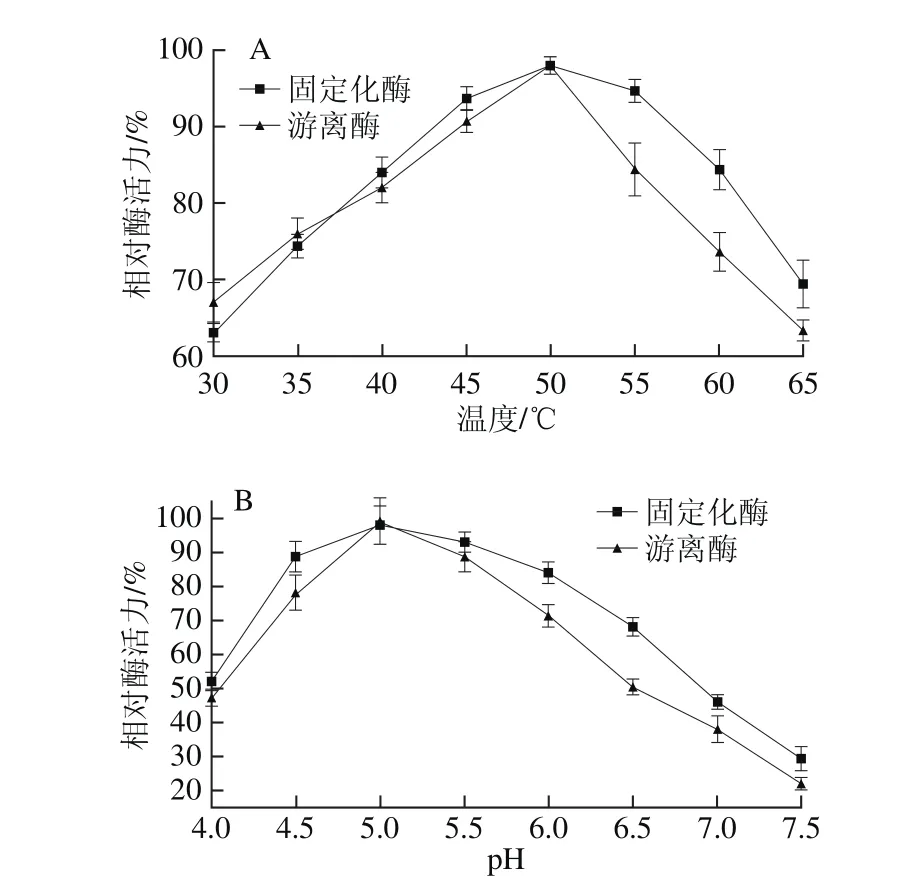
图4 固定化酶的最适温度(A)和最适pH值(B)分析Fig. 4 Optimum temperature (A) and pH (B) for immobilized and free phospholipase
2.4 固定化酶脱胶工艺优化结果
2.4.1 单因素试验结果
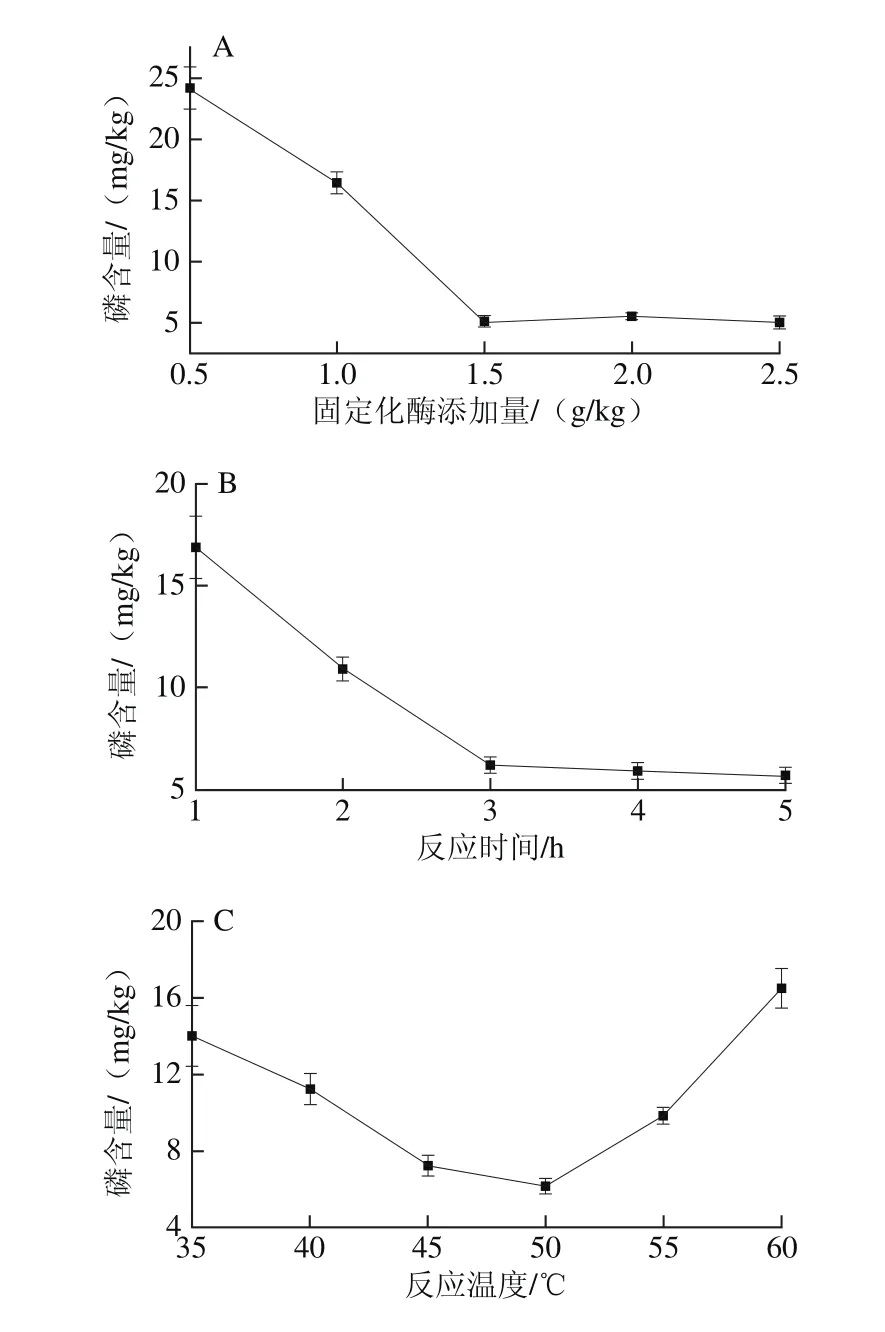
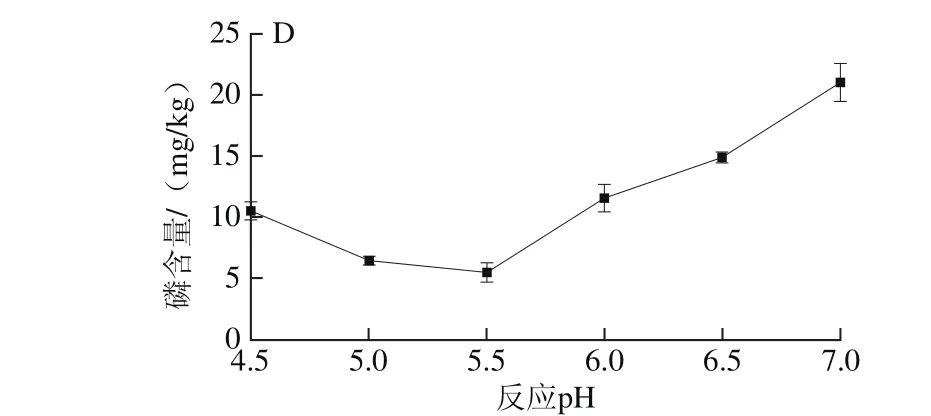
图5 固定化酶添加量(A)、反应时间(B)、反应温度(C)和反应pH值(D)对脱胶效果的影响Fig. 5 Effects of phospholipase dosage (A), reaction time (B), temperature (C)and pH value (D) on degumming efficiency
由图5A可知,当固定化酶添加量逐渐增大时,脱胶油中磷含量逐渐降低,当酶添加量超过1.5 g/kg后,磷含量基本不再发生变化,考虑到酶的成本,选择酶添加量为1.5 g/kg。由图5B可知,随着反应时间的延长,磷含量逐渐下降,当时间达到3 h以后,磷脂酶与油中的磷脂反应完全,磷含量不再发生明显的变化。因此较好脱胶反应时间为3 h左右。由图5C可知,在45~55 ℃的范围内,脱胶油中磷含量均在10 mg/kg以下,说明脱胶的最佳温度在45~55 ℃之间。过高或过低的温度均会导致酶活力降低,从而导致脱胶效果不理想。由图5D可知,在pH 4.5~5.5范围内,固定化酶活力较高,可以将油脂中磷含量降低到10 mg/kg以下。
2.4.2 响应面试验结果
2.4.2.1 响应面试验结果与分析
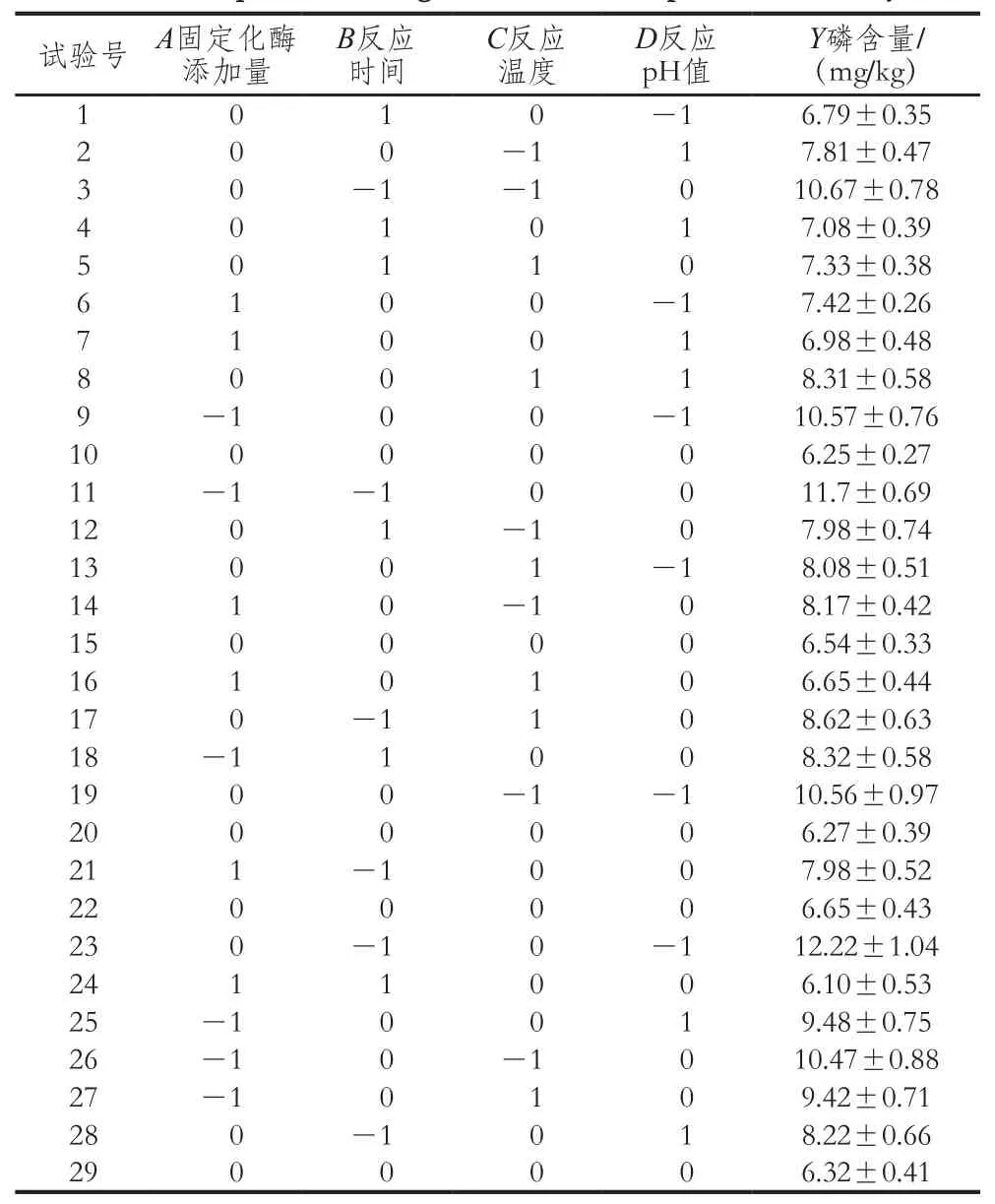
表3 响应面试验设计与结果Table3 Experimental design and results for response surface analysis
如表3所示,以磷含量为响应值Y,使用Design-Expert 8.0.6软件进行分析。回归模型的方差分析见表4。
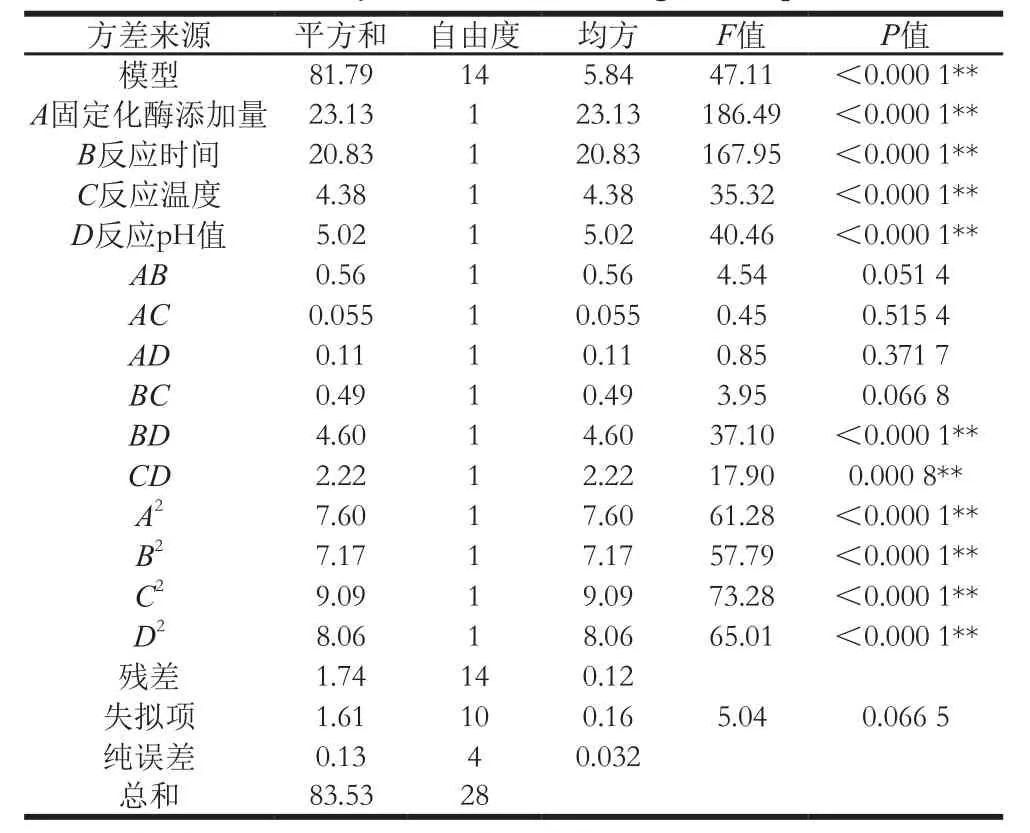
表4 回归模型的方差分析Table4 Analysis of variance of the regression equation
由表4可知,二次回归模型的F值为47.11,P值小于0.000 1,说明此回归模型极显著;失拟项P值为0.066 5,大于0.05,表明差异不显著,此模型拟合效果良好,可以接受。一次项、二次项和交互项BD、CD对响应值的影响均为极显著(P<0.01),交互项的影响主次顺序为BD>CD。方程决定系数R2值为0.979 2,说明使用此回归方程进行分析时,各因素与响应值之间有良好的线性关系[26-27]。
从图6可以看出,反应时间和反应pH值、反应温度和反应pH值两两交互作用的曲线较陡,呈现较规则的曲面,说明交互作用影响显著,且反应时间和反应pH值交互作用曲面图较反应温度和反应pH更为陡峭,说明反应时间和反应pH值交互作用更为显著。
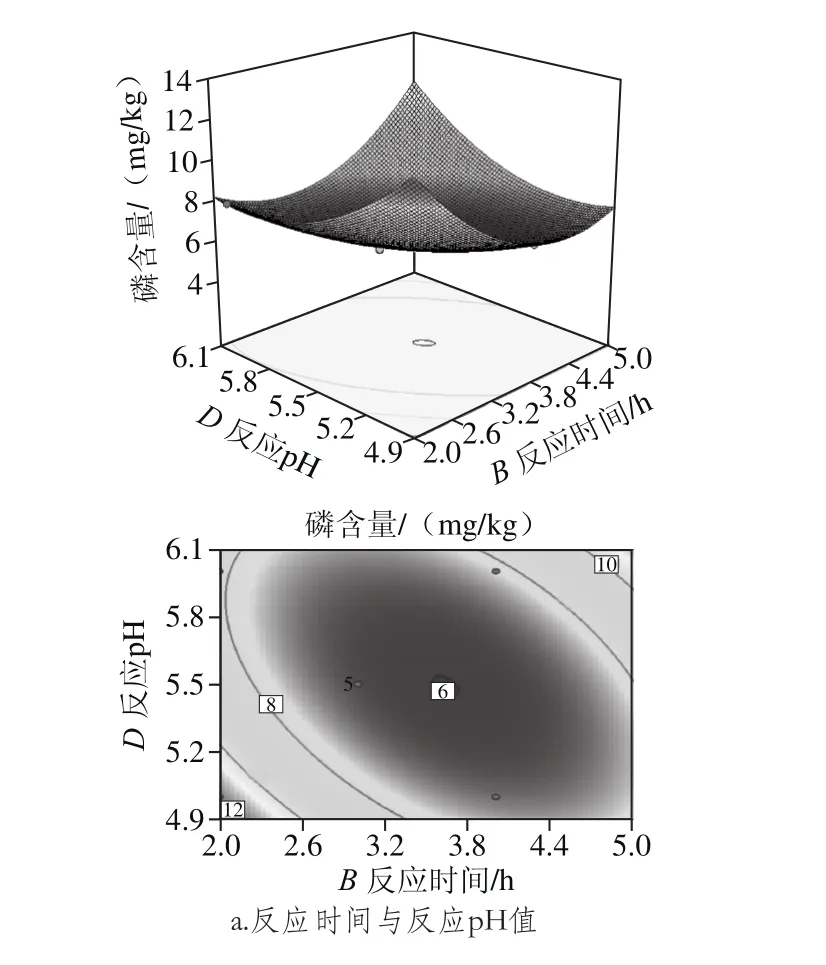
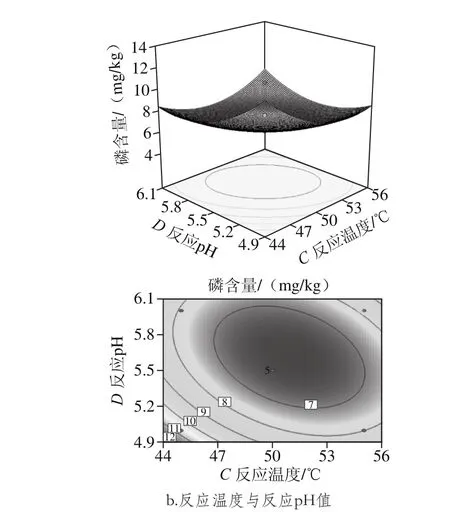
图6 两因素交互作用对磷含量影响的响应面和等高线图Fig. 6 Response surface and contour plots showing the intereactive effect of variables on phosphorus content of degummed oil
通过Design-Expert 8.0.6获得的回归方程为Y=433.21-19.24A-24.05B-6.63C-72.66D+0.75AB-0.047AC+0.65AD+0.07BC+2.15BD+0.30CD+4.33A2+1.05B2+0.05C2+4.5D2。根据此回归方程,确定固定化磷脂酶用于菜籽毛油脱胶的最佳条件为固定化酶添加量1.79 g/kg、反应时间3.56 h、反应温度51.22 ℃、反应pH 5.46。
2.4.2.2 验证实验结果
根据响应面试验所得的最佳脱胶条件,进行3 次重复验证实验。根据实际操作的需要,将脱胶反应最佳条件修正为固定化酶添加量1.8 g/kg、反应时间3.6 h、反应温度51 ℃、反应pH 5.5。在此条件下进行固定化酶脱胶实验,得到的脱胶油中的平均磷含量为5.82 mg/kg,在响应值Y的95%预测区间[4.80,6.45]内,说明此回归模型具有良好的拟合性。
2.5 固定化酶的重复使用稳定性结果
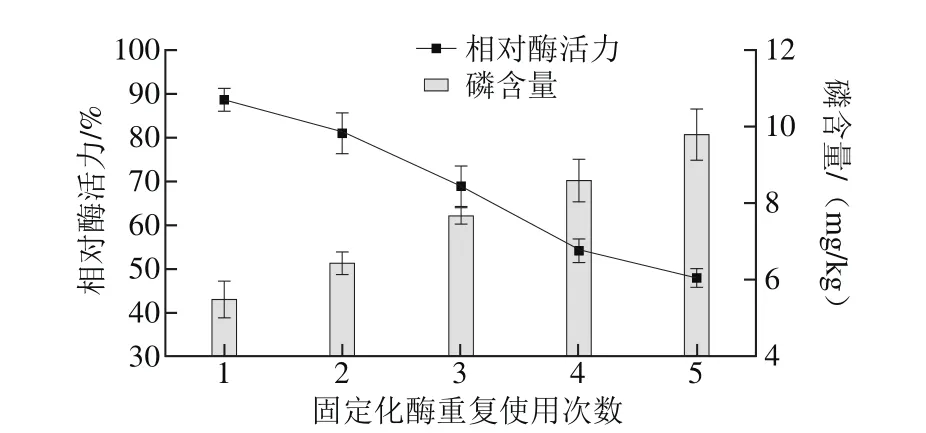
图7 固定化酶的重复使用性Fig. 7 Reusability of immobilized phospholipase
由图7可知,脱胶油中的磷含量随着固定化酶使用次数增加不断上升,当固定化酶使用5 次后,磷含量上升为9.78 mg/kg。工业生产中要求,脱胶油的磷含量在10 mg/kg以下[28],可见固定化酶重复使用5 次后,其脱胶效果仍可满足工业生产的要求。固定化酶活力随着使用次数的增加不断下降,当使用5 次后,固定化酶只含有初始酶活力的47.9%。固定化酶活力急剧下降的原因可能是酶与载体结合不牢固,在脱胶的过程中由于不断搅拌的缘故,酶从载体上脱落,造成酶活力损失较大[29-30]。
3 结 论
以离子交换树脂D001为载体固定化磷脂酶A1,最佳固定化反应条件为pH 5.0、酶添加量1.5 mL/g、固定化时间4 h。获得的固定化磷脂酶A1的活力为665.8 U/g。与游离酶相比,固定化酶的最适温度和pH值均未发生改变,但固定化反应可以在一定程度上增加酶的稳定性,使固定化酶在更广的温度和pH值范围内保持较高的相对酶活力。将固定化酶用于菜籽油脱胶实验,并通过响应面试验优化了脱胶条件。将固定化酶进行5 次脱胶实验后,脱胶油中磷含量为9.78 mg/kg,满足工业生产中脱胶油中磷含量小于10 mg/kg的要求,但是固定化酶只有其初始酶活力的47.9%,酶活力损失较大。说明该固定化酶用于油脂脱胶,还是存在着固定化酶重复利用次数较少,酶活力损失较大的问题,还需研究更加有效的固定化方法,使固定化磷脂酶A1实现较多次数的重复使用。实验表明,使用大孔树脂固定化磷脂酶A1脱除菜籽毛油中的磷脂,得到的脱胶油完全符合工业生产对脱胶效果的要求,并且可以方便地实现酶的分离和重复利用。
[1] 杨继国, 杨博, 孟炯, 等. 新型磷脂酶Lecitase Ultra用于大豆油脱胶的研究[J]. 中国油脂, 2003, 28(10): 10-13. DOI:10.3321/j.issn:1003-7969.2003.10.002.
[2] YU D, MA Y, XUE S J, et al. Characterization of immobilized phospholipase A1on magnetic nanoparticles for oil degumming application[J]. LWT-Food Science and Technology, 2013, 50(2): 519-525.DOI:10.1016/j.lwt.2012.08.014.
[3] ROY S K, RAO B V S K, PRASAD R B N. Enzymatic degumming of rice bran oil[J]. Journal of the American Oil Chemists’ Society, 2002,79(8): 845-846. DOI:10.1016/j.lwt.2012.08.014.
[4] 从艳霞, 万建春, 姜波, 等. 磷脂酶A1酶法脱胶精炼油稳定性研究[J]. 中国油脂, 2012, 37(8): 8-11. DOI:10.3969/j.issn.1003-7969.2012.08.003.
[5] LIU N, FU M, WANG Y, et al. Immobilization of Lecitase®Ultra onto a novel polystyrene DA-201 resin: characterization and biochemical properties[J]. Applied Biochemistry and Biotechnology, 2012, 168(5):1108-1120. DOI:10.1007/s12010-012-9845-y.
[6] 王瑾, 李振岚, 王玉, 等. 固定化磷脂酶用于冷榨菜籽油脱胶[J]. 食品工业科技, 2010(9): 276-278. DOI:10.13386/j.issn1002-0306.2010.09.043.
[7] 曹茜, 汪勇, 唐书泽, 等. 磷脂酶A1(Lecitase Ultra)大孔树脂固定化研究[J]. 食品研究与开发, 2012, 33(8): 32-35. DOI:10.3969/j.issn.1005-6521.2012.08.010.
[8] LIU Y, ZHANG X, TAN H, et al. Effect of pretreatment by different organic solvents on esterification activity and conformation of immobilized Pseudomonas cepacia lipase[J]. Process Biochemistry,2010, 45(7): 1176-1180. DOI:10.1016/j.procbio.2010.03.023.
[9] 朱珊珊, 李铁, 王永华, 等. 磷脂酶A1的固定化及应用研究[J]. 中国油脂, 2010, 35(12): 33-37.
[10] POOJARI Y, CLARSON S J. Thermal stability of Candida antarctica lipase B immobilized on macroporous acrylic resin particles in organic media[J]. Biocatalysis and Agricultural Biotechnology, 2013, 2(1): 7-11.DOI:10.1016/j.bcab.2012.10.002.
[11] 付敏, 赵谋明, 刘宁, 等. 吸附-涂层法固定化磷脂酶Lecitase®Ultra的研究[J]. 食品工业科技, 2011(10): 277-280. DOI:10.13386/j.issn1002-0306.2011.10.082.
[12] YAN Y, ZHANG X, CHEN D. Enhanced catalysis of Yarrowia lipolytica lipase LIP2 immobilized on macroporous resin and its application in enrichment of polyunsaturated fatty acids[J]. Bioresource Technology, 2013, 131: 179-187. DOI:10.1016/j.biortech.2012.12.092.
[13] LIU T, LIU Y, WANG X, et al. Improving catalytic performance of Burkholderia cepacia, lipase immobilized on macroporous resin NKA[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 71(1/2): 45-50. DOI:10.1016/j.molcatb.2011.03.007.
[14] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.DOI:10.1016/0003-2697(76)90527-3.
[15] 占剑峰, 姜绍通, 潘丽军. 磷脂酶酶活力测定条件的优化[J]. 食品科学, 2012, 33(17): 174-178.
[16] YANG B, WANG Y H, YANG J G. Optimization of enzymatic degumming process for rapeseed oil[J]. Journal of the American Oil Chemists’ Society, 2006, 83(7): 653-658. DOI:10.1007/s11746-006-1253-4.
[17] GÜRDAS S, GÜLEC H A, MUTLU M. Immobilization of Aspergillus oryzae, β-galactosidase onto duolite A568 resin via simple adsorption mechanism[J]. Food & Bioprocess Technology, 2012, 5(3): 904-911.DOI:10.1007/s11947-010-0384-7.
[18] LI B, CHEN Y, CAO Z, et al. Reversible, selective immobilization of nuclease P1, from a crude enzyme solution on a weak base anion resin activated by polyethylenimine[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 101: 92-100. DOI:10.1016/j.molcatb.2013.12.021.
[19] SUN J, CHEN Y, SHENG J, et al. Immobilization of Yarrowia lipolytica lipase on macroporous resin using different methods:characterization of the biocatalysts in hydrolysis reaction[J]. BioMed Research International, 2015, 2015(3): 1-7. DOI:10.1155/2015/139179.
[20] BORNSCHEUER U T. Immobilizing enzymes: how to create more suitable biocatalysts[J]. Angewandte Chemie International Edition, 2003,42(29): 3336-3337. DOI:10.1002/anie.200301664.
[21] FERNANDEZ-LORENTE G, PALOMO J M, GUISAN J M, et al. Effect of the immobilization protocol in the activity, stability, and enantioslectivity of Lecitase®Ultra[J]. Journal of Molecular Catalysis B:Enzymatic, 2007, 47(3/4): 99-104. DOI:10.1016/j.molcatb.2007.04.008.
[22] WEN S, TAN T, ZHAO H. Improving the thermostability of lipase Lip2 from Yarrowia lipolytica[J]. Journal of Biotechnology, 2013, 164(2): 248-253. DOI:10.1016/j.jbiotec.2012.08.023.
[23] SHEELU G, KAVITHA G, FADNAVIS N W. Efficient immobilization of lecitase in gelatin hydrogel and degumming of rice bran oil using a spinning basket reactor[J]. Journal of the American Oil Chemists’Society, 2008, 85(8): 739-748. DOI:10.1007/s11746-008-1261-7.
[24] LI X, LI D, WANG W, et al. Immobilization of SMG1-F278N lipase onto a novel epoxy resin: characterization and its application in synthesis of partial glycerides[J]. Journal of Molecular Catalysis B: Enzymatic, 2016,133: 154-160. DOI:10.1016/j.molcatb.2016.08.011.
[25] DOS SANTOS J C S, GARCIA-GALAN C, RODRIGUES R C, et al.Improving the catalytic properties of immobilized lecitase via physical coating with ionic polymers[J]. Enzyme and Microbial Technology, 2014,60: 1-8. DOI:10.1016/j.enzmictec.2014.03.001.
[26] 李莉, 张赛, 何强, 等. 响应面法在试验设计与优化中的应用[J].实验室研究与探索, 2015, 34(8): 41-45. DOI:10.3969/j.issn.1006-7167.2015.08.011.
[27] 熊志琴, 潘丽军, 姜绍通, 等. 响应面试验优化两步酶法合成母乳脂替代品工艺及脂肪酸组成分析[J]. 食品科学, 2017, 38(2): 248-254.DOI:10.7506/spkx1002-6630-201702039.
[28] YANG J G, WANG Y H, YANG B, et al. Degumming of vegetable oil by a new microbial lipase[J]. Food Technology & Biotechnology, 2006,44(1): 101-104.
[29] SINGHANIA T, SINHA H, DAS P, et al. Efficient degumming of rice bran oil by immobilized PLA1 from Thermomyces lanuginosus[J].Food technology and Biotechnology, 2015, 53(1): 91. DOI:10.17113/ftb.53.01.15.3740.
[30] QU Y, SUN L, LI X, et al. Enzymatic degumming of soybean oil with magnetic immobilized phospholipase A2[J]. LWT-Food Science and Technology, 2016, 73: 290-295. DOI:10.1016/j.lwt.2016.06.026.
