高血压小鼠动脉血管平滑肌细胞PI3K/Akt/SREBP1信号活化及表型转化研究
2018-02-09韩阳高登峰李明军倪亚萍
韩阳 高登峰 李明军 倪亚萍
心血管疾病是全世界成人的首要致死因素,而高血压是心血管疾病中最重要的危险因素[1]。研究显示,2002年至2012年间,我国高血压患病率每年增加1.4%,且北方人群患病率高于南方人群[2]。持续性高血压可诱导血管重塑及血管功能不全,改变血管壁胞外基质成分,同时诱导血管平滑肌细胞(vascular smooth muscle cells,VSMC)表型转化[3,4]。在血管重塑过程中,位于血管壁中间层的VSMC生长、增殖和迁移,同时合成大量细胞外基质[5]。固醇调节元件结合蛋白1(sterol regulatory elementbinding protein 1,SREBP1)是细胞内重要的转录因子,参与调控细胞内脂质代谢平衡[6]。研究发现,SREBP1介导了VSMC细胞内胆固醇累积进而影响细胞正常功能,同时脂质代谢失衡也改变VSMC细胞行为,诱导细胞增殖和迁移[7,8]。因此,我们猜测高血压是否能够通过影响VSMC内SREBP1的表达,进而改变细胞表型、诱发血管重塑。本研究利用高血压动物和细胞模型,探索SREBP1在VSMC表型转化中的作用,以期为高血压治疗提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 动物 8周龄雄性C57BL/6J小鼠购自国家实验动物种子中心,饲养于恒温[(20±2)℃]、恒湿[(55±5)%]动物房中,12/12 h光周期,自由饮水、摄食。
1.1.2 试剂 血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)、缬沙坦、辣根过氧化物酶标记的第二抗体购自美国Sigma-Aldrich公司,苏木素-伊红染色液、聚偏氟乙烯膜(PVDF)、LY294002购自江苏碧云天公司,LipofectamineTM2000、Trizol试剂、反转录试剂盒、ECL试剂盒购自美国Thermo Fisher公司,SYBR PremixEx TaqⅡ购自大连宝日医公司,第一抗体包括SREBP1抗体、Akt抗体、磷酸化Akt p-Akt抗体、α平滑肌肌动蛋白α-SMA抗体、骨桥蛋白OPN抗体、β-actin抗体购自美国Novus Biological公司,其余常见试剂均为国产。
1.2 方法
1.2.1 动物分组处理 将50只C57BL/6J小鼠随机分为对照组、处理组1、处理组2、处理组3和缬沙坦组,每组10只。小鼠预先通过手术于背部皮下植入微渗透泵,处理组小鼠通过微渗透泵按照150 ng·kg-1·min-1(处理组1)、300 ng·kg-1·min-1(处理组2)、600 ng·kg-1·min-1(处理组3)的速率灌注AngⅡ(溶于0.9%生理盐水),缬沙坦组小鼠按照600 ng·kg-1·min-1的速率灌注 AngⅡ,对照组小鼠则通过微渗透泵灌注生理盐水,共处理28 d。缬沙坦组小鼠在灌注AngⅡ的同时通过灌胃方式给予40 mg·kg-1·d-1缬沙坦进行处理,对照组和处理组则灌注等体积蒸馏水。称量小鼠体质量,并检测小鼠心率和血压变化。
1.2.2 苏木素-伊红(HE)染色 取小鼠主动脉根部至主动脉弓血管,在中性甲醛溶液中进行固定,石蜡包埋后制成5 μm厚切片,将切片脱蜡至水后用苏木素染液处理10 min,0.5%盐酸乙醇处理10 s后伊红染色5 min,梯度乙醇脱水、二甲苯透明,中性树脂封片,显微镜下观察。
1.2.3 VSMC细胞分组处理 将VSMC细胞随机分为正常组、处理组1、处理组2、处理组3、缬沙坦组、LY294002组、沉默对照组、沉默组。处理组细胞分别添加 0.1×10-6mol/L(处理组 1)、0.5×10-6mol/L(处理组 2)、1.0×10-6mol/L(处理组 3)AngⅡ处理24 h,缬沙坦组则在添加 AngⅡ(1.0×10-6mol/L)处理前用 1.0×10-6mol/L缬沙坦预处理 6 h,LY294002组在 AngⅡ(1.0×10-6mol/L)处理前用10 ng/ml LY294002预处理6 h,沉默对照组和沉默组细胞在AngⅡ(1.0×10-6mol/L)处理24 h前转染scramble siRNA和SREBP1 siRNA,正常组添加等体积溶媒处理。
1.2.4 siRNA转染 查找SREBP1基因序列(NM_011480.4),设计含BamⅠ和 HindⅢ酶位点的siRNA引物并合成siRNA,其中SREBP1 siRNA上游引物为 5′-GAT CCG ACA TGC TCC AGC TCA TCA TTC AAG ACG TGA TGA GCT GGA GCA TGT CTT TTT TGT CGA CA-3′,下游引物为 3′-GCT GTA CGA GGT CGA GTA AGT TCT GCA CTA CTC GAC CTC AAA AAA CAG CTG TTC GA-5′,产物长度65 bp,由华大基因合成。将扩增产物克隆到shRNA质粒中并测序鉴定。VSMC细胞生长至80%融合时用于转染,取5 μl LipofectamineTM2000稀释到250 μl减血清MEM培养基,室温下孵育5 min后加入8 μl siRNA,室温共孵育20 min。将混合后的siRNA-Lipofectamine复合物加入到VSMC细胞培养孔中,轻轻摇动混匀,37℃、5%CO2条件下进行培养。
1.2.5 实时荧光定量PCR(qRT-PCR)分析 利用Trizol试剂提取小鼠主动脉总RNA,反转录试剂盒合成cDNA第一链作为qRT-PCR模板(10 μl反应体系)。qRT-PCR 扩增体系(20 μl),包含上、下游引物各 0.5 μl,SYBR PremixEx TaqⅡ10 μl,模板 2 μl,ddH2O 7 μl。qRT-PCR 扩增条件:95 ℃ 2 min,94 ℃20 s,60℃ 20 s,40个循环;溶解曲线温度 65℃~95 ℃。SREBP1(NM_011480.4)引物:上游 5′-GTA CCT GCG GGA CAG CTT AG-3′,下游 5′-GTC CAT TGC TGG TAC CGT GA-3′,产物长度 161 bp。β-actin(NM_007393.5) 引物:上游 5′-CCT AAG AGG AGG ATG GTC GC-3′,下游 5′-CTC AGA CCT GGG CCA TTC AG-3′,产物长度 155 bp。根据PCR反应得出的循环阈值(cycle threshold value,Ct),由 2-ΔΔCt公式计算目的基因相对表达量。
1.2.6 免疫印迹检测 取小鼠主动脉或VSMC细胞,添加 RIPA 裂解液[50 mM Tris(pH 7.4),150 mM氯化钠,1%Triton X-100,1%去氧胆酸钠,0.1%SDS,0.1 g/L PMSF]提取总蛋白,利用 Braford法测定蛋白浓度。取40 μg蛋白上样,SDS-PAGE凝胶电泳分离蛋白。电泳结束后将蛋白通过湿法转移至PVDF上,随后将PVDF膜用5%脱脂奶粉在室温下封闭2 h。T-PBS漂洗3次,添加第一抗体在4℃中封闭过夜。本研究使用的第一抗体包括SREBP1抗体(1∶1000)、Akt抗体(1∶1000)、p-Akt抗体(1∶800)、α-SMA 抗体(1∶1000)、OPN 抗体(1∶1000)、β-actin抗体(1∶1000)。T-PBS漂洗 3次,添加辣根过氧化物酶标记的第二抗体(1∶5000)于37℃孵育2 h,ECL试剂盒显影,利用Image J软件检测灰度值,计算相对表达量。
1.3 统计学方法 利用SPSS 13.0统计软件进行统计分析。所有数据均采用±s的方式表示,多组间比较采用单因素方差分析(one-way ANOVA),并利用SNK-q检验进行两两比较。P<0.05为差异具有统计学意义。
2 结果
2.1 高血压小鼠体质量、心率、收缩压、舒张压变化 与对照组比较,各处理组和缬沙坦组小鼠体质量、心率水平无明显变化(P>0.05)。处理组1、处理组2和处理组3小鼠收缩压和舒张压水平明显高于对照组(P<0.05)。缬沙坦组收缩压和舒张压水平低于处理组(P<0.05),但高于对照组(P<0.05)。见表1。
表1 高血压小鼠生理指标检测(±s)

表1 高血压小鼠生理指标检测(±s)
注:与对照组比较,aP<0.05;与处理组 1、2、3 组比较,bP<0.05
舒张压(mm Hg)对照组 10 25.8±2.7 532.9±46.7 121.4±11.8 69.3±5.5处理组 1 10 24.3±3.6 541.2±50.1 132.4±12.7a 74.6±6.3a处理组 2 10 25.1±2.9 544.8±48.4 141.7±12.9a 82.1±4.9a处理组 3 10 24.8±3.5 546.5±47.3 149.6±11.5a 90.3±7.9a缬沙坦组 10 25.6±4.1 542.9±45.6 134.9±13.4ab 75.3±6.8ab组别 例数 体质量(g)心率(次/min)收缩压(mm Hg)
2.2 高血压小鼠主动脉血管形态学观察 与对照组比较,处理组小鼠主动脉血管壁增厚、管腔增大,血管重塑明显。缬沙坦抑制血管重塑改变。见图1。
2.3 高血压小鼠主动脉血管SREBP1 mRNA和蛋白表达水平检测 3个处理组主动脉血管SREBP1 mRNA水平均显著高于对照组(P<0.05),而缬沙坦组主动脉血管SREBP1 mRNA明显低于处理组(P<0.05)而高于对照组(P<0.05)。SREBP1蛋白表达水平与mRNA的表达水平一致。见图2~4。
2.4 小鼠动脉VSMC细胞SREBP1蛋白水平检测相比于正常组,处理组细胞SREBP1蛋白水平明显上升(P<0.05)。缬沙坦组细胞SREBP1 mRNA水平低于处理组2和处理组3(P<0.05),与处理组1无显著差异(P>0.05),同时高于正常组(P<0.05)。见图 5、6。
2.5 VSMC细胞PI3K/Akt信号影响SREBP1表达与正常组比较,处理组细胞磷酸化Akt水平明显增高(P<0.05),缬沙坦组细胞磷酸化Akt水平则低于处理组 (P<0.05) 而高于正常组 (P<0.05),LY294002组磷酸化Akt水平明显低于正常组(P<0.05)。与正常组比较,LY294002组SREBP1表达水平也明显降低(P<0.05)。见图 7、8。
2.6 VSMC细胞SREBP1参与VSMC表型转化 与正常组及沉默对照组比较,SREBP1 siRNA显著降低VSMC细胞SREBP1蛋白表达水平(P<0.05)。与正常组比较,处理组细胞α-SMA表达明显降低而OPN表达则升高(P<0.05),缬沙坦组细胞α-SMA表达高于处理组而OPN低于处理组;同时LY294002组和沉默组α-SMA表达均高于处理组和缬沙坦组,而OPN表达则降低(P<0.05),与正常组无明显差异。见图9、10。
3 讨论
肾素-血管紧张素系统(renin-angiotensin,RAS)是诱导高血压和心血管疾病的关键性因素。AngⅡ是RAS的效应物,刺激细胞的AT1R受体诱导不良心血管反应,如降低组织血供、血压升高、钠潴留、内皮功能不全和纤维化等[9]。本研究建立了AngⅡ处理小鼠高血压模型,通过HE染色观察到高血压小鼠模型主动脉血管壁增厚,发生血管重塑,缬沙坦处理则可逆转AngⅡ的作用。李洋等[10]发现,低剂量 AngⅡ(100 ng·kg-1·min-1)仅诱导小鼠血管重塑,但不影响小鼠舒张压和收缩压,高剂量AngⅡ(400 ng·kg-1·min-1)则可影响小鼠血压和血管重塑。本实验中低剂量组使用药物剂量相对较高(150 ng·kg-1·min-1),同时观察到小鼠血压和血管变化。
在正常细胞中,SREBP1位于内质网膜内并与SREBP裂解激活蛋白结合,当细胞固醇含量降低时,SREBP1释放至高尔基体中酶解修饰,随后进入细胞核中调控靶基因表达[6]。有研究也发现,SREBP1的表达与多种肿瘤如胰腺癌、子宫内膜肿瘤、卵巢癌等恶性肿瘤细胞的生长有关[11-13]。本研究发现,小鼠主动脉血管及VSMC细胞中SREBP1的表达水平随着AngⅡ处理剂量增加而增高,并且其表达能被缬沙坦降低,说明了AngⅡ具有通过AT1R受体调节SREBP1表达的作用。AT2R是细胞中AngⅡ的另一个受体,其活化具有抑制VSMC生长的作用,需要进一步实验证明AngⅡ是否也通过AT2R调控下游SREBP1的表达。
本研究利用PI3K特异性抑制剂LY294002处理VSMC细胞,细胞中磷酸化Akt的表达水平降低,证明LY294002可阻断PI3K/Akt信号在细胞中转导。缬沙坦也可抑制PI3K/Akt信号活化,证明AngⅡ活化PI3K/Akt途径是通过VSMC细胞中AT1R受体。与此同时,SREBP1的表达受到抑制,说明AngⅡ对SREBP1的调控依赖于PI3K/Akt信号途径。磷酸化的Akt可通过两条途径调控SREBP1活性:①Akt通过下调泛素化酶Fwb-7的表达稳定细胞核SREBP1蛋白,促进其靶基因的表达;②Akt可通过mTORC1调节SREBP1向细胞核转移[6]。
在正常生理条件下,VSMC细胞呈现高度分化、低增殖性的收缩型表型。受到外界刺激后,如生长因子、丝裂原、炎症介质和机械力作用,VSMC则可能丢失收缩型表型,开始生长、分裂、迁移,同时合成大量细胞外基质[14]。α-SMA是收缩型VSMC的标志蛋白,而OPN则是非收缩型(合成型)VSMC的标志蛋白。本研究发现,AngⅡ处理可下调VSMC细胞中α-SMA的表达而上调OPN的表达,缬沙坦和LY294002则可拮抗AngⅡ的作用,从而验证了AngⅡ在VSMC表型转化中的作用机制。此结果通过转染SREBP1 siRNA直接敲低VSMC细胞中SREBP1的表达而进一步得到证明。研究发现,SREBP1能够直接与TGF-β启动子区结合启动基因表达,从而改变细胞外基质成分和结构[15]。因此,SREBP1可能直接影响VSMC细胞外基质而促进表型转化。
综上所述,AngⅡ诱导高血压小鼠主动脉血管重塑和VSMC表型转化,其中PI3K/Akt/SREBP1途径介导了AngⅡ在VSMC表型转化中的作用,从而可能为治疗高血压及相关的血管病变提供新的靶点。
高血压小鼠动脉血管平滑肌细胞PI3K/Akt/SREBP1信号活化及表型转化研究 P79
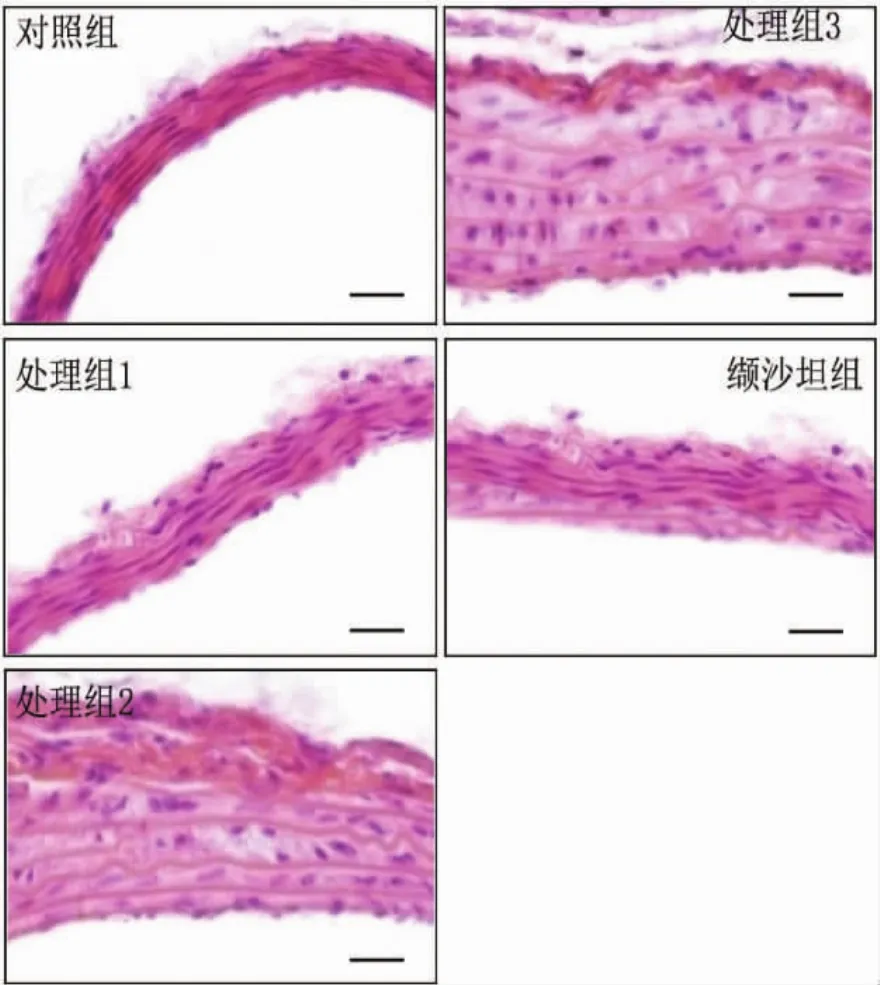
图1 各组高血压小鼠主动脉重塑变化(标尺 50 μm)
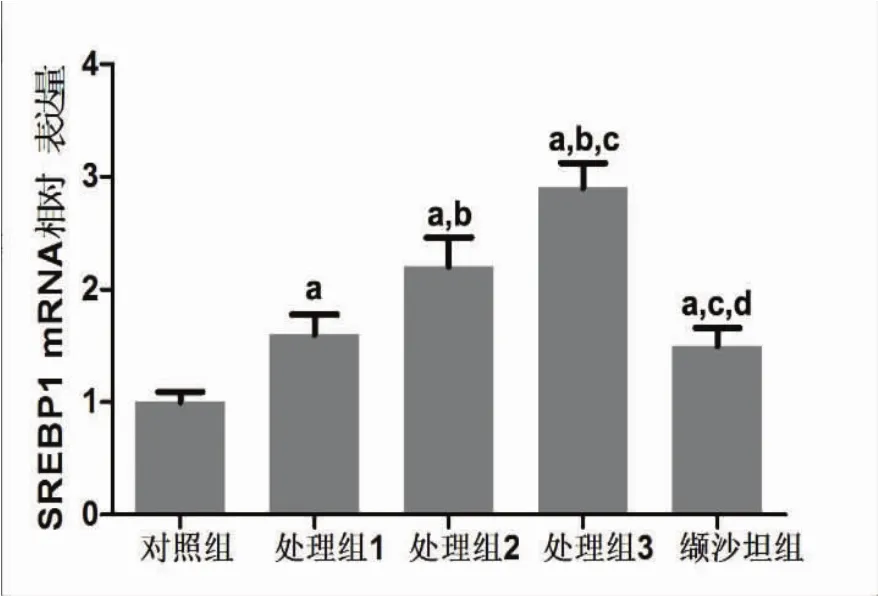
图2 高血压小鼠主动脉血管SREBP1 mRNA表达水平检测
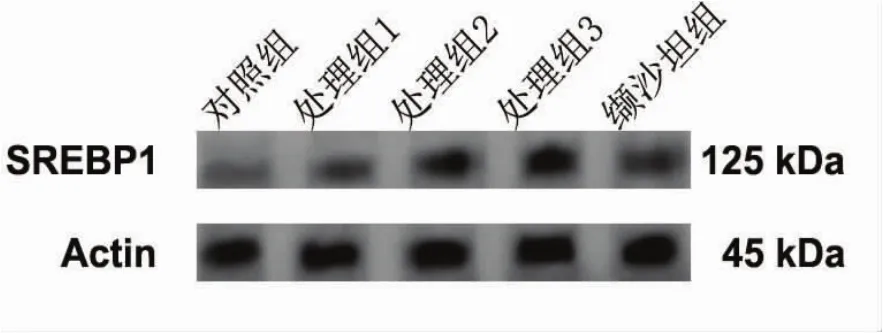
图3 高血压小鼠主动脉血管SREBP1蛋白免疫印迹条带

图4 高血压小鼠主动脉血管SREBP1蛋白相对表达水平

图5 各组VSMC细胞SREBP1蛋白免疫印迹条带
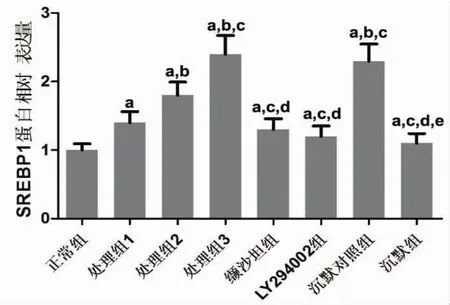
图6 各组VSMC细胞SREBP1蛋白相对表达水平
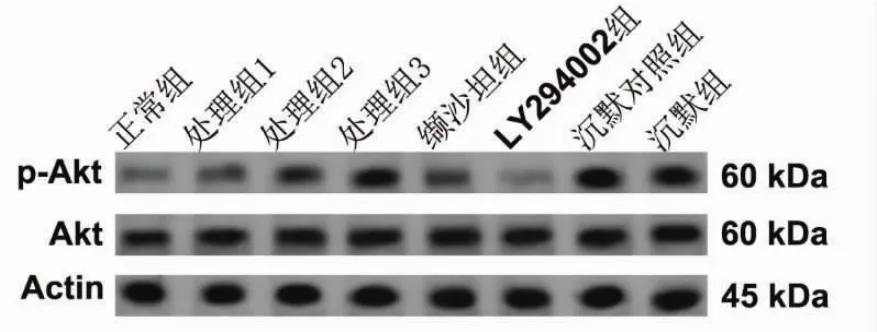
图7 各组VSMC细胞磷酸化Akt和Akt蛋白免疫印迹条带
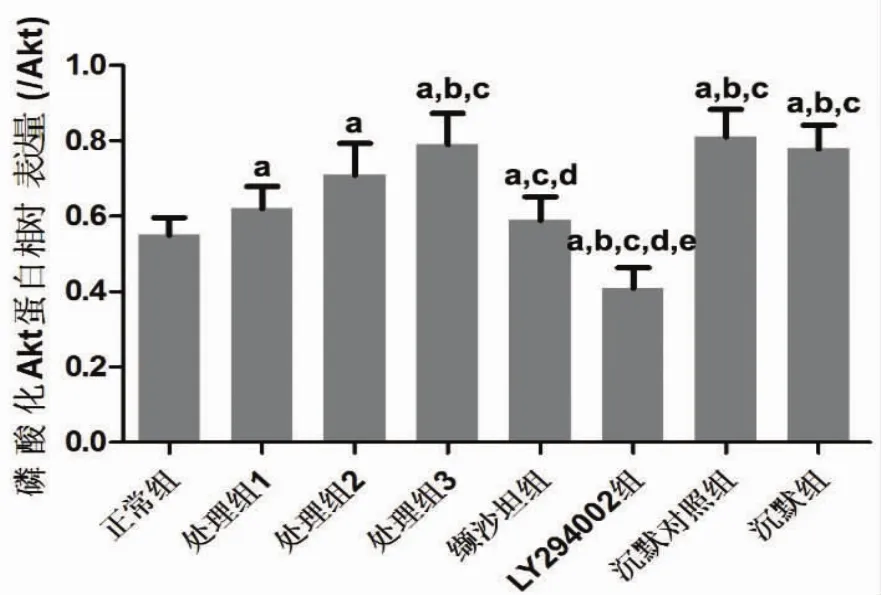
图8 各组VSMC细胞磷酸化Akt相对表达水平

图9 各组VSMC细胞α-SMA和OPN蛋白免疫印迹条带

图10 各组VSMC细胞α-SMA和OPN蛋白相对表达水平
[1]Laurent S,Boutouyrie P.The structural factor of hypertension:large and small artery alterations.Circ Res,2015,116:1007-1021.
[2]Wang X,Bots ML,Yang F,et al.Prevalence of hypertension in China:a systematic review and meta-regression analysis of trends and regionaldifferences.JHypertens,2014,32:1919-1927;discussion 1927.
[3]Castro MM,Tanus-Santos JE.Inhibition of matrix metalloproteinases(MMPs) as a potential strategy to ameliorate hypertension-induced cardiovascularalterations.CurrDrugTargets,2013,14:335-343.
[4]Belo VA,Guimaraes DA,Castro MM.Matrix Metalloproteinase 2 as a Potential Mediator of Vascular Smooth Muscle Cell Migration and Chronic Vascular Remodeling in Hypertension.J Vasc Res,2015,52:221-231.
[5]马维红,赵娜,苏赢,等.牛蒡根水提物对高血压大鼠血管重塑的影响.中草药,2015,46:1954-1957.
[6]Guo D,Bell EH,Mischel P,et al.Targeting SREBP-1-driven lipid metabolism to treat cancer.Curr Pharm Des,2014,20:2619-2626.
[7]Yuan HY,Kuang SY,Zheng X,et al.Curcumin inhibits cellular cholesterolaccumulation by regulating SREBP-1/caveolin-1 signaling pathway in vascular smooth muscle cells.Acta Pharmacol Sin,2008,29:555-563.
[8]Vengrenyuk Y,Nishi H,Long X,et al.Cholesterol loading reprograms the microRNA-143/145-myocardin axis to convert aortic smooth muscle cells to a dysfunctional macrophage-like phenotype.Arterioscler Thromb Vasc Biol,2015,35:535-546.
[9]Van Twist DJ,Kroon AA,De Leeuw PW.Angiotensin-(1-7)as a strategy in the treatment of hypertension?Curr Opin Nephrol Hypertens,2014,23:480-486.
[10]李洋,张艳,闫承慧,等.血管紧张素Ⅱ诱导的小鼠高血压血管重塑模型的建立.中华高血压杂志,2016,24:428-434.
[11]Sun Y,He W,Luo M,et al.SREBP1 regulates tumorigenesis and prognosisofpancreatic cancerthrough targeting lipid metabolism.Tumour Biol,2015,36:4133-4141.
[12]Li W,Tai Y,Zhou J,et al.Repression of endometrial tumor growth bytargetingSREBP1 and lipogenesis.CellCycle,2012,11:2348-2358.
[13]Chakraborty PK,Xiong X,Mustafi SB,et al.Role of cystathionine beta synthase in lipid metabolism in ovarian cancer.Oncotarget,2015,6:37367-37384.
[14]Kudryavtseva O,Aalkjaer C,Matchkov VV.Vascular smooth muscle cell phenotype is defined by Ca2+-dependent transcription factors.FEBS J,2013,280:5488-5499.
[15]Wang TN, ChenX, LiR, etal.SREBP-1Mediates AngiotensinⅡ-InducedTGF-beta1Upregulationand Glomerular Fibrosis.J Am Soc Nephrol,2015,26:1839-1854.
