异基因造血干细胞移植受者CYP3A4及CYP3A5基因多态性对他克莫司血药浓度及疗效的影响
2018-02-06江佳刘俊汪琳徐文科汪魏平栾家杰
江佳,刘俊,汪琳,徐文科,汪魏平,栾家杰
(皖南医学院弋矶山医院药剂科,安徽芜湖 241001)
血液病发病率逐年升高,使之成为常见病、多发病,严重危害人类健康。异基因造血干细胞移植(allo-HSCT)术虽然是目前治愈恶性血液病的最有效手段,但术后重度急性移植物抗宿主病(GVHD)或慢性广泛型GVHD的发生皆可能会导致受者的死亡。因此,受者在移植后需要接受免疫抑制治疗[1],他克莫司(Tac)是 allo-HSCT患者常用的免疫抑制剂之一。随着基因组学的发展,发现细胞色素P450 3A(CYP3A)酶系中的 CYP3A4*18B及CYP3A5*3位点的多态性是影响Tac血药浓度的重要因素,根据不同基因型指导首次给药剂量及应用效果的预判研究引起了临床相关人员的关注[2]。本文将对采用Tac+吗替麦考酚酯+泼尼松免疫抑制方案的allo-HSCT受者进行基因分型,并对不同基因型受者采用该免疫抑制方案后Tac的血药浓度/剂量比、基因突变率等进行观察研究,以便为该类患者合理应用免疫抑制方案提供依据。
1 资料与方法
1.1 一般资料 纳入标准:选择首次接受allo-HSCT术的受者为研究对象,受者年龄≥18岁,汉族人;术后接受Tac+吗替麦考酚酯+泼尼松三联免疫抑制治疗方案治疗>14 d;连续监测(每周两次)血药浓度均在治疗窗内。排除标准:排除术前肝肾功能异常(血清转氨酶大于正常值3倍或胆红素大于正常值2倍,血清肌酐值≥200μmol·L-1)、合并使用肾毒性药物(如两性霉素B、氨基糖苷类抗生素等)及给药前2周内服用CYP3A酶诱导剂或抑制剂(如利福平、大环内酯类药物等)的受者,术后死亡的受者。
1.2 相关给药方案及项目技术路线 记录受者基本信息,包括Tac血药浓度、性别、年龄、体质量、身高、肝肾功能、合并用药、疾病状态等。共有16例受者符合入组标准。男、女各8例,原发病皆为急性白血病,年龄21~56岁,中位年龄43岁,体质量38~68 kg,平均55.4 kg。均为allo-HSCT术后。术后均采用Tac+吗替麦考酚酯+泼尼松三联免疫抑制治疗方案。Tac起始剂量 0.15 mg·kg-1·d-1,分早晚两次使用。以后剂量根据血药浓度调整,术后1个月维持血清药物谷浓度在6~10μg·L-1,之后维持5~8μg·L-1。吗替麦考酚酯用量均为早0.75 g,中0.5 g,晚0.5 g。术后常规予以甲泼尼龙琥珀酸钠6 mg·d-1静滴,连续3 d,于第4天改为泼尼松片2 mg·kg-1·d-1使用,以后每晚减量0.2 mg·kg-1连续5 d,完成5晚减量后,开始晨药连续5 d减量,每早减量0.2 mg·kg-1,减量至15 mg·d-1后开始交替减量,以 5 mg·d-1量减少至 5 mg·d-1维持。根据 CYP3A4、CYP3A5的基因型将受者分组。详细技术路线见图1。
1.3 样本采集与处理 Tac血药浓度测定周期为受者移植后1周至半年。期间进行临床评估包括Tac的日剂量D、谷浓度C0、体质量等,计算浓度剂量比。受者第7天给晨药前抽2 mL静脉血加入EDTA抗凝采血管,处理后采用Viva-E全自动生化分析仪进行Tac全血浓度监测。
DNA提取及CYP3A4、CYP3A5基因多态性分析:空腹状态下EDTA抗凝管采血2 mL。采取改良后的NH4CL提取DNA法提取白细胞中的DNA并采用原位杂交荧光染色脱氧核糖核酸测序技术检测CYP3A4、CYP3A5基因型。
1.4 统计学方法 采用SPSS11.5进行统计软件进行各项分析。计量资料以x±s表示,计数资料以频数表示。不同组别间计量资料的比较进行t检验或单因素方差分析,研究对象Hardy-Weinberg遗传平衡的符合程度、组间基因型及等位基因频率的比较进行χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 受者疾病类型及移植方式 见表1。

图1 技术路线
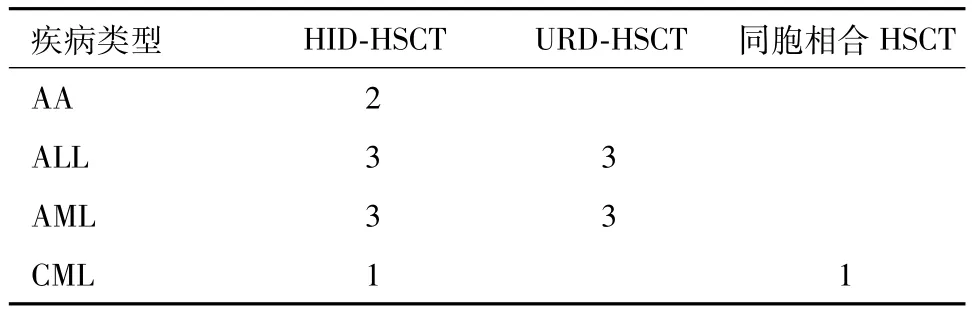
表1 受者疾病类型及移植方式/例
2.2 受者进行移植术前预处理方案 见表2。
2.3 CYP3A4*18B和CYP3A5*3基因型分布16例受者CYP3A4*18B、CYP3A5*3突变等位基因发生的频率分别是25%和75%(P<0.05),见表3。Hardy-Weinberg检验分析结果显示,各基因频率达到遗传平衡,研究资料具有群体代表性。
2.4 CYP3A4和CYP3A5基因型联合效应对受者Tac浓度/剂量的影响 根据受者基因型结果,将其分为4组(表4),对移植后7、15、30 d的Tac血药浓度/剂量进行比较后发现,CYP3A5纯合突变型受者中,CYP3A4野生纯合型者的浓度剂量比高于CYP3A4突变型。CYP3A5野生纯合型或突变杂合型的浓度剂量比为:CYP3A4野生纯合型>CYP3A4突变型。
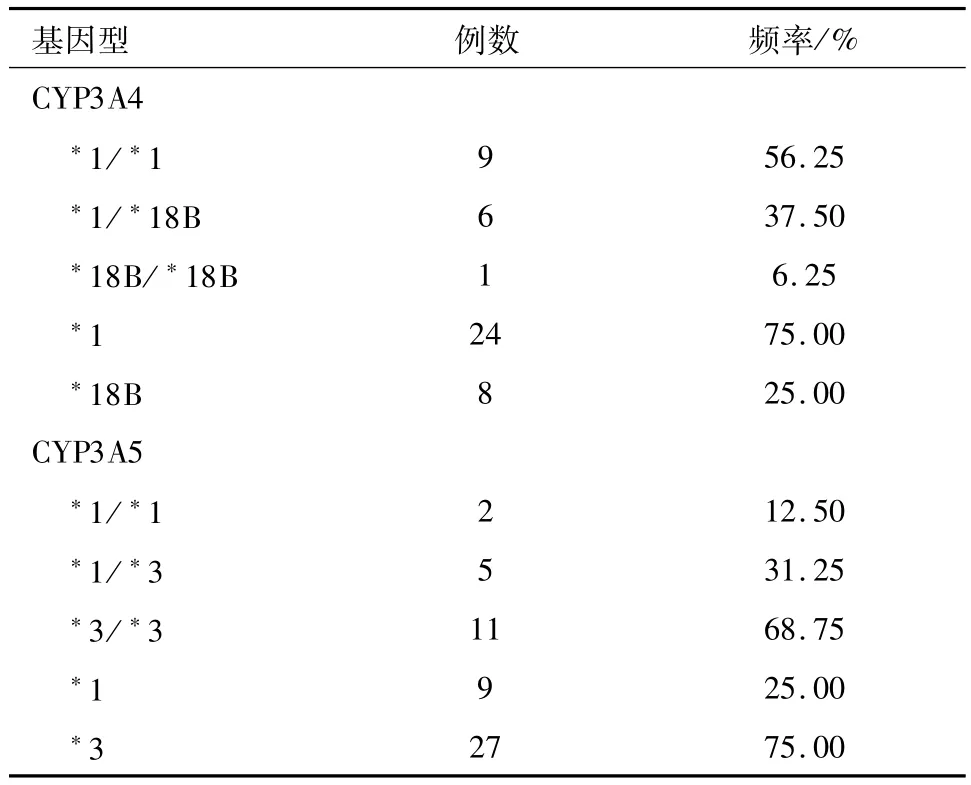
表3 CYP3A4*18B、CYP3A5*3基因型及等位基因突变频率

表2 移植前预处理方案

表4 CYP3A4*18B、CYP3A5*3对受者Tac C0/D的影响/x±s
3 讨论
Tac在体内主要经过 CYP3A4和 CYP3A5代谢,分别受到CYP3A4和CYP3A5基因多态性调控。CYP3A5*3是导致CYP3A5酶的缺失或活性低表达最常见的基因型,其在中国肾移植患者中突变频率高达75.4%。当CYP3A5*3为*1/*1或*1/*3型时,该酶表型为快代谢型;*3/*3型时,该酶表型为慢代谢型。快代谢型比慢代谢型对于Tac清除率高25%~40%。而CYP3A4*18B位点的突变却能增加CYP3A4的表达且其在亚洲人群的突变频率也较高[3-7]。目前关于CYP3A4和CYP3A5的研究主要集中在肝肾移植,有研究表明[8],超过70%的肝肾移植患者通过基因分型优化治疗方案而受益,但在异基因造血干细胞移植术中实施并通过基因多态性检测以及血药浓度监测相结合的模式进行调节的免疫抑制方案国内外还少有报道。因此本项目联合分析了CYP3A4*18B和CYP3A5*3在16例allo-HSCT术受者中的分布特征。
研究发现两者突变频率与现有报道[9-10]基本一致,说明纳入排除标准合理且研究对象具代表性。同时,本项目也对多位点多态性联合药物影响进行了研究。由于CYP3A4*1/*1是其活性较低时的基因型而CYP3A5*3/*3则是其活性完全丧失时的基因型,因此,理论上该基因型受者使用较低剂量的Tac即可达到目标需要浓度,而CYP3A4*18B/*18B携带受者较*1/*1而言则需要较高剂量来保证目标浓度。本研究中CYP3A5基因多态性与药物浓度确实存在上述相关性,由于样本纳入例数有限,只能验证CYP3A4部分基因型与C0/D的关系,但仍然可以观察到CYP3A4对TAC药代动力学的显著影响,这也为后期该项目的继续深入研究奠定了一定的基础。
综上所述,CYP3A5*3突变等位基因发生的频率在汉族人群较高,通过术前对将接受allo-HSCT术受者进行基因预测可以很好的为首次TAC的剂量提供较为个体化的建议,对患者的用药安全性,有效性及预后都具有重要的意义。本研究的开展也为药物剂量的优化提供了依据。
[1] PRZEPIORKA D,NASH RA,WINGARD JR,et al.Relationship of tacrolimus whole blood levels to efficacy and safety outcomes after unrelated donor marrow transplantation[J].Biol Blood Marrow Transplant,1999,5(2):94-97.
[2] 陈有娥.CYP3A4,CYP3A5,MDR1基因多态性与他克莫司个体间差异相关性的研究进展[J].中国医药指南,2013,11(14):71-73.
[3] SHI XJ,GENG F,JIAO Z,et al.Association of ABCB1,CYP3A4*18B and CYP3A5*3 genotypes with the pharmacokinetics of tacrolimus in healthy Chinese subjects:a population pharmacokinetic analysis[J].J Clin Pharm Ther,2011,36(5):614-624.
[4] HOU MM,HOUY,SONGH,et al.Effectsof CYP3A4 genetic polymorphism on the efficacy and adverse reaction of tacrolimus in patients with renal transplantion[J].J China Pharm,2010,21:2427-2429.
[5] UTECHT KN,HILESJJ,KOLESAR J.Effects of genetic polymorphisms on the pharmacokinetics of calcineurin inhibitors[J].Am J Health Syst Pharm,2006,63(23):2340-2348.
[6] IKEMURA K,URANO K,MATSUDA H,et al.Decreased oral absorption of cyclosporine A after liver transplantation[J].Transplantation,2002,73(11):1824-1828.
[7] YAMAUCHI A,DOHGU S,TAKATA F,et al.Partial hepatectomy aggravates cyclosporin A-induced neurotoxicity by lowering the function of the blood-brain barrier in mice[J].Life Sci,2011,88(11/12):529-534.
[8] KATSAKIORI PF,PAPAPETROU EP,SAKELLAROPOULOS G C,et al.Factors affecting the long-term response to tacrolimus in renal transplant patients:Pharmacokinetic and pharmacogenetic approach[J].International Journal of Medical Sciences,2010:94-100.
[9] 王化明,胡永芳.基因多态性对器官移植患者FK506药动学的影响[J].中国新药杂志,2009,18(14):1300-1303.
[10] LI D,ZHANG GL,LOU YQ,et al.Genetic polymorphisms in MDR1 and CYP3A5 and MDR1 haplotype in mainland Chinese Han,Uygur and Kazakh ethnic groups[J].J Clin Pharm Ther,2007,32(1):89-95.
