慢性阻塞性肺疾病急性加重期患者外周血中树突状细胞亚群的水平变化及其意义
2018-02-06门翔党强段秋立郑大炜
门翔,党强,段秋立,郑大炜
(郑州大学附属南阳市中心医院呼吸内科,河南南阳 473000)
慢性阻塞性肺疾病(Chronic Obstructive Pulmonary Disease,COPD)是临床常见的慢性气道炎症性疾病之一,其临床特征为不可逆的气流受限,主要表现为反复咳嗽、咳痰、气促、进行性肺功能下降。COPD的发病率很高,病死率居世界第4位[1],慢性阻塞性肺疾病急性加重(AECOPD)是慢阻肺患者死亡的重要因素,也是慢阻肺患者医疗费的主要支出部分。尤其因AECOPD死亡的患者在末次住院期间的医疗费用显著增高,这与生命支持等诊治措施的费用居高不下有关[2],AECOPD对患者的生命质量和社会经济负担产生巨大的负面影响,因此预防及早发现和早治疗AECOPD是临床上重大的医疗任务。目前已有研究表明,COPD患者细胞免疫功能存在显著异常[3],但外周血T细胞亚群和COPD产生、发展可能存在相关性的临床研究资料较少。笔者选取郑州大学附属南阳市中心医院呼吸内科收治的120例AECOPD和60例门诊复查的COPD稳定期(SCOPD)患者作为研究对象,分析其外周血中树突状细胞(DC)亚群的水平变化和AECOPD发展间的相关性。
1 资料与方法
1.1 一般资料 选取郑州大学附属南阳市中心医院呼吸内科收治的120例AECOPD和门诊复查的60例SCOPD患者作为病例组,选取年龄、性别基本与之相匹配的60例健康人群作为对照组。120例AECOPD患者,男性75例、女性45例,年龄58~84岁,平均年龄(69.2±8.5)岁,其中具有吸烟史48例,合并高血压23例、糖尿病9例;慢性阻塞性肺疾病全球倡议(GOLD)Ⅰ组44例、GOLDⅡ组50例、GOLDⅢ~Ⅳ组26例。60例SCOPD患者,男性42例,女性18例,年龄55~82岁,平均(66.7±8.1)岁。60例健康对照者,男性34例、女性26例,年龄55~85岁,平均年龄(66.9±12.0)岁。三组研究对象的年龄构成、性别比例差异无统计学意义(P>0.05)。见表1。

表1 三组研究对象的性别、年龄比较
1.2 纳入排除标准
1.2.1 纳入标准 (1)COPD患者的诊断及分级标准参考2017年GOLD推荐的标准[4]:基于使用支气管扩张剂后的第1秒用力呼气容积(FEV1)值,GOLDⅠ≥80%预计值,50%≤GOLDⅡ<80%预计值,30%≤GOLDⅢ<50%预计值,GOLDⅣ<30%预计值。AECOPD定义为临床过程表现为呼吸系统症状急性加重,尤其是呼吸困难、咳嗽、咳痰加重和出现脓痰。(2)入院后接受肺功能、血生化等常规检查。(3)所有AECOPD患者均在本院完成治疗,对照组来源于本院体检中心抽取的健康体检对象。(4)本研究报请医学伦理委员会的批准,获得研究对象的知情同意。
1.2.2 排除标准[5](1)合并呼吸道肿瘤(肺癌等);(2)各项临床资料不完整的患者;(3)急慢性感染性疾病患者、类风湿性疾病患者。
1.3 血样采集 采集患者外周血标本5 mL,滴入无菌抗凝试管,选择3 200 r·min-1离心10 min,以分离外周血标本,获得上清液,于-70℃条件下冷存备检。
1.4 观察指标及检查方法
1.4.1 观察指标 对比各组研究对象的肺功能指标:FEV1、FEV1/FVC,检测并比较各组研究对象的外周血 C-反应蛋白(CRP)、血沉(ESR)、白细胞计数(WBC)的水平变化;检测并比较各组研究对象外周血DC细胞亚群:CD123+、CD11+、mDCs、pDCs的水平差异。
1.4.2 检测方法 取出血检样本使用PBS冲洗3次,每次30 s,使用FAS-Calibur流式细胞仪(购自美国BD公司)进行检测 DC细胞亚群,后使用CellQuest软件分析各DC细胞亚群检测;免疫散射比浊法测定两组的CRP水平,试剂盒购自德国西门子医学诊断产品有限公司。检测仪器是日本日立公司生产7600-020型全自动生化分析仪。WBC计数及ESR测定用美国贝克曼库尔特LH 750型全自动血液分析仪。检测过程严格按照说明书进行。
1.5 统计学方法 数据分析及统计在专业软件SAS9.0软件包中处理,计量指标采用x±s表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验;相关性分析采用Pearson分析法;P<0.05表示差异有统计学意义。
2 结果
2.1 各组肺功能指标比较 AECOPD患者中GOLDⅠ组、GOLDⅡ组、GOLDⅢ~Ⅳ组及SCOPD组的FEV1、FEV1/FVC(%)值均小于对照组,均差异有统计学意义(P<0.05),SCOPD组及AECOPD患者的 FEV1、FEV1/FVC(%)值比较发现:SCOPD组>GOLDⅠ组>GOLDⅡ组>GOLDⅢ~Ⅳ组,均差异有统计学意义(P<0.05)。见表2。
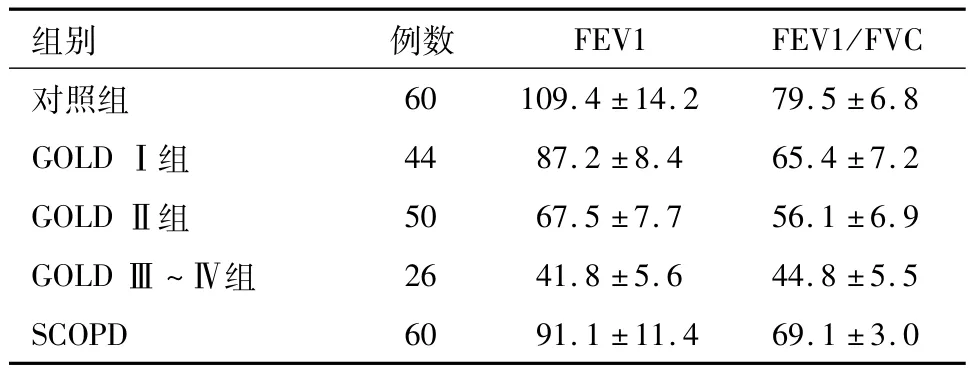
表2 各组肺功能指标比较/(%,x±s)
2.2 各组炎症相关指标比较 AECOPD患者中GOLDⅠ组、GOLDⅡ组、GOLDⅢ~Ⅳ组的CRP、ESR、WBC值均大于SCOPD组及对照组,均差异有统计学意义(P<0.05),AECOPD患者的 CRP、ESR、WBC值比较发现GOLDⅠ组<GOLDⅡ组<GOLDⅢ~Ⅳ组,均差异有统计学意义(P<0.05)。见表3。
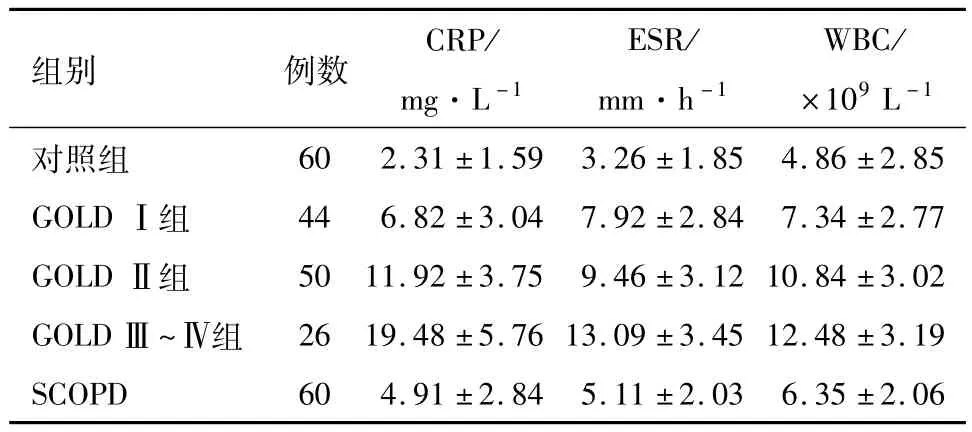
表3 各组炎症相关指标比较/x±s
2.3 各组DC细胞亚群测定 AECOPD患者中GOLDⅠ组、GOLDⅡ组、GOLDⅢ~Ⅳ组及SCOPD组的 mDCs、pDCs细胞比例均大于对照组、CD123+、CD11+细胞比例小于对照组,均差异有统计学意义(P<0.05),AECOPD患者的 mDCs、pDCs细胞比例比较发现GOLDⅠ组<GOLDⅡ组<GOLDⅢ~Ⅳ组,CD123+、CD11+细胞比例组间比较为GOLDⅠ组>GOLDⅡ组>GOLDⅢ~Ⅳ组,均差异有统计学意义(P<0.05)。见表4。
2.4 病例组患者FEV1水平与DC细胞亚群的相关性分析 AECOPD患者的FEV1%值与mDCs、pDCs细胞比例值呈显著负相关(r=-0.339,-0.284);AECOPD患者FEV1%值与CD123+、CD11+细胞比例值呈显著正相关(r=0.269,0.302)。见表5。
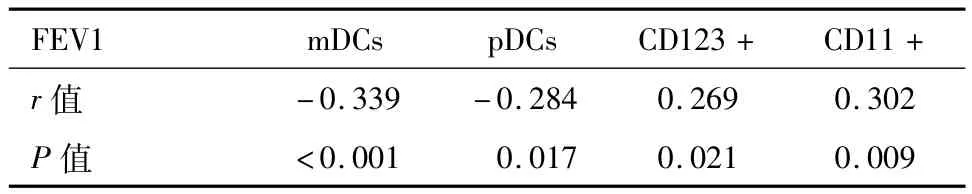
表5 AECOPD患者FEV1水平与DC细胞亚群的相关性分析/x±s
3 讨论
在呼吸内科临床中,COPD属于常见、高发型呼吸系统炎症,其病程发展具有进行性、逐步性及阶跃性的特点[6],患者中气道的炎性反应是最为明显,且可进一步恶化为高反应性急性气道炎症[7]。AECOPD患者常合并严重肺部炎症,可导致其出现全身性、系统性呼吸障碍等不良反应[8],且可致机体呈现级联式的病症表现,能够累及心脏和心血管,形成中、重度心血管疾病,严重者会出现急性呼吸衰竭,致临床急救难度较高,故AECOPD具有难预防、难治疗、病死率高等特点,为呼吸内科临床中主要顽疾之一。在本研究中,AECOPD患者中GOLDⅠ组、GOLDⅡ组、GOLDⅢ~Ⅳ组的FEV1、FEV1/FVC值均小于对照组,均差异有统计学意义(P<0.05),而AECOPD患者中,GOLDⅠ组患者的FEV1、FEV1/FVC(%)值最高,其次为 GOLDⅡ组,最低为GOLDⅢ~Ⅳ组,均差异有统计学意义(P<0.05);这表明AECOPD可诱发不同程度的呼吸功能障碍甚至衰竭,其原因可能为患者肺部合并感染和(或)炎症相关。
相关文献报道称AECOPD患者合并肺部感染概率较高,并可显著增加其呼吸道和肺实质的炎性反应,这是因为COPD合并肺部感染概率较高,约为35.5%[9],而肺部感染还可进一步导致肺功能下降,加重肺损伤程度;同时COPD属于慢性病,使得其对肺部组织侵害处于不断发展的状态,当该病患者出现突发性炎症激发反应即进入AECOPD病发期时,其免疫功能较正常水平呈现显著降低,外周血内各T淋巴细胞亚群均明显减少。有研究显示[10],即使AECOPD患者病情趋于缓解和稳定时,其机体防御和免疫系统也会出现异常性障碍,导致其肺及呼吸道易被病菌侵袭感染。本研究表明,AECOPD患者中 GOLDⅠ组、GOLDⅡ组、GOLDⅢ~Ⅳ组的CRP、ESR、WBC值均大于对照组(P<0.05),因此,我们认为固有及获得性免疫异常 T淋巴细胞和COPD炎症产生及发展、急性程度间具有相关性;AECOPD患者中,GOLDⅠ组的 CRP、ESR、WBC值最低,其次为 GOLDⅡ组,最高为 GOLDⅢ~Ⅳ组,均差异有统计学意义(P<0.05);这表明患者炎症程度越重,其血清内相关炎性因子指标表达越高,清晰证明AECOPD患者机体具有不同程度免疫系统功能缺陷,导致正常的抗炎、清除细菌的免疫应答不能有效发挥。
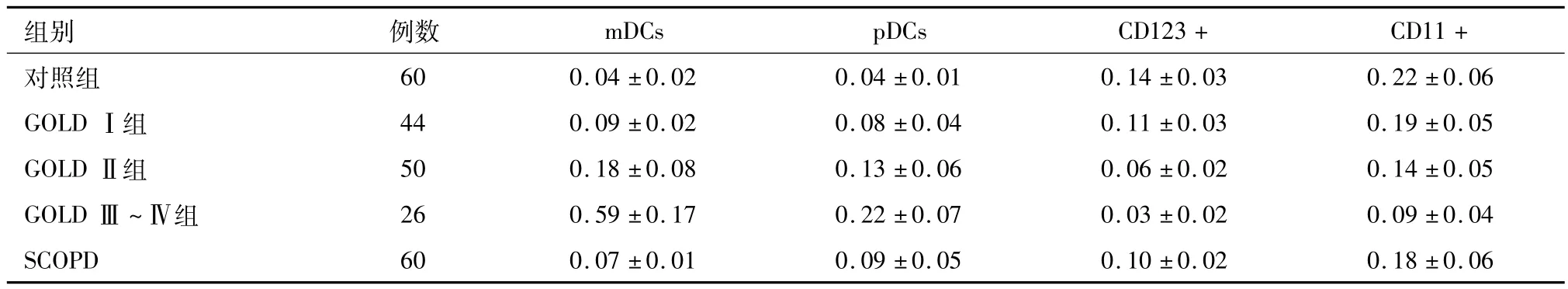
表4 各组DC细胞亚群测定/(%,x±s)
DC能够增强初始性T细胞的抗原活性,并诱导该类T细胞复制及增殖,提高细胞免疫应答效能,同时介导细胞毒性和辅助性两类T淋巴细胞数量上升,促使他们参与人整体免疫系统答应。研究显示,根据DC细胞来源,可将其分为外源性髓样DC与内源性浆细胞样DC,而它们均可增强COPD患者肺组织内T淋巴细胞活性[11],并调节和介导B细胞功能发挥。其作用机制为外源性抗原需激活DC生理功能,并将其传导给CD8+;内源性抗原加工DC后,促使其和T细胞膜表面相互结合,通过黏附素辅助传导给CD4+。从某种意义上,在人体免疫系统激活体系中,DC属于启动因子,并对COPD产生和发展过程具有显著的影响作用,而通过测定外周血内DC数量能够有效评估患者免疫现状态[12-13],为临床预防 AECOPD及治疗 COPD、AECOPD提供高价值的指导。本研究中,AECOPD患者的mDCs、pDCs细胞比例均大于对照组,CD123+、CD11+细胞比例小于对照组(P<0.05),同时AECOPD患者的 mDCs、pDCs细胞比例比较发现,GOLDⅠ组最低,Ⅱ组其次,Ⅲ~Ⅳ组最高,相应的CD123+、CD11+细胞比例组间比较为GOLDⅠ组最高,GOLDⅡ组其次,GOLDⅢ~Ⅳ组最低,均差异有统计学意义(P<0.05);结果证明AECOPD患者机体内DC亚群表达异常,导致免疫答应功能障碍,而患者炎症程度越重,其DC亚群表达异常越明显,稳定期患者的异常程度明显低于急性加重期,本研究中,AECOPD患者的FEV1值与mDCs、pDCs细胞比例值呈显著的负相关、与CD123+、CD11+细胞比例值呈显著的正相关,表明AECOPD患者肺功能障碍或呼吸衰竭和DC亚群间具有显著相关性,其原因可能为相关炎性细胞活性上升或表达异常,从而导致人体免疫功能障碍,造成肺和呼吸道损伤或出现炎性反应。
综上所述,AECOPD患者外周血内DC细胞亚群水平可呈现显著改变,能够导致患者炎症产生、发展,并和炎症严重程度具有明显相关性,这表明DC细胞亚群与患者炎性反应过程有关,为我们临床预防和治疗AECOPD提供有效指导。
[1] RABE KF,HURDS,ANZUETOA,et al.Global initiative for chronic obstructivelungdisease:global strategy for the diagnosis,management and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2007,176:532-555.
[2] 朱敏立,蔡柏蔷.慢性阻塞性肺疾病急性加重与肺癌患者的终末期住院费用[J].中华结核和呼吸杂志,2009,32(4):258-261.
[3] 郭旭琼.降钙素原、C-反应蛋白在慢性阻塞性肺疾病急性加重期的应用价值[D].大连:大连医科大学,2014.
[4] 慢性阻塞性肺疾(COPD)诊断、处理与预防袖珍指南2017版[OL].慢性阻塞性肺疾病全球倡议官网,2016.
[5] 杨声灼,朱光升,白燕群.胸腺肽α1在改善慢阻肺并肺曲霉菌病患者预后的作用[J].浙江临床医学,2015,17(5):776-777.
[6] SINGH VK,PATRICIA GEORGE M,GRIESCJ.Pulmonary hypertension is associated with increased post-lung transplant mortality risk in patients with chronic obstructive pulmonary disease[J].J Heart Lung Transplant,2015,34(3):424-429.
[7] 丁宏辉,刘时憧.结核感染T细胞斑点试验在老年人慢性阻塞性肺疾病合并肺结核诊断中的应用[J].中国基层医药,2015,22(10):1505-1507.
[8] 王文秀,邵玉霞.哮喘-慢性阻塞性肺疾病重叠综合征诊疗研究进展[J].疑难病杂志,2015,14(7):759-762.
[9] 章颖妹,徐晓玲.Treg在慢性阻塞性肺疾病中的研究新进展[J].临床肺科杂志,2015,20(5):919-921.
[10]姜克家,潘华琴,秦少云,等.AECOPD外周血CD3+、CD4+、CD8+及CD16+56+细胞表达变化及胸腺五肽的干预作用[J].国际呼吸杂志,2014,34(19):1476-1478.
[11]钟萍,黄成亮,范贤明.NF-κB与慢性阻塞性肺疾病合并营养不良的研究进展[J].临床肺科杂志,2015,20(4):711-713.
[12]廖茜.TNF-α、sTREM-1、IL-6、PCT在慢性阻塞性肺疾病伴肺炎诊断中的应用[J].临床肺科杂志,2015,20(3):530-532,535.
[13]HE ZH,CHEN P,CHEN Y,et al.Comparison between cigarette smoke-induced emphysema and cigarette smoke extract-induced emphysema[J].Tob Induc Dis,2015,13(1):6.
