视频脑电图联合弥散张量成像诊断和定位MRI阴性的颞叶局灶性皮质发育不良
2018-02-05郭韬,郭非
郭 韬,郭 非
1河北省人民医院功能神经外科,河北 石家庄 050051;2河北医科大学第二医院康复科,河北 石家庄 050000
局灶性皮质发育不良(FCD)是颞叶癫痫常见病因,而手术是治疗颞叶癫痫有效的方法,FCD的诊断和定位对于手术治疗颞叶癫痫具有重要意义[1]。而部分颞叶FCD因形态结构改变细微、常规影像学表现阴性,识别较困难。病理确诊的颞叶FCD,不到50%的患者术前MRI检查能够确诊[2-4],这令手术治疗难以施行。目前对MRI阴性而又怀疑颞叶FCD的患者多采用颅内电极埋藏的方法确定手术范围,创伤大,花费高,患者难以接受。寻找无创技术对影像学表现为阴性的颞叶FCD的诊断和定位尤显重要。
我科自2008年3月~2009年6月应用视频脑电图联合弥散张量成像(DTI)诊断和定位影像学表现阴性的颞叶FCD癫痫患者38例,取得满意疗效,并经手术、病理证实,现报告如下。
1 资料与方法
1.1 一般资料
选择2008年3月~2009年6月期间,影像学表现阴性的颞叶癫痫手术治疗后病理诊断为FCD患者38例,男27例,女11例,年龄17~43岁,平均23岁,病史2~31年,平均15.7年。癫痫发作形式:简单部分性发作2例、复杂部分性发作4例、简单部分性继发全面性发作者9例,复杂部分继发全面性发作23例。常规CT、MRI检查无阳性表现。
1.2 视频脑电图记录
应用奥地利EMS Phoenix视频脑电监测系统检查。视病人情况嘱其减药或停药,按国际10/20系统安放电极,盘状电极用火棉胶固定,采用32导联+蝶骨电极,描记清醒、睡眠脑电并进行剥夺睡眠及过度换气等诱发试验。监测时间12~148 h,捕捉发作期脑电1~5次,由神经电生理专业人员进行描记与分析。
1.3 联合弥散张量成像及表观弥散系数值(ADC)和部分各向异性(FA)值的测量
MRI采用Siemens Trio 3.0T MR扫描仪。将采集到的DTI原始数据经工作站提供的DTI分析软件包进行分析,产生ADC、FA图。各参数图进行图像配准,配合视频脑电图提示的放电灶区域确定为感兴趣区,获取感兴趣区的ADC和FA参数值。选择对侧半球对称部位为参考区,获取相应的数据信息。
1.4 统计分析
采用SPSS 10.0统计软件进行数据处理,计量资料以均数±标准差表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 视频脑电图表现
发作间期38例患者均记录到异常放电或阵发异常棘波,颞叶占优势但多个异常灶26例,非颞区局灶异常5例,双侧颞叶者7例。记录到61次临床发作,其中34次在夜间睡眠中,27次在清醒期,发作期视频脑电图主要表现为棘波、尖波和阵发性或节律性的棘波活动,慢波出现较少或没有。
2.2 感兴趣区域与对侧颞叶对照区的ADC和FA
感兴趣区域的ADC值较对侧显著升高,而FA值明显降低,差异有统计学意义(P<0.05,表1)。

表1 感兴趣区域与对侧颞叶对照区ADC和FA值(Mean±SD)
2.3 病理与随访
全部患者依据视频脑电图和DTI确定的FCD位置、范围行手术切除。病理回报为FCDⅠA型11例,ⅠB型13例,ⅠC型10例,ⅡA型4例。本组患者术后随访12~46月,平均17.3月,按Engel’s分级评价,Engel’sⅠa级7例,Ⅰb级13例,Ⅱ 级12例,Ⅲ级6例。
2.4 典型病例
患者女性,17岁,主诉间断性意识障碍伴肢体抽搐11年。病例特点:足月顺产,出生后10月开始抽搐。发作性愣神,发作前恐惧、恶心并伴幻听、咂嘴,头眼右偏之后肢体抽搐,3~5 d/次。久服多种抗癫痫药物,控制效果不佳。神经系统查体未见明显异常。视频脑电图检查提示发作间期、发作期左颞区M1、F7、T3导联大量低中幅尖波、棘慢波、棘波(图1)。MRI T1、T2、Flair序列均未见异常(图2)。结合视频脑电图结果选择左前颞叶为感兴趣区,行DTI检查,提示左颞前部白质纤维较右侧减少(图3),左颞叶FA为0.212,右颞叶对称部位FA为0.289;左颞ADC=1.50,右颞ADC=0.98。综合诊断:症状性癫痫,左颞FCD。完善各项检查,手术切除左前颞叶及左侧海马,病理回报FCDⅠA型(图4)。随访39月,Engel’sⅠa级。
3 讨论

图1 左颞区M1、F7、T3导联大量低中幅尖波、棘慢波、棘波
FCD是因胚胎发育早期神经元的增殖、移行、组织等过程中受到遗传或环境因素影响而发生,具有内在致痫性及范围的局限性[5]。结合文献[6-9]及对我科38例颞叶FCD患者的视频脑电图总结、分析,认为影像学表现阴性的颞叶FCD的视频脑电图有如下特点:(1)棘波出现频率很高;局灶性单棘波或多棘波(2~3个)节律持续或阵发性出现;(2)睡眠与清醒时棘波出现几率差别不大。普遍呈中低波幅,有时甚至极低波幅(<30 mV):(3)棘波灶与病灶有很好的重叠性;阵发性或节律性的棘波活动高度提示FCD;(4)FCDⅡ与FCDⅠ相比,发作间期,病变区域有间断节律性慢波阵发性出现,FCDⅠ慢波出现较少或没有;(5)阵发性或持续性快棘波节律(>10 Hz)与慢棘波节律(<10 Hz)模式均与癫痫源有很好的相关性,同1个病人同一部位可有单棘波、多棘波、小尖波等多种放电形式,而标准的如教科书的棘慢波相对较少出现;(6)与病灶对应区域可记录到持续或间断的慢波,棘波源则往往出现在病灶周围甚至相隔脑回。

图2 MRI T1、T2、Flair序列显示双侧前颞叶皮层、海马、杏仁核均未见异常
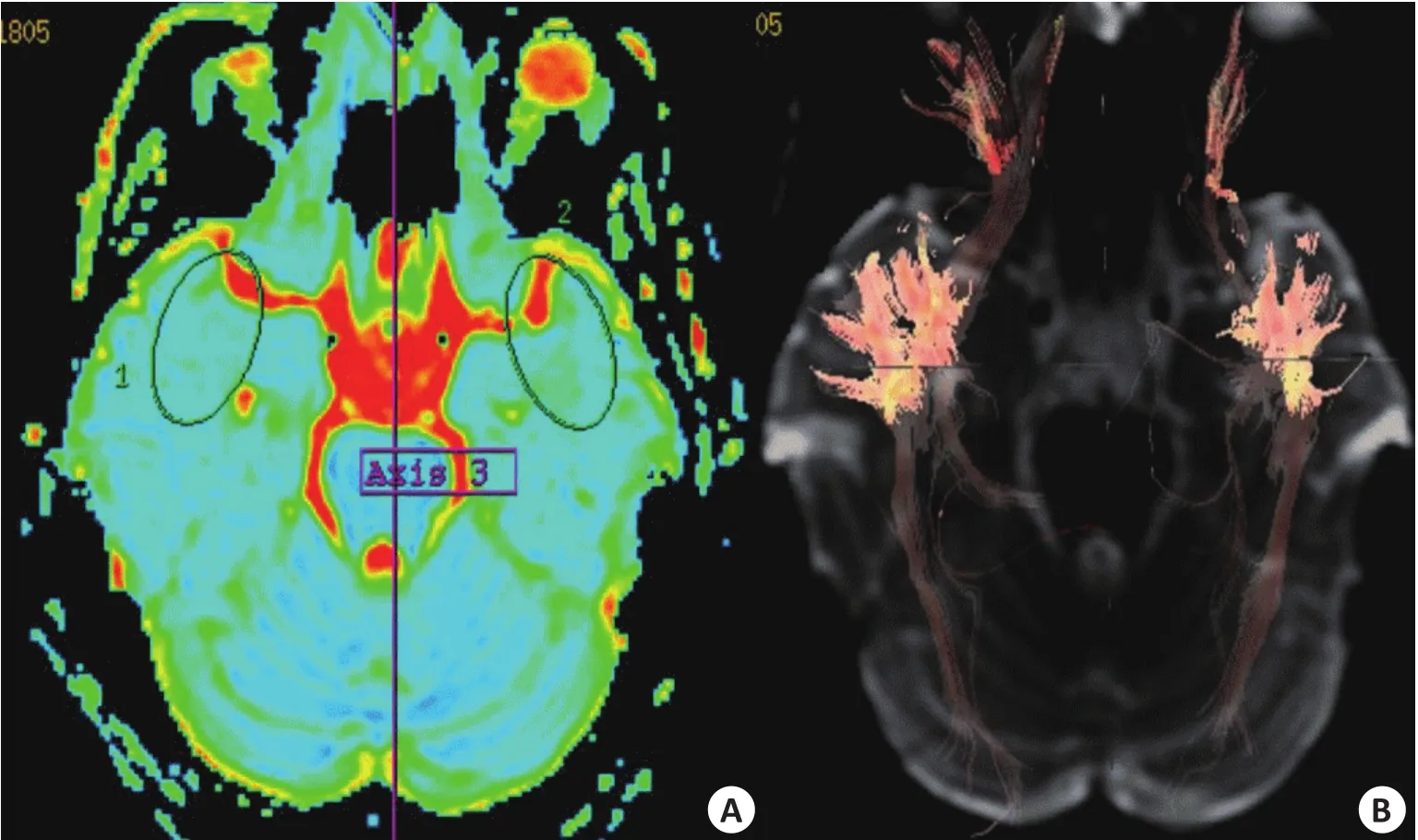
图3 DTI检查

图4 病理回报FCDⅠA型(HE,×100)
根据视频脑电图特点,并结合临床表现可作为初步定性诊断与定位影像学检查阴性颞叶FCD的神经电生理基础。但是,视频脑电图并不能直观显示FCD的确切范围,需要进一步联合DTI检查来印证、补充。本组资料表明,视频脑电图可以根据异常放电区域,确定客观、准确的感兴趣区范围,为DTI检查的精确性提供依据。
DTI是在分子水平上研究组织中水分子随机运动的一种无创性的功能性磁共振成像技术,可以直观显示脑组织神经纤维的分布、密度、走形等多种信息[4]。DTI常用参数为ADC和FA,ADC值反映水分子弥散能力的大小,FA值描述各向异性的程度[10]。FCD侧的ADC值较对侧显著升高,而FA值明显低于对侧,这主要是因为FCD区域神经元丢失、胶质增生,神经元密集度减低,树突减少,使细胞外间隙扩大水分子随机活动增加,令FCD区域ADC值增高[11-14]。FCD区域往往存在髓鞘缺失、轴索膜的通透性升高和轴索排列松散等情况,就使FCD区域部分各向异性的程度下降,出现FA值降低。本组病例的ADC和FA值对比情况的统计学分析结果与文献所述相同,证明应用ADC和FA值诊断FCD客观、准确。有研究对22例患有FCD的癫痫患者行DTI检查[15],结果发现,病变区的ADC值升高、FA值减低,而且DTI显示的异常区域范围明显大于常规MRI,,认为DTI不仅可以对FCD进行定位,而且能够准确地描绘FCD的范围。本组患者术后疗效满意,也证实了DTI能够准确地认定FCD的范围。
与其他学者的研究[16-20]相比,本研究调整了癫痫患者术前评估检查顺序。对既往影像学检查阴性的颞叶癫痫患者首先行长程视频脑电图检查,仔细分析视频脑电图细节特点,与影像科医生充分沟通后,在视频脑电图结果指导下确定感兴趣区,对感兴趣区行0.5 cm无间隔薄层MRI扫描,提高影像阳性发现机率。并对感兴趣区加做DTI序列检查,可增强对影像学检查阴性颞叶FCD的术前定性和定位诊断机会。
综上所述,联合应用视频脑电图和DTI技术安全、无创,可以准确定性、定位影像学检查阴性的FCD,为精确切除致痫灶、提高颞叶癫痫控制率、解除患者病痛提供保障[21],对常规影像学难以确诊的颞叶癫痫的诊断定位具有重要意义。
[1]梁晋川, 周晓平. 局部脑皮层发育不良与癫痫的关系[J]. 立体定向和功能性神经外科杂志, 2009, 22(1): 52-4.
[2]常 亮. 癫痫患者质量调整生命年的研究[J]. 中国全科医学,2013, 16(13): 1506-9.
[3]Blümcke I, Thom M, Aronica E, et al. The clinicopathologic spectrum of focal cortical dysplasias: a consensus classification proposed by an adhoc task force of the ILAE diagnostic methods commission[J]. Epilepsia, 2011, 52(1): 158-74.
[4]蔡立新, 李勇杰, 张国君, 等. 局灶性皮层发育不良癫痫患者头皮脑电图的特点及其定位意义[J]. 临床神经电生理学杂志, 2008,17(1): 20-5.
[5]Reich DS, Smith SA, Jones CK, et al. Quantitative characterization of the corticospinal tract at 3T[J]. Am J Neurorad, 2006, 27(10):2168-78.
[6]Bello L, Cambini A, Castellano A, et al. Motor and language DTI fiber tracking combined with intraoperative subcortical mapping for surgical rmoval of glioma[J]. Neurolmage, 2008, 39(1): 369-82.
[7]李德军, 包尚联, 马 林, 等. 弥散张量成像在中枢神经系统中的应用[J]. 国外医学:生物医学工程分册, 2003, 26(5): 197-202.
[8]Pavlisa G, Rados M, Pavlisa G. et aL the differences of water diffusion between brain tissue infiltrated by tumor and peritumoml vasogenic edema[J]. Clin Imaging, 2009, 33(2): 96-101.
[9]Rugg-Gunn FJ, Eriksson SH, Symms MR, et al. Diifusion tensor imaging in refractory epilepsy[J]. Lancet, 2002, 359(9319): 1748-51.
[10]张 硕, 强金伟, 张康乐. 弥散张量成像对常规性临床应用的初步建立和实现[J]. 中国生物医学工程学报, 2007, 26(5): 796-800.
[11]Keller SS, Richardson MP, Schoene-Bake 1, et al. Thalamotemporal alteration and postoperative seizure in temporal lobeepilepsy[J]. Ann Neural, 2015, 77(5): 760-74.
[12]Gascoigne M, Webster R, Barton B, et al. Accelerated long-term forgetting in children with temporal lobe epilepsy[J]. Neuropsychologia, 2013, 54(3, SI): 93-102.
[13]Stewart CC, Swanson SJ, Sabsevitz DS, et al. Predictors of language lateralization in temporal lobe epilepsy[J].Neuropsychologia, 2014, 60(7): 93-102.
[14]Pope RA, Centeno M, Flügel D, et al. Neural correlates of de novo depression following left temporal lobe epilepsy surgery:A voxel based morphometry study of pre-surgical structural MRI[J].Epilepsy Res, 2014, 108(3): 517-25.
[15]Shurtleff HA, Barry D, Firman T, et al. Impact of epilepsy surgery on development of preschool children: identification of a cohort likely to benefit from early intervention[J]. J Neurosurg Pediatr,2015, 16(4): 383-92.
[16]周 健, 鲍 民, 翟 锋, 等. MRI阴性的颞叶癫痫的外科治疗[J].中华神经外科杂志, 2011, 27(12): 1241-3.
[17]Thom M. Review:hippocampal sclerosis in epilepsy: a neuropathology review[J]. Neuropathol Appl Neurobiol, 2014, 40(5): 520-43.
[18]Haneef Z,Chen DK. Functional neuro-imaging as a pre-surgical tool in epilepsy[J]. Ann Indian Acad Neural, 2014, 17(Suppl 1):S56-64.
[19]高觉民, 李 铭, 胡 静, 等. 颞叶癫痫的显微外科治疗[J]. 临床神经外科杂志, 2014, 11(4): 286-8.
[20]Goellner E, Bianchin MM, Burneo JG, et al. Timing of early and late seizure recurrence after temporal lobe epilepsy surgery[J].Epilepsia, 2013, 54(11): 1933-41.
[21]Schaller K, Cabrilo I. Anterior temporal lobectomy[J]. Acta Neurochir, 2016, 158(1): 161-6.
