慢性阻塞性肺疾病急性加重期患者甲状腺功能研究
2018-02-05胡萍程洋戴丽夏国光张运剑
胡萍,程洋,戴丽,夏国光,张运剑
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的以持续呼吸系统症状和气流受限为特征的可以预防和治疗的疾病,通常与有毒颗粒或气体的显著暴露引起的气道和/或肺泡异常有关[1]。COPD急性加重期(AECOPD)可降低患者的生命质量,增加住院患者的病死率,加重社会经济负担。由于长期慢性低氧、高碳酸血症,AECOPD可以导致全身不良效应,并促进或加重多系统合并症(如心血管疾病、骨骼肌功能障碍、代谢综合征、骨质疏松、抑郁、肺癌等)的发生。目前国内外研究显示COPD患者存在甲状腺激素水平异常[2-3],可以呈现为亚临床甲状腺功能减退(亚临床甲减)、甲状腺功能减退及非甲状腺疾病综合征(non-thyroidal illness syndrome,NTIS),其中,20% COPD稳定期患者和70% AECOPD患者中较常见NTIS[4]。NTIS又称正常甲状腺病态综合征(euthyroid sick syndrome,ESS),是指由于非甲状腺的全身性疾病、手术、禁食引起的甲状腺功能检查上的异常,是由下丘脑-垂体-甲状腺轴、甲状腺素结合血浆蛋白、组织对甲状腺激素的摄取和/或甲状腺激素代谢异常所致。通常表现为三碘甲状腺原氨酸(triiodothyronine,T3)的下降和甲状腺素(thyroxine,T4)的正常或下降,血清促甲状腺激素(thyroid stimulating hormone,TSH)水平通常是正常的,包括低T3综合征、低T4综合征及高T4综合征[5]。然而,AECOPD患者发生NTIS时,是否对垂体-甲状腺轴功能有影响尚存争议。TSH反映垂体-甲状腺轴的功能,在以往大部分研究中,COPD患者检测空腹TSH结果在参考范围内[2-3],但并未考虑到TSH分泌的周期性变化,因此本研究回顾性分析AECOPD患者甲状腺功能的变化,进一步探讨AECOPD对垂体-甲状腺轴功能的影响。
1 对象与方法
1.1 研究对象 选取2014年—2016年北京积水潭医院呼吸内科收治的AECOPD患者214例。纳入标准:(1)符合中华医学会呼吸病学分会制定的COPD诊断标准[6],有COPD病史、症状及影像学表现,吸入支气管舒张剂后第1秒末用力呼气容积占用力肺活量比值(FEV1/FVC)<70%;(2)AECOPD指患者呼吸系统症状出现急性加重,典型表现为呼吸困难、咳嗽、痰量增多和/或痰液呈脓性。排除标准:(1)有基础甲状腺疾病患者;(2)合并支气管哮喘、肺栓塞、肺癌、间质性肺疾病、急性呼吸窘迫综合征等其他呼吸系统疾病的患者;(3)伴有心脏病、内分泌系统疾病、肾脏病及其他系统严重合并症的患者;(4)近3个月应用过影响甲状腺分泌或代谢的药物,如盐酸胺碘酮、胺碘酮、多巴胺等;(5)因合并免疫系统疾病等需长期使用糖皮质激素者;(6)妊娠与哺乳期妇女。另于同期在北京积水潭医院选取接受体检的健康者56例。均无心脑血管疾病、高血压、糖尿病及急性感染性、血栓性、肿瘤性、血液系统疾病,且自愿配合者。本研究经北京积水潭医院伦理委员会审核批准且受试者签署知情同意书。
1.2 研究方法
1.2.1 治疗方法 AECOPD患者住院后均给予规范治疗,若出现其他症状则进行对症治疗。病情好转出院标准参照《慢性阻塞性肺疾病急性加重诊治中国专家共识(2014年修订版)》:(1)患者能够使用长效支气管扩张剂,吸入短效β2-受体激动剂<1次/4 h;(2)患者能够进食,且睡眠不受呼吸困难影响;(3)临床稳定12~24 h;(4)动脉血气分析稳定12~24 h[7]。
1.2.2 甲状腺激素水平检测及评价 分别于对照组体检当天、观察组入院次日和出院前1天的8:00、16:00、24:00抽取空腹静脉血,检测8:00的血清总三碘甲状腺原氨酸(total triiodothyronine,TT3)、总甲状腺素(total thyroxine,TT4)、游离三碘甲状腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(freethyroxine,FT4)水平以及 8:00、16:00、24:00的血清TSH水平。检测仪器为罗氏e601型全自动电化学发光分析仪,试剂均由罗氏公司提供。亚临床甲减诊断标准:血清TSH(参考范围为0.27~4.20 mU/L)水平升高且血清FT3(参考范围为3.10~6.80 pmol/L)、TT4(参考范围为4.40~12.50 nmol/L)水平在参考范围内。NTIS表现为血清T(3参考范围为1.20~3.10 nmol/L)水平下降和血清T4(参考范围为66.00~181.00 nmol/L)水平在参考范围内或下降,血清TSH水平通常在参考范围内,包括低T3综合征、低T4综合征及高T4综合征[5]。
1.3 统计学方法 采用SPSS 18.0统计软件进行数据分析。正态分布的计量资料以(x ±s)表示,组间比较采用两独立样本t检验,连续测量资料比较采用双因素重复测量方差分析;计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 观察组甲状腺功能情况 214例观察组患者甲状腺激素水平异常者168例(78.5%),其中包括亚临床甲减患者10例(6.0%),NTIS患者158例(94.0%)。158例NTIS患者中,低T3综合征119例(75.3%),低T4综合征34例(21.5%),高T4综合征5例(3.2%)。2.2 观察组存活者与对照组一般资料比较 214例AECOPD患者经治疗好转出院188例,死亡26例。观察组存活者与对照组性别、年龄比较,差异无统计学意义(P>0.05,见表1)。
2.3 观察组存活者与对照组血清TT3、TT4、FT3、FT4水平比较 治疗前观察组存活者与对照组血清TT3、TT4、FT3水平比较,差异有统计学意义(P<0.05);血清FT4水平比较,差异无统计学意义(P>0.05)。治疗后观察组存活者与对照组血清TT3、TT4、FT3水平比较,差异有统计学意义(P<0.05);血清FT4水平比较,差异无统计学意义(P>0.05)。治疗后观察组存活者血清TT3、TT4、FT3水平与治疗前比较,差异有统计学意义(P<0.05);血清FT4水平与治疗前比较,差异无统计学意义(P>0.05,见表2)。
2.4 观察组存活者与对照组血清TSH水平比较 治疗前观察组存活者与对照组血清TSH水平比较,差异有统计学意义(P<0.05);不同时间点比较,差异有统计学意义(P<0.05);组别和时间在血清TSH水平上存在交互作用(P<0.05);其中,观察组存活者与对照组24:00血清TSH水平比较,差异有统计学意义(P<0.05)。治疗后观察组存活者与对照组血清TSH水平比较,差异无统计学意义(P>0.05);不同时间点比较,差异有统计学意义(P<0.05);组别和时间在血清TSH水平上存在交互作用(P>0.05);其中观察组存活者24:00血清TSH水平与同期治疗前比较,差异有统计学意义(P<0.05,见表3)。
3 讨论
COPD是一种呼吸系统疾病,伴有多系统合并症。COPD的发病机制尚未完全明确,吸入有害颗粒或气体可引起肺内氧化应激、蛋白酶和抗蛋白酶失衡及肺部炎性反应。COPD进展后期出现低氧血症及高碳酸血症,进一步引起全身不良效应[8]。而严重的气道阻塞、低氧血症、系统性炎性病变以及糖皮质激素的应用均可能引起甲状腺激素水平的降低[9]。NTIS尤其是低T3,可能是COPD多种病理过程的综合体现:(1)长期慢性低氧导致患者下丘脑-垂体-甲状腺轴功能发生紊乱,TSH分泌相对减少,从而影响外周血甲状腺激素的合成与代谢[2];(2)低氧使外周血5'-脱碘酶活性降低,T4向T3转化减少,T3生成减少[10];(3)低氧及二氧化碳潴留,机体应激反应导致神经内分泌系统被激活,

表1 观察组存活者与对照组一般资料比较
表2 观察组存活者与对照组血清TT3、TT4、FT3、FT4水平比较Table 2 Serum thyroid hormone(TT3、TT4、FT3、FT4) levels in the controls versus those in the AECOPD survivors before and after treatment

表2 观察组存活者与对照组血清TT3、TT4、FT3、FT4水平比较Table 2 Serum thyroid hormone(TT3、TT4、FT3、FT4) levels in the controls versus those in the AECOPD survivors before and after treatment
注:与治疗前比较,aP<0.05;TT3=总三碘甲状腺原氨酸,TT4=总甲状腺素,FT3=游离三碘甲状腺原氨酸,FT4=游离甲状腺素;-代表对照组未进行检测
组别 例数 TT3(nmol/L) TT4(nmol/L) FT3(pmol/L) FT4(pmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 56 1.49±0.37 - 103.03±23.19 - 4.06±0.87 - 16.45±2.38 -观察组 188 1.05±0.34 1.38±0.31a 89.35±21.45 95.51±18.40a 3.06±0.81 3.67±0.66a 16.17±2.91 16.47±2.31 t值 8.60 2.07 4.40 2.42 7.67 3.10 0.70 0.06 P值 <0.001 0.039 <0.001 0.016 <0.001 0.008 0.485 0.951
Table 1 Demographic data of the AECOPD survivors and the controls儿茶酚胺、糖皮质激素、皮质醇的合成和分泌增加,抑制了TSH释放,同时抑制外周血T4向T3转化,T3生成减少[5,11];(4)低氧易引起胃肠道淤血及黏膜水肿,致使肠道对碘的吸收减少。而严重低氧常伴有心功能不全,肾血流减少,肾小管重吸收碘减少。应用利尿剂后导致尿碘增加,也会加重缺碘,从而导致TT3、TT4减少[3];(5)感染及低氧等应激状态可引起甲状腺激素结合球蛋白水平降低,影响甲状腺激素与甲状腺结合蛋白结合,使TT3水平下降[10];(6)COPD患者在肺部感染时可以出现炎性因子如白介素6(IL-6)、白介素1(IL-1)及肿瘤坏死因子-α(TNF-α)水平的增加[4]。这些细胞因子可以抑制TSH、T3和甲状腺过氧化物酶的合成或分泌,并且抑制T4脱碘成为T3,从而降低血清T3、T4的水平;(7)低氧、酸中毒、心肌损害等应激状态,使T3在组织中利用增加,血清中T3减少[3];(8)氧化应激的增加会破坏脱碘酶需要的细胞内环境[12],进而参与NTIS的发生,VIDART等[13]一项随机多中心临床研究发现应用抗氧化治疗可改善甲状腺激素水平,进一步证实氧化应激参与NTIS的发生;(9)有研究发现血清T4水平与口服泼尼松的剂量呈负相关[14],而COPD急性加重时多应用全身激素。糖皮质激素可能通过减少血清TSH、减少T4和T3的血管和组织重新分布以及减少外周血T4到T3的转换来降低循环中的甲状腺激素水平[15]。
表3 观察组存活者与对照组TSH水平比较(,mU/L)Table 3 TSH levels in the controls versus those in the AECOPD survivors before and after treatment
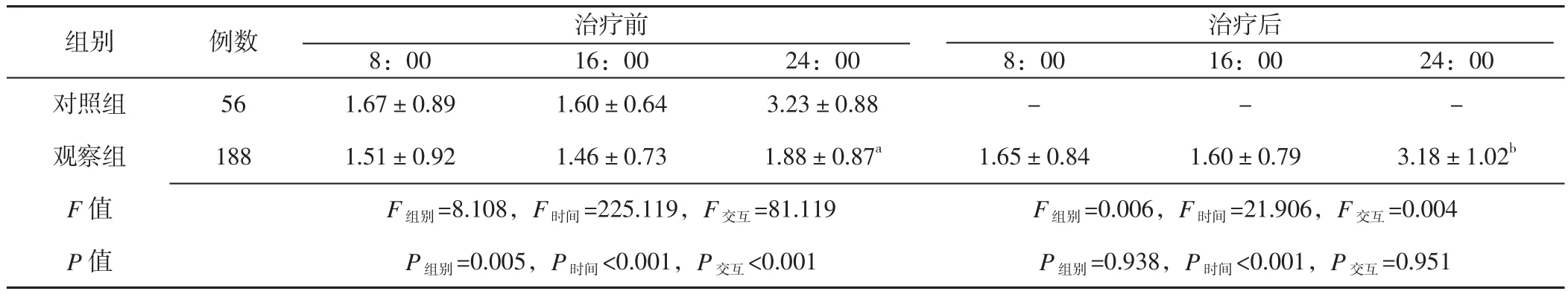
表3 观察组存活者与对照组TSH水平比较(,mU/L)Table 3 TSH levels in the controls versus those in the AECOPD survivors before and after treatment
注:与对照组比较,aP<0.05;与观察组同期比较,bP<0.05;-代表对照组未进行检测
组别 例数 治疗前治疗后8:00 16:00 24:00 8:00 16:00 24:00对照组 56 1.67±0.89 1.60±0.64 3.23±0.88 - - -观察组 188 1.51±0.92 1.46±0.73 1.88±0.87a 1.65±0.84 1.60±0.79 3.18±1.02b F值 F组别=8.108,F时间=225.119,F交互=81.119 F组别=0.006,F时间=21.906,F交互=0.004 P值 P组别=0.005,P时间<0.001,P交互<0.001 P组别=0.938,P时间<0.001,P交互=0.951
本研究发现,观察组中甲状腺激素水平异常者高达78.5%,其中NTIS为94.0%。而在NTIS患者中,以低T3综合征最为多见,为75.3%,这与国外报道是一致的[4]。甲状腺激素在调节新陈代谢中起到重要作用。甲状腺激素水平降低可以引起肺泡换气不足、肺容积减少、上气道梗阻、呼吸兴奋性降低以及呼吸衰竭。而高碳酸血症合并低甲状腺素水平的患者会出现低氧和通气下降[3],并且可以出现膈肌功能障碍,呼吸肌力量与甲状腺激素水平呈线性相关[8]。这使COPD患者的呼吸功能进一步下降。
健康成年人血清TSH与其他内分泌激素的分泌一样具有昼夜节律和脉冲分泌的特征[16]。血清TSH水平自20:00开始升高,约2 h后达高峰,持续约4 h(22:00~2:00),于次日8:00开始下降,17:00~20:00达低谷。目前国外研究证实TSH呈脉冲式分泌[17],24 h平均TSH释放的脉冲次数为6~12个峰,脉冲平均升高幅度约为0.6 mU/L。平均24 h TSH水平与脉冲幅度呈明显相关。TSH昼夜节律为一系列脉冲所构成,夜间TSH平均水平高于日间,与夜间TSH脉冲次数和幅度二者的增加有关。TSH昼夜节律的完整性对维持正常的甲状腺功能具有重要作用[18]。研究表明,TSH昼夜节律与甲状腺碘释放的昼夜变化有关,并影响甲状腺滤泡的功能[17]。甲状腺获得主要的营养物质供应是在TSH夜间高峰之后。若TSH昼夜节律紊乱,即使基础TSH水平正常,甲状腺功能也会受到影响。
本研究结果显示,治疗前和治疗后,观察组存活者血清TT3、TT4、FT3水平均低于对照组,而血清FT4水平无差异。此外本研究入选病例中有26例死亡,既往研究发现死亡患者的血清TT3、FT3水平下降更明显[2],进一步说明血清甲状腺激素水平可能能够反映AECOPD患者的病情严重程度。稳定期COPD患者由于存在慢性低氧及慢性炎性反应,其甲状腺激素水平仍低于健康人群[10]。并且观察组存活者治疗前血清TSH水平在24:00时明显低于治疗后与对照组,即夜间分泌峰值缺失,这与既往研究结果一致[19],AECOPD患者除有NTIS表现外,存在TSH昼夜节律变化,即TSH夜间分泌峰值缺失,但日间血清TSH水平与对照组无差异;而病情稳定后,这种分泌峰值又趋于恢复。虽然外周血T3、T4水平下降,但TSH并无反应性增高。而且甲状腺激素虽可抑制垂体TSH分泌,但对TSH节律和脉冲式分泌影响不大。因此,NTIS患者TSH节律消失是下丘脑功能失调的结果,而非甲状腺激素的负反馈抑制所致。提示AECOPD患者下丘脑-垂体-甲状腺轴功能可能受到一定损伤。FLIERS等[20]的病理解剖发现,因严重疾病死亡的住院患者下丘脑室旁核促甲状腺素释放激素(thyrotropin releasing horone,TRH)基因表达下降,且室旁核TRH mRNA表达和血清中TSH、T3水平呈正相关;因交通事故等导致急性死亡的患者却未发现这种改变。提示下丘脑-垂体-甲状腺轴改变也是NTIS发生机制之一。
在危重病患者中NTIS的出现与疾病的严重程度密切相关[21],但对于合并NTIS的重症患者是否可以通过补充甲状腺激素进一步缓解原发病仍存在较大争议。既往认为NTIS是机体在重症疾病状态下一种自我保护的适应方式,即减少心、肝、肾及肌肉组织的分解代谢,降低消耗,从而有利于病情恢复。近年来研究发现尤其是伴有低T4的NTIS患者,可能是危重病或应激损伤的结果,并与不良预后密切相关[3],因此应用小剂量的甲状腺激素治疗可能是有益的[22]。有学者提出新的治疗方法,对伴有NTIS患者联合应用生长激素释放肽2(GHRP-2)和TRH进行治疗,可以恢复T4水平和TSH对TRH的反应,并且可以改善代谢状况[23]。进一步提示下丘脑-垂体-甲状腺轴的功能改变参与NTIS的发生。既往研究发现在重症COPD患者中存在低氧、甲状腺功能外周代谢异常以及甲状腺激素水平的下降,监测血清中甲状腺激素水平的变化,有利于判断病情的严重程度、指导疾病治疗以及预后评估[3,24-25]。综上所述,AECOPD患者可能存在下丘脑-垂体-甲状腺轴功能受损。期待对其发生机制有更为深入的研究,从而为合并NTIS重症疾病患者的治疗开辟新的道路。
作者贡献:胡萍、程洋进行文章的构思与设计,研究的实施与可行性分析,数据收集;胡萍进行数据整理,统计学处理,结果的分析与解释,撰写论文;戴丽、夏国光、张运剑进行论文的修订;张运剑对文章整体负责,监督管理。
本文无利益冲突。
[1]Global Initiative for Chronic Obstructive Lung Disease.Global strategy for the diagnosis, management, and prevention for chronic obstructive pulmonary disease 2017 report[EB/OL].(2016-11-16)[2016-12-09]. http://www.goldcopd.org.
[2]程洋,戴丽,夏国光.慢性阻塞性肺疾病急性加重患者血清甲状腺激素水平变化及临床意义[J].中华结核和呼吸杂志,2016,39(12):1-5.DOI:10.3760/cma.j.issn.1001-0939.2016.12.007.CHENG Y,DAI L,XIA G G.The alterations and clinical significance of serum thyroid hormone levels in patients with acute exacerbation of chronic obstructive pulmonary disease[J].Chinese Journal of Tuberculosis and Respiratory Diseases,2016,39(12):1-5.DOI:10.3760/cma.j.issn.1001-0939.2016.12.007.
[3]SARINC U S,BOZBAS S S,OZEN Z E,et al.Effect of thyroid function on COPD exacerbation frequency:a preliminary study[J].Multidiscip Respir Med,2013,8(1):64.DOI:10.1186/2049-6958-8-64.
[4]MILKOWSKA-DYMANOWSKA J,BIALAS A J,LASKOWSKA P,et al.Thyroid gland in chronic obstructive pulmonary disease[J].Adv Respir Med,2017,85(1):28-34.DOI:10.5603/ARM.2017.0006.
[5]WARNER M H, BECKETT G J.Mechanisms behind the nonthyroidal illness syndrome:an update[J].J Endocrinol, 2010,205(1):1-13.DOI:10.1677/JOE-09-0412.
[6]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼 吸 杂 志,2013,36(4):255-264.DOI:10.3760/cma.j.issn.1001-0939.2013.04.007.Chronic Obstructive Pulmonary Disease Group of Chinese Medical Association Respiratory Branch.Guidelines for the diagnosis and treatment of chronic obstructive pulmonary disease(revised in 2013)[J].Chinese Journal of Tuberculosis and Respiratory Diseases,2013,36(4):255-264.DOI:10.3760/cma.j.issn.1001-0939.2013.04.007.
[7]慢性阻塞性肺疾病急性加重诊治专家组.慢性阻塞性肺疾病急性加重诊治中国专家共识(2014年修订版)[J].国际呼吸 杂 志,2014,34(1):1-11.DOI:10.3760/cma.j.issn.1673-436x.2014.01.001.Acute Exacerbation Chronic Obstructive Pulmonary Disease(AECOPD) Expert Group on Diagnosis and Treatment.Acute exacerbation of chronic obstructive pulmonary disease (AECOPD)diagnosis and treatment of Chinese experts consensus(revised in 2014)[J].Int J Respir January,2014,34(1):1-11.DOI:10.3760/cma.j.issn.1673-436x.2014.01.001.
[8]DATTA D, SCALISE P.Hypothyroidism and failure to wean in patients receiving prolonged mechanical ventilation at a regional weaning center[J].Chest,2004,126(4):1307-1312.DOI:10.1378/chest.126.4.1307.
[9]LAGHI F,ADIGUZEL N,TOBIN M J.Endocrinological derangements in COPD[J].Eur Respir J,2009,34(4):975-996.DOI:10.1183/09031936.00103708.
[10]TERZANO C,ROMANI S,PAONE G,et al.COPD and thyroid dysfunctions[J].Lung,2014,192(1):103-109.DOI:10.1007/s00408-013-9537-6.
[11]WAJNER S M,GOEMANN I M,BUENO A L,et al.IL-6 promotes nonthyroidal illness syndrome by blocking thyroxine activation while promoting thyroid hormone inactivation in human cells[J].J Clin Invest,2011,121(5):1834-1845.DOI:10.1172/JCI44678.
[12]REDOUT E M,VAN DER T A,ZUIDWIJK M J,et al.Antioxidant treatment attenuates pulmonary arterial hypertension-induced heart failure[J].Am J Physiol Heart Circ Physiol,2010,298(3):H1038-1047.DOI:10.1152/ajpheart.00097.2009.
[13]VIDART J,WAJNER S M,LEITE R S,et al.N-acetylcysteine administration prevents nonthyroidal illness syndrome in patients with acute myocardial infarction: a randomized clinical trial[J].J Clin Endocrinol Metab,2014,99(12):4537-4545.DOI:10.1210/jc.2014-2192.
[14]BANKS W A,COOPER J A.Hypoxia and hypercarbia of chronic lung disease:minimal effects on anterior pituitary function[J].South Med J,1990,83(3):290-293.
[15]RUBELLO D,SONINO N,CASARA D,et al.Acute and chronic effects of high glucocorticoid levels on hypothalamic-pituitary-thyroid axis in man[J].J Endocrinol Invest,1992,15(6):437-441.DOI:10.1007/BF03348767.
[16]BRABANT G,RANFT U,OCRAN K,et al.Pulsatile pattern of thyrotropin-release in normal men[J].Clin Chim Acta,1986,155(2):159-162.
[17]BRABANT G,PRANK K,RANFT U,et al.Physiological regulation of circadian and pulsatile thyrotropin secretion in normal man and woman[J].J Clin Endocrinol Metab,1990,70(2):403-409.DOI:10.1210/jcem-70-2-403.
[18]ROSE S R,MANASCO P K,PEARCE S,et al.Hypothyroidism and deficiency of the nocturnal thyrotropin surge in children with hypothalamic-pituitary disorders[J].J Clin Endocrinol Metab,1990,70(6):1750-1755.DOI:10.1210/jcem-70-6-1750.
[19]MANCINI A,CORBO G M,GABALLO A,et al. Relationship between plasma antioxidants and thyroid hormones in chronic obstructive pulmonary disease[J].Exp Clin Endocrinol Diabetes,2012,120(10):623-628.DOI:10.1055/s-0032-1323808.
[20]FLIERS E,GULDENAAR S E,WIERSINGA W M,et al.Decreased hypothalamic thyrotropin-releasing hormone gene expression in patients with nonthyroidal illness[J].J Clin Endocrinol Metab,1997,82(12):4032-4036.DOI:10.1210/jcem.82.12.4404.
[21]YASAR Z,KIRAKLI C,CIMEN P,et al.Is non-thyroidal illness syndrome a predictor for prolonged weaning in intubated chronic obstructive pulmonary disease patients[J].Int J Clin Exp Med,2015,8(6):10114-10121.
[22]CHOPRA I J.Clinical review 86:euthyroid sick syndrome:is it a misnomer[J].J Clin Endocrinol Metab,1997,82(2):329-334.DOI:10.1210/jcem.82.2.3745.
[23]VAN DEN B G, BAXTER R C, WEEKERS F, et al. The combined administration of GH-releasing peptide-2(GHRP-2),TRH and GnRH to men with prolonged critical illness evokes superior endocrine and metabolic effects compared to treatment with GHRP-2 alone[J].Clin Endocrinol(Oxf),2002,56(5):655-669.DOI:10.1046/j.1365-2265.2002.01255.x.
[24]张广梅.慢性阻塞性肺疾病患者血清IL-6、IL-8、高敏C反应蛋白、甲状腺激素水平变化的临床研究[J].实用心脑 肺 血 管 病 杂 志,2012,20(5):791-792.DOI:10.3969/j.issn.1008-5971.2012.05.011.ZHANG G M.COPD patients blood serum IL-6,IL-8,highsensitivity C-reactive protein,thyroxin level change clinical research[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2012,20(5):791-792.DOI:10.3969/j.issn.1008-5971.2012.05.011.
[25]林蓉香,岳媛,张亚萍.亚临床甲状腺功能减退症与心血管疾病关系的研究进展[J].实用心脑肺血管病杂志,2017,25(8):7-10.DOI:10.3969/j.issn.1008-5971.2017.08.002.LIN R X,YUE Y,ZHANG Y P.Advances in the study of the relationship between subclinical hypothyroidism and cardiovascular disease[J].Practical Journal of Cardiac Cerebral Pneumal and Vascular Disease,2017,25(8):7-10.DOI:10.3969/j.issn.1008-5971.2017.08.002.
