CNRIP1启动子区去甲基化对结肠癌细胞糖酵解及增殖、迁移活性的影响
2018-02-05冯馨园王旗春仰舒静张梦荧姚嘉诚
冯馨园, 张 婷, 崔 戈, 王旗春, 钱 乙, 蔡 莹, 仰舒静, 张梦荧, 姚嘉诚
1)湖州师范学院医学院病理教研室 浙江湖州 313000 2)湖州师范学院附属第一医院病理科 浙江湖州 313000
大麻素受体互作蛋白1(cannabinoid receptor interacting protein 1, CNRIP1)是大麻素受体的负性调控因子[1],参与调节眼及神经系统的发育等[2-3]。近年来研究[4-6]发现,CNRIP1基因启动子区在结直肠腺癌组织存在较高程度的甲基化,但目前关于CNRIP1基因及其启动子区甲基化在肿瘤发生发展中的作用尚不清楚。本研究采用5-氮杂胞苷(5-azacytidine, 5-azaC)干预结肠癌细胞株SW620以降低CNRIP1启动子区区甲基化水平,观察CNRIP1启动子区去甲基化对结肠癌细胞糖酵解途径关键酶[己糖激酶2(hexokinase 2,HK2)、M2型丙酮酸激酶(M2-pyruvate kinase,PKM2)、乳酸脱氢酶-A(LDH-A)]以及细胞增殖、迁移能力的影响。
1 材料与方法
1.1细胞、试剂及仪器结肠癌细胞株SW620购自中国科学院上海生命科学研究院细胞资源中心(ATCC,CCL227)。低糖-DMEM培养基、胎牛血清、胰蛋白酶液购自美国Gibco 公司,5-azaC、亚硫酸氢盐修饰试剂盒购自德国QIAGEN公司,DNA提取试剂盒购自上海朝瑞生物科技有限公司,Trizol 购自日本TaKaRa公司,T载体PCR产物克隆试剂盒购自上海生工生物技术有限公司,RT-PCR试剂、逆转录试剂盒购自美国DBI公司,DEPC购自美国Sigma公司,RNasin 购自美国Promega公司,蛋白胶回收试剂盒购自美国OmegaBio-Tek公司,兔抗人CNRIP1、GAPDH多克隆抗体购自美国Abcam公司,辣根过氧化物酶标记的羊抗兔IgG(多克隆二抗)购自武汉博士德生物工程有限公司,ECL试剂盒购自美国Millipore 公司,乳酸测定试剂盒购自南京建成生物科技有限公司,CCK-8比色法试剂盒购自武汉博士德生物工程有限公司。Transwell插入式细胞培养皿购自美国康宁公司,光学倒置显微镜为德国蔡司公司产品,PCR扩增仪为美国ABI公司产品,实时荧光定量PCR 仪为美国Agilent公司产品,生化分析仪为美国贝克曼库尔特公司产品。
1.2实验分组复苏SW620,在37 ℃、体积分数5%CO2、饱和湿度条件下用低糖-DMEM培养基培养;2.5 g/L胰蛋白酶液消化传代,取对数生长期细胞备用。将细胞分为干预组及未干预组,每组接种3个复孔。干预组采用5 μmol/L的5-azaC干预,未干预组加入等量培养液,处理48 h后做后续实验。
1.3亚硫酸盐测序法检测2组结肠癌细胞中CNRIP1启动子区甲基化水平收集2组细胞,使用DNA提取试剂盒提取基因组DNA,定量后进行亚硫酸氢盐修饰。CNRIP1(177 bp)上游引物序列:5’-GCATCCAGCCTAATGACGG-3’,下游引物序列:5’-TCAGTTCCAGTGGGACAAGC-3’,引物由上海生工生物技术有限公司合成。用TaKaRa TaqTMHot Start Version进行PCR扩增。反应条件:94 ℃ 10 min; 94 ℃ 30 s,52 ℃ 30 s,40 个循环;72 ℃ 40 s,72 ℃ 10 min。采用蛋白胶回收试剂盒回收PCR产物,连接克隆载体(T载体),挑选5个阳性克隆PCR产物由上海生工生物技术有限公司测序。采用BiQ Analyzer软件分析位点甲基化水平。
1.4qRT-PCR检测2组结肠癌细胞中CNRIP1及糖酵解途径关键酶mRNA的表达水平收集2组细胞,充分裂解后离心取上清,Trizol法提取总RNA,逆转录成cDNA,进行PCR扩增。设计合成PCR引物,以GAPDH作为内参照,相关引物序列见表1。PCR反应条件按照试剂盒要求操作。PCR产物行琼脂糖凝胶电泳,利用凝胶成像系统扫描、拍照,分析数据。按2-ΔΔCt法计算mRNA相对表达量。 实验重复3次。

表1 qRT-PCR引物序列及扩增产物长度
1.5Westernblot检测2组结肠癌细胞中CNRIP1及糖酵解途径关键酶蛋白的表达水平收集2组细胞,加入RIPA裂解液提取总蛋白,Bradford法检测浓度。取50 μg总蛋白上样电泳、转膜、封闭,加入一抗(CNRIP1稀释比例12 000,HK2稀释比例1800,PKM2稀释比例13 000,LDH-A稀释比例12 000,GAPDH稀释比例12 000),300 mA恒流转膜30 min,膜接触过夜。洗膜,加入二抗,稀释比例120 000,室温孵育40 min,洗膜,加入ECL化学发光显示剂显影,采用凝胶图像处理系统(Image-Pro Plus 6.0)分析条带净光密度值。以目的条带灰度值与内参条带灰度值的比值作为目的蛋白的相对表达量。实验重复3次。
1.6生化法检测2组结肠癌细胞培养液中的乳酸含量离心取2组细胞培养液上清,按乳酸测定试剂盒说明书步骤加入样本、酶工作液、色剂,涡旋混匀,37 ℃孵育10 min,加入终止剂终止反应,采用自动生化分析仪进行比色分析,检测波长为530 nm,比色杯光径为1 cm。实验重复3次。
1.7CCK-8比色法检测2组结肠癌细胞的增殖活性将1.2所述2组细胞放入培养箱,分别孵育0、24、48、72、96 h;然后每孔加入10 μL CCK-8检测工作液继续孵育2 h后用酶标仪测定450 nm处的吸光度。实验重复3次。绘制细胞增殖曲线。
1.8Transwell法检测2组结肠癌细胞的迁移能力
将1.2所述2组细胞放入培养箱孵育96 h,收集细胞,接种于Transwell插入式培养板上室;下室加入含体积分数20%胎牛血清的细胞培养液;上下室之间为聚碳酸酯微孔滤膜(孔径8 μm)。培养18 h除去未黏附细胞,固定染色,显微镜下计数滤膜下侧贴壁细胞,200倍光镜下选择5个视野计数,取均值。实验重复3次。
1.9统计学处理运用SPSS 22.0进行数据分析,采用两独立样本t检验比较2组细胞CNRIP1启动子区甲基化水平、CNRIP1和糖酵解途径关键酶mRNA及蛋白表达水平、细胞增殖活性和迁移细胞数的差异。检验水准α=0.05。
2 结果
2.1 2组CNRIP1启动子区甲基化水平的比较未干预组结肠癌细胞CNRIP1启动子区第2216(75%)、2226(100%)、2231(100%)、2245(100%)、2254(100%)、2273(100%)、2286(100%)、2325(100%)位点平均甲基化程度为(96.88±8.84)%;
干预组结肠癌细胞CNRIP1启动子区第2216(60%)、2226(60%)、2231(60%)、2245(40%)、2254(40%)、2273(40%)、2286(40%)、2325(40%)位点平均甲基化程度为(47.50±10.35)%。与未干预组相比,干预组这8个位点的平均甲基化水平降低(t=8.428,P<0.001)。
2.2 2组CNRIP1mRNA及蛋白表达水平的比较
与未干预组相比,干预组CNRIP1 mRNA及蛋白表达水平均升高(图1、表2)。
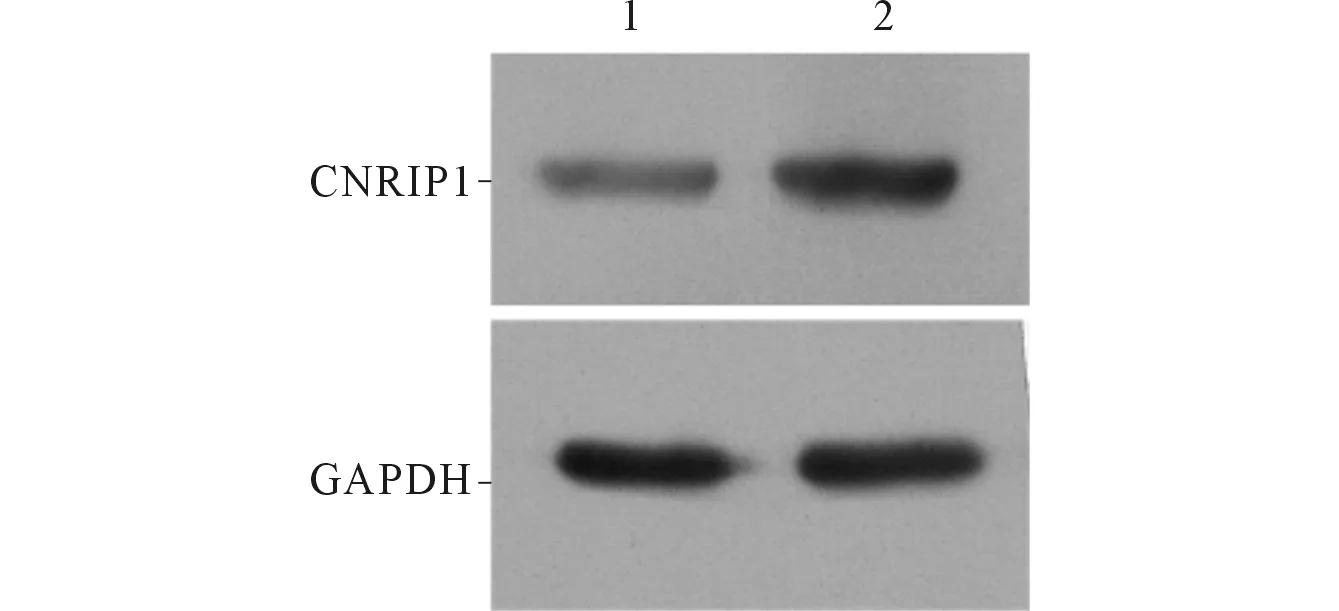
1:未干预组;2:干预组图1 2组结肠癌细胞CNRIP1 蛋白的表达水平

组别nmRNA蛋白未干预组31.000±0.0380.329±0.020干预组32.720±0.3310.899±0.050t9.89180.429P0.0100.008
2.3 2组糖酵解途径关键酶mRNA及蛋白表达水平的比较与未干预组相比,干预组SW620细胞HK2、PKM2、LDH-A mRNA及蛋白表达水平均降低(图2,表3、4)。

1:未干预组;2:干预组图2 2组结肠癌细胞糖酵解关键酶蛋白的表达水平
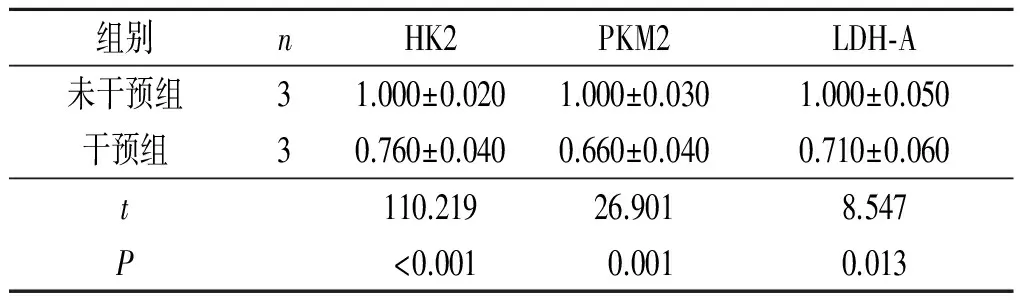
组别nHK2PKM2LDH⁃A未干预组31.000±0.0201.000±0.0301.000±0.050干预组30.760±0.0400.660±0.0400.710±0.060t110.21926.9018.547P<0.0010.0010.013
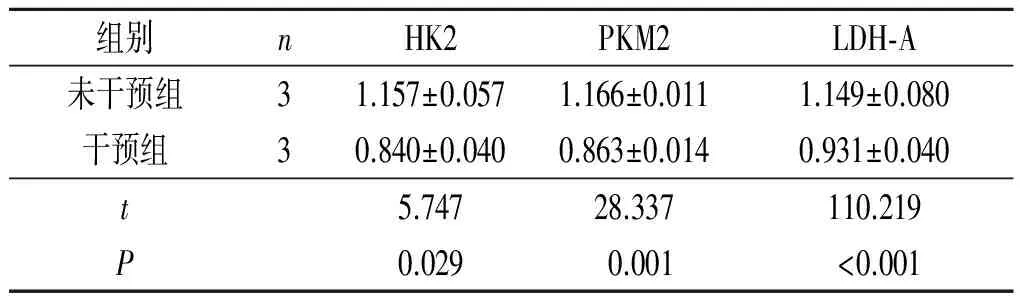
表4 2组结肠癌细胞糖酵解途径关键酶蛋白表达水平比较
2.4 2组细胞培养液中乳酸水平的比较与未干预组[(5.21±0.42) mmol/L)]相比,干预组细胞培养液中乳酸含量[(2.54±0.23) mmol/L]降低(t=24.034,P=0.002)。
2.5 2组细胞增殖和迁移能力的比较与未干预细胞相比,干预组SW620细胞增殖及迁移能力均减弱(图3、4,表5)。

A:未干预组;B:干预组图3 2组结肠癌细胞的增殖曲线

A:未干预组;B:干预组图4 2组结肠癌细胞的迁移数量

组别n细胞增殖活性∗迁移细胞数未干预组31.443±0.02154.33±17.48干预组30.792±0.0579.83±9.50t25.8128.178P0.001<0.001
*:以吸光度值表示
3 讨论
DNA甲基化与肿瘤的发生发展关系密切。抑癌基因与修复基因的高甲基化可导致抑癌基因沉默与修复基因失活,造成肿瘤抑制丧失与基因损伤增加[7]。研究[8]表明去除肿瘤细胞启动子区CpG岛高甲基化可影响肿瘤活性,DNA甲基化干预成为肿瘤新型治疗策略的研究热点。
CNRIP1是一个由164个氨基酸组成的蛋白,作为G蛋白偶联受体与大麻素受体1的C末端相互作用,是CNRIP家族成员之一,在正常人的脑组织中有表达,在睾丸中也有较低水平的表达,参与调节食欲、突触可塑性及神经保护作用等[2-3]。近来研究[4-6]发现,结直肠腺癌细胞存在较高程度的CNRIP1基因启动子区甲基化,但其作用尚不清楚。我们前期采用焦磷酸测序技术发现结直肠腺癌患者CNRIP1启动子区5个位点甲基化程度高,其甲基化程度分别与肿瘤直径、原发灶浸润深度、TNM分期正相关,CNRIP1启动子区甲基化程度可反映结肠癌进展程度[9]。本研究中,我们采用5-azaC干预结肠癌细胞,结果显示,CNRIP1启动子区5个位点的甲基化水平降低,结肠癌细胞的增殖及迁移能力均减弱,提示CNRIP1去甲基化可降低结肠癌细胞的增殖及迁移活性。
DNA甲基化与肿瘤的能量代谢有着密切联系[10],而恶性肿瘤细胞即使在氧充足条件下仍以糖酵解为主要供能方式,这种有氧糖酵解代谢特性被称为Warburg效应[11]。因此,监测糖酵解途径关键酶的表达及乳酸的生成对于评估肿瘤能量来源具有重要意义。HK是糖酵解途径第一个限速酶,HK2在4种同工酶中与肿瘤相关性最大[12]。PK催化磷酸烯醇式丙酮酸和ADP变为丙酮酸和ATP,是糖酵解过程主要限速酶之一;PKM2是肿瘤细胞中丙酮酸激酶的主要亚型[13]。LDH是催化丙酮酸转化为乳酸的限速酶,其中LDH-A(即LDH-5、M4 型)与肿瘤生长密切相关[14]。乳酸是细胞糖酵解的最终产物。本研究发现,与未干预组相比,5-azaC干预组结肠癌细胞中HK2、PKM2、LDH-A mRNA及蛋白表达水平及乳酸含量均降低,表明CNRIP1去甲基化可显著抑制结肠癌细胞糖酵解途径、减少乳酸生成,可能通过抑制结肠癌细胞Warburg效应,减少其获取能量,抑制其增殖及迁移能力。
综上所述,CNRIP1可能是一种抑癌基因或修复基因;CNRIP1启动子区去甲基化可能通过抑制糖酵解途径,进而降低结肠癌细胞的增殖及迁移能力。CNRIP1启动子区去甲基化可作为结肠癌治疗策略的一个新选择。
[1] SMITH TH,BLUME LC,STRAIKER A,et al.Cannabinoid receptor-interacting protein 1a modulates CB1 receptor signaling and regulation[J].Mol Pharmacol,2015,87(4):747
[2] ZHENG X,SUZUKI T,TAKAHASHI C,et al.cnrip1 is a regulator of eye and neural development in Xenopus laevis[J].Genes Cells,2015,20(4):324
[3] SMITH TH,SIM-SELLEY LJ,SELLEY DE.Cannabinoid CB1 receptor-interacting proteins: novel targets for central nervous system drug discovery?[J].Br J Pharmacol,2010,160(3):454
[4] LIND GE,DANIELSEN SA,AHLQUIST T,et al.Identification of an epigenetic biomarker panel with high sensitivity and specificity for colorectal cancer and adenomas[J].Mol Cancer,2011,10:85
[5] OSTER B,THORSEN K,LAMY P,et al.Identification and validation of highly frequent CpG island hypermethylation in colorectal adenomas and carcinomas[J].Int J Cancer,2011,129(12):2855
[6] BETHGE N,LOTHE RA,HONNE H,et al.Colorectal cancer DNA methylation marker panel validated with high performance in Non-Hodgkin lymphoma[J].Epigenetics,2014,9(3):428
[7] KULIS M,ESTELLER M.DNA methylation and cancer[J].Adv Genet,2010,70:27
[8] CHEISHVILI D,BOUREAU L,SZYF M.DNA demethylation and invasive cancer: implications for therapeutics[J].Br J Pharmacol,2015,172(11):2705
[9] 张婷,崔戈,冯文明,等.结直肠腺癌患者外周血CNRIP1基因启动子甲基化的临床病理学分析[J].临床与实验病理学杂志,2014,30(10):1086
[10]BARRES R,ZIERATH JR.DNA methylation in metabolic disorders[J].Am J Clin Nutr,2011,93(4):897S
[11]WARBURG O.On the origin of cancer cells[J].Science,1956,123(3191):309
[12]PATRA KC,HAY N.Hexokinase 2 as oncotarget[J].Oncotarget,2013,4(11):1862
[13]LI C,ZHAO Z,ZHOU Z,et al.PKM2 promotes cell survival and invasion under metabolic stress by enhancing Warburg effect in pancreatic ductal adenocarcinoma[J].Dig Dis Sci,2016,61(3):767
[14]MIAO P,SHENG S,SUN X,et al.Lactate dehydrogenase A in cancer:a promising target for diagnosis and therapy[J].IUBMB Life,2013,65(11):904