家蚕安全转基因技术研究现状与展望
2018-02-04龙定沛郝占章向仲怀赵爱春
龙定沛,郝占章,向仲怀,赵爱春
家蚕安全转基因技术研究现状与展望
龙定沛,郝占章,向仲怀,赵爱春
(西南大学蚕学与系统生物学研究所/家蚕基因组生物学国家重点实验室/农业部蚕桑生物学与遗传育种重点实验室, 重庆 400716)
转基因技术是实现基因功能研究和生物遗传改良的重要工具。转基因生物安全问题主要包括转基因操作技术安全与转基因产品安全这两个方面。近年来业内对转基因生物的安全性研究主要集中于转基因农作物、水生动物和家禽、家畜等大型动物在医药、农业和食品工业等领域的安全评估,而对于具有重要科研与经济价值的农业昆虫安全转基因技术研究的报道则较为有限,而且农业部至今未有转基因昆虫安全性评估的先例。家蚕()是重要的鳞翅目模式昆虫和农业经济昆虫,家蚕安全转基因技术的深入研究对于促进基础遗传学发展和推动蚕丝产业发展均具有重要价值和意义。自2000年第一例转基因家蚕建立以来,转基因技术已广泛应用于家蚕基因功能鉴定的基础研究和品种改良的应用研究领域,但转基因家蚕的安全性问题却成了限制转基因家蚕实用化应用的主要瓶颈。因此,开展家蚕安全转基因技术体系研究对促进转基因家蚕安全性评估和产业化具有重要意义。本文系统地概述了基于条件基因打靶的家蚕安全转基因技术体系的建立与研究现状,讨论了家蚕安全转基因技术的发展趋势和应用前景,以期为转基因动物特别是农业转基因昆虫的安全转基因技术建立和完善提供参考。
家蚕;生物安全;安全转基因技术;位点特异性重组;标记基因删除;基因定点修饰
转基因技术是进行基因功能研究和生物遗传改良的重要工具。自20世纪70年代初被建立以来,经过近半个世纪的发展,转基因技术已经日臻成熟,并于近年来在功能基因组研究、定向遗传育种、建立人类疾病模型和生物反应器开发等方面发挥了巨大作用。自转基因技术自诞生之日起,科学界和社会公众对转基因生物(genetically modified organisms,GMOs)安全性的关注一直存在。近年来,随着以大豆、玉米、棉花和油菜为代表的全球转基因作物商业化种植面积的逐年扩大[1],以及美国食品药品管理局(FDA)确认水优三文鱼(商品名:)成为首个可以依法商业销售和食用的转基因动物[2],标志着转基因生物产业已成为全球新的经济增长点和增强农业国际竞争力的重要保障。
目前,人们对转基因生物安全问题的考虑主要包括转基因操作技术安全问题与转基因产品(genetically modified products,GMPs)安全问题这两个方面(中国将“转基因植物种植和转基因动物养殖环境安全评估”单独列为农业部转基因动植物申报的三大安全性评估内容之一,本文将其归为转基因操作技术安全范畴)。转基因操作技术安全问题主要体现在转入的外源基因是否会对受体动植物生长产生不良影响以及是否会对生态环境造成破坏(包括转基因植物种植和转基因动物养殖环境安全评估问题)。转基因产品安全问题则主要体现在转基因食品(主要指农作物)以及利用转基因生物反应器生产的抗体、疫苗等医药制品或经其他基因工程下游技术生产的生物类制品是否会对人类健康造成潜在危害。因此,利用并结合不同的遗传操作手段,消除转基因生物中潜在的安全隐患,是转基因生物新品种培育、推广和产业化开发应用中必须解决的关键问题。近年来科学技术界对转基因生物的安全性研究,主要集中于转基因植物特别是转基因农作物和转基因鱼类、贝类等水生动物以及转基因家禽、家畜等大型动物在食品、医药和农业等领域的安全评估研究[3-8],而对于具有重要科研与经济价值的农业昆虫安全转基因技术研究的报道则较为有限。
家蚕()是重要的鳞翅目模式昆虫,同时也是人工饲养和迄今唯一被完全驯化的农业经济昆虫。利用家蚕生产丝蛋白已有超过5 000年历史,蚕丝构成了丝绸产业的基础,与此相关的产业还包括桑苗繁育业、蚕种制造业、养蚕业,以及食品、医药和生物材料等生物技术产业。蚕丝业作为中国的传统优势产业,为中华文明的历史文化传播和经济发展作出了卓越贡献。此外,由于家蚕具有生长周期短、遗传背景清楚、遗传资源丰富、丝蛋白合成、分泌及加工能力强等优点,其遗传学研究曾与著名实验昆虫果蝇并驾齐驱,对经典遗传学的发展作出了重要贡献。自2000年第一例利用转座子实现建立转基因家蚕的报道以来[9],转基因技术已经被广泛应用于家蚕基因功能鉴定、生物反应器开发和创制具有特定基因差异的家蚕材料。同其他转基因生物一样,转基因家蚕的安全性也引起了蚕学研究者的广泛关注。本文将介绍基于条件基因打靶技术的家蚕安全转基因技术体系的建立与研究现状,并对家蚕安全转基因技术的发展趋势和应用前景进行讨论,旨在为转基因动物特别是农业转基因昆虫的安全转基因技术建立和完善提供参考。
1 基于条件基因打靶的家蚕安全转基因体系建立
近年来,随着转基因技术逐渐广泛应用于家蚕基因功能鉴定的基础研究和品种改良的应用研究领域,越来越多的研究人员意识到,转基因家蚕的生物安全问题是转基因家蚕新品种推广应用过程中不容忽视的关键问题。
目前创制转基因家蚕的主要方法仍旧是基于转座子(主要是转座子)介导外源基因在基因组随机整合的家蚕种系转化技术。家蚕作为非食用性的经济昆虫,其转基因安全问题主要体现在转基因操作技术安全方面,例如转座子在家蚕基因组的随机整合[10]、家蚕内源或外源基因在转基因个体中的过量[11]或异位表达[12]均可能带来转基因家蚕自身的生存问题。此外,尚不能完全排除转基因家蚕携带的外源基因可能经由垂直漂移(vertical gene flow)所带来的生态环境安全隐患。
为解决上述潜在转基因家蚕生物安全问题,一方面要求管理人员加强对已获得转基因家蚕的生长发育、繁殖、遗传以及各种生物性状的监测和评估,并建立严格和完善的针对转基因家蚕的管理制度和措施;另一方面则要求研究人员对现有的家蚕转基因技术进行整合和改进,力争从根本上解决转基因操作技术手段所引起的转基因家蚕潜在生物安全隐患。近年来,国内外的研究者相继开展了利用家蚕条件基因打靶技术来解决转基因家蚕安全隐患问题的研究。特别是自2007年以来,本研究小组系统地开展了建立基于条件基因打靶技术的家蚕安全转基因体系的研究工作,通过利用不同种类的位点特异性重组(site-specific recombination)系统并将其与复合型转座载体系统相结合,在一定程度上有效地解决了家蚕转基因研究中的潜在生物安全隐患问题。
1.1 克服转座子随机整合引起的家蚕转基因安全隐患
针对由转座子随机整合导致目标基因表达变化(异位、上调或下调表达),进而引起非预期负面效应的转基因家蚕的问题,目前主要可利用组织特异型启动子[11,13-15]、热激或病菌诱导型启动子[16-17]、药物诱导表达系统[18-20]和GAL4/UAS双元诱导表达系统[21]等来实现调控内源或外源目标基因在转基因家蚕不同发育时期和不同组织中的时空特异性表达,从而达到在一定程度上克服目标基因表达变化对转基因个体生长发育带来的不良影响。但是,上述策略并没有从根本上解决转座子介导目标基因随机整合所带来的转基因家蚕存活率低的问题。
自2006年以来,来源于链霉菌噬菌体phiC31(phiC31)的phiC31/系统先后被证实具有在家蚕细胞[22]、胚胎[23]以及个体[24]中介导发生位点特异性整合反应的活性。2013年,Long等[25]建立了一种基于phiC31/系统的重组酶介导盒式交换(phiC31-RMCE)反应的策略,用于实现外源基因在转基因家蚕基因组预先确定染色体位点(靶位点)的精确定点整合/替换(图1):首先建立基因组中含有纯合接纳位点(/)的转基因靶品系(transgenic target strain,TTS)家蚕,随后将phiC31整合酶(pSLA3-Int或mRNA)与供体质粒(pSL{-3×P3-EGFP-SV40-})共同导入TTS家蚕受精卵,从而实现phiC31整合酶介导整个供体质粒或目标基因表达框(3×P3-EGFP表达框)序列,经/位点对间的单次重组反应(即仅发生步骤1的单次交换)或2次重组反应(即同时发生步骤1和2的RMCE)定点整合至位点特异性整合品系(site-specific integration strain,SSIS)家蚕基因组。值得注意的是,经步骤1的单次交换反应整合进入SSIS家蚕基因组的供体质粒,还可进一步通过步骤2的单次交换反应,实现除3×P3-EGFP表达框序列之外载体骨架序列的完全删除(图1)。此外,phiC31/系统所特有的单向不可逆的整合特性,确保了定点整合的外源目标基因在SSIS家蚕后代基因组中的稳定遗传和表达[25]。由此可见,利用phiC31-RMCE反应的策略不但能够克服转座子随机整合可能引起的非预期负面效应对转基因家蚕生长发育带来的不良影响,而且还有助于在一定程度上消除转座子随机整合位置效应和插入突变以及非目标基因序列对目的基因表达及基因功能研究的影响。
1.2 克服筛选标记基因保留带来的家蚕转基因安全隐患
为了实现对阳性转基因家蚕的快速筛选鉴定,研究人员往往在转基因个体基因组中引入并保留、和neo等筛选标记基因。然而众所周知,筛选标记基因在宿主基因组的保留,可能会增加转基因逃逸现象的发生概率并对目标外源基因的表达产生影响,进而带来可能的安全隐患。因此,筛选标记基因的安全问题是包括家蚕在内的几乎所有转基因动植物在实际推广应用过程中必须要解决的关键问题之一。
位点特异性重组法是目前转基因动植物中应用最为广泛和有效的实现筛选标记基因删除的方法,其在实验设计上具有普遍性:用两个同向排列的重组酶识别位点(、P、或等)锚定筛选标记基因,随后通过有性杂交、温度或化学处理等条件诱导、二次转化等方法,在宿主个体或细胞中引入位点特异性重组酶(FLP、Cre或phiC31等)的表达来介导识别位点间的重组反应,进而实现选择标记基因的删除。2012年,Long等[26]率先建立了一种基于酿酒酵母()来源的FLP/系统的策略,用于实现家蚕个体基因组水平筛选标记基因的定点删除(图2):首先建立基因组中含有被位点锚定筛选标记基因(3×P3-EGFP表达框)的G1代转基因靶品系(TTS)家蚕,随后通过显微注射方式在G2代TTS家蚕受精卵中引入FLP重组酶表达(pSLA3-FLP),结果将实现筛选标记基因序列在G3代位点特异性重组品系(site-specific recombination strain,SSRS)家蚕基因组的定点删除。

图1 经由phiC31-RMCE反应实现外源基因在转基因家蚕基因组定点整合策略
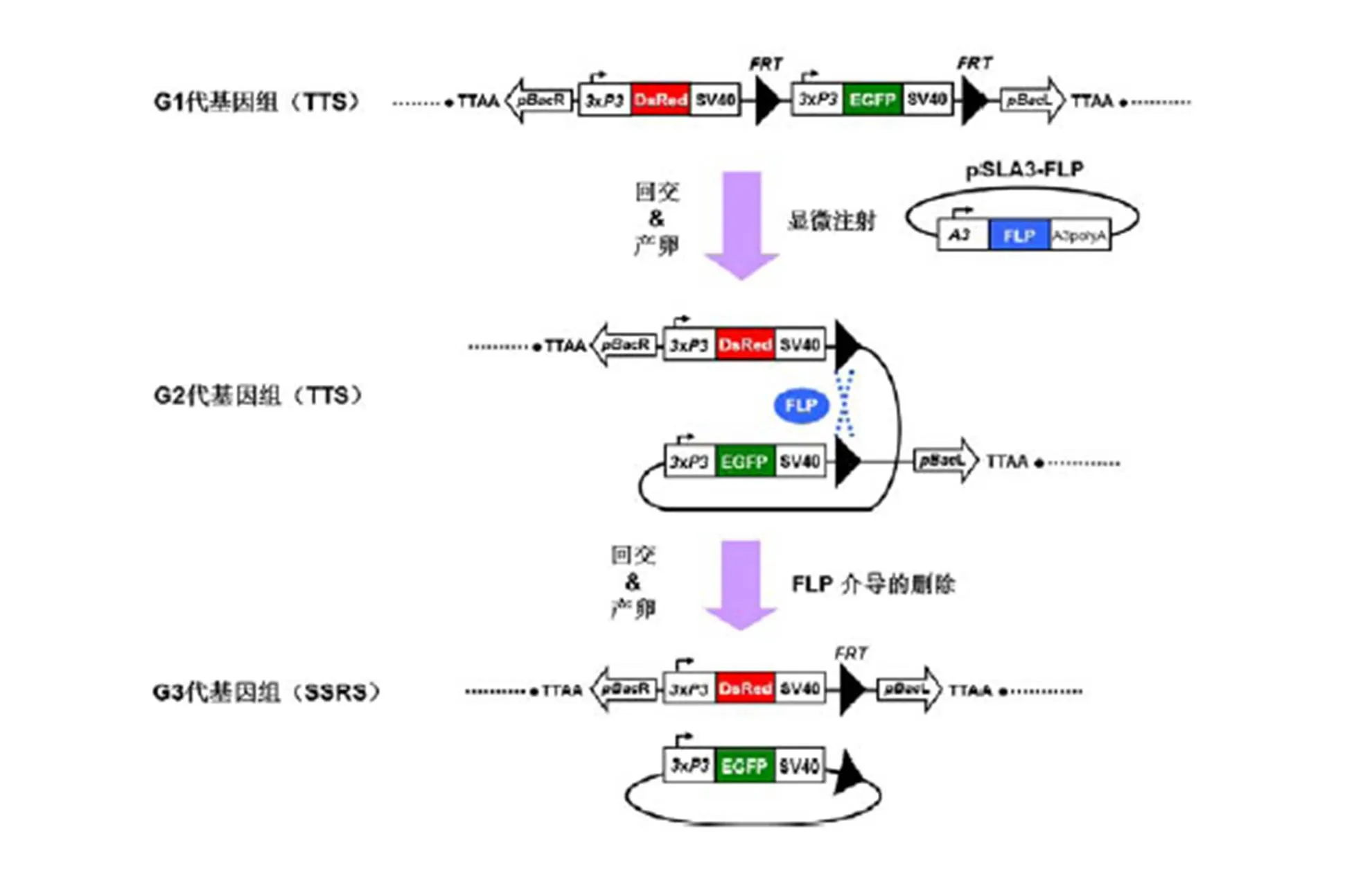
图2 FLP重组酶介导的转基因家蚕筛选标记基因定点删除策略
2016年,Long等[27]进一步证实胚胎显微注射FLP重组酶mRNA和杂交引入FLP重组酶持续表达的方式,均能够有效提高位点锚定的筛选标记基因在转基因家蚕基因组的定点删除效率。此外,还构建了由黑腹果蝇()基因启动子调控FLP重组酶表达的转基因表达辅助品系家蚕,通过有性杂交结合42℃热激处理(heat shock treatment,HST)方式在双转基因家蚕后代中实现了筛选标记基因的可诱导性定点删除。
日本研究人员Kômoto等[28]同样利用FLP/系统,通过将含有hsp70-FLP表达框的FLP重组酶表达系家蚕和含有OpIE2-FRT-GFP-FRT- DsRed表达框的转基因报告品系家蚕进行有性杂交结合热激处理的方式,实现了被位点锚定的标记基因表达框在杂交F1代双转基因家蚕体细胞中的定点删除,以及下游基因的表达激活。
1.3 实现外源基因稳定整合、表达以及精确替换的家蚕安全转基因策略
外源目标基因在宿主基因组的不稳定整合现象,是转基因生物最主要的潜在安全隐患之一。转座子在宿主基因组中再转座所引起的外源基因不稳定整合现象,可能会带来诸如外源基因表达不稳定、转基因丢失和逃逸等问题。目前在包括小鼠[29]、果蝇[30]、家蚕[31]等动物中均观察到了转座子在宿主细胞基因组中的再转座现象。张雨丽等[32]在广西大面积试点饲养含有单拷贝外源基因插入的转基因家蚕品种“西绿”的过程中,曾观察到外源基因在传代培养和杂交选育过程中丢失的现象。引起转基因丢失现象的关键原因可能在于宿主细胞中含有非预期的具有转座酶活性的蛋白,这些蛋白可能是由宿主基因组中存在的未经鉴定的内源转座酶基因所编码,也可能是通过水平基因转移进入宿主基因组的外源转座酶基因所编码[10]。家蚕是人工驯化的昆虫,其生存与繁殖完全依赖于人工饲养[33],因此家蚕通过水平基因转移获得具有转座酶活性的外源蛋白的可能性相对较小。早期研究证实,家蚕基因组中至少存在100条-like转座子序列(BmPBLE1-98、yabusame-1和yabusame-W)[34-35],这些序列编码产生的具有潜在转座酶活性的内源蛋白在家蚕体内是否具有功能需要进一步研究。
根据的转座原理,理论上只要删除转座子臂单侧或两侧的末端反向重复序列(ITR),就可实现转座子在宿主基因组的稳定整合[36]。2015年,Long等[37]联合phiC31/系统和改造的复合型转座载体系统,开发了一项通用且有效的实现外源目标基因在家蚕基因组稳定整合、表达以及精确替换的策略(图3):利用复合型转座载体(PB-TP),建立基因组中含有完整的4个转座子臂序列(L1、R1、L2和R2)插入的转基因家蚕(TS1-RgG);通过热激诱导转座酶(PBase)在转基因家蚕(TS2-RgG)体内表达,从而使得目标基因表达框(Fib-H-EGFP-LBS)单侧或两侧的转座子(R1–L2和/或R2–L1)经再转座而删除,最终获得单侧(TS3-Rg和TS3-gG)或两侧转座子(TS3-g和TS4-g)删除的后代转基因家蚕。
利用上述策略可实现包括转座子臂和筛选标记基因在内的所有目标基因以外载体骨架序列的完全消除,从而确保了目标基因在家蚕基因组的稳定整合。此外,通过phiC31-RMCE反应可实现将由启动子或者其他丝腺特异型启动子(如-启动子和启动子),甚至其他类型组织特异型启动子(如脂肪体和中肠组织特异型启动子)调控的不同外源蛋白基因,精确地整合进入与TS3-g2家蚕的FibH-EGFP表达框相同的基因组位点,从而创制出外源蛋白表达更为优化的家蚕生物反应器[37]。
值得注意的是,Long等[37]还以上述研究为基础,进一步描述了一种联合复合型转座载体、phiC31-RMCE系统以及FLP/系统的家蚕安全转基因策略,用于实现对预先插入家蚕基因组的外源基因的定点修饰(图4):首先利用复合型转座载体建立基因组中仅含有被位点锚定目标基因表达框(Target 1)的转基因家蚕系;随后通过phiC31-RMCE反应介导携带其他目标基因表达框(Target 2)以及被位点锚定的筛选标记基因表达框(Marker 2)和FLP重组酶表达框的外源DNA序列,与基因组靶位点稳定整合的Target 1发生定点替换;最后利用诱导型启动子(inducible promoter,IP)调控FLP重组酶表达,实现对Marker 2以及FLP重组酶表达框自身的自动定点删除。上述策略在确保实现外源基因稳定整合于家蚕基因组靶位点的同时,有效克服了转座子随机整合位置效应和载体骨架序列保留对基因功能分析的影响,并可实现对不同外源基因在相同染色体插入位点功能的比较研究。最为关键的是,该策略对真正意义上建立安全转基因家蚕具有重要的理论和实践意义,该策略应用的通用性决定其同样可适用于其他鳞翅目类转基因昆虫的生物安全防控研究领域。

L1、R1、L2和R2分别表示4个piggyBac转座子臂;G1代转基因品系(transgenic strain,TS)命名为TS1,其后代依次命名为TS2、TS3……,依次类推;含有不同荧光表型的TSn家蚕,根据其荧光表型的不同,如3×P3-DsRed(R)、FibH-EGFP(g)或3×P3-EGFP(G),分别缩写为TSn-R、TSn-G或TSn-g(“n”代表世代),比如来自G1代的转基因家蚕个体同时含有3种不同的荧光表型,则记为“TS1-RgG”
2 家蚕安全转基因技术的发展趋势及应用前景
2.1 不同位点特异性重组系统的联合应用
FLP/、Cre/和phiC31/系统作为目前应用最为广泛的3种位点特异性重组系统,均已经被证实能够应用于家蚕个体基因组水平的遗传操作,而且不同类型系统介导的位点特异性重组形式(整合或删除)具有偏好性[25-26,38]。因此,基于位点特异性重组系统的家蚕条件基因打靶技术,往往需要将多种不同类型重组系统进行组合运用,才能通过对基因组的精细操作来实现安全转基因家蚕的创制。如上文所述,Long等[37]建立的实现对预先插入家蚕基因组的外源基因进行定点修饰的家蚕安全转基因策略,即结合了phiC31/系统更适用于通过RMCE反应介导外源目标DNA在靶位点定点整合的优点和FLP/系统更适用于介导目标DNA定点删除的特性。
早在2005年,基于FLP/和Cre/系统的RMCE(FLP-RMCE和Cre-RMCE)反应就已经被成功应用于黑腹果蝇的转基因研究[39-41]。2013年,Schetelig等[42]在加勒比按实蝇()中证实了通过Cre-RMCE反应实现外源目标基因在基因组靶位点定点整合的可行性。与phiC31-RMCE相比,FLP-RMCE和Cre-RMCE的最主要优势在于其能够实现转基因在单个靶位点的反复插入/删除反应[39,42]。2015年,Haghighat-Khah等[43]联合phiC31/和Cre/(或FLP/)系统开发了一种整合酶-重组酶介导的盒式交换(integrase-recombinase mediated cassette exchange,iRMCE)策略,并利用该策略分别在埃及伊蚊()和小菜蛾()中实现了基于phiC31/系统介导的外源供体质粒定点整合以及基于Cre/(或FLP/)系统介导的载体骨架序列定点删除。 由此可见,随着昆虫遗传转化技术的不断进步与发展,在今后的研究中,包括FLP-RMCE、Cre-RMCE以及多种不同类型位点特异性重组系统相结合的策略,均具有应用于实现更为精细的家蚕遗传操作 的潜力,是家蚕安全转基因技术发展的主要趋势 之一。
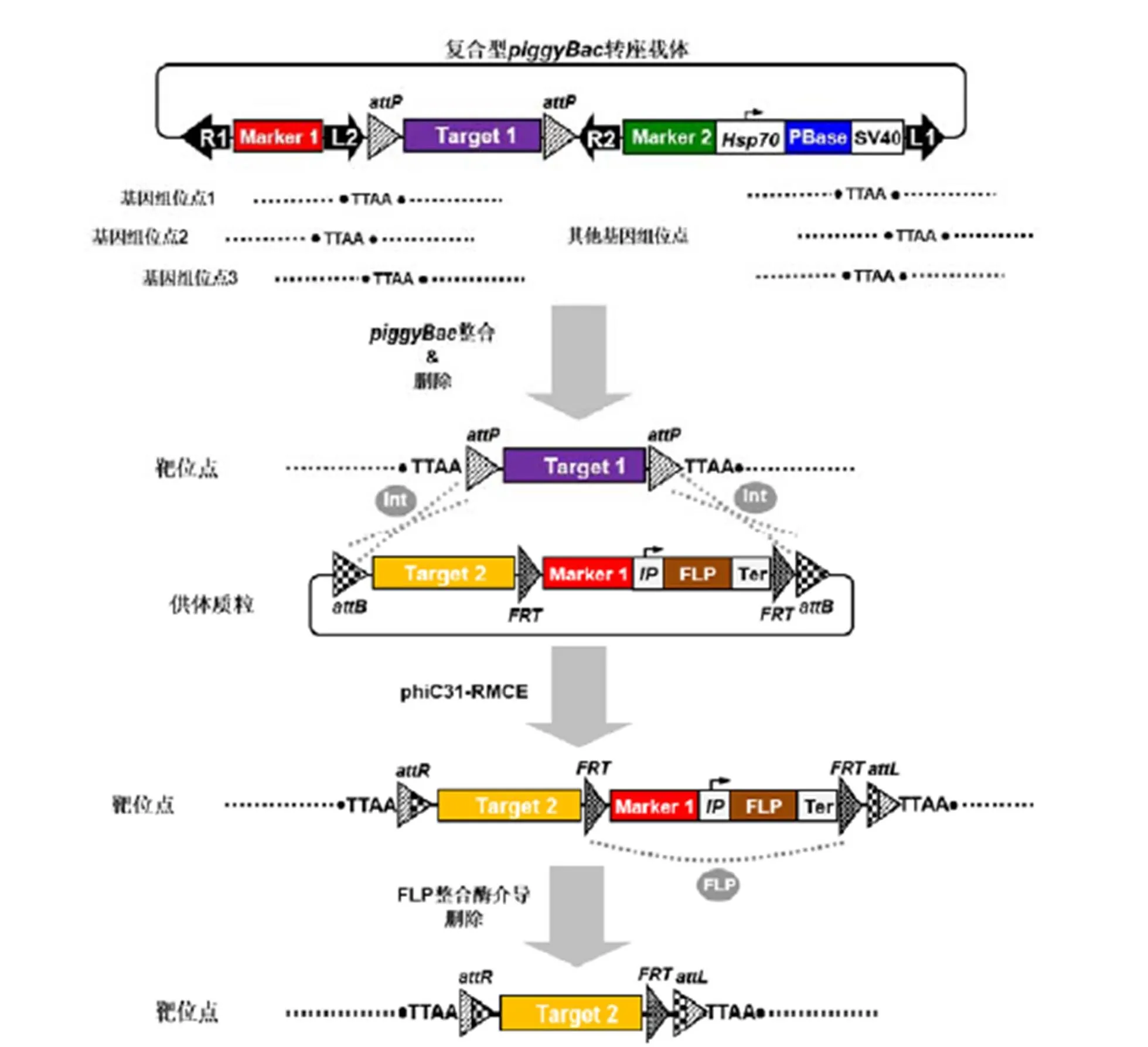
Marker 1和Marker 2分别代表不同的筛选标记基因表达框;Target 1和Target 2分别代表不同的目标基因表达框;IP代表诱导型启动子,Ter代表终止子 Marker 1 and Marker 2 indicate different marker gene expression cassettes; Target 1 and Target 2 indicate different target gene expression cassettes; IP indicates the inducible promoter, and Ter indicates the termination sequence
2.2 基因组靶向编辑技术与位点特异性重组系统的联合应用
近年来,不同类型人工核酸内切酶(包括ZFN、TALEN和CRISPR/Cas9系统等)系统的基因组靶向编辑技术已成功应用于对家蚕内源基因的定点敲除以及外源基因的定点整合操作[44-46]。显而易见,利用这些基因组靶向编辑技术,有望实现介导不含任意非目标序列的外源基因在家蚕基因组的定点整合,有效克服外源目标基因随机整合和不稳定整合带来的转基因家蚕生物安全隐患。此外,这些基因组靶向编辑技术同样具有实现转基因家蚕中删除筛选标记基因的潜力。但是,目前报道的家蚕基因组靶向编辑技术仍存在介导外源基因整合效率较低、整合外源片段大小较为有限、定点整合供体质粒同源臂构建较为困难等缺点和局限性[47-49]。
针对上述基因组靶向编辑技术在单独应用时存在的缺点或局限性,在以后的研究中可首先利用人工核酸内切酶系统将、P、或等整合酶识别位点序列定点整合至家蚕基因组靶位点,随后即可借助FLP、Cre或phiC31等位点特异性重组酶/整合酶介导大片段外源基因在基因组靶位点的定点整合。位点特异性重组系统与基因组靶向编辑技术联合应用于开发更为完善的家蚕转基因操作体系,必将有助于克服基因组靶向编辑系统单独应用的缺点和局限性,推动家蚕安全转基因研究和转基因家蚕产业化推广研究的发展。
2.3 实现对转基因蚕种的安全控制问题
如前文所述,通过联合复合型转座系统与不同的位点特异性重组系统建立的安全转基因策略,已经能够有效克服由转座子随机整合引起的转基因家蚕自身安全问题,以及由转座子整合不稳定性和非目标基因序列保留在基因组中的问题。但是,携带外源基因的转基因蚕种在实际大规模推广应用过程中可能发生的生产和生态环境安全问题目前尚未得到有效解决。众所周知,蚕业只用家蚕日系原种×华系原种的杂交一代(F1)蚕种进行大面积生产,蚕农在农村饲养家蚕的过程中无法施行对蚕种的严格管理与控制,无法防止转基因蚕种的不可控扩散,所以转基因家蚕目前只能在实验室或蚕种场严格管理的转基因蚕房中小规模饲养。关于转基因蚕种的安全控制问题仍然是目前最根本和亟待解决的重要问题之一。这一问题将直接影响转基因家蚕被批准应用和推广的安全评估,阻碍转基因家蚕的大规模推广应用和产业化发展。在今后的研究中,为了防止转基因F1蚕种在推广应用过程中不可控的转基因扩散安全隐患,本研究小组将在前期研究基础上,探索联合应用包括家蚕组织特异型启动子(特别是生殖腺特异表达基因启动子[50])、GAL4/UAS二元表达系统[21]、位点特异性重组系 统[51-53]、人工核酸内切酶系统等在内的不同基因操作工具,在生殖细胞基因组中删除外源目的基因,而在非生殖细胞基因组中保留外源目的基因,创制新型F1转基因家蚕种。这一策略既可实现外源有益蛋白在转基因家蚕特定组织或器官中的表达(即 目的经济性状的实现),又可避免转基因在后代蚕种保留所带来的生物安全隐患。利用上述策略, 有望从根本上解决F1转基因蚕种的安全控制问题,推动建立较为完善的转基因家蚕安全操作技术体系促进转基因家蚕的产业化开发与应用,同时为其他动植物物种的安全转基因研究发展提供重要 参考。
总而言之,随着科学技术尤其是转基因技术的不断进步与发展,期望转基因家蚕能够在不久的将来,作为一种真正实现安全转基因的昆虫甚至动物范本,通过不断消除转基因生物的安全隐患,消除公众对转基因生物安全性的疑虑,推动安全转基因技术的多元化发展及转基因经济动物的产业化开发,实现使转基因技术造福于人的目标。
[1] James C. 2015年全球生物技术/转基因作物商业化发展态势. 中国生物工程杂志, 2016, 36(4): 1-11.
James C. Global status of commercialized biotech/GM crops: 2015., 2016, 36(4): 1-11. (in Chinese)
[2] 王大元. 美国转基因三文鱼商业化的启示. 科学通报, 2016, 61(3): 289-295.
Wang D Y. Implications of US GMO Salmon approved for commercial food use., 2016, 61(3): 289-295. (in Chinese)
[3] 张然, 王嫒嫒, 鲍永华, 赵杰, 李宁. 转基因动物应用的研究现状与生物安全评价. 生物产业技术, 2010(3): 48-59.
Zhang R, Wang Y Y, Bao Y H, Zhao J, Li N. Current status and biosafety evaluation of transgenic animals., 2010(3): 48-59. (in Chinese)
[4] 连庆, 王伟威. 我国转基因动物研究进展及安全评价管理. 江苏农业科学, 2012, 40(8): 287-289.
Lian Q, Wang W W. Research progress and safety evaluation of transgenic animals in China., 2012, 40(8): 287-289. (in Chinese)
[5] 许建香, 李宁. 转基因动物生物安全研究与评价. 生物工程学报, 2012, 28(3): 267-281.
Xu J X, Li N. Biosafety assessment of genetically engineered animals., 2012, 28(3): 267-281. (in Chinese)
[6] 王根平, 杜文明, 夏兰琴. 植物安全转基因技术研究现状与展望. 中国农业科学, 2014, 47(5): 823-843.
Wang G P, Du W M, Xia L Q. Current status of transgenic technologies for safety consideration in plants and future perspectives., 2014, 47(5): 823-843. (in Chinese)
[7] 陈亮, 黄庆华, 孟丽辉, 邢焕, 姚斌, 杨晓光, 张宏福. 转基因作物饲用安全性评价研究进展. 中国农业科学, 2015, 48(6): 1205-1218.
Chen L, Huang Q H, Meng L H, Xing H, Yao B, Yang X G, Zhang H F. Safety evaluation of feeds from genetically modified crops on livestock and poultry., 2015, 48(6): 1205-1218. (in Chinese)
[8] 包琪, 贺晓云, 黄昆仑. 转基因食品安全性评价研究进展. 生物安全学报, 2014, 23(4): 248-252.
Bao Q, He X Y, Huang K L. Review of food safety evaluation on genetically modified food., 2014, 23(4): 248-252. (in Chinese)
[9] Toshiki T,Chantal T, Corinne R, TOSHIO K, EAPPEN A, MARI K, NATUO K, JEAN-LUC T, BERNARD M, GéRARD C, PAUL S, MALCOLM F, JEAN-CLAUDE P, PIERRE C. Germline transformation of the silkwormL. using atransposon-derived vector., 2000, 18(1): 81-84.
[10] Schetelig M F, Götschel F, Viktorinová I, Handler A M, Wimmer E A. Recombination technologies for enhanced transgene stability in bioengineered insects., 2011, 139(1): 71-78.
[11] Tomita M, Hino R, Ogawa S, Iizuka M, Adachi T, Shimizu K, Sotoshiro H, Yoshizato K. A germline transgenic silkworm that secretes recombinant proteins in the sericin layer of cocoon., 2007, 16(4): 449-465.
[12] Li Z, You L, Zeng B, Ling L, Xu J, Chen X, Zhang Z, Palli S R, Huang Y, Tan A. Ectopic expression of ecdysone oxidase impairs tissue degeneration in., 2015, 282(1809): 20150513.
[13] Thomas J L, Da Rocha M, Besse A, Mauchamp B, Chavancy G. 3×P3-EGFP marker facilitates screening for transgenic silkwormL. from the embryonic stage onwards., 2002, 32(3): 247-253.
[14] Tomita M, Munetsuna H, Sato T, Adachi T, Hino R, Hayashi M, Shimizu K, Nakamura N, Tamura T, Yoshizato K. Transgenic silkworms produce recombinant human type III procollagen in cocoons., 2003, 21(1): 52-56.
[15] Kojima K, Kuwana Y, Sezutsu H, Kobayashi I, Uchino K, Tamura T, Tamada Y. A new method for the modification of fibroin heavy chain protein in the transgenic silkworm., 2007, 71(12): 2943-2951.
[16] Uhlířová M, Asahina M, Riddiford L M, Jindra M. Heat-inducible transgenic expression in the silkmoth., 2002, 212(3): 145-151.
[17] Imamura M, Nakahara Y, Kanda T, Tamura T, Taniai K. A transgenic silkworm expressing the immune-inducible cecropin B-GFP reporter gene., 2006, 36(5): 429-434.
[18] Karasaki N, Mon H, Takahashi M, Lee J M, Koga K, Kawaguchi Y, Kusakabe T. Establishment of tetracycline- inducible gene expression systems in the silkworm,., 2009, 31(4): 495-500.
[19] Tan A, Fu G, Jin L, Guo Q, Li Z, Niu B, Meng Z, Morrison N I, Alphey L, Huang Y. Transgene-based, female-specific lethality system for genetic sexing of the silkworm,., 2013, 110(17): 6766-6770.
[20] Tatsuke T, Lee J M, Kusakabe T, Iiyama K, Sezutsu H, Uchino K. Tightly controlled tetracycline-inducible transcription system for explosive gene expression in cultured silkworm cells., 2013, 82(4): 173-182.
[21] Imamura M, Nakai J, Inoue S, Quan G X, Kanda T, Tamura T. Targeted gene expression using thesystem in the silkworm., 2003, 165(3): 1329-1340.
[22] Nakayama G, Kawaguchi Y, Koga K, KUSAKABE T. Site-specific gene integration in cultured silkworm cells mediated by φC31 integrase., 2006, 275(1): 1-8.
[23] Yonemura N, Tamura T, Uchino K, Kobayashi I, Tatematsu K, Iizuka T, Sezutsu H, Muthulakshmi M, Nagaraju J, Kusakabe T. PhiC31 integrase-mediated cassette exchange in silkworm embryos., 2012, 287(9): 731-739.
[24] Yonemura N, Tamura T, Uchino K, Kobayashi I, Tatematsu K, Iizuka T, TSUBOTA T, Sezutsu H, Muthulakshmi M, Nagaraju J, Kusakabe T. phiC31- integrase-mediated, site-specific integration of transgenes in the silkworm,(Lepidoptera: Bombycidae)., 2013, 48(3): 265-273.
[25] Long D P, Zhao A C, Xu L X, Lu W J, Guo Q, Zhang Y, Xiang Z H.site-specific integration of transgene in silkworm via PhiC31 integrase-mediated cassette exchange., 2013, 43(11): 997-1008.
[26] Long D P, Zhao A C, Chen X J, Zhang Y, Lu W J, Guo Q, Handler A M, Xiang Z H. FLP recombinase-mediated site-specific recombination in silkworm,., 2012, 7(6): e40150.
[27] Long D P, Lu W J, Hao Z Z, Xiang Z H, Zhao A C. Highly efficient and inducible DNA excision in transgenic silkworms using the FLP/site-specific recombination system., 2016, 25(6): 795-811.
[28] Kômoto N, Tomita S. Development of a clonal analysis system in the silkworm,, mediated by FLP and., 2012, 81(2): 63-67.
[29] Wang W, Lin C, Lu D, Ning Z, Cox T, Melvin D, Wang X, Bradley A, Liu P. Chromosomal transposition ofin mouse embryonic stem cells., 2008, 105(27): 9290-9295.
[30] Horn C, Offen N, Nystedt S, Hacker U, Wimmer E A.-based insertional mutagenesis and enhancer detection as a tool for functional insect genomics., 2003, 163(2): 647-661.
[31] Uchino K, Sezutsu H, Imamura M, Kobayashi I, Tatematsu K I, Iizuka T, Yonemura N, Mita K, Tamura T. Construction of a-based enhancer trap system for the analysis of gene function in silkworm., 2008, 38(12): 1165-1173.
[32] 张雨丽, 张桂征, 闭立辉, 祁广军, 赵爱春. 转绿色荧光蛋白基因家蚕品系的纯化与综合经济性状改良. 蚕业科学, 2013, 39(2): 384-389.
Zhang Y L, Zhang G Z, Bi L H, Qi G J, Zhao A C. Purification and comprehensive economic trait improvement of transgeniclines with enhanced green fluorescent protein gene., 2013, 39(2): 384-389. (in Chinese)
[33] Goldsmith M R, Shimada T, Abe H. The genetics and genomics of the silkworm,., 2005, 50: 71-100.
[34] Xu H F, Xia Q Y, Liu C, Cheng T C, Zhao P, Duan J, Zha X F, Liu S P. Identification and characterization of-like elements in the genome of domesticated silkworm,., 2006, 276(1): 31-40.
[35] Daimon T, Mitsuhiro M, Katsuma S, Abe H, Mita K, Shimada T. Recent transposition of, a novel- like transposable element in the genome of the silkworm,., 2010, 53(8): 585-593.
[36] Finnegan D J. Transposable elements., 1992, 2(6): 861-867.
[37] Long D P, Lu W J, Zhang Y L, Bi L H, Xiang Z H, Zhao A C. An efficient strategy for producing a stable, replaceable, highly efficient transgene expression system in silkworm,., 2015, 5: 8802.
[38] Duan J p, Xu H f, Ma S y, Guo H z, Wang F, Zhao P, Xia Q Y. Cre-mediated targeted gene activation in the middle silk glands of transgenic silkworms ()., 2013, 22(3): 607-619.
[39] Horn C, Handler A M. Site-specific genomic targeting in., 2005, 102(35): 12483-12488.
[40] Oberstein A, Pare A, Kaplan L, Small S. Site-specific transgenesis by Cre-mediated recombination in., 2005, 2(8): 583-585.
[41] Wimmer E A. Insect transgenesis by site-specific recombination., 2005, 2(8): 580-582.
[42] Schetelig M F, Handler A M. A functional comparison of thepromoter by recombinase-mediated cassette exchange inand a tephritid fly,., 2013, 3: 687-693.
[43] Haghighat-Khah R E, Scaife S, Martins S, St John O, Matzen K J, Morrison N, Alphey L. Site-specific cassette exchange systems in themosquito and themoth., 2015, 10(4): e0121097.
[44] Takasu Y, Kobayashi I, Beumer K, Uchino K, Sezutsu H, Sajwan S, Carroll D, Tamura T, Zurovec M. Targeted mutagenesis in the silkwormusing zinc finger nuclease mRNA injection., 2010, 40(10): 759-765.
[45] Ma S Y, Zhang S L, Wang F, Liu Y, Liu Y Y, Xu H F, Liu C, Lin Y, Zhao P, Xia Q Y. Highly efficient and specific genome editing in silkworm using custom TALENs., 2012, 7(9): e45035.
[46] Wang Y, Li Z, Xu J, Zeng B, Ling L, You L, Chen Y, Huang Y, Tan A. The CRISPR/Cas System mediates efficient genome engineering in., 2013, 23(12): 1414-1416.
[47] Daimon T, Kiuchi T, Takasu Y. Recent progress in genome engineering techniques in the silkworm,., 2014, 56(1): 14-25.
[48] Nakade S, Tsubota T, Sakane Y, Kume S, Sakamoto N, Obara M, Daimon T, Sezutsu H, Yamamoto T, Sakuma T, SUZUKI K T. Microhomology-mediated end-joining-dependent integration of donor DNA in cells and animals using TALENs and CRISPR/Cas9., 2014, 5: 5560.
[49] Wang Y, Tan A, Xu J, Li Z, Zeng B, Ling L, You L, Chen Y, James A A, Huang Y. Site-specific, TALENs-mediated transformationof., 2014, 55: 26-30.
[50] Xu J, Bi H, Chen R, Aslam A F, Li Z, Ling L, Zeng B, Huang Y, Tan A. Transgenic characterization of two testis-specific promoters in the silkworm,., 2014, 24(2): 183-190.
[51] 赵爱春, 龙定沛, 谭兵, 许龙霞, 向仲怀. FLP/位点特异性重组系统在高等真核生物中的研究进展. 中国农业科学, 2011, 44(15): 3252-3263.
Zhao A C, Long D P, Tan B, Xu L X, Xiang Z H. Progress in research of FLP/site-specific recombination system in higher eukaryotes., 2011, 44(15): 3252-3263. (in Chinese)
[52] 龙定沛, 谭兵, 赵爱春, 许龙霞, 向仲怀. Cre/位点特异性重组系统在高等真核生物中的研究进展. 遗传, 2012, 34(2): 177-189.
Long D P, Tan B, Zhao A C, Xu L X, Xiang Z H. Progress in Cre/site-specific recombination system in higher eukaryotes., 2012, 34(2): 177-189. (in Chinese)
[53] Xu L X, Zhao A C, Long D P, Tan B, Xiang Z H. φC31 integrase mediates genome manipulation in higher eukaryotes., 2011, 37(3): 507-519.
(责任编辑 岳梅)
Current Status of Transgenic Technologies for Safety Consideration in Silkworm () and Future Perspectives
LONG DingPei, Hao ZhanZhang, XIANG ZhongHuai, ZHAO AiChun
(Institute of Sericulture and Systems Biology, Southwest University/State Key Laboratory of Silkworm Genome Biology/Key Laboratory of Sericultural Biology and Genetic Breeding, Ministry of Agriculture, Chongqing 400716)
Transgenic technology is an important tool for gene function analysis and genetic improvement of biological variety.At present, the safety problems of GMOs mainly focus on the safety of genetic manipulation techniques and genetically modified products. In recent years, the researches on the safety of GMOs werefocused on evaluating the security level of genetically modified crops, aquatic animals and poultry, livestock and other large animals in medicine, agriculture, and food industry, but the reports of the safety of genetic manipulation techniquesare still rare in the agricultural insects which have important scientific and economic value, and the Ministry of Agriculture has not yet set a precedent forthe safety assessment of transgenic insects. The silkworm () is an important mode lepidopteran and economic insect for agriculture. In-depth research on the safety of transgenic technologies of, which has important value and significance for promoting the development of basic genetics and silk industry. Since the first report of the germline transformation of theusing atransposon-derived vector in 2000, transgenic technology has been widely used in the basic research of gene function identification and the applied research of creating new varieties with specific gene differences in. But the safety problems of transgenichave become the key problems that hindering the practical application of transgenic. Therefore, doing research on the safety of transgenic technologies ofis of great significance to promote the safety assessment and industrialization of transgenic. This paper summarizes the establishment and research status of the conditional gene targeting-based safety of transgenic technologies of, while the development trends and application prospect of these technologies inare also discussed, as well as provide references for establishing andperfecting the safety of transgenic technologies in other transgenic animals, especially the agriculture insect species.
silkworm(); biosafety; safe transgenic technology; site-specific recombination; marker gene deletion; target genome editing and integration
2017-03-30;
2017-05-23
国家现代农业产业技术体系建设专项(CARS-22-ZJ0102)、中国博士后科学基金(2015M580768,2016T90829)、重庆市基础科学与前沿技术研究专项(cstc2016jcyjA0237)、中央高校基本科研业务费项目(XDJK2016C089)
龙定沛,Tel:023-68251903;E-mail:dplong@yeah.net。
赵爱春,Tel:023-68251803;E-mail:zhaoaichun@hotmail.com;zhaoaichun@swu.edu.cn
