液相贝克曼重排反应催化剂研究进展
2018-02-03王珍妮陈祥铤刘俊华胡鸿雨
王珍妮,赵 滢,陈祥铤,傅 威,刘俊华,胡鸿雨
芳香酮或脂肪酮和羟胺作用生成酮肟,酮肟在催化剂作用下,发生分子内重排,生成相应酰胺,这个反应称为贝克曼重排反应,此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名[1]。其反应机理如下:
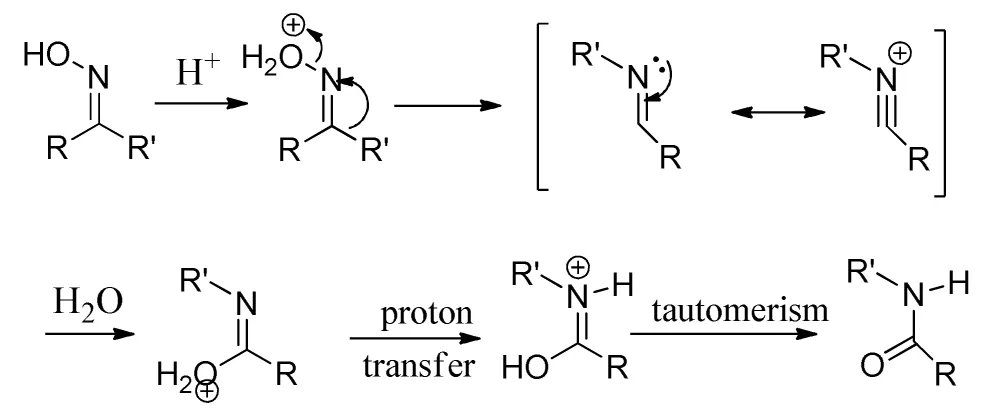
图1 贝克曼重排反应机理
贝克曼重排反应是由酮肟合成酰胺的重要反应[2],在有机合成中有极其重要的地位,工业上利用环己酮肟发生贝克曼重排生产大量己内酰胺,而己内酰胺是尼龙纤维和树脂制造必需的起始原料[3]。
传统贝克曼重排所用催化剂为液体酸或金属氧化物,如 H2SO4、HCl、H3PO4等[4]。 这类催化剂具有很高的转化率和选择性,但因其具有强酸性、强氧化性、强腐蚀性,并产生大量无机盐副产物,导致后处理繁琐,产物分离难,反应后废液对环境产生很大破坏[5]。寻找温和、高效的催化剂催化贝克曼重排反应,对有机化学及相关领域发展有着十分重要的意义。
贝克曼重排实施方法按反应物状态可分为气相贝克曼重排和液相贝克曼重排,气相贝克曼重排反应避免了大量产生副产物硫酸钠,也解决了设备腐蚀的问题[6-7],但该法需在高温下进行,副产物多,催化剂使用寿命短,使其工业化困难。而液相贝克曼重排反应具有反应温度较低,能耗较低,成本较低等特点[8],而备受研究者们追捧。贝克曼重排反应关键在于酮肟与氮相连羟基的离去,一个好的催化剂有利于和羟基结合转化为容易离去的基团,从而促进反应进行。鉴于以上上述原因,本文着重综述了近年来液相贝克曼重排反应催化体系。
1 离子液体催化
离子液体作为环境友好溶剂表现出很大的潜力,被称为“绿色溶剂”[9],并因其可循环利用受到高度重视[10]。
Peng J.J.等[11]研究了以含磷化合物作催化剂,分别在离子液体1-丁基-3-甲基咪唑三氟乙酸盐(BMImTFA)、正丁基吡啶四氟硼酸盐(BPyBF4)和1-丁基-3-甲基咪唑四氟硼酸盐(BMImBF4)中进行贝克曼重排反应,结果发现:以PCl5为催化剂、在80℃条件下,在BPyBF4离子液体进行重排反应,己内酰胺的选择性可达99%,环己酮肟的转化率更是高达100%。但在后处理过程中,离子液体和催化剂均被破坏,无法重复使用。
王洪林等[12]研究了将离子液体负载在惰性催化剂MCM-48上,形成的催化剂载体能促使PCl5高效、高选择性催化环己酮肟进行贝克曼重排。其中以20%离子液体-MCM-48作催化剂载体,以PCl5作催化剂,甲苯作溶剂,环己酮肟的转化率为97%,己内酰胺的选择性为94.6%,具体数据见表1。

表1 不同催化剂载体对重排反应的影响Tab.1 Effect of catalysts on the rearrangement
王洪林还研究了回收催化剂载体对重排反应的影响,发现重复使用时环己酮肟的转化率为98%,己内酰胺的选择性为92.1%,具体结果见表2。重复使用催化剂效果理想,但因离子液体稳定性很差,有些使用一次之后就会变黑,能否多次使用有待继续研究。

表2 不同的回收催化剂对重排反应的影响Tab.2 Effect of the recovered catalysts on the reaction
Kore R等[13]研究了一种可回收的双功能酸性离子液体催化剂,通过改变阴阳离子制备了离子液体(ILS)。发现以[Hmim][Cl]为催化剂,苯乙酮肟的转化率达到100%,酰胺的选择性也有93%。Ren R.X.[14]研究了在离子液体1-丁基-3-甲基咪唑六氟磷酸盐(BMIPF6)中,以P2O5或伊顿试剂(7.7%的甲基磺酸钠溶液)作催化剂,温度为75℃的条件下环己酮肟分别反应16 h或21 h,收率高达95%或99%,其反应式如下:
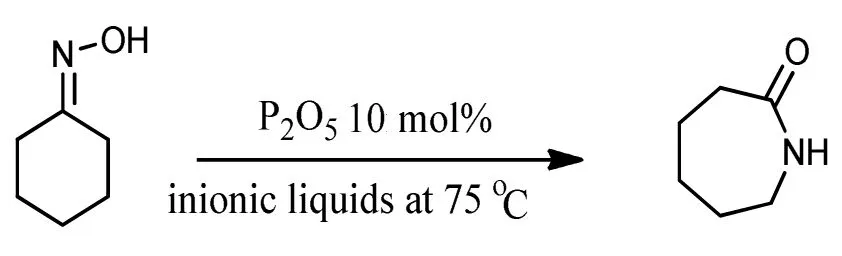
目前,离子液体催化液相贝克曼重排效率可观,但因离子液体价格昂贵,极易分解,不易保存,反应后与溶剂结合非常牢固,两者很难分离,不利于产物的精制及下游产品制备。如何克服这些弊端,尚待更深入研究,以利于工业化应用推广。
2 酸催化
2.1 无机中强酸催化
Zheng L等[15]研究以硅磺酸作催化剂,在乙腈或者丙酮中用450 W的微波辐射反应5 min,酰胺的收率为91%,反应式如下:
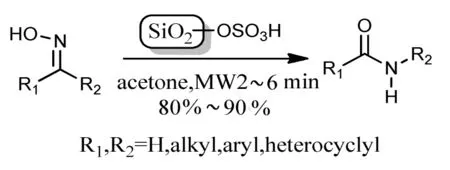
该方法操作简单,但磺酸基极易水解,故反应体系中不能有水,而且催化剂不易回收。
Hiroshi Satao等[16]用P2O5作催化剂,研究了不同加热条件下贝克曼重排反应的进程,发现以DMF为溶剂,于95℃温度条件下反应2 h,环己酮肟转化率达到99.8%,己内酰胺选择性为94.2%。若改成微波辐射法,环己酮肟的转化率达到98.69%,己内酰胺的选择性为95.75%。程庆彦等[17]在微波辐射下,以P2O5为催化剂,催化环己酮肟在液相中的贝克曼重排,研究发现:在P2O5的质量分数为14.0%,微波辐射强度为280 W,辐射时间为5 min时,环己酮肟转化率最高,达到98.69%,己内酰胺选择性为95.75%。
将相应中强酸浸渍负载在特定固相载体上,形成非均相反应体系,以改善其催化性能。也是当下研究热点。Marziano N.C.等[18]研究了将不同强度的酸(硫酸、磷酸、甲基磺酸等)浸渍于硅胶上进行非均相催化贝克曼重排反应,研究显示:无论何等强度的酸浸渍硅胶,非均相催化反应过程中都会使肟发生水解,酸性催化剂还易失活,直接导致产率降低。其中将硫酸浸渍到二氧化硅上,辅以ZrSO3时己内酰胺的收率最高,可达92%。
Tatsumi T.等[19]用苯甲腈作溶剂,对用H-USY分子筛做催化剂催化液相贝克曼重排的反应也做了类似研究,发现当反应体系无水时,酰胺的收率为67.1%;当反应体系含水时,收率增加至78.2%,说明一定量的水有利于重排反应进行,原因在于,水利于溶剂苯甲腈水解反应,从而减少水对底物肟的水解副反应。
2.2 有机酸及其衍生物催化
有机酸指一些具有酸性的有机化合物。最常见的有羧酸,其酸性源于羧基 (-COOH)。磺酸(-SO3H)、亚磺酸(RSOOH)、硫羧酸(RCOSH)等也属于有机酸,有机酸衍生物主要包括酰氯和磺酰氯等。
Xiao L.F.等[20]研究了各种催化剂对苯乙酮肟贝克曼重排影响,发现以对甲苯磺酸为主催化剂,ZnCl2为助催化剂,乙腈为溶剂回流5 h,可得到99%的收率,具体数据见表3。
进一步研究该催化剂对不同结构酮肟底物的催化效果,发现各类酮肟反应收率高低不等,其中环己酮肟转化为己内酰胺收率仅40%,苯乙酮肟转换率却高达97%。
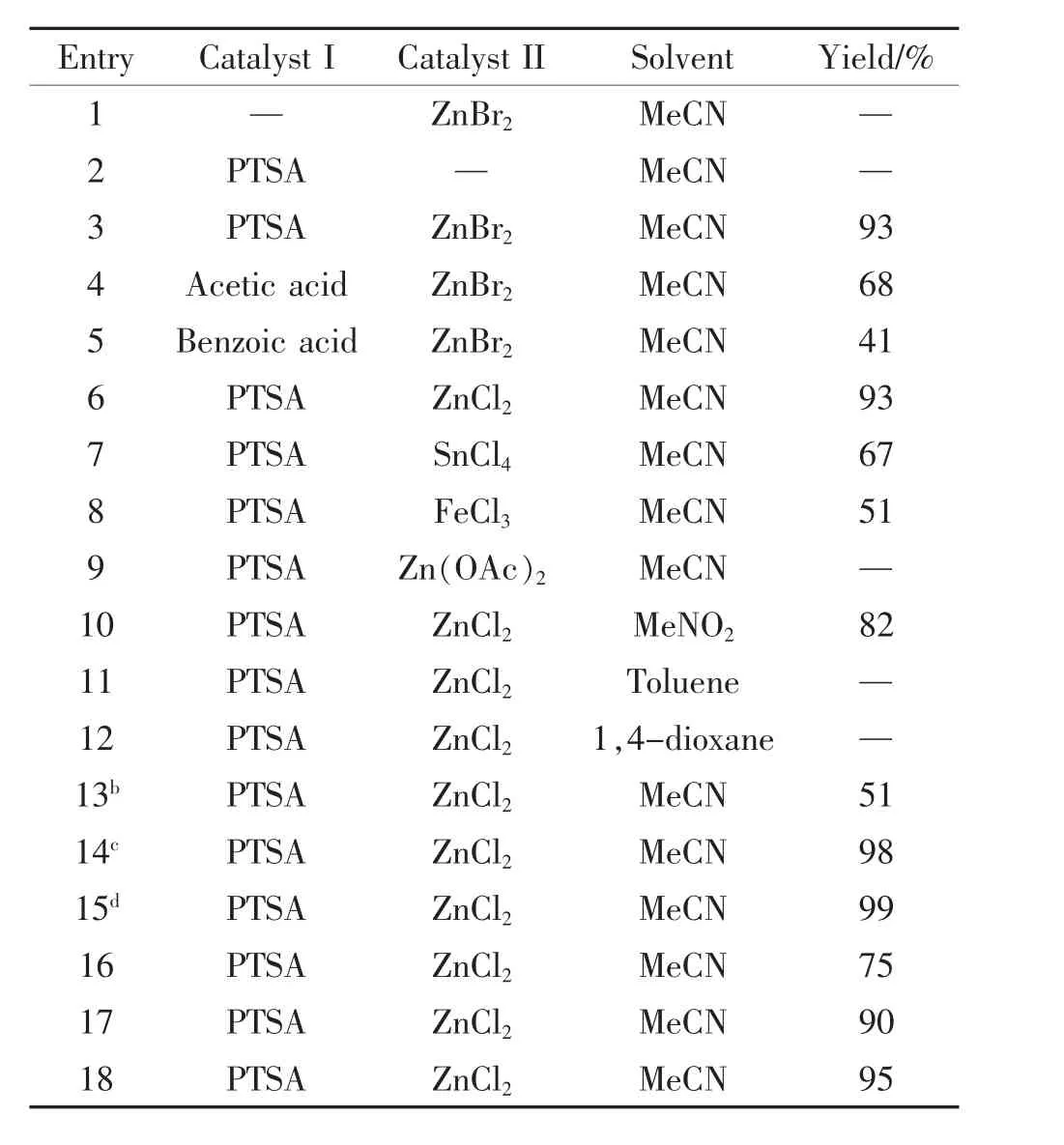
表3 反应条件对苯乙酮肟贝克曼重排反应的影响Tab 3 Effects of reaction conditions on the Beckmann rearrangement of acetophenone oxime
张风雷等[21]研究比较了各类催化剂活性后,选择活性较高的对甲苯磺酰氯(TsCl)作催化剂,乙腈作溶剂,催化环己酮肟制备己内酰胺。结果表明在乙腈中保温60℃反应2.5 h,环己酮肟转化率为98.4%,己内酰胺选择性为93.6%。该方法操作简单,反应条件温和,但催化剂无法回收重复使用。
You K.Y.等[22]以一种磺酸树脂作催化剂,于130℃下反应12 h,环己酮肟转化率为100%,己内酰胺的选择性为97.9%。
其反应机理如下:
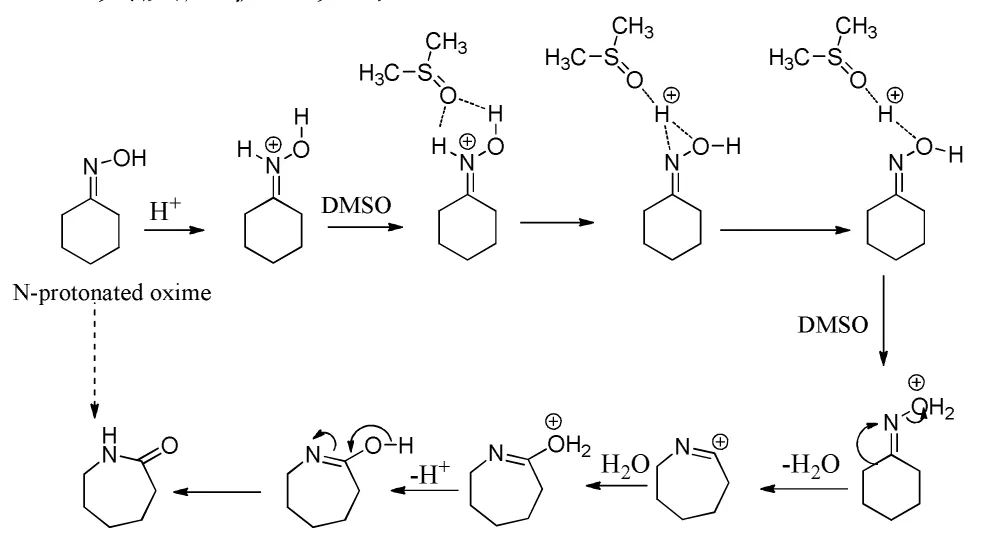
磺酸树脂参与反应一次后可通过酸浸泡活化再生,但因磺酸树脂机械强度差,反应温度高,故参与一次反应后就会出现树脂破裂现象,导致其再次催化效果大大下降。
Giampaolo Giacomelli等[23]以三聚氯氰作催化剂,DMF作溶剂,环己酮肟室温下反应3 h,转化率可达100%,但作者未探讨三聚氯氰对己内酰胺的选择性及催化剂的回收重复使用效果。Masaharu Hashimoto等[24]以六氯三聚磷腈为催化剂,在六氟异丙醇(HFIP)中进行液相贝克曼重排,用甲基磺酸、正丁醇和水的混合物处理重排粗产物,得到酰胺收率为92%,但HFIP非常昂贵,不能满足于工业要求。
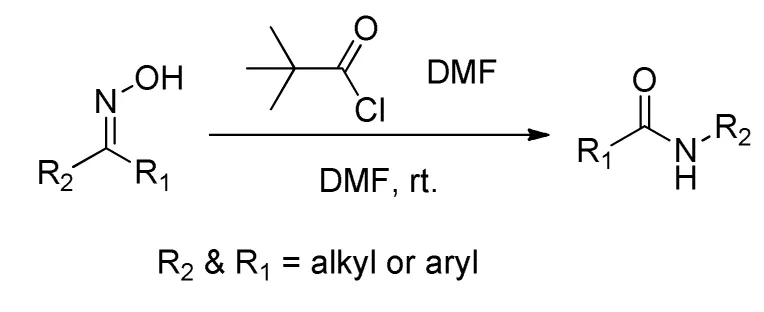
Srinivasa Reddy Narahari等[25]用特戊酰氯催化肟进行贝克曼重排(反应式如下),室温下反应2.5 h,点板跟踪贝克曼重排反应进程,环己酮肟转化率达到100%。
2.3 金属氯化盐类催化
2.3.1 AlCl3催化剂
Liu L F等[26]报道了在氮气保护、恒温恒压条件下,以无水乙腈为溶剂,AlCl3为催化剂,进行贝克曼重排反应相关研究,各种构型的底物所得酰胺产率均较好。其中二苯甲酮肟重排产物收率高达99%,其余二芳基酮肟重排为相应酰胺也均不低于90%,但当芳基上连有较强给电子基(如甲氧基等)的酮肟时,贝克曼重排的最终产率下降了20%左右,这一发现值得进一步理论探讨。
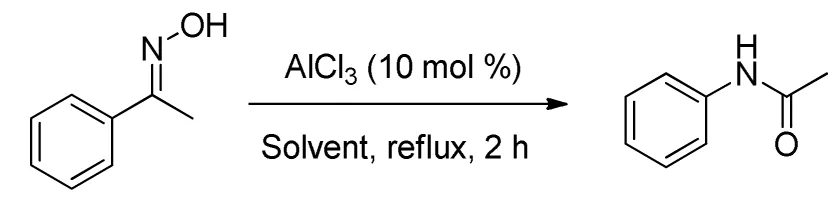
Ghiaci M等[27]报道了不同底物和AlCl3以不同比例混合的催化效果,酮肟转化率均大于80%。但AlCl3作催化剂必须要求反应体系无水,因此工业化困难。
2.3.2 FeCl3催化剂
Sheena Mahajan 等[28]研究了 FeCl3·6H2O 催化酮肟贝克曼重排。在以二苯甲酮肟为研究底物,发现FeCl3·6H2O在无水甲苯中对贝克曼重排的具有较好催化效果。进一步研究比较1,2-二氯乙烷、甘醇二甲醚、乙腈及二噁烷等溶剂对FeCl3·6H2O催化重排反应影响,发现乙腈的催化效果最好;同时还研究了以FeCl3·6H2O为催化剂的一锅法固相反应,从二苯甲酮一步反应生成N-苯基苯甲酰胺,产率可达92%,改变芳基酮底物上,所得相应的酰胺产率均在80%以上。
受Comelis A[29]将ZnCl2浸渍于蒙脱石催化剂的启发,S.G.Pai等[30]将FeCl3溶于无水乙腈后再加入蒙脱土K10混合反应从而制得粘土型催化剂。该催化剂在甲苯中能实现酮肟高效贝克曼重排,且可回收重复使用5次,之后于280℃下活化1 h,可再继续使用,其活性没有明显的损失。结果表明二甲苯酮肟在该催化剂的催化下进行贝克曼重排反应,产率可达98%,其他的二芳基酮肟重排为酰胺的产率也均在90%以上,不过对于芳基上连接强吸电子基或强给电子基的酮肟,贝克曼重排的催化效率呈小幅下降,但仍保持在90%以上;对于单芳基酮肟的反应,因反应物底物碳原子所连两个基团都可能发生重排迁移,导致副产物较多,产率较低,在50%左右波动。
2.3.3 BiCl3催化剂
Ashim J等[31]研究了微波辐射金属固相反应法对贝克曼重排反应的影响。结果表明:将二苯甲酮肟与BiCl3混合在微波辐射下照射8 min,得到N-苯基苯甲酰胺的产率高达90%;而对于其他酮肟的贝克曼重排也具有一定的催化效果,产率均在70%以上,且芳基上连有强吸电子或强给电子的酮肟相比连有弱吸电子基或弱给电子基的酮肟,贝克曼重排效率相对低一些。在其他条件相同,不使用微波辐射的情况下,单独进行固相反应,最终产率仅为40%。由此可见,微波辐射对BiCl3催化重排反应有特别促进作用。
2.3.4 ZnCl2催化剂
ZnCl2为交界路易斯酸,单独使用即具有催化贝克曼重排反应能力。Loupy等[32]报道了ZnCl2在微波辐射下能够有效催化苯甲醛肟和邻羟基苯乙酮肟贝克曼重排反应,通过对比实验发现微波辐射可提高产率,在无溶剂条件下产率高于有溶剂存在条件下的产率。Furuya Y等[33]也研究过ZnCl2的催化贝克曼重排反应,发现以ZnCl2为催化剂,以乙腈为溶剂,在ArCl中反应回流,苯乙酮肟的转换率高达100%。
也有研究者将ZnCl2作为辅助催化剂使用,李等[34]以ZnCl2作为辅助催化剂,氨基磺酸为主催化剂,催化贝克曼重排,以苯乙酮肟为底物,在无水乙腈溶剂中,用氨基磺酸作为主催化剂,ZnCl2为辅助催化剂,产率由原来的48%增至98%。和Wang等[35]单以氨基磺酸为催化剂的研究比较,发现ZnCl2助催化剂的加入显著提高了酮肟贝克曼重排的效率。进一步实验研究,发现这种复合催化剂对与连有强吸电子基的酮肟催化效率较低,而其余芳基酮肟催化效率较为可观。
2.3.5 HgCl2催化剂
Ramalingan C等[36]研究了以HgCl2为催化剂,乙腈为溶剂催化二苯甲酮肟的贝克曼重排反应,酰胺收率为96%,其机理如下。
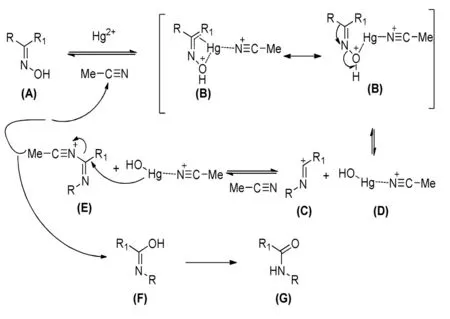
改变反应底物结构,研究发现,以HgCl2为催化剂催化贝克曼重排,酰胺收率都在80%以上,唯独己内酰胺的收率只有48%,说明该类催化剂尚不适于环酮肟类重排反应。HgCl2催化效率很高,但因汞属剧毒重金属,对环境及人体危害较大,故不适于工业化生产推广。
2.3.6 稀有金属氯化盐类催化剂
Surya Kanta De等[37]报道了用RuCL3作为催化剂催化贝克曼重排反应,将肟溶于乙腈溶剂,再加入RuCl3催化剂,回流反应即可得到产物,且酰胺收率为90%。Arisawa M等[38]以铑复合物作催化剂,在磺酸溶液中进行反应,得到了78%的收率。
Yasuo Kikugawa等[39]研究了ZrCl4对于芳基酮肟进行贝克曼重排的影响,发现ZrCl4催化酮肟选择性较强,可以在一定程度上保证酮肟转变为构型单一的酰胺,而不存在顺式和反式两种,提高酰胺的选择性,相应构型产率提高,研究所涉及的芳基酮肟的转换率在60%~80%不等。Torisawa等[40]研究ZrCl4及甲磺酰氯共同作用下的贝克曼重排,发现添加ZrCl4的重排反应催化效果显著增加,在室温下反应1 h,相应酰胺收率即可达到80%。
3 Mukaiyama试剂催化
Azadi R等[41]以Mukaiyama试剂作催化剂,乙腈作溶剂,三乙胺作碱催化贝克曼重排反应,其反应机理如下:
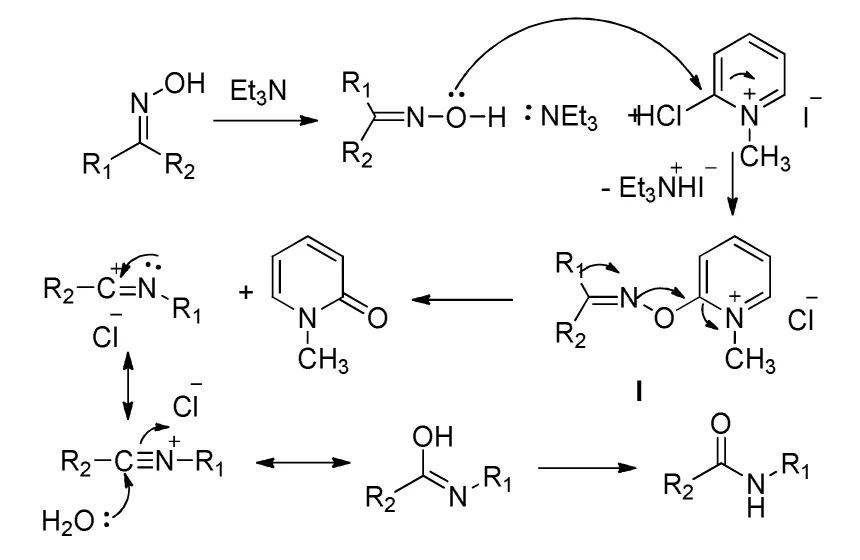
其中二苯甲酮肟的转化率达到了97%,该催化剂对不同结构酮肟底物的催化效果研究,发现酰胺收率都在85%以上,且反应条件温和,不需加热,室温即可完成,反应时间短。对不同结构的酮肟,最长反应时间35 min,最短的对硝基苯酮肟,不到1 min即可完成重排,且产率达到93%。该类催化剂特别优势在于对苯环有强吸电子基团硝基的底物催化反应效果极好,其他类催化剂很难达到这种效果。唯一不足之处在于三乙胺必须在0℃~6℃保存,且毒性很强,因此该方法要应用于现在对环保要求日益严格的工业化生产,还需要做大量研究工作。
4 总论与展望
近年来,贝克曼重排反应的各种新型催化剂不断涌现,但对不同取代基的酮肟贝克曼重排反应催化选择性研究有待进一步深入;对能催化芳环上含有强吸电子基团的贝克曼重排反应研究报道还太少;可以重复利用的催化剂报道也不多。在绿色化学的大背景下,以降低成本、提高催化效率为前提,开发环保、高效催化剂仍是当前研究的一大挑战。
[1] 荣国斌,袁履冰,王全瑞,等.高等有机化学[M].上海:华东理工大学出版社,2007:457.
[2]Donaruma L G,Heldt W Z.The Beckmann rearrangement[J].Org.Reactions,1960,11:1-156.
[3] Chu Y,Ji P,Yi X,et al.Strong or weak acid,which is more efficient for Beckmann rearrangement reaction over solid acid catalysts[J].Catalysis Science& Technology,2015,5:3675.
[4] Pi H J,Dong J D,An N,et al.Unexpected results from the re-investigation of the Beckmann rearrangement of ketoximes into amides by using TsCl[J].Tetrahedron, 2009,65:7790.
[5] Izumi Y,Sato S,Urabe K.Vapor-phase Beckmann rearrangement of cyclohexanone oxime over boria-hydroxyapatite catalyst[J].Chemistry Letters, 1983, 12: 1649.
[6] Conesa T D,Luque R,Campelo J M,et al.Gas-phase Beckmann rearrangement of cyclododecanone oxime on Al,B-MCM-41 mesoporous materials[J].Journal of materials science, 2009, 44: 6741.
[7] Hao F, Zhong J, Liu P L,et al.Preparation of mesoporous SiO2-Al2O3supported Co or Mn catalysts and their catalytic properties in cyclohexane nitrosation to ε-caprolactam[J].Journal of Molecular Catalysis A: Chemical,2011,351: 210.
[8] 贾金锋.液相贝克曼重排合成 ε-己内酰胺研究[D].郑州:郑州大学,2015.
[9] 黄碧纯,黄仲涛.离子液体的研究开发及其在催化反应中的应用[J].工业催化,2003,11:1.
[10]Wasserscheid P, Keim W.Ionic liquids—new “solutions”for transition metal catalysis[J].Angewandte Chemie International Edition, 2000, 39: 3772.
[11]Peng J,Deng Y.Catalytic Beckmann rearrangement of ketoximes in ionic liquids[J].Tetrahedron Letters, 2001, 42:403.
[12]Kore R, Srivastava R.A simple, eco-friendly, and recyclable bi-functional acidic ionic liquid catalysts for Beckmann rearrangement[J].Journal of Molecular Catalysis A:Chemical, 2013, 376: 90.
[13]王洪林,张文媛.在负载离子液体的MCM-48上的环己酮肟重排[J].云南大学学报 (自然科学版),2008,30(2): 180.
[14]Ren R X, Zueva L D, Ou W.Formation of ε-caprolactam via catalytic Beckmann rearrangement using P2O5in ionic liquids[J].Tetrahedron Letters, 2001, 42: 8441.
[15]Li Z,Ding R,Lu Z,et al.Silica sulfate as a recyclable and efficient catalyst for Beckmann rearrangement under microwave irradiation[J].Journal of Molecular Catalysis A:Chemical, 2006, 250: 100.
[16]程庆彦,姬亚宁,王延吉.微波辐射促进P2O5催化液相贝克曼重排制己内酰胺 [J].石油学报 (石油加工),2011,27:393.
[17]Sato H,Yoshioka H,Izumi Y.Homogeneous liquid-phase Beckmann rearrangement of oxime catalyzed by phosphorous pentaoxide and accelerated by fluorine-containing strong acid[J].Journal of Molecular Catalysis A: Chemical,1999, 149:25.
[18]Marziano N C, Ronchin L, Tortato C, et al.Catalyzed Beckmann rearrangement of cyclohexanone oxime in heterogeneous liquid/solid system:Part 1:Batch and continuous operation with supported acid catalysts[J].Journal of Molecular Catalysis A:Chemical, 2007, 277:221.
[19]Ngamcharussrivichai C, Wu P, Tatsumi T.Catalytically active and selective centers for production of?-caprolactam through liquid phase Beckmann rearrangement over H-USY catalyst[J].Applied Catalysis A: General, 2005,288:158.
[20]Xiao L,Xia C,Chen J.p-Toluenesulfonic acid mediated zinc chloride:highly effective catalyst for the Beckmann rearrangement[J].Tetrahedron Letters, 2007, 48: 7218.
[21]张风雷,章亚东.温和催化液相重排制备 ε-己内酰胺[J].精细化工,2013,30:1073.
[22]You K,Mao L,Yin D,et al.Beckmann rearrangement of cyclohexanone oxime to ε-caprolactam catalyzed by sulfonic acid resin in DMSO[J].Catalysis Communications,2008, 9: 1521.
[23]De Luca L,Giacomelli G,Porcheddu A.Beckmann rearrangement of oximes under very mild conditions[J].The Journal of organic chemistry, 2002, 67: 6272.
[24]Hashimoto M,Obora Y,Sakaguchi S,et al.Beckmann rearrangement of ketoximes to lactams by triphosphazene catalyst[J].The Journal of organic chemistry, 2008, 73:2894.
[25]Narahari S R,Reguri B R,Mukkanti K.Beckmann rearrangement of oximes using pivaloyl chloride/DMF complex[J].Tetrahedron letters, 2011, 52: 4888.
[26]Liu L F,Liu H, Pi H J, et al.Facile AlCl3-Promoted Catalytic Beckmann Rearrangement of Ketoximes[J].Synthetic Communications, 2011, 41: 553.
[27]Ghiaci M,Imanzadeh G H.A facile Beckmann rearrangement of oximes with AlCl3in the solid state[J].Synthetic, , :
[28]Mahajan S, Sharma B, Kapoor K K.A solvent-free one step conversion of ketones to amides via Beckmann rearrangement catalysed by FeCl3·6H2O in presence of hydroxylamine hydrochloride[J].Tetrahedron Letters, 2015,56:1915.
[29]Mahajan S, Sharma B, Kapoor K K.A solvent-free one step conversion of ketones to amides via Beckmann rearrangement catalysed by FeCl3·6H2O in presence of hydroxylamine hydrochloride[J].Tetrahedron Letters, 2015,56:1915.
[30]Pai S G,Bajpai A R,Deshpande A B,et al.Beckmann rearrangement of substituted diaryl ketoximes using FeCl3impregnated montmorillonite K10[J].Synthetic communications, 1997, 27: 379.
[31]Thakur A J,Boruah A,Prajapati D,et al.Microwave induced bismuth trichloride catalysed Beckmann rearrangement of oximes[J].Synthetic Communications, 2000, 30:2105.
[32]Loupy A, Régnier S.Solvent-free microwave-assisted Beckmann rearrangement of benzaldehyde and 2-hydroxyacetophenone oximes[J].Tetrahedron letters, 1999, 40:6221.
[33]Furuya Y,Ishihara K,Yamamoto H.Cyanuric chloride as a mild and active Beckmann rearrangement catalyst[J].Journal of the American Chemical Society, 2005, 127:11240.
[34]Li J T, Meng X T, Yin Y.Efficient procedure for Beckmann rearrangement of ketoximes catalyzed by sulfamic acid/zinc chloride[J].Synthetic Communications ,2010,40:1445.
[35]Wang B,Gu Y,Luo C,et al.Sulfamic acid as a cost-effective and recyclable catalyst for liquid Beckmann rearrangement,a green process to produce amides from ketoximes without waste[J].Tetrahedron letters, 2004, 45:3369.
[36]Ramalingan C,Park Y T.Mercury-catalyzed rearrangement of ketoximes into amides and lactams in acetonitrile[J].The Journal of organic chemistry,2007,72:4536.
[37]Kanta De S.RuCl3catalyzed facile conversion of arylalkyl ketoximes to amides[J].Synthetic communications, 2004,34:3431.
[38]Arisawa M,Yamaguchi M.Rhodium-catalyzed Beckmann rearrangement[J].Organic letters, 2001, 3: 311.
[39]Kikugawa Y,Tsuji C,Miyazawa E,et al.A new intramolecular migration of the imino group of O-arylketoximes to the aryl group under the Beckmann condition[J].Tetrahedron Letters, 2001, 42: 2337.
[40]Torisawa Y,Nishi T,Minamikawa J.Continuing efforts on the improvement of Beckmann rearrangement of indanone oxime[J].Bioorganic&medicinal chemistry letters, 2007,17:448.
[41]Azadi R,Shams L.The Highly efficient Beckmann rearrangement of ketoximes to amides by using Mukaiyama reagent under mild conditions[J].Letters in Organic Chemistry, 2017, 14: 141.
