青蛤MAPK/p38基因的克隆及Poly:Ic胁迫下的表达分析
2018-02-02姚玥彤王玉梅侯梓园石雅峰潘宝平闫春财
姚玥彤,王玉梅,侯梓园,王 斌,石雅峰,潘宝平,闫春财*
(1.天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2.天津市北大港湿地自然保护区管理中心,天津 300270)
青蛤(Cyclinasinensis)是我国传统的经济养殖贝类[1],它不仅肉质鲜美,还具有极高的药用和营养价值。但近年来,随着不断扩大的增养殖规模、日益加深的集约化程度以及不断恶化的养殖环境,青蛤的大规模病害和死亡现象日渐增多[2]。为了保证青蛤养殖业的可持续发展,更好地推动我国沿海经济的发展,青蛤免疫抗病害方面的研究迫在眉睫。
贝类属于非特异性免疫系统,其中Toll样受体是非特异性免疫反应中一类重要的识别受体,在对抗病原物的侵染过程中起着关键作用[3-8]。MAPK家族是TLRs信号通路中的重要成员之一,它作为介导细胞反应的一种重要信号系统,参与了细胞间多种生化反应信号的识别、传递以及放大等处理过程[9]。目前研究认为MAPKs主要由细胞外信号调节激酶1/2、氨基末端激酶、p38MAPK和ErK5这4条信号转导途经组成[10-12]。p38是MAPKs通路的主要蛋白之一,它的激活途径很保守,属于典型的3级激酶级联反应磷酸化激活途径[9]。目前对此通路的研究在脊椎类如人类[13]、小鼠[14]等中的报道较多,但在无脊椎动物中的报道较少,因此对贝类免疫学的研究具有重要的理论意义。探究MAPK/p38在MAPKs信号通路中的作用,为探索丝裂原活化蛋白激酶所参与的青蛤免疫机制提供重要的试验数据,并为选育贝类新品种、开发疫苗提供理论依据,减少其养殖过程中的大规模死亡现象,从而推动沿海地区的经济发展。
1 材料与方法
1.1材料在天津大港的滩涂区域采集青蛤后选取各形态指标无显著差异的有活性个体为试验对象,在海水密度为1.02~1.04 g/cm3,水温为21~24 ℃,pH 7.0的通气人工海水中暂养14 d左右[15]。暂养期间需要每天更换一次水且持续曝气,并喂养一次0.005 g/mL的小球藻[16]。该试验所用的Poly:Ic低温冷冻保存于天津师范大学生命科学学院分子免疫学实验室内[17]。
1.2方法
1.2.1材料处理。饲养14 d后选取无明显形态差异且表面无破损的青蛤进行分组。试验之前将保存的Poly:Ic接种到2216E液体培养基中(比例1∶100)。将接好的菌种转移进摇床中培养1 d,控制温度为37 ℃、转速为200 r/min,用无菌海水洗脱至OD600=0.4[17]。试验组每只青蛤注射50 μL Poly:Ic菌液,对照组中每只青蛤注射等量的灭菌生理盐水。每个组别采用随机分组的方法设置10个平行组。在注射0、3、6、12、24、48、96 h后分别提取青蛤的血淋巴冷冻备用。
1.2.2青蛤转录组文库构建。TRIZOL法提取青蛤各个组织的总RNA,用RNA提取试剂盒分离mRNA。采用第二代MiSeq测序仪,pair end双端模式完成青蛤转录组测序,利用De novo RNA-seq analysis技术综合分析,分析相关基因功能注释和代谢途径,后通过筛选得到MAPK/p38基因的类似序列。
1.2.3MAPK/p38基因结构域的克隆及生物信息学分析。利用获得的MAPK/p38基因类似序列设计克隆引物MAPK/p38-S:5′-CCAATGTCTTAGCCCGGTAGG-3′,MAPK/p38-A:5′-GTAAGGGTGTGCAAGAGCC-3′,进行克隆,与GenBank中的核酸数据库进行Blastx比对,并完成系统树的建立。
1.2.4Poly:Ic刺激下青蛤MAPK/p38基因在血淋巴内的时序性表达。按照上述材料中的方法处理青蛤,并分别在0、3、6、12、24、48、96 h时提取Poly:Ic试验组和对照组青蛤血淋巴的总RNA后,将其反转成cDNA(TRIZOL法),保存在-20 ℃条件下[18]。
以β-actin基因为内参基因进行实时定量,β-actin-S:5′-CACCACAACTGCCGAGAG-3′,β-actin-A:5′-C-CGATAGTGATGACCTGACC-3′;MAPK/p38-S:5′-CCAATGTCTTAGCCCGGTAGG-3′,MAPK/p38-A:5′-GTAAGGGTGTGCAAGAGCC-3′,上述为所用引物[15]。
Rotor-Gene 7500实时定量PCR仪为反应仪器。扩增体系共20 μL,其反应程序为95 ℃预变性30 s,94 ℃变性5 s,56 ℃退火30 s,72 ℃延伸 30 s,40个循环。采用2-ΔΔCT法进行数据处理,用SPSS 19.0软件对数据进行分析[16]。
1.2.5Poly:Ic刺激后青蛤不同组织中的表达特征。在Poly:Ic刺激后用TRIZOL法提取青蛤血淋巴、闭壳肌、外套膜、肝脏和鳃的总RNA,之后反转成cDNA,-20 ℃保存。内参基因、实时定量时所用的引物序列、体系和程序、数据处理方法同“1.2.4”。
2 结果与分析
2.1青蛤MAPK/p38基因的生物信息学分析分析显示MAPK/p38基因无跨膜区,为完整的胞内蛋白;其信息传递序列位于第30~40个氨基酸;有一个完整的激酶结构域:S-TKc,位于第27~311个氨基酸;建立系统发育树(图1),青蛤的MAPK/p38基因与光滑双脐螺的亲缘关系最近。

图1 青蛤MAPK/p38基因和其他物种的MAPK/p38基因氨基酸序列构建的系统树Fig.1 The phylogenetic tree constructed by the amino acid sequence of MAPK/p38 from C. sinensis and MAPK/p38 from other species
2.2青蛤MAPK/p38基因结构域的克隆用“1.2.3”中的引物,采用PCR技术扩增得到青蛤MAPK/p38基因的结构域序列(图2),结构域序列长855 bp。扩增体系为25 μL,其反应程序为95 ℃预变性30 s,94 ℃变性5 s,60 ℃退火1 min,72 ℃延伸30 s,40个循环。

图2 青蛤MAPK/p38基因结构域的克隆结果Fig.2 Cloning result of genetic structure domain of MAPK/p38 from C. sinensis
2.3青蛤MAPK/p38基因在不同组织间的表达以β-actin基因在各组织中的表达量为内参对照,利用实时荧光定量PCR分析MAPK/p38基因在青蛤刚刚注射Poly:Ic后其血淋巴、肝脏、外套膜、闭壳肌和鳃5个组织中的表达情况,结果表明该基因在以上组织中普遍表达(图3),但表达量有明显不同,在血淋巴中表达量最高,与其他组织相比差异极显著(P<0.01),鳃中表达量最少。

图3 MAPK/p38基因在青蛤不同组织中的表达分布Fig.3 The distribution of MAPK/p38 expression in different tissues of C.sinensis
2.4Poly:Ic刺激下青蛤MAPK/p38基因在血淋巴中的时序性表达以β-actin基因为内参基因,用实时定量荧光PCR技术分析被Poly:Ic侵染后的青蛤MAPK/p38基因在血淋巴中表达的时序性变化。结果表明:表达量达到最大值时为刺激3 h后,与对照组相比存在极显著差异(P<0.01),之后的数值逐渐下降,最后趋于正常水平(图4)。
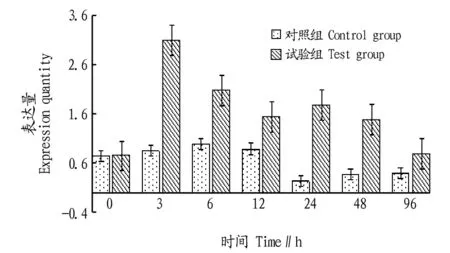
图4 Poly:Ic刺激下青蛤MAPK/p38基因在血淋巴中的时序性表达结果Fig.4 The temporal expression of MAPK/p38 gene in hemolymph was stimulated by the Poly:Ic
3 讨论
该试验发现,经Poly:Ic刺激过后的试验组中,目的基因在各个组织中均有表达,其中在血淋巴中表达量最高,在鳃中的表达量最低。这与未刺激时目的基因在各个组织中表达的相对含量一致;在随后的时序性表达中发现,经Poly:Ic刺激后的96 h中血淋巴内的表达量呈先升高后又逐渐减少直至趋于正常水平的趋势,在刺激3 h后达到表达的最高值且与对照组的差异具有高度统计学意义。这与刺激其他动物的结果相吻合:长牡蛎和蚕的defenfe经刺激后血淋巴的表达量明显上升并在刺激6 h后达到最高值[19-20],虾夷扇贝的TOllip和NF-κB基因在刺激3 h后表达量显著上升,而且MKK和TNFR基因的表达水平也有变化[21-24]。青蛤血淋巴中MAPK/p38基因在刺激后大量表达这一现象,能揭示该基因的表达产物可能承担着青蛤对于防御细菌感染等免疫应答方面的特殊作用。同时,由于表达结果所得数据与其他微生物刺激后的表达量具有差异性,得知青蛤MAPK/p38基因在不同刺激下的免疫应答反应进程是不同的,并且发现在Poly:Ic菌液刺激下的免疫应答程度更显著。后续可以从以上方面入手进一步研究。
青蛤受到外界因素胁迫后,其血淋巴中MAPK/p38基因表达在较短时间内至最大值,说明病原物能够识别并诱导TLRs免疫受体及下游MAPK/p38信号通路蛋白,而后使其血液中合成相应的免疫信号蛋白,防止机体自身受到外来胁迫物的侵害。同时,MAPK/p38基因的表达量大体上呈现先升高后降低的趋势,证明MAPK/p38基因参与了非特异免疫的全部过程。该试验结果为探索丝裂原活化蛋白激酶所参与的青蛤免疫机制提供了重要的试验数据,并为选育贝类新品种、开发疫苗提供相应的理论依据。
[1] 丁理法,徐礼明.贝类人工育苗技术之一青蛤全人工育苗技术要点[J].中国水产,2005(12):43-44.
[2] 孙成渤,施文革,张鹏,等.青蛤亲贝的培育技术[J].天津农林科技,2005(1):4-6.
[3] GE H,WANG G D,ZHANG L L,et al.Molecular cloning and expression of interleukin-1 receptor-associated kinase 4,an important mediator of Toll-like receptor signal pathway,from small abaloneHaliotisdiversicolor[J].Fish & shellfish immunology,2011,30(4/5):1138-1146.
[4] MEDZHITOV R,PRESTON-HURLBURT P,JANEWAY JR C A.A human homologue of theDrosophilaToll protein signals activation of adaptive immunity[J].Nature,1997,388(6640):394-397.
[5] ZHANG D,ZHANG G,HAYDEN M S,et al.A toll-like receptor that prevents infection by uropathogenic bacteria[J].Science,2004,303(5663):1522-1526.
[6] TAKEUCHI O,KAWAI T,SANJO H,et al.TLR6:A novel member of an expanding toll-like receptor family[J].Gene,1999,231(1/2):59-65.
[7] CHUANG T H,ULEVITCH R J.Cloning and characterization of a sub-family of human toll-like receptors:hTLR7,hTLR8 and hTLR9[J].Eur Cytokine Netw,2000,11(3):372-378.
[8] HEMMI H,TAKEUCHI O,KAWAI T,et al.A Toll-like receptor recognizes bacterial DNA[J].Nature,2000,408(6813):740-745.
[9] 王晓琳,周元丽,孙伟,等.p38MAPK信号通路调控人主动脉平滑肌细胞Ⅰ型和Ⅲ型胶原的表达[J].山东大学学报(医学版),2016,54(8):12-16.
[10] 刘婷婷,张淑萍,覃筱燕,等.MAPK信号转导通路与神经损伤研究进展[J].中国公共卫生,2016,32(2):248-254.
[11] HUANG Y N,LAI C C,CHIU C T,et al.L-ascorbate attenuates the endotoxin-induced production of inflammatory mediators by inhibiting MAPK activation and NF-κB translocation in cortical neurons /glia cocultures[J].Plos one,2014,9 (7):1-12.
[13] NASHIDA T,TAKUMA K,FUKUDA S,et al. The specific Na+/Ca2+exchange inhibitor SEA0400 prevents nitric oxide-induced cytotoxicity in SH-SY5Y cells[J].Neurochemistry international,2011,59(1):51-58.
[14] 李熙.p38MAPK信号通路在逆灸防治阿尔茨海默病模型大鼠中的作用研究[D].武汉:湖北中医药大学,2012.
[15] 高晶,任毅鹏,潘宝平,等.鳗弧菌(Vibrioanguillarum)侵染对青蛤(Cyclinasinensis)髓样分化因子88基因表达的影响[J].海洋与湖沼,2015,46(2):440-445.
[16] 杨莹,高珊,潘宝平,等.青蛤(Cyclinasinensis)IRAK-4基因的克隆及其组织间的表达分析[J].安徽农业科学,2015,43(27):33-36.
[17] 任毅鹏,高晶,潘宝平,等.青蛤(Cyclinasinensis)TLR2基因的克隆与表达分析[J].海洋与湖沼,2014,45(5):1037-1043.
[18] 罗凯娅,刘欣欣,葛端阳,等.鳗弧菌(Vibrioanguillarum)侵染对青蛤(Cyclinasinensis)谷胱甘肽硫转移酶及其基因表达的影响[J].海洋与湖沼,2012,43(4):735-740.
[19] 刘敏敏,占鹏飞,黄绍华,等.家蚕组织蛋白酶L及其特异性抑制剂基因参与微生物诱导蚕体的免疫响应研究[J].蚕业科学,2015,41(4):650-657.
[20] 张冉冉,韦秀梅,杨建敏,等.短蛸(Octopusocellatus)酪氨酸蛋白激酶基因的克隆及其mRNA在细菌刺激后的表达规律[J].海洋与湖沼,2015,46(1):173-180.
[21] 邢强.虾夷扇贝(Patinopectenyessoensis)肿瘤坏死因子受体(TNFR)的全基因组鉴定、进化分析和其在免疫应答中的表达谱构建[C]//遗传多样性:前沿与挑战—中国的遗传学研究(2013-2015)—2015中国遗传学会大会论文摘要汇编.上海:中国遗传学会,2015.
[22] 李若佼.虾夷扇贝(Patinopectenyessoensis)NF-κB家族的基因鉴定及表达分析[C]//遗传多样性:前沿与挑战—中国的遗传学研究(2013-2015)—2015中国遗传学会大会论文摘要汇编[C].上海:中国遗传学会,2015.
[23] 李若佼.虾夷扇贝NF-κB家族基因和Tollip基因鉴定及表达分析[D].青岛:中国海洋大学,2015.
[24] 邹佳君.虾夷扇贝(Patinopectenyessoensis)MAPKK基因家族结构及表达分析[D].青岛:中国海洋大学,2015.
