鲬鱼肉酶解物抗氧化活性的研究
2018-02-01戴遥吴胜军舒留泉王祥鹏徐亚军于梦媛盘赛昆
戴遥,吴胜军,2,3,舒留泉,王祥鹏,徐亚军,于梦媛,盘赛昆,2,3,*
(1.淮海工学院海洋生命与水产学院,江苏连云港222005;2.江苏省海洋资源开发研究院,江苏连云港222005;3.江苏省海洋生物产业技术协同创新中心,淮海工学院,江苏连云港222005;4.江苏天边渔村食品有限公司,江苏连云港222005)
肽(peptide)是蛋白质水解过程的中间生成物,具有多种生物活性,包括促进免疫、激素调节抗疲劳、降血脂等生理作用,且食用安全性极高,容易被人体所吸收[1]。因此,在功能性食品添加剂与多肽药物研发过程中,功能性短肽食品的开发与应用必将对功能性食品产生不可替代的影响[2]。
鲬鱼(Platycephalus indicus),又名狗腿鱼、秘书鱼等,属于硬骨鱼纲,鲬科。分布于太平洋西部和印度洋,我国黄海与渤海产量较大,是我国重要的经济鱼类。然而国内外学者对鲬鱼的研究较少,大多集中在生物学方面[3],对鲬鱼中的各种活性物质进行研究尚未见报道。而鱼类中蛋白质含量丰富,是肽的主要来源,渐渐受到重视,李吉绪等[4]通过检测鲢鱼肽对DPPH自由基的清除作用、对羟自由基的清除作用和抑制脂质过氧化作用的能力来研究其体外抗氧化活性,结果表明:经过酶解制得的鲢鱼肽具有一定的抗氧化活性。厉望[5]以带鱼为原料,优化带鱼蛋白的酶解条件,评价了酶解物的抗氧化特性,并采用多种分离技术方法对抗氧化肽进行分离纯化,得到抗氧化性最高的组分对自由基清除率比分离前提高了27%,表明分离纯化能明显提高带鱼抗氧化肽的抗氧化能力。因此,采用酶定向适度水解技术制备活性肽是其深加工和高值化利用的重要发展方向。
1 材料与方法
1.1 原料与试剂
鲜活鲬鱼:连云港水产批发市场;D-脱氧核糖、2-硫代巴比妥酸(生化试剂):BIO BASIC INC(Canada);谷胱甘肽(色谱级):北京欣经科生物技术有限公司;碱性蛋白酶等(食品级);其他试剂均为分析纯。
供试酶的活力分别为菠萝蛋白酶13 996 U/g,胰蛋白酶14 995 U/g,碱性蛋白酶 14 588 U/g,胃蛋白酶34 727.4 U/g,木瓜蛋白酶7 485.6 U/g。
1.2 主要仪器设备
真空冷冻干燥机(ALpHA-4):德国CHRIST公司;紫外分光光度计(UV754N):上海精密科学仪器有限公司;台式高速冷冻离心机(TGL-16M):上海卢湘仪离心机仪器有限公司。
1.3 方法
1.3.1 水解度(DH)的测定
参照文献[6]采用pH-stat法测定。
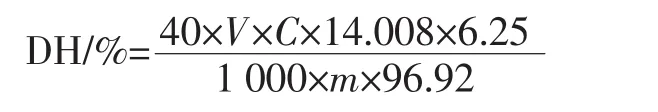
式中:V为碱液体积,mL;C为碱液的摩尔浓度,mol/L;m为底物质量,g;40为水解液稀释倍数。
1.3.2 清除羟自由基能力测定
采用酶解物对于Fenton体系产生羟自由基清除率的体外试验进行测定[7-8]。
1.3.3 肽含量的测定
采用双缩脲试剂法[9],以氧化型谷胱甘肽为标准,绘制标准曲线计算样品肽含量。
1.3.4 鲬鱼酶解工艺
1.3.4.1 鲬鱼的预处理
将新买回来的鲬鱼去头去内脏,洗净,沥干,分装,置于-40℃冰箱预冻48 h以上,取出置于托盘,放入冷冻干燥机中干燥,粉碎,用索氏抽提脱脂,再把石油醚挥发完毕之后用超微粉碎机再次粉碎,取出后分装,放在干燥器内,储存备用。
1.3.4.2 鲬鱼蛋白酶解液的制备
准确(0.001 g)称取4 g鲬鱼干粉放入三角瓶中,加200mL双蒸水配液,调节pH值,加入一定的酶,在适当的温度下酶解,每30 min测一次水解度,直到达到特定水解度为止,将酶解液装于离心管中,10 000 r/min,4℃,离心15 min,取上清液,于冰箱中保存,备用。
1.3.5 酶的选择
按表1控制5种酶在适宜的条件下酶解鲬鱼,加酶量均为2 000 U/g蛋白,根据水解进程确定适宜的酶。
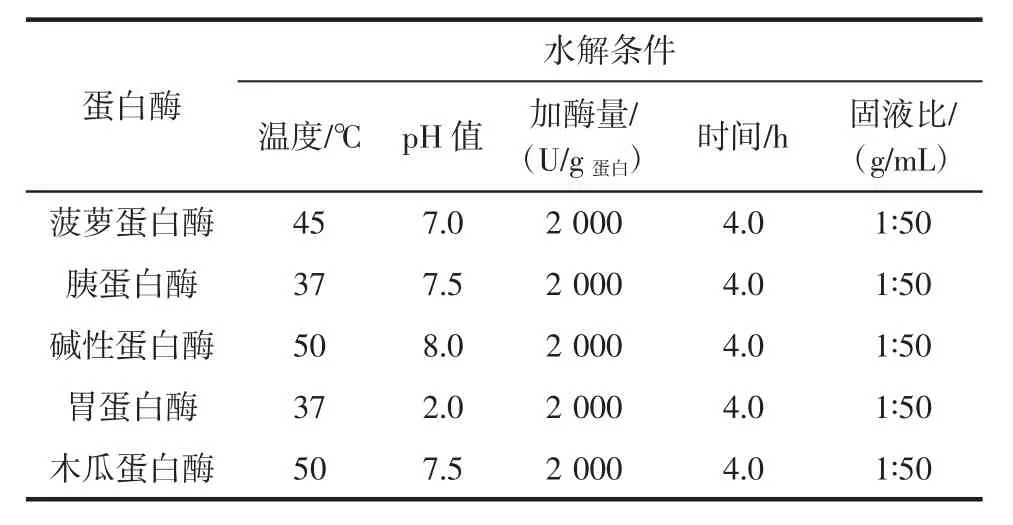
表1 供试蛋白酶作用条件Table 1 Hydrolysis conditions of tested proteinase
1.3.6 酶解单因素试验
影响酶解作用的因素一般为pH值,温度,加酶量,固液比,酶解时间5个单因素。以羟自由基清除率和水解度为指标,考察各因素对碱性蛋白酶水解作用及产物抗氧化活性的影响。
1.3.6.1 时间影响
固液比 1 ∶50(g/mL),pH=8,酶量 2 000 U/g蛋白,温度 50 ℃,时间设置为 30、60、90、120、150 min。
1.3.6.2 pH值影响
固液比 1∶50(g/mL),温度:50℃,酶量 2 000 U/g蛋白,酶解时间由1.3.6.1的试验结果确定,pH值分别为7.0、7.5、8.0、8.5、9.0。
1.3.6.3 温度影响
固液比1∶50(g/mL),pH值取1.3.6.2确定的最适合的pH值,酶量2 000 U/g蛋白,酶解时间由1.3.6.1的试验结果确定,温度分别为 40、45、50、55、60 ℃。
1.3.6.4 酶量影响
固液比 1∶50(g/mL),温度:取 1.3.6.3确定的最适温度,pH值取1.3.6.2确定的最适合的pH值,酶解时间由1.3.6.1的试验结果确定,酶量分别为1 000、1 500、2 000、2 500、3 000、3 500U/g蛋白。
1.3.6.5 固液比影响
按固液比 1 ∶30、1 ∶35、1 ∶40、1 ∶45、1 ∶50(g/mL)配成悬浮液,调整温度、pH值、酶量至以上1.3.6.2~
1.3.6.4的试验结果确定的值,水解时间由1.3.6.1的试验结果确定值。
1.3.7 响应面试验
根据单因素试验结果,选择对清除率有显著影响的因素,采用Design Expert 6.0软件设计试验方案,分析数据,构建数学回归模型,求解最优参数,因素水平见表2。
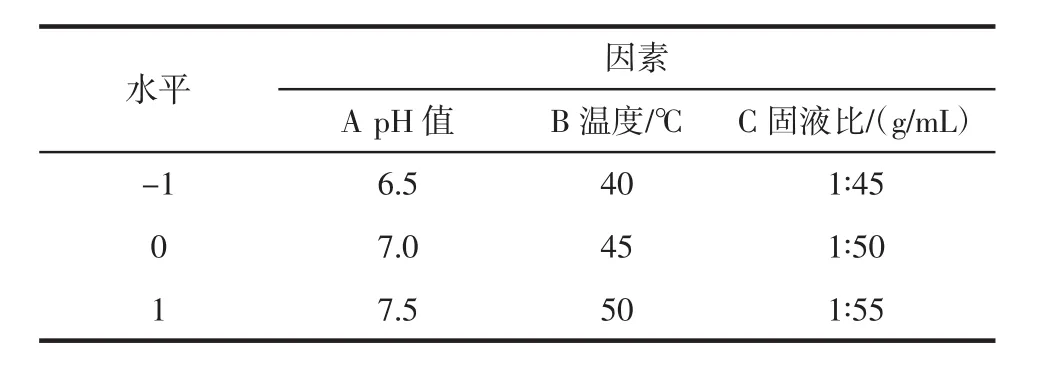
表2 响应面试验因素水平表Table 2 Factors and levels of response experiment design
1.3.8 IC50测定
采用倍比稀释的方法对样品进行系列稀释,测定其对自由基的清除率,根据样品的肽含量计算各稀释度的肽含量,作图,拟合量效关系,根据拟合方程计算IC50。
1.3.9 相对分子质量分布测定
利用凝胶层析法测定酶解物的分子量分布,通过Sephadex G-15柱(φ1.1 cm×50 cm)进行分析检测。样品的分子量通过洗脱体积根据标准曲线求出[10]。
2 结果与讨论
2.1 鲬鱼蛋白酶解物清除·OH能力测定
鲬鱼肉5种蛋白酶解液对·OH的清除作用如图1。
由图1可知,在5种供试酶中碱性蛋白酶的酶解物清除羟自由基的作用最强,水解30 min时供试酶的水解物均呈现较大的清除能力,随着水解时间的延长,不同酶的水解物清除羟自由基的能力出现不同的上下波动,但碱性蛋白酶的水解物具有较稳定羟自由基清除能力,所以选取碱性蛋白酶进行下面的试验。

图1 不同时间下酶解物对羟自由基的清除作用Fig.1 The scavenging effect of hydrolysates on hydroxyl free radical in different times
2.2 单因素试验
2.2.1 时间对碱性蛋白酶水解物清除羟自由基的影响
时间对碱性蛋白酶水解物清除羟自由基的影响如图2。
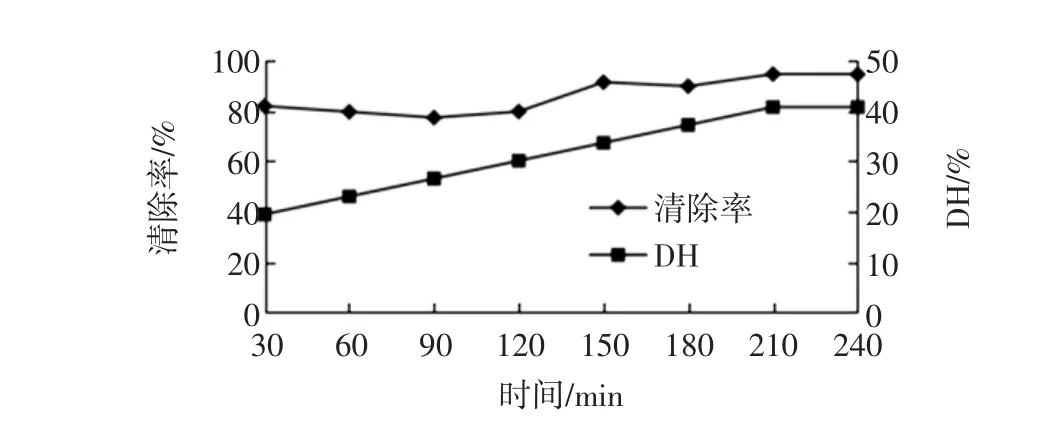
图2 时间对碱性蛋白酶清除羟自由基的影响Fig.2 The effect of different time to scavenging of Alacasle
图2显示,羟自由基清除率在30 min时即达到了较高的水平,随时间的延长维持在一个较稳定的状态。水解度则随时间的延长呈现缓慢的升高趋势,210 min时达到最大。
2.2.2 pH值对碱性蛋白酶水解物清除羟自由基的影响
pH值对碱性蛋白酶水解物清除羟自由基能力的影响如图3所示。
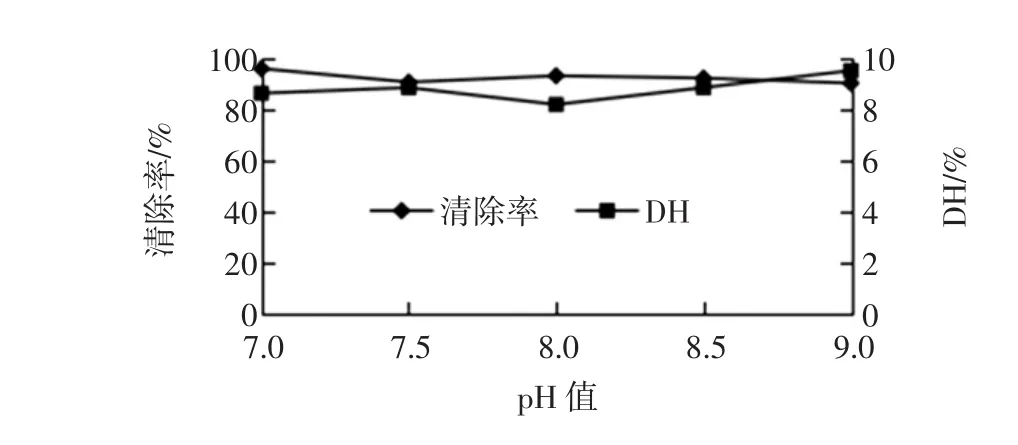
图3 pH值对碱性蛋白酶清除羟自由基能力的影响Fig.3 The effect of pH to scavenging of Alacasle
碱性蛋白酶水解物对羟自由基的清除能力在选定的范围内随pH值增大波动不大,偏碱条件下水解度相对较高。
2.2.3 温度对碱性蛋白酶水解物清除羟自由基的影响
温度对碱性蛋白酶水解物清除羟自由基能力的影响如图4。
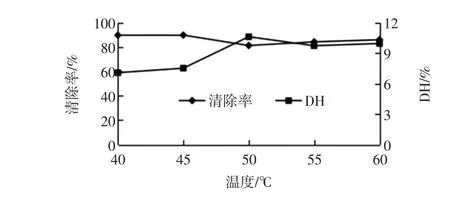
图4 温度对碱性蛋白酶清除羟自由基能力的影响Fig.4 The effect of temperature to scavenging of Alacasle
图4所示,碱性蛋白酶水解物清除羟自由基和水解度随温度的变化并不一致,50℃时水解度最大,但此时清除率处于较低的水平,55℃清除率和水解度都处在相对较高的水平,因此取55℃为适宜温度。
2.2.4 加酶量对碱性蛋白酶水解物清除羟自由基的影响
加酶量对碱性蛋白酶水解物清除羟自由基能力的影响如图5。
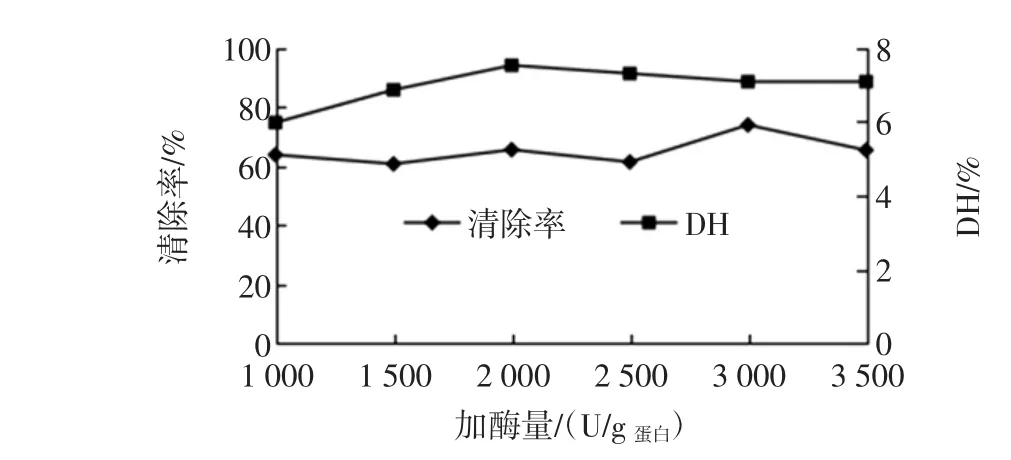
图5 酶量对碱性蛋白酶清除羟自由基能力的影响Fig.5 The effect of enzyme substrate ratio to scavenging of Alacasle
从图5可以看出,碱性蛋白酶水解物清除羟自由基的能力在加酶量为1 000 U/蛋白~2 500 U/g蛋白时无较明显波动,之后开始提升,清除率在3 000 U/g蛋白时达到最大,当酶量超过3 000 U/g蛋白时,清除率随酶量增加而有所减小。随着加酶量的增加,水解度一直保持在一定范围内,无明显变化。
2.2.5 固液比对碱性蛋白酶水解物清除羟自由基的影响
固液比对碱性蛋白酶水解物清除羟自由基能力的影响如图6。
如图6所示,碱性蛋白酶水解物对羟自由基的清除能力在1∶30(g/mL)时最大,随着固液比增加而减小,当固液比为1∶40(g/mL)时清除率最低,而后随着固液比增加清除率也增加。水解度在一定范围内波动,但不显著。
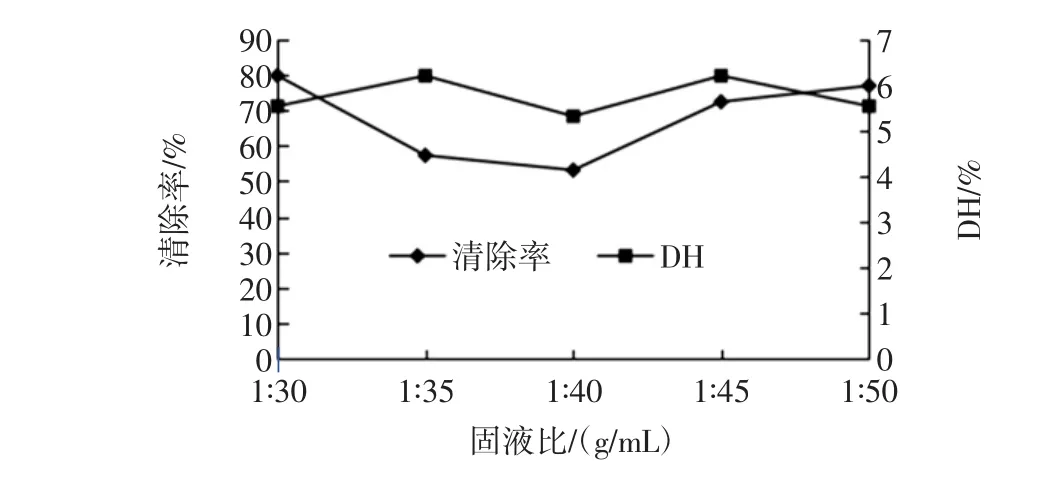
图6 固液比对碱性蛋白酶清除羟自由基能力的影响Fig.6 The effect of solid-liquid ratioto scavenging of Alacasle
2.3 响应面结果与分析
依据单因素试验的结果,由响应面试验的设计原理,对酶解条件进行优化,响应面试验安排和结果分析见表3。
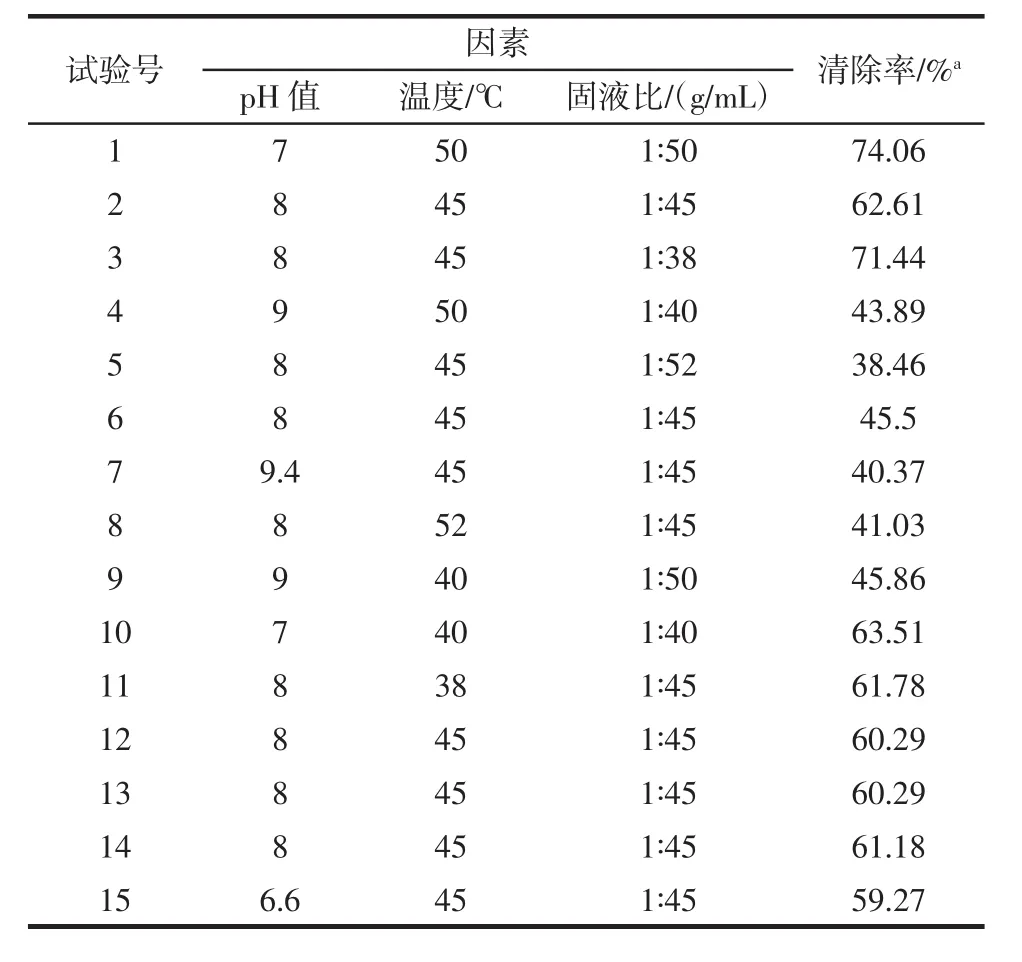
表3 响应面试验安排及结果Table 3 Experiment arrangement and results of response surface method design
经Design-Expert 6.0.10分析发现,2FI模型合适拟合试验数据,去除不显著项后,模型方差进行相应分析如表4所示。
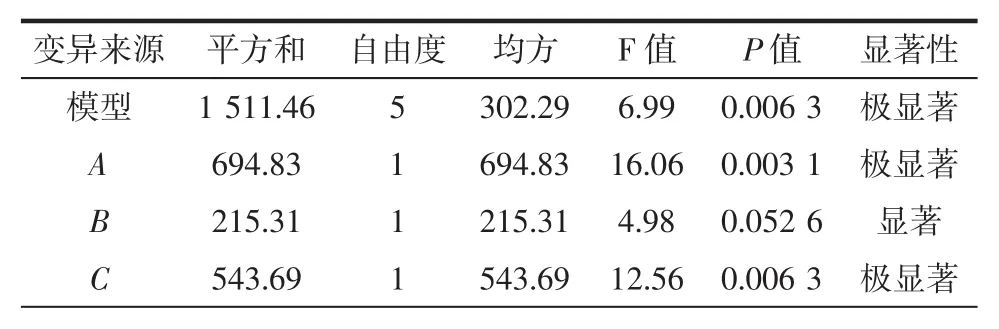
表4 优化后的模型方差分析表Table 4 The ANOVA table of the model after optimization
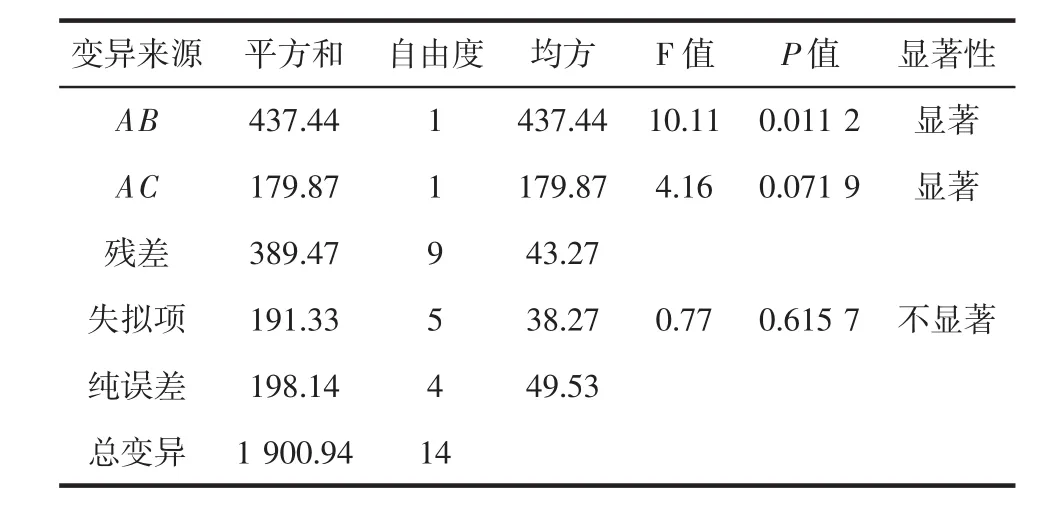
续表4 优化后的模型方差分析表Continue table 4 The ANOVA table of the model after optimization
从表4可以看出,模型和失拟项的P值分别为0.006 3与0.615 7,表明该模型拟合良好。模型的各项中,A项、C项、A与B的交互作用对响应值有极显著影响(P≤0.01),B项、A与C的交互作用对响应值有显著影响(0.05≤P≤0.1)。羟自由基清除率(SA%)与因素的回归方程为:
SA/%=-1 446.812 49+209.133 94A+22.195 39B+12.841 71C-2.957 84AB-1.896 68AC
式中:A为pH值;B为温度,℃;C为固液比,g/mL。
回归模型的最优解为:A=9.0、B=40、C=40,即最优的酶解条件是:pH值为9.0、温度为40℃、固液比为1 ∶40(g/mL)、加酶量 3 000 U/g蛋白、时间 180 min,在此条件下,SA的模型预测值为89.23%。
2.4 抗氧化肽的半清除浓度(IC50)
2.4.1 标准曲线
肽含量标准曲线见图7。
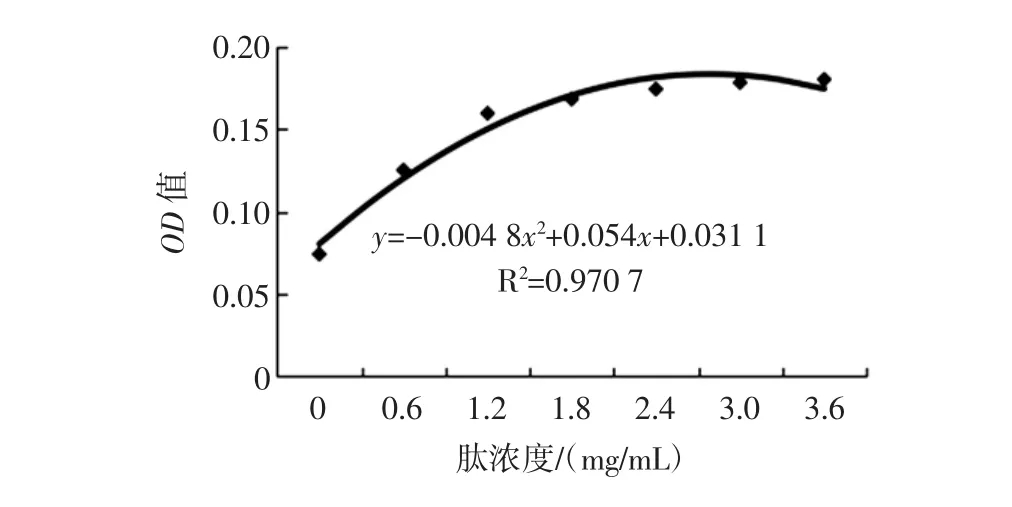
图7 肽含量标准曲线Fig.7 Standard curve of peptide
2.4.2 肽含量的测定
采用响应面试验优化得到的最佳条件进行酶解得到酶解物,测得OD值,带入肽含量标准曲线得到酶解液的肽含量为3.02 mg/mL。
2.4.3 酶解物羟自由基清除率IC50
酶解物肽含量与羟自由基清除作用量效关系如图8。
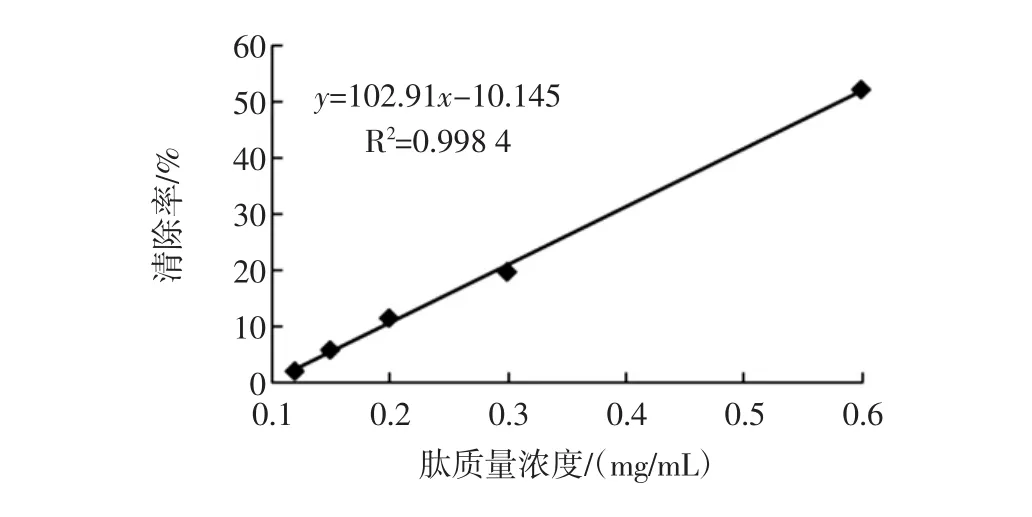
图8 肽含量与羟自由基清除率的量效关系Fig.8 The relationship between hydroxyl radical scavenging and peptide content
如图8所示,酶解物肽含量与羟自由基清除率呈很好的线性关系,采用Excel进行线性拟合得到拟合方程,根据方程计算得IC50为0.58 mg/mL。
2.5 分子量分布测定
用pH7.5磷酸缓冲液作为洗脱液,流速0.7mL/min,上样量为1.5 mL,QuadTecTM检测器进行检测,检测波长为280 nm。测得Sephadex G-15柱的Vo(流动相体积)是 17.95 mL,Vt(柱总体积)是 38.94 mL,根据保留各标准物的时间求出对应的Ve(洗脱体积),L-酪氨酸(Mr=181.19)的 Ve是 49.81 mL,辅酶 I(NAD,Mr=681.44)的Ve是30.93 mL,短杆菌肽锌(Bacit racin zinc,Mr=1 486.2)的 Ve是 23.82 mL,卡托普利(Mr=217.29)的Ve是45.14 mL,氧化型谷胱甘肽(Mr=612.63)的Ve是31.10。根据各标准物Ve计算出有效分的配系数为Kav,制成标准物曲线如图9。
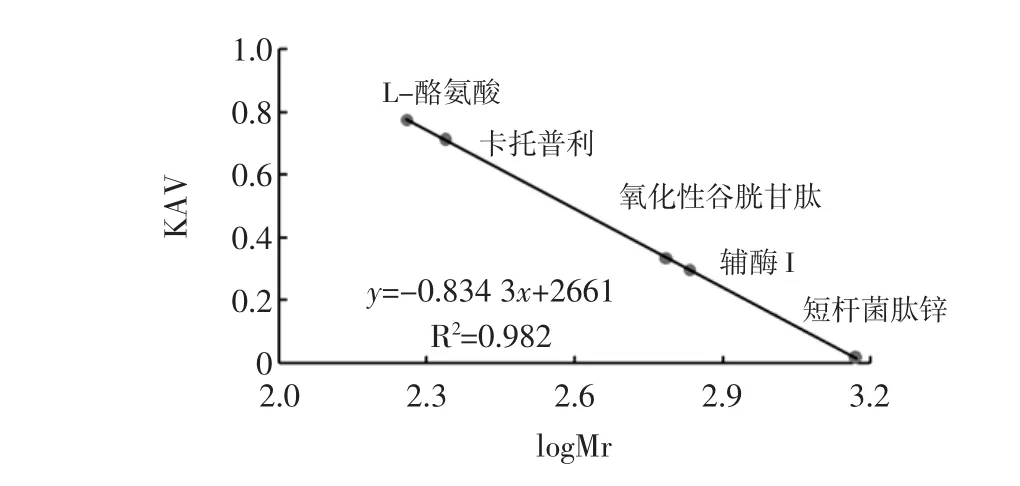
图9 SepHadex G-15柱标准物校准Fig.9 Standard curve of Standard material on SepHadex G-15
采用凝胶过滤层析分析出鲬鱼酶解物层析图谱如图10。
分子量分布采用凝胶过滤层析,峰1出现在168 min,峰 2出现在 192 min,峰 3出现在 216 min,峰4出现在230 min,又因为流速为0.7 mL/min,经过计算得出峰1的相对分子质量为3 010,峰2的相对分子质量为2 163,峰3的相对分子质量为794,峰4的相对分子质量为268。
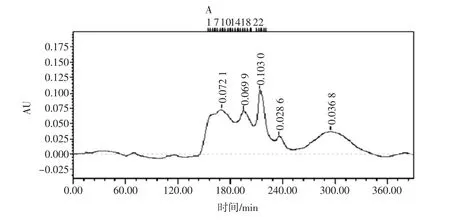
图10 鲬鱼酶解物SepHadex G-15层析图谱Fig.10 Chromatography of hydrolysates of protein from Platycephalus indicus
3 结论
在供试的5种蛋白酶中碱性蛋白酶是最适合水解鲬鱼蛋白制备具有抗氧化活性肽的水解酶。通过响应面试验得到碱性蛋白酶酶解鲬鱼蛋白的最佳条件为:温度40℃,时间180 min,pH=9.0,降低了水解温度,缩短了水解时间,有效地提高了水解效率,在此条件下获得的鲬鱼酶解物清除羟自由基的IC50值为0.58 mg/mL,肽含量为3.02 mg/mL。分子量分布测定结果显示,鲬鱼蛋白酶解物主要是相对分子质量为268~3 010的小肽和寡肽。
[1]张开平,苏仕林,刘燕丽,等.生物活性肽功能及制备方法的研究进展[J].农产品加工,2015(12):61-64
[2]张宇昊,王强.功能性短肽的研究进展[J].中国油脂,2007,32(2):69-73
[3]秦岩,高天翔.东营近海鲬鱼渔业生物学及资源丰度的季节变化[J].中国海洋大学学报(自然科学版),2012,42(7/8):106-111
[4]李吉绪,周坚,陈轩.鲢鱼肽抗氧化活性比较研究[J].农业机械,2012(12):136-139
[5]厉望.带鱼蛋白酶解制备抗氧化活性肽的研究[D].杭州:浙江大学,2013
[6]张水华.食品分析试验[M].北京:化学工业出版社,2006:48-163
[7]李贵荣.枸杞多糖的提取及其对活性氧自由基的清除作用[J].中国现代应用药学,2002,19(2):94-96
[8]李茂昌,曹秋娥,刘亚.亮绿褪色光度法检测Fenton体系产生的羟自由基[J].云南化工,2006,33(4):39-42
[9]徐娟,吕嘉枥.乳蛋白水解液中多肽含量测定方法的研究[J].食品科技,2010(12):275-278
[10]陈露.鲤鱼鱼鳞胶原蛋白肽的制备工艺和分析[D].呼和浩特:内蒙古农业大学,2013

