基于蜂蜜中氨基酸的毛细管电泳指纹图谱构建
2018-02-01毛月慧毕晓彤闫师杰刘翠翠
毛月慧,毕晓彤,闫师杰,刘翠翠
(天津农学院食品科学与生物工程学院,天津300384)
蜂蜜,因其独特的营养价值和保健功效,被人们誉为大自然最完美的营养品,深受广大消费者的青睐。近年来,由于蜂蜜产量供不应求,有些企业为了提高产量经常在蜂蜜中勾兑玉米糖浆、大米糖浆、甜菜糖浆、木薯糖浆、蔗糖、饴糖等造假成分[1]。然而,我国现行的蜂蜜食品安全标准中在蜂蜜辨伪方面存在漏洞,导致不法商贩的造假行为屡禁不止,国内蜂蜜行业遭遇严重的信任危机。
毛细管电泳指纹图谱技术是利用毛细管电泳技术得到的能够代表该样品特性的色谱数据资料的技术。目前,在中药材质量评价方面应用比较广泛[2-4]。周贤婧等首次将毛细管电泳技术用于蜂蜜中氨基酸含量的测定,旨在为蜂蜜的蜜源鉴别及质量评估提供借鉴方法。该方法实现了9种氨基酸的基线分离[5]。然而蜂蜜中氨基酸种类丰富,构建蜂蜜中常见氨基酸指纹图谱必将成为蜂蜜质量评估更为可靠的方法。细菌纤维素(Bacterial cellulose,BC)是由葡萄糖以 β-1,4-糖苷键连接而成的高分子化合物,与植物纤维素相比,BC具有许多独特性质,比如:超细网状纤维结构,比表面积大,氢键结合能力强[6]。BC作为一种具有多孔网状结构及一定孔径分布的新型纳米生物材料,目前已有研究报道以BC为原料制备吸附型滤膜用于大分子蛋白及无机重金属离子的分离[7-8]。这些结果表明:BC在毛细管电泳分离领域具有潜在的应用价值。
本研究针对消费者对高效、权威蜂蜜辨伪技术的迫切需求,基于毛细管电泳技术便捷、高效、快速、样品用量极小等优点[9-10],结合指纹图谱技术在辨伪领域的应用潜力,构建蜂蜜中常见的17种氨基酸毛细管电泳指纹图谱,并实现准确定量,为天然蜂蜜质量控制提供新参考。
1 材料与方法
1.1 仪器与设备
贝克曼P/ACE MDQ毛细管电泳仪配激光诱导荧光检测器(Ex 488 nm,Em 520 nm):美国贝克曼库尔特有限公司;毛细管(50 μm):河北永年光纤厂;pH计:瑞士METTLER-TOLEDO公司;万分之一分析天平:德国梅特勒公司;单道微量可调移液器:德国Eppendorf公司;水系针头过滤膜(0.22 μm):菲罗门科技发展有限公司;玻璃仪器:天津玻璃仪器厂。
1.2 试剂与材料
BC:海南亿德食品有限公司;732阳离子交换树脂:麦克林试剂公司;17种氨基酸标准品:麦克林试剂公司;异硫氰酸荧光素(Fluorescein isothiocyanate,FITC):美国Sigma公司;盐酸:天津市化学试剂一厂;氢氧化钠(NaOH):天津光复精细化学研究所;硼砂(Na2B4O7)、磷酸二氢钠(NaH2PO4):天津市化学试剂一厂;实验用水为二次去离子水。蜂产品包括洋槐蜜、枣花蜜及蜂王浆蜜膏:市售。
1.3 试验方法
1.3.1 BC处理
市售BC呈片状,本研究采用酸水解法对BC进行处理[11]。具体操作步骤如下:称取3 g干燥BC于烧杯,加入150 mL蒸馏水2 500 r/min搅拌匀浆3 min,4000 r/min离心10min。去上清,在沉淀中加入100mL 50%硫酸溶液,50℃水解,5 h后加入500 mL蒸馏水终止反应。静置过夜,除去上层清液,对下层产物进行离心洗涤直至中性,离心转速10 000 r/min。最后冷冻干燥备用。
1.3.2 溶液配制
1.3.2.1 氨基酸标准液配制
准确称取氨基酸标准品,用去离子水配成0.1 mmol/L氨基酸标准溶液,4℃储存备用。
1.3.2.2 电泳缓冲液配制
由去离子水分别配制不同浓度的Na2B4O7,NaH2PO4溶液;然后,按照需要配制不同pH电泳缓冲液。上仪器前缓冲液需要过膜超声处理。
1.3.2.3 FITC丙酮溶液
准确称取5.0 mg FITC溶于10 mL丙酮,配成1.3 mmol/L,-20℃保存备用。
1.3.3 样品制备
蜂蜜中氨基酸提取采用固相萃取法[12]。①活化:732阳离子交换树脂由饱和NaCl溶液、1 mol/L NaOH溶液1.5 mol/L盐酸溶液分别浸泡8 h,最后以去离子水冲至中性并装柱。②氨基酸吸附:准确称取蜂蜜5.0 g,加入40 mL去离子水搅拌溶解后,用盐酸调节pH 2.0,过 732阳离子交换树脂柱(16 mm×300 mm),流速为1 mL/min。③氨基酸洗脱:以50 mL 2 mol/L氨水洗脱,流速1.0 mL/min,收集氨水部分,50℃蒸干溶剂,用去离子水溶解定容至10 mL。
1.3.4 氨基酸衍生化
取0.1mmol/L氨基酸标准溶液1mL,加入1.3 mmol/L FITC 0.1 mL,漩涡震荡1 min,4℃避光反应2 h。
1.3.5 标准曲线绘制
将1.3.4氨基酸衍生物稀释至所需浓度,进样分析。以氨基酸衍生物浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
1.3.6 电泳条件
毛细管(内径:50 μm;有效长度 45 cm)使用前分别用1.0 mol/L盐酸、1.0 mol/L NaOH溶液和去离子水各冲洗3 h;每天实验前毛细管用1.0 mol/L盐酸、0.1 mol/L NaOH溶液、去离子水及分离缓冲溶液各冲洗5 min;两次运行之间,毛细管依次用0.1 mol/L NaOH冲洗1 min,去离子水冲洗2 min,分离缓冲溶液冲洗3 min。分离电压25 kV;分离柱温25℃;压力进样0.5 psi(34 475 Pa)3 s;运行缓冲液:30 mmol/L Na2B4O7-NaH2PO4(pH 9.8,包含0.5%BC素)缓冲液。
2 结果与讨论
2.1 分离缓冲液种类选择
分离缓冲液种类对17种氨基酸分离效果的影响见图1。
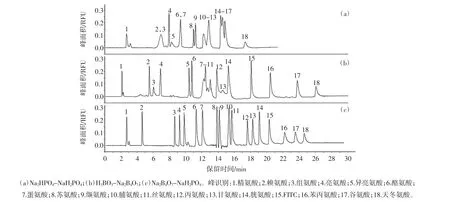
图1 分离缓冲液种类对17种氨基酸分离效果的影响Fig.1 Effect of running buffer on separation of 17 amino acids
不同的电泳缓冲液对分离物的溶解能力不同,进而影响迁移时间和分离度。此外,电泳缓冲液的选择主要取决于所需的pH。FITC荧光强度对环境pH较为敏感,pH低于7时,其荧光强度会显著猝灭,pH 9~10时,荧光强度基本达到峰值。本试验考察了磷酸盐缓冲液、硼酸盐缓冲液及硼砂-磷酸盐缓冲液对氨基酸分离效果的影响。结果如图1显示硼砂-磷酸盐缓冲液能实现17种氨基酸的基线分离。因此,选择硼砂-磷酸盐缓冲液作为分离电解质溶液。
2.2 分离缓冲液pH优化
分离缓冲液pH对17种氨基酸分离效果的影响见图2。
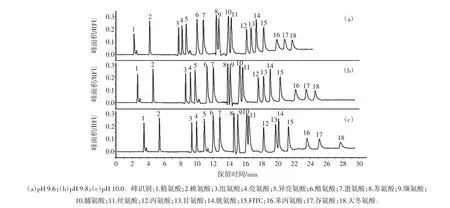
图2 分离缓冲液pH对17种氨基酸分离效果的影响Fig.2 Effect of running buffer pH on separation of 17 amino acids
分离缓冲液pH直接影响分析物解离情况及带电荷情况,进而影响分析物保留情况及分离效果。本试验考察了9.6、9.8、10.0 3个pH梯度对氨基酸分离效果的影响。如图2所示,在此pH条件下绝大多数氨基酸净电荷为负值,与毛细管内壁的硅羟基无吸附作用。但随着净负电荷的增多,电迁移速度增加,最终导致保留时间延长。此外,随着pH变化,各氨基酸带电量直接影响了他们的保留情况及分离效果。综合考虑,选择9.8作为分离缓冲液最佳pH。
2.3 分离缓冲液离子强度的选择
分离缓冲液离子强度对17种氨基酸分离效果的影响见图3。
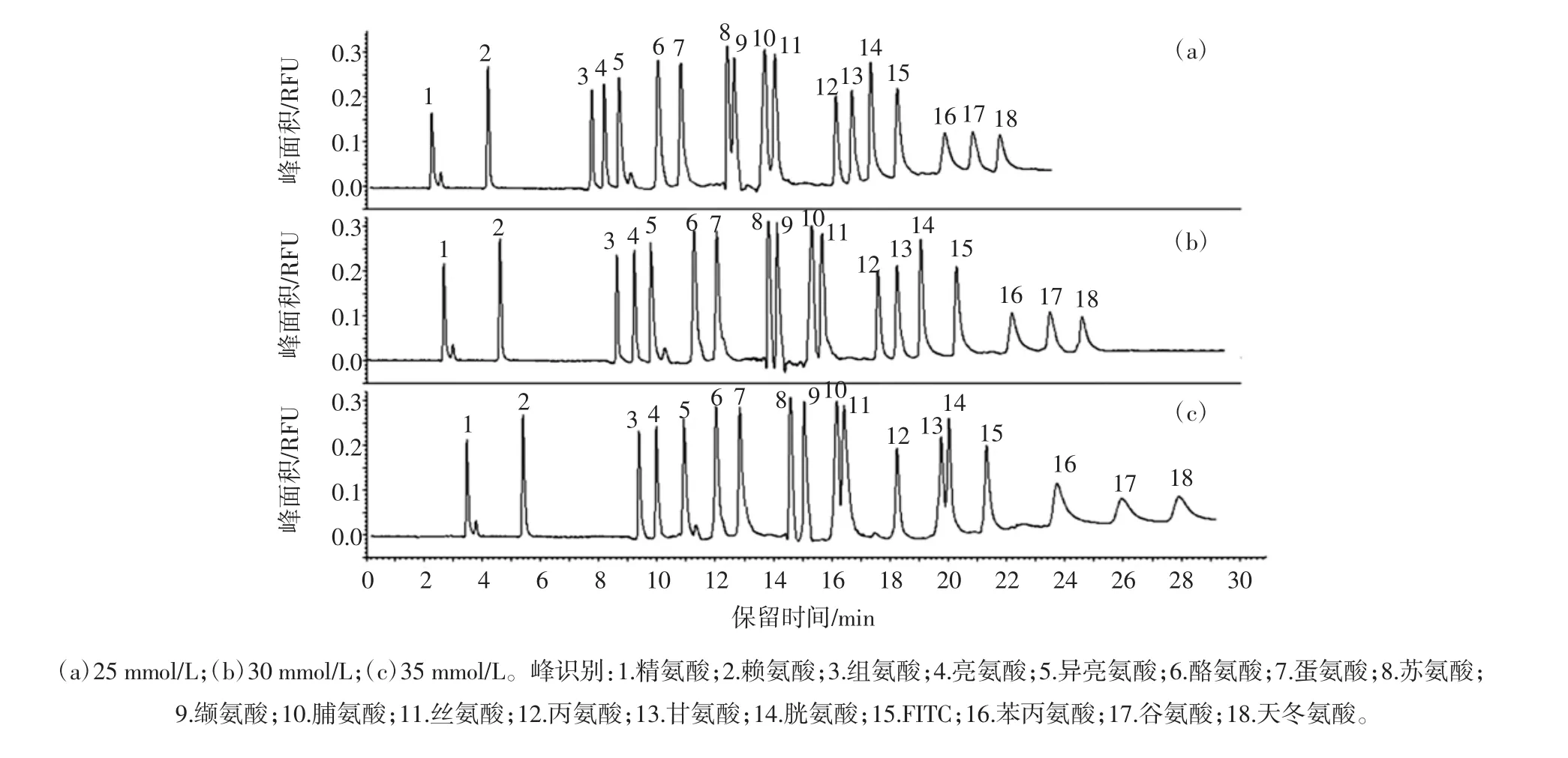
图3 分离缓冲液浓度对17种氨基酸分离效果的影响Fig.3 Effect of running buffer concentration on separation of 17 amino acids
在毛细管电泳分离过程中,分离缓冲液离子强度是影响分析物迁移行为的关键因素之一。随着分离缓冲液浓度从25 mmol/L增加到35 mmol/L,双电层厚度减小,导致电渗流减小,分析时间从22 min延长至30 min。同时,分离缓冲液浓度增加还会使得电流强度及热效应增加,加剧分离物纵向扩散,致使峰形展宽。综合考虑分析时间和峰形,选择30 mmol/L作为分离缓冲液最佳浓度。
2.4 分离电压优化
高电压能够通过提高电场强度直接缩短分析时间,同时在一定程度上改善峰形。但是电压过高同样使热效应增加,降低柱效和分离度。本试验选择25 kV作为最佳分离电压。
2.5 BC添加量优化
BC添加量对17种氨基酸分离效果的影响见图4。

图4 BC对17种氨基酸分离效果的影响Fig.4 Effect of BC on separation of 17 amino acids
BC的添加对于氨基酸分离效果有明显的改善作用,如图4所示,当添加量为0.5%时,17种氨基酸基本达到基线分离。继续增加BC添加量,不但不能改善分离效果,还会造成电流不稳甚至断电流。因此BC最佳添加量为0.5%。
2.6 分析方法评价
以氨基酸浓度为横坐标,峰面积为纵坐标建立标准曲线。各种氨基酸检测限、线性范围、回归方程及相关系数见表1。
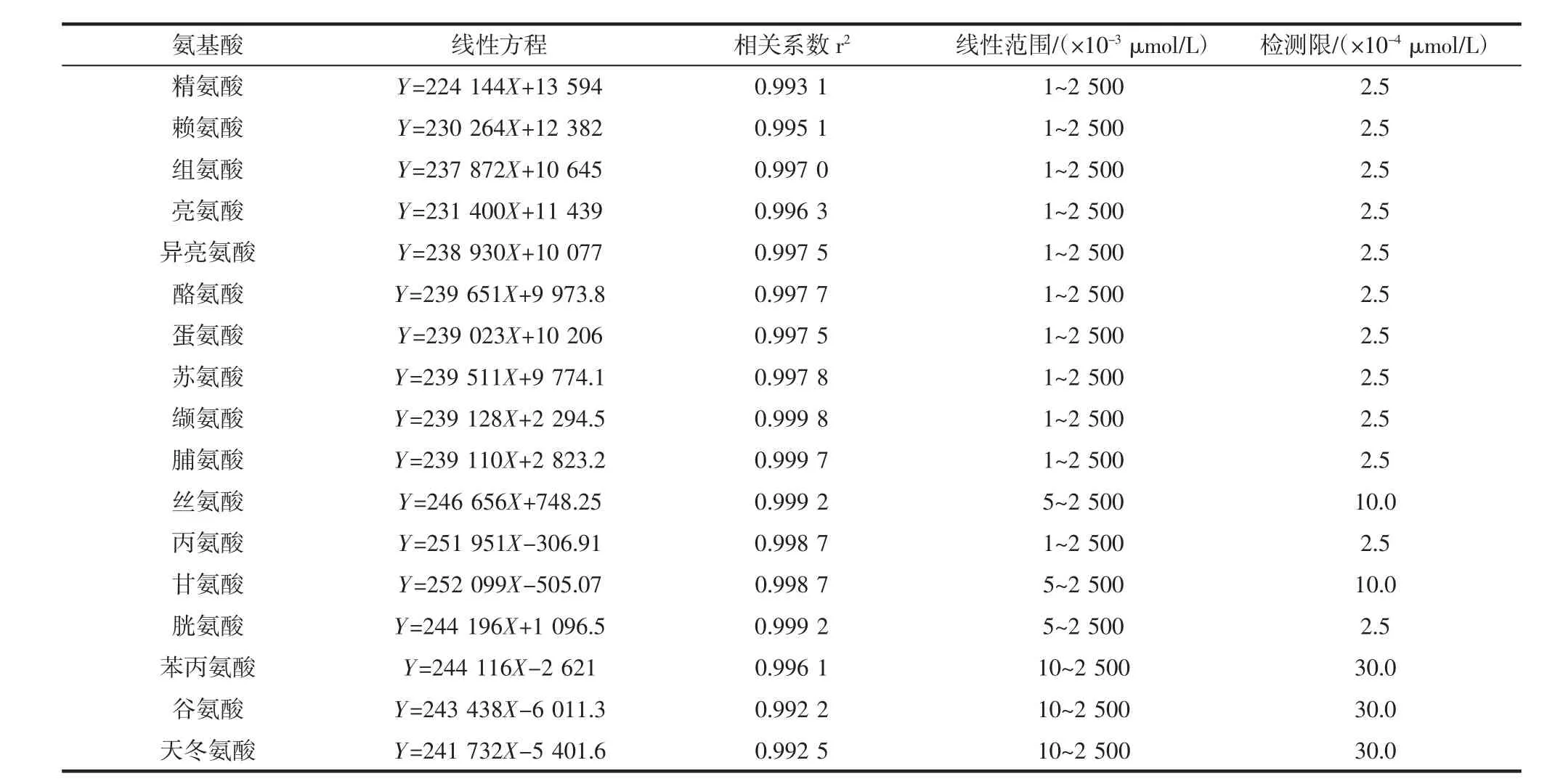
表1 17种氨基酸的线性方程、相关系数、线性范围及检出限Table 1 Regression equations,correlation coefficients(r2),linear ranges and limit of detection of 17 amino acids
2.7 精密度
17种氨基酸保留时间及峰面积精密度计算结果如表2所示。
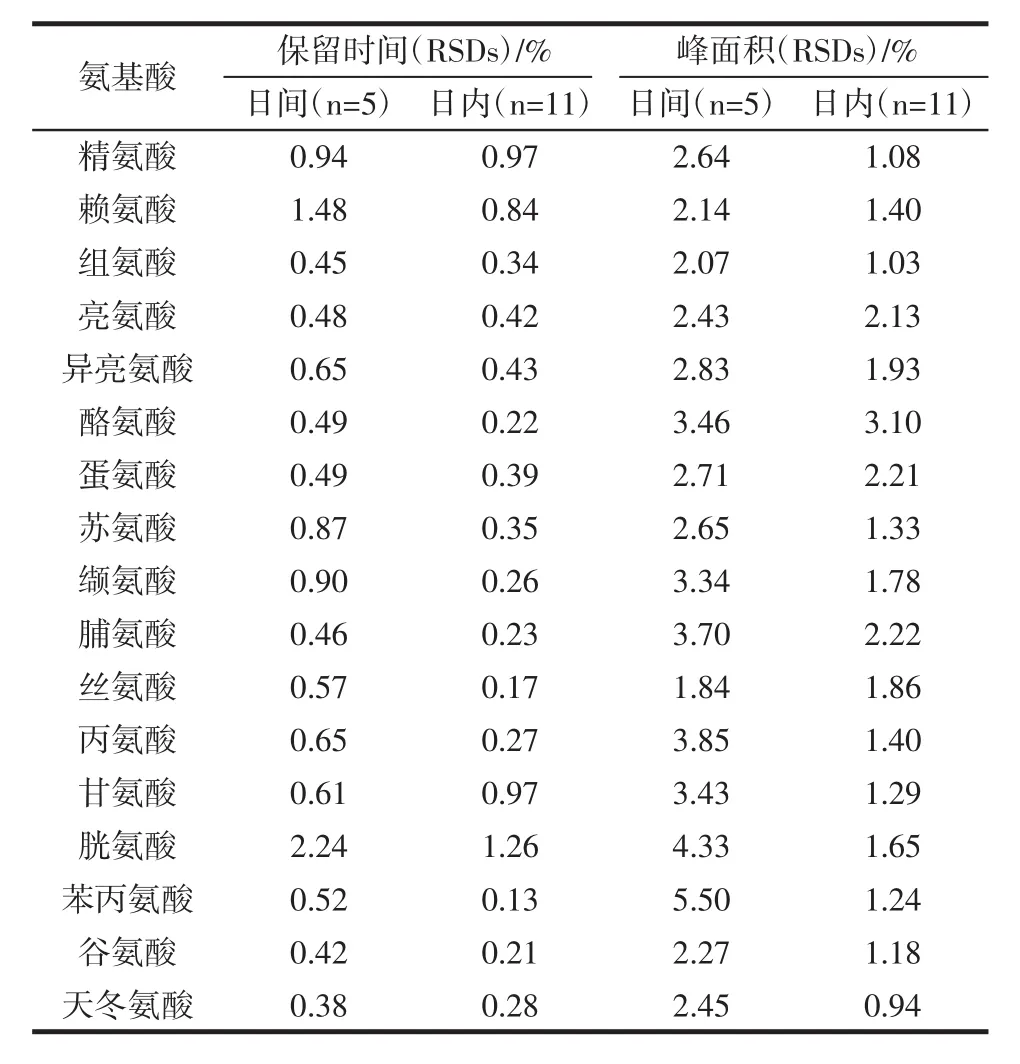
表2 17种氨基酸日间、日内测定精密度Table 2 Intra-day and inter-day precision of 17 amino acids
同一日内,对氨基酸衍生液(5×10-8mol/L)连续测定11次,计算各氨基酸峰面积、保留时间的相对标准偏差(Relative standard deviation,RSDs)得到日内精密度。每日配置新鲜试剂对氨基酸衍生,连续5天进行测定,计算各氨基酸峰面积、保留时间的RSDs,得日间精密度。
2.8 加标回收试验及实际样品测定
洋槐蜜中17种氨基酸的加标回收率如表3所示。
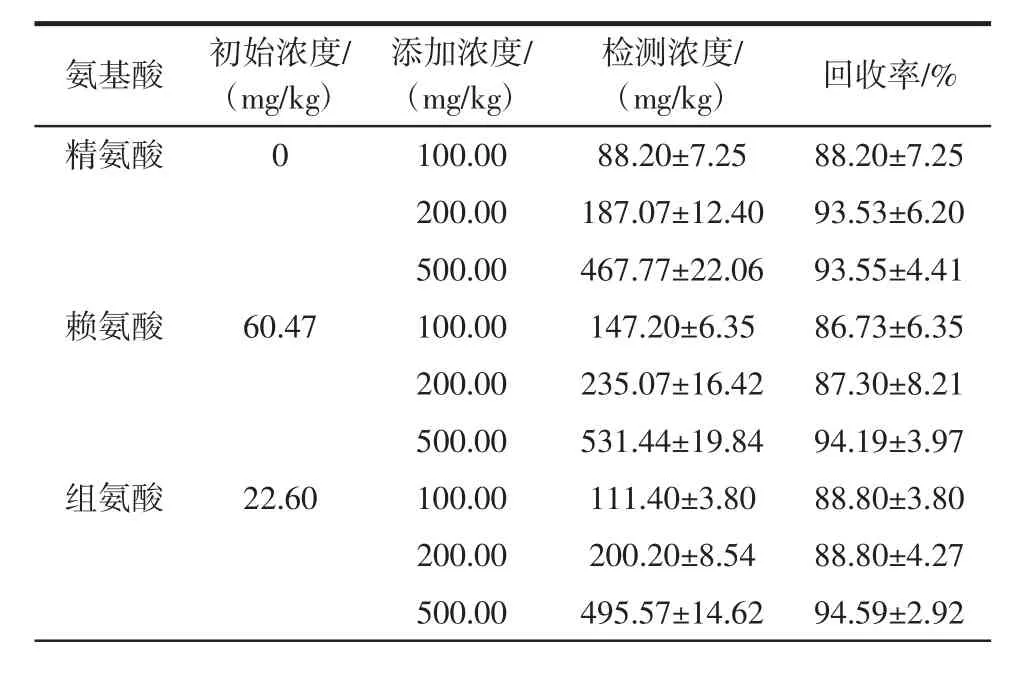
表3 洋槐蜜中17种氨基酸的加标回收率(X±SD,n=3)Table 3 Recoveries of 17 amino acids spiked in honey(mean±SD,n=3)
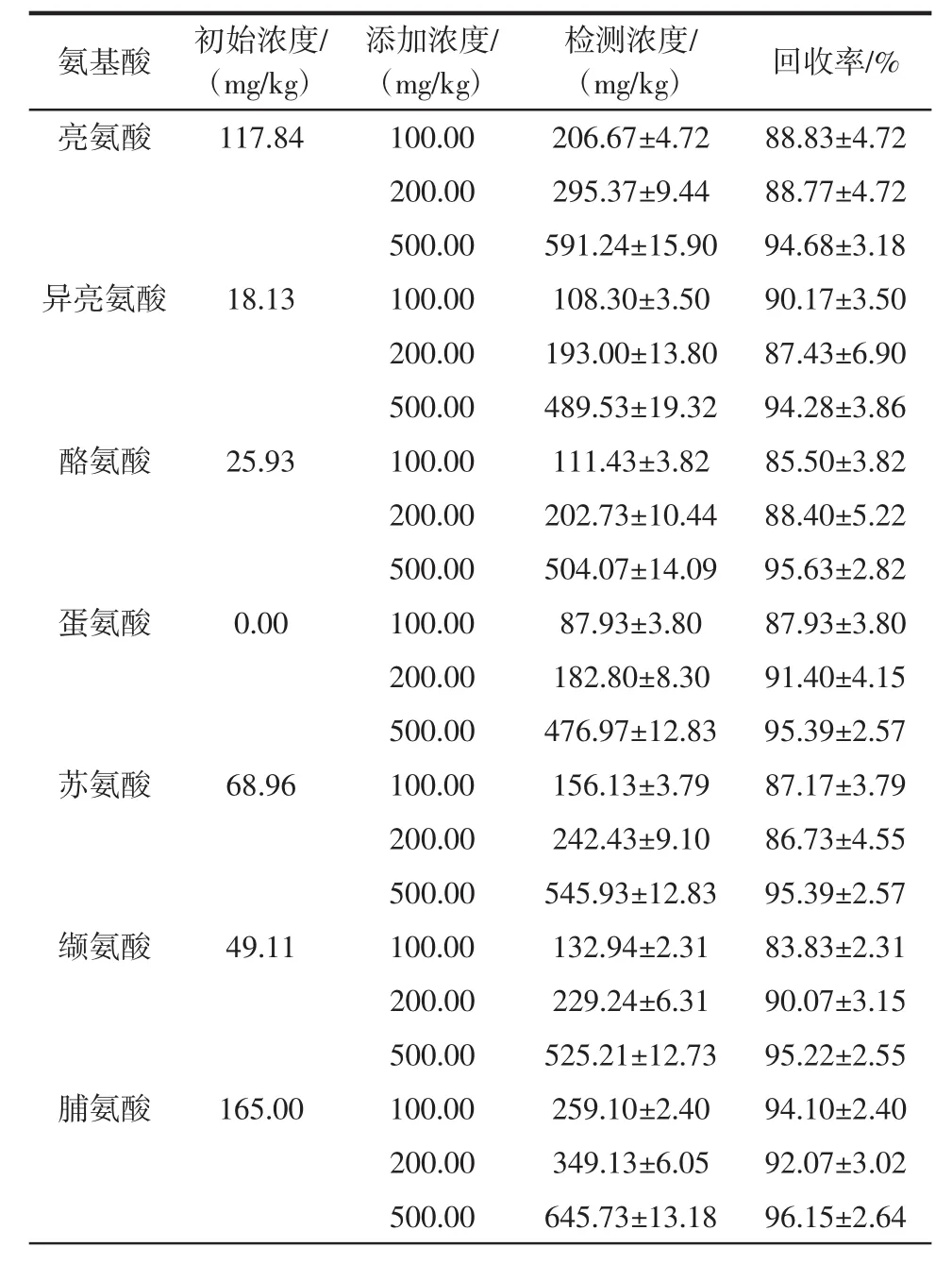
续表3 洋槐蜜中17种氨基酸的加标回收率(X±SD,n=3)Continut table 3 Recoveries of 17 amino acids spiked in honey(mean±SD,n=3)
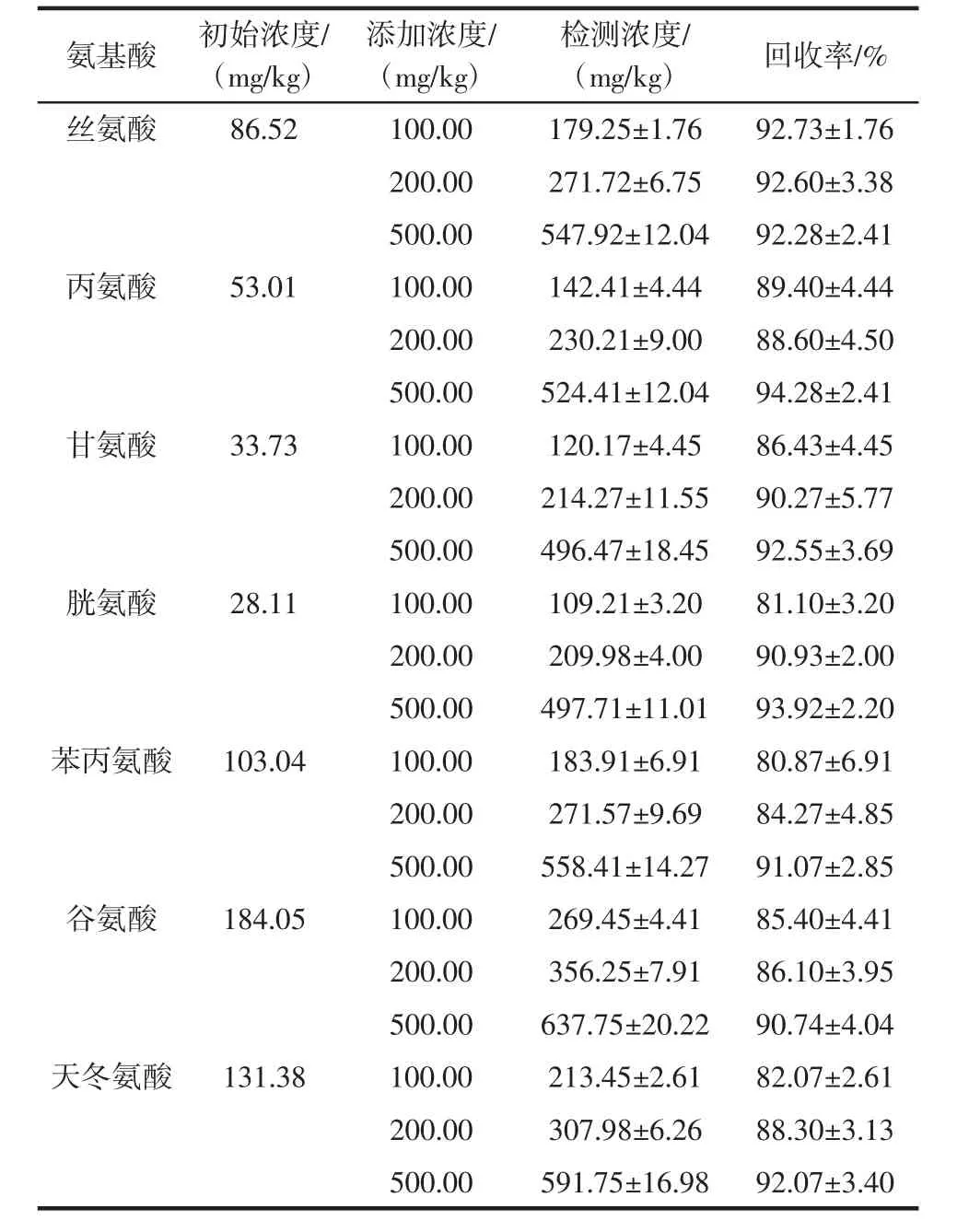
续表3 洋槐蜜中17种氨基酸的加标回收率(X±SD,n=3)Continut table 3 Recoveries of 17 amino acids spiked in honey(mean±SD,n=3)
向已知分析物含量的洋槐蜜样品中分别加入100.00、200.00、500.00 mg/kg 3个不同的浓度水平的氨基酸标品,提取后通过该方法测定回收率。结果显示,回收率均在81.10%以上,RSD小于8.22%。
将该方法用于洋槐蜂蜜、枣花蜂蜜及蜂王浆3种蜂制品中氨基酸组成分析。图5为3种蜂制品典型的氨基酸特征图谱,各氨基酸含量列于表4。
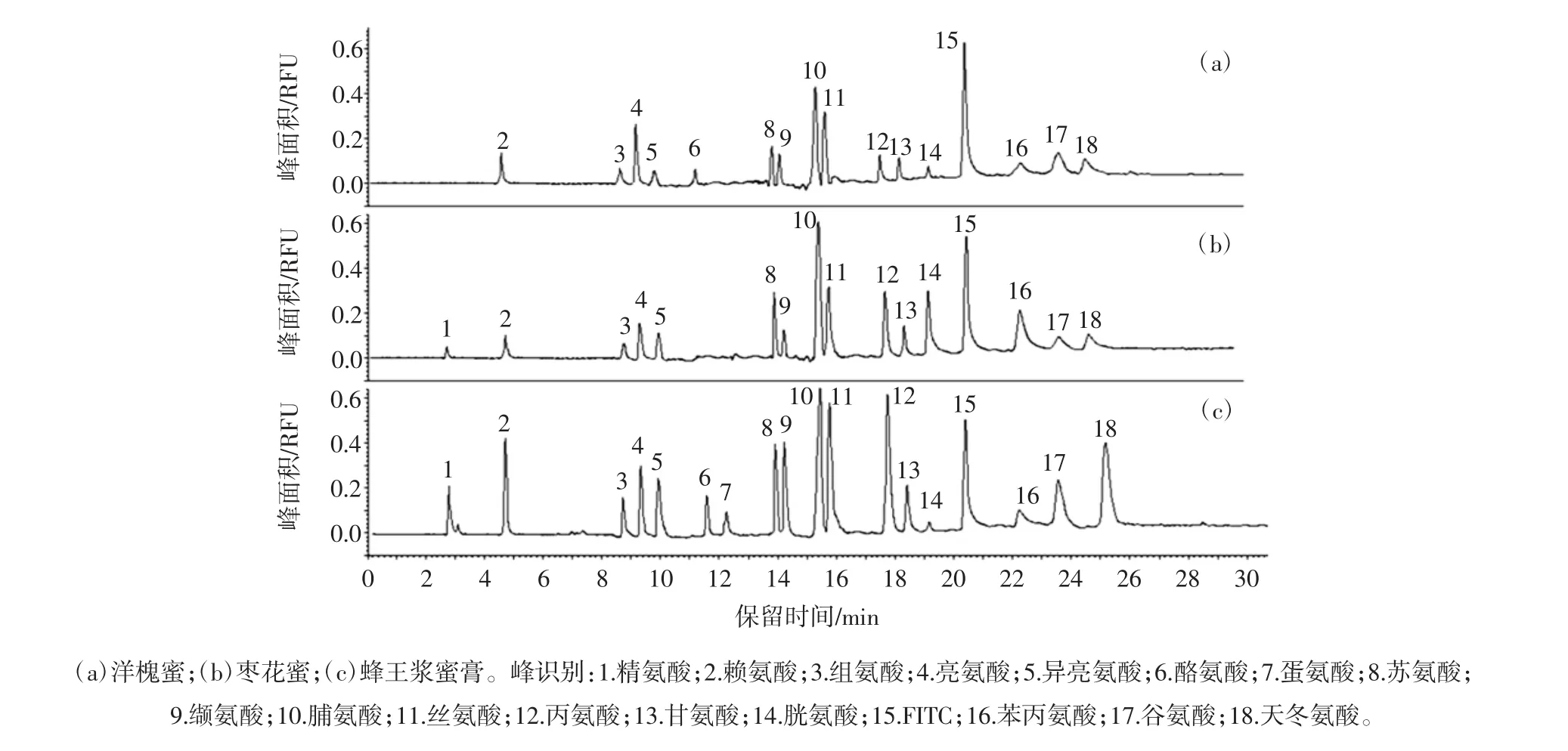
图5 3种蜂产品中氨基酸指纹图谱Fig.5 Fingerprints of amino acids in three bee products
由于蜜源不同,各蜂制品中氨基酸含量及组成差异较大。蜂王浆中含有17种氨基酸,总含量达2 987.61 mg/kg。洋槐蜂蜜中不含精氨酸和蛋氨酸,枣花蜂蜜中不含酪氨酸、蛋氨酸和胱氨酸,氨基酸总量分别为1 147.89 mg/kg和1 389.22 mg/kg。亮氨酸、脯氨酸、丝氨酸、苯丙氨酸、谷氨酸、天冬氨酸在3种蜂制品中含量均相对较高。其中枣花蜜中苯丙氨酸含量最高为336.33 mg/kg,蜂王浆蜜膏中天冬氨酸含量最高为561.13 mg/kg。
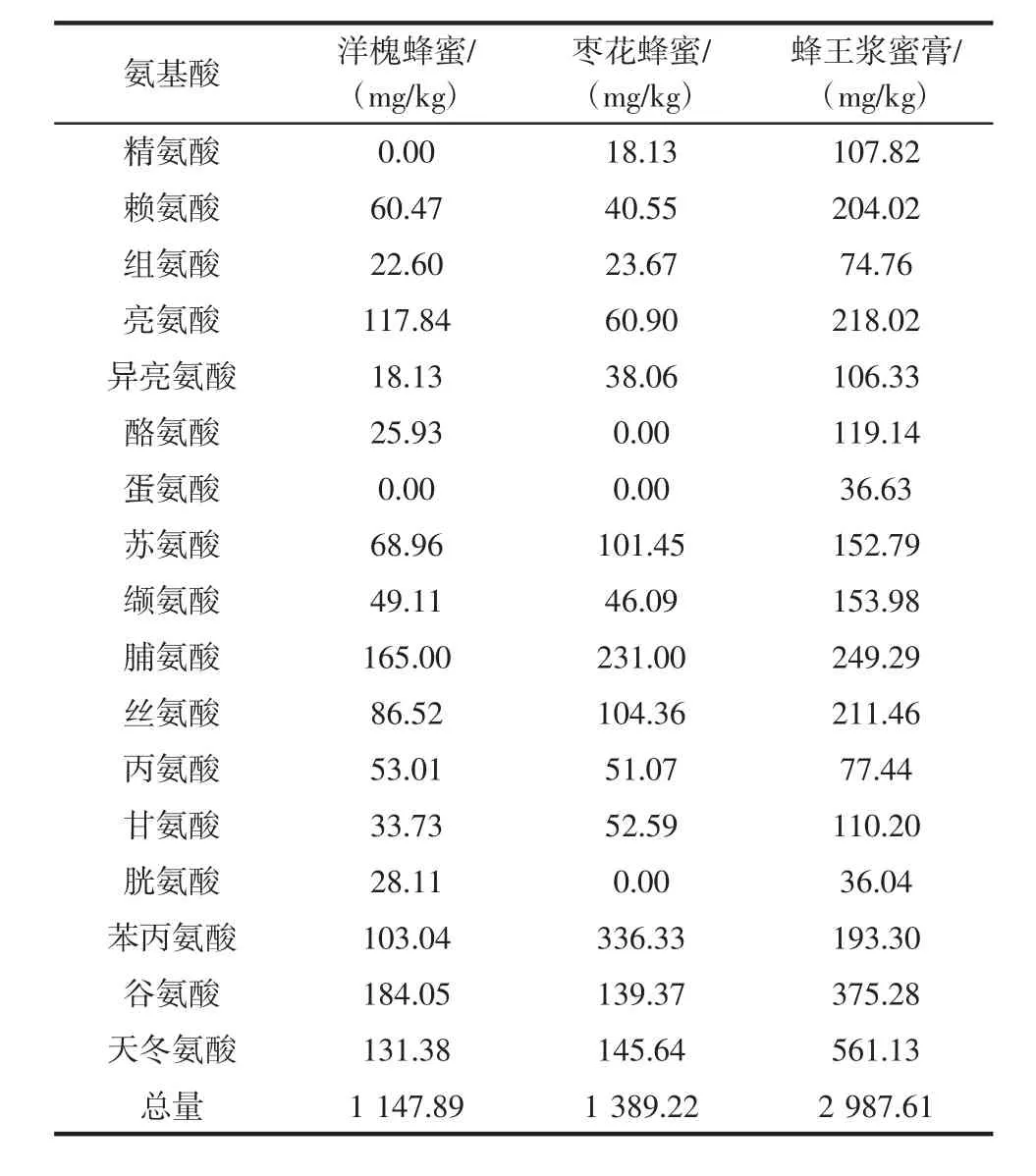
表4 3种蜂产品中氨基酸组成Table 4 Contents of amino acids in three bee products
3 结论
本研究以BC为电泳缓冲液添加剂,提高毛细管电泳分离能力,构建基于蜂蜜中氨基酸组成的指纹图谱分析方法。优化条件下,该方法能在25 min内实现17种氨基酸的基线分离,方法检测限2.5×10-4μmol/L~30.0×10-4μmol/L。洋槐蜂蜜的加标回收率在81.10%以上,RSDs小于8.22%,证明所构建的方法是可靠的。该方法成功用于洋槐蜜、枣花蜜及蜂王浆蜜膏中氨基酸组成分析。结果表明,不同植物蜜源蜂蜜中氨基酸种类、含量存在明显差异。该方法为天然蜂蜜质量控制提供新参考。
[1]杜宗绪.蜂蜜掺假鉴别检测方法研究进展[J].保鲜与加工,2015,15(5):67-71
[2]胡玥珊,孙国祥,刘迎春.系统指纹定量法评价牛黄解毒片毛细管电泳指纹图谱[J].中南药学,2015,13(9):897-990
[3]王荧荧,孙国祥.天王补心丸毛细管电泳指纹图谱[J].中国实验方剂学杂志,2012,18(16):97-101
[4]孙国祥,蔡新凤.补中益气丸的毛细管电泳指纹图谱研究[J].中南药学,2012,10(4):307-311
[5]周贤婧,师彦平.毛细管电泳-间接紫外检测法测定蜂蜜中的氨基酸[J].色谱,2013,31(7):661-666
[6]CHEN S,SHEN W,YU F,HU W,et al.Preparation of amidoximated bacterial cellulose and its adsorption mechanism for Cu2+and Pb2+[J].Journal of Applied Polymer Science,2010(117):8-15
[7]WANG J,LU X,NG P F,et al.Polyethylenimine coated bacterial cellulose nanofiber membrane and application as adsorbent and catalyst[J].journal of colloid and interface science,2015(440):32-38
[8]LIN Q,ZHENG Y,WANG G,et al.Protein adsorption behaviors of carboxymethylated bacterial cellulose membranes[J].International Journal of Biological Macromolecules,2015(73):264-269
[9]尹东光,吴明红,谢春娟,等.新型毛细管电泳化学发光系统应用于氨基酸分离测定[J].分析化学,2009,37(1):152-156
[10]陈彦,殷学军,王东芝,等.氨基酸衍生物的非水毛细管电泳分离[J].曲阜师范大学学报,2008,34(1):80-83
[11]李延灏,牛千雪,范金石.纳晶纤维素的制备及其应用展望[J].中华纸业,2012,33(22):20-23
[12]黄蕴芝,祁龙凯,林励,等.蜂蜜中氨基酸类成分高效液相指纹图谱研究[J].广州中医药大学学报,2015,32(4):745-750
