响应面法优化生姜蛋白酶活性测定方法
2018-02-01侯婴惠张秀娟王帅唐晓珍
侯婴惠,张秀娟,王帅,唐晓珍,*
(1.山东农业大学食品科学与工程学院,山东泰安271000;2.济宁学院,山东曲阜273100)
酶作为一种生物催化剂,能够通过降低从底物到产物的反应活化能,在温和环境条件下提高反应速度[1-2],因为酶具有催化高效性、底物专一性等优势,使其在食品、工业、医药、分子生物学等领域具有越来越广泛的应用[3-4]。目前在食品工业中开发利用的植物蛋白酶主要有木瓜蛋白酶[5]、菠萝蛋白酶[6-8]、无花果蛋白酶[9-11]以及相对研究较晚较弱的生姜蛋白酶[12-13]等,这些植物蛋白酶结构与性质均相似。生姜酶活测定常参照木瓜蛋白酶活性测定标准,但实际试验中因生姜蛋白酶与木瓜蛋白酶并非完全相同,具体反应温度、时间等条件尚不统一,不能完全参照木瓜蛋白酶标准进行测定[14]。近年来关于生姜蛋白酶的研究虽多有报道,但生姜酶活性具体测定条件尚未统一。宋琦等[13]以酪蛋白为底物,单位时间内以生姜蛋白酶分解酪蛋白的生成物的量来表示酶活大小,此过程以需要加三氯乙酸等强酸终止反应;周慧等[15]采用考马斯亮蓝法测定单位时间内生姜蛋白酶分解酪蛋白后溶液残留蛋白,以此为指标确定酶活大小,但此方法受溶液中杂质影响较大,所测结果真实性有待考究;于洁等[16]以加热生姜蛋白酶失活后样液为对照,以考马斯亮蓝法直接测出蛋白酶活性,但具体工艺条件有待筛选。因此建立快速、准确的生姜酶活测定方法非常重要。介于响应面试验[17-19]周期短,回归方程精确度高,能研究多因素间交互作用等优点[20-23],本试验以生姜蛋白酶活性为指标,通过单因素试验,筛选出主要影响因素,再进行响应面试验设计,从而优化了生姜蛋白酶活性测定工艺条件,为后续姜酶提取、纯化提供基础。
1 材料与方法
1.1 试验材料
生姜蛋白酶:实验室提取;干酪素、三氯乙酸:天津市博迪化工有限公司;半胱氨酸、BSA(牛血清白蛋白):北京索莱宝有限公司;考马斯亮蓝G-250:天津市凯通化学试剂有限公司提供;其他试剂均为实验室常规试剂。
1.2 试验仪器
UV-5500型紫外可见分光光度计:上海元析仪器有限公司;数显恒温水浴锅HH-4:上海梅香仪器有限公司;离心机TDL-40B:上海安亭科学仪器厂。
1.3 试验方法
1.3.1 生姜蛋白酶的制备
生姜洗净切碎,称取200 g,按1∶3(g/mL)料液比打浆,低温(4℃)静置2 h,离心取沉淀用磷酸缓冲液1 ∶4(g/mL)复溶,低速搅拌 15 min后再静置 3 h,用四层纱布过滤后离心取上清液,加95%的乙醇至醇体积为60%,冰浴7 h离心取沉淀[24]。
1.3.2 蛋白质含量的测定
本试验采用考马斯亮蓝法测蛋白质含量[25]。标准曲线为:y=0.019 3x-0.018 7,R2=0.999 4,式中:x 为蛋白质浓度,μg/mL;y为吸光度值。
1.3.3 生姜蛋白酶酶活力测定
生姜蛋白酶酶活测定条件:40℃水浴条件下,酶促反应15 min降解酪蛋白产生TCA可溶的多肽增加量,以灭活的生姜蛋白酶为对照[22],根据酪氨酸标准曲线,测得样品中酶活力大小。酶活力标准曲线为:y=774.11x-8.590 1,R2=0.999,式中:x 为样品吸光度;y 为酶活力,U。
1.3.4 生姜蛋白酶酶活测定单因素试验
生姜蛋白酶活性测定各单因素梯度设置:反应温度 20、30、40、50、60、70℃;反应时间 1、3、5、7、9、11 min;酪蛋白底物浓度0.3%、0.6%、0.9%、1.2%、1.5%、1.8%;磷酸盐缓冲液 pH5、5.5、6、6.5、7、7.5。
1.3.5 响应面法优化提取条件
在单因素的基础上采用Design-Expert 8.0.6软件进行四因素三水平试验设计,以生姜蛋白酶酶活为响应值进行回归分析,建立二次回归模型,拟合得到二次回归方程。
2 结果与分析
2.1 单因素试验
2.1.1 反应温度对酶活性测定的影响
反应温度对生姜蛋白酶活性测定的影响见图1。
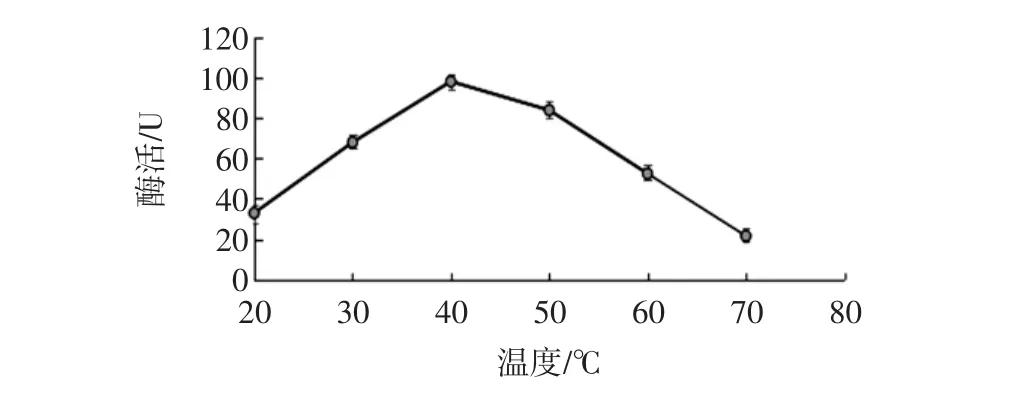
图1 反应温度对生姜蛋白酶活性测定的影响Fig.1 Effect of reaction temperature on the activity of Ginger protease
控制酶活测定时间5 min,酪蛋白浓度0.6%,缓冲液pH6.5,考察温度在20℃~80℃时酶活大小。在一定温度下酶具有最大活性,此温度称为酶的最适温度[8]。由图1可知,随着温度的升高酶活增大,在温度为40℃时酶活测定值最大。当温度大于40℃时,随着温度升高酶活性逐渐降低趋于0,此时酶已失活变性[13]。所以,选择反应温度为40℃。
2.1.2 反应时间对酶活性测定的影响
反应时间对生姜蛋白酶活性测定的影响见图2。
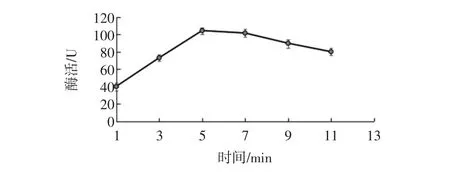
图2 反应时间对生姜蛋白酶活性测定的影响Fig.2 Effect of reaction time on the activity of Ginger protease
控制酶活测定反应温度40℃,酪蛋白浓度0.6%,缓冲液pH6.5,考察反应时间在1 min~11 min时酶活大小。由图2可知,随着反应时间的延长,酶活先增大后降低,反应时间5 min时酶活测定值最大。随着反应时间继续增大,酶活缓慢降低,是因为5 min时酶已充分参与反应,随着时间的增大,酶在40℃的水浴条件下逐渐失活。所以,选择反应时间为5 min。
2.1.3 底物浓度对酶活性测定的影响
底物浓度对生姜蛋白酶活性测定的影响见图3。
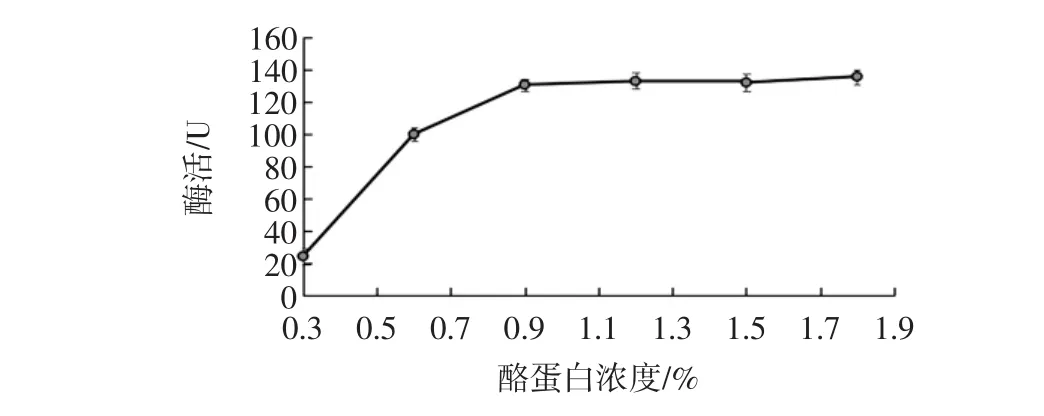
图3 底物浓度对生姜蛋白酶活性测定的影响Fig.3 Effect of substrate concentration on the activity of Ginger protease
控制酶活测定反应温度40℃,反应时间5 min,缓冲液pH6.5,考察酪蛋白底物浓度在0.3%~1.8%时酶活大小。由图3可知,在反应温度、缓冲液pH值适宜的条件下,酶促反应随底物浓度的增大迅速增大,当底物浓度大于0.9%时,底物浓度继续增大,酶活性中心分子逐渐被饱和,反应速度的增加率将会减少[26]。所以,选择酪蛋白浓度为0.9%。
2.1.4 缓冲液pH值对酶活性测定的影响
缓冲液pH值对生姜蛋白酶活性测定的影响见图4。
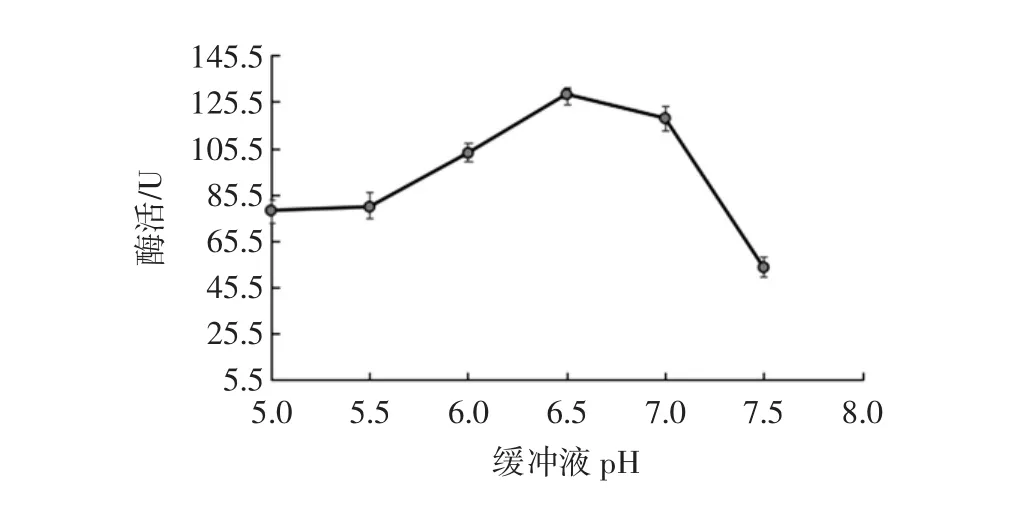
图4 缓冲液pH值对生姜蛋白酶活性测定的影响Fig.4 Effect of buffer pH on the activity of Ginger protease
控制酶活测定反应温度40℃,反应时间5 min,酪蛋白浓度0.9%,考察缓冲液pH值在5~7.5时酶活大小。由图4可知,随着缓冲液pH值的增大,酶活先增大后降低。pH值之所以影响酶的活性是因为缓冲液pH值改变了酶活性部位相关的基团的解离状态[13],当缓冲液pH6.5时酶活最大,此时酶分子上活性基团的解离状态最适于酶与底物结合;当pH值大于7.5时酶活性突然降低,其原因为过碱使蛋白质中的氢键、化学键断裂或与游离的氨基或羧基形成盐,从而使蛋白质变性[16]。所以,选择缓冲液为pH6.5。
2.2 响应面法分析
2.2.1 响应面优化生姜蛋白酶酶活测定条件
根据单因素试验结果筛选出反应时间、反应温度、底物浓度、缓冲液pH值作为优化条件,应用Design-Expert 8.0.6软件设计四因素三水平的响应面试验,利用响应面试验结果确定生姜蛋白酶酶活测定最佳方案。响应面试验因素水平表如表1,试验结果如表2所示。

表1 因素水平表编码表Table 1 Factors and levels in central composite design
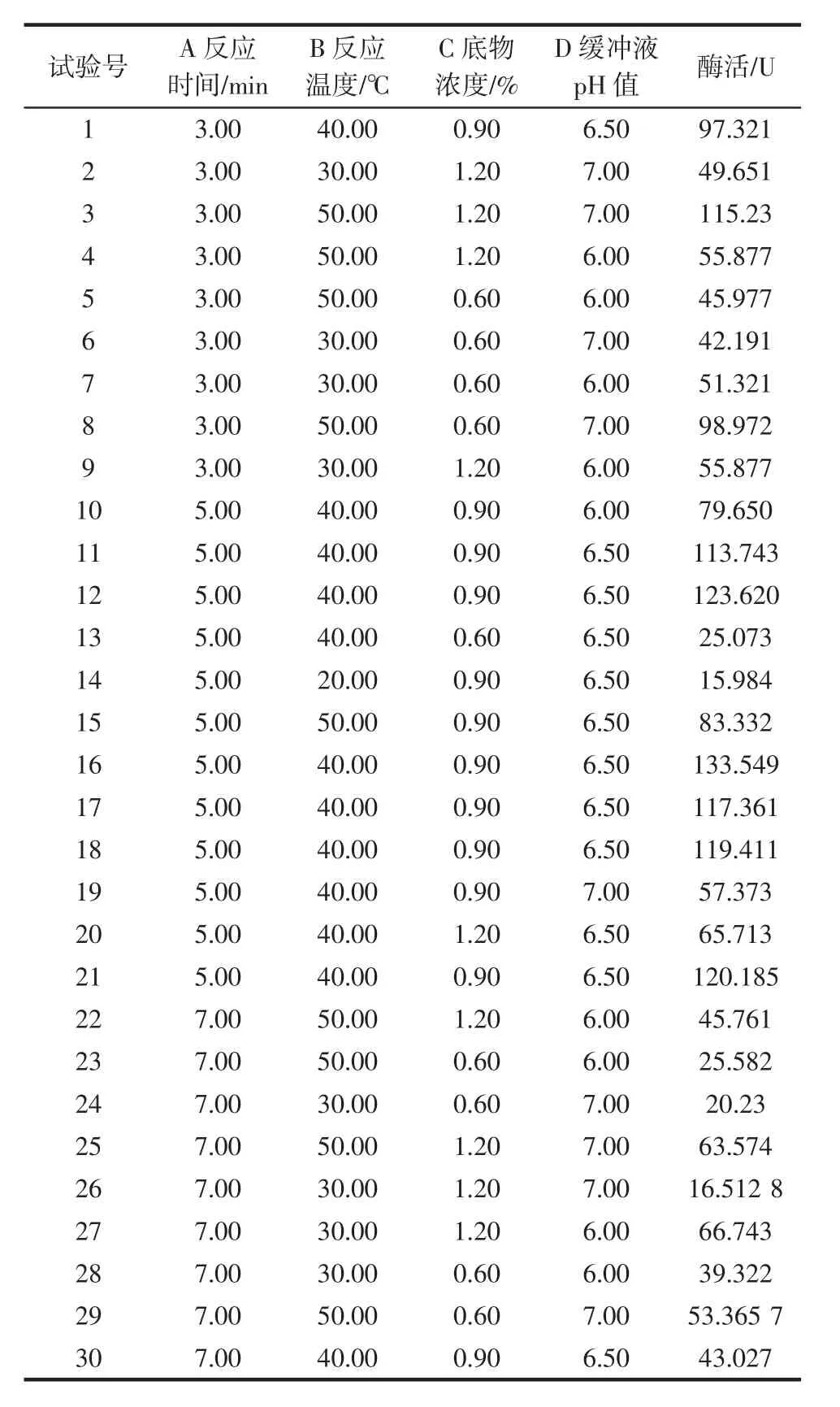
表2 响应面分析方案与试验结果Table 2 Experimental scheme and results of central composite design
根据表1设定的水平和因素,以A(反应时间)、B(反应温度)、C(底物浓度)、D(缓冲液pH值)为自变量,酶活(Y)为响应值,按表2实施30次试验,并测得各条件下的酶活。所得回归方程为:
酶活=-2 444.190 99+84.668 55A-2.676 57B+482.823 24C+665.213 34D-0.223 58AB+1.657 38AC-7.544 74AD+0.433 75BC+3.032 71BD-13.271 33CD-3.427 20A2-0.188 38B2-221.162 64C2-56.497 05D2
式中:Y 为酶活预测值;A、B、C、D 为上述 4个自变量的编码值。
2.2.2 方差分析及显著性检验
利用Design-Expert 8.0.6软件对表2试验数据进行多元回归拟合,进行显著性检验。得到的回归方程的显著性检验及方差分析结果见表3。
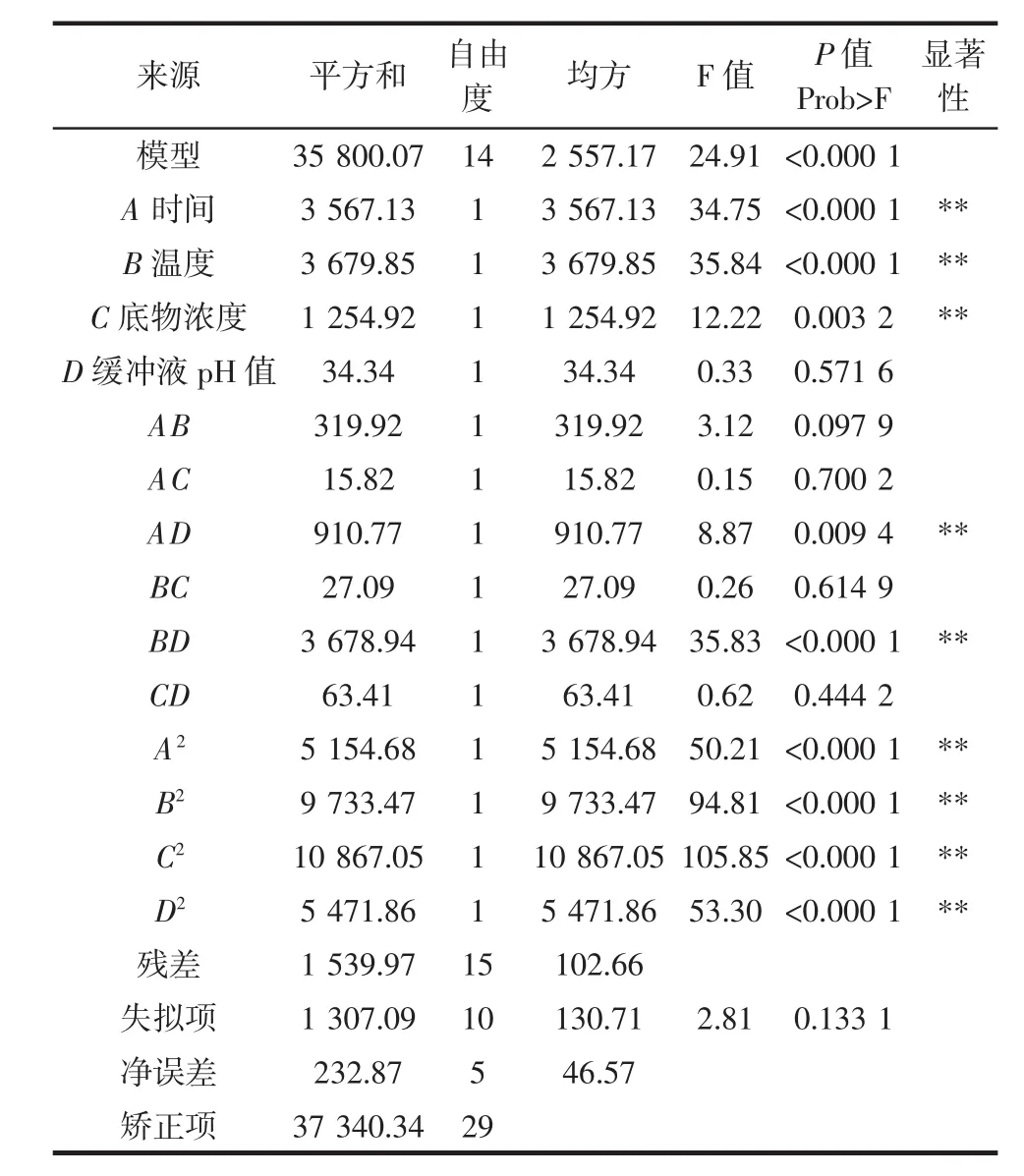
表3 回归模型方差分析Table 3 Variance analysis of the regression equation for the yield of xylan
P值的大小表明模型及各考察因素的显著水平。P值小于0.05,表明模型或各因素有显著影响;P值小于0.01,表明模型或各因素高度显著。从表3可知,以酶活为响应值时,模型P<0.010 0,表明该二次方程模型极显著。同时失拟项P=0.133 1>0.100 0,表示正交试验结果和数学模型拟合良好,即可用该数学模型推测试验结果。由表3还可以看出,4个因素中A、B、C影响极显著,AD、BD、A2、B2、C2、D2影响极显著,D、AB、AC、BC、CD、影响差异不显著,其结果表明在酶活测定时,反应时间、温度、底物浓度均对测定结果有较大影响。虽然过酸或过碱性条件可使蛋白变性,但在响应面试验过程中溶液缓冲液pH值均在7左右,因此测定结果表明D缓冲液pH对酶活测定影响不显著。
2.2.3 响应面分析及酶活测定工艺优化
响应面交互作用分析与优化通过Design Expert8.0.6软件对各因素之间的交互作用进行响应面分析,绘制响应面曲线图。图5分别显示6组以酶活为响应值的趋势图。从其等高线图可直观反映出2个变量间交互作用的显著程度,其中圆形表示两因素交互作用不显著,而椭圆形表示两因素交互作用显著。
由图5响应面立体图和等高线图形可知:反应时间、反应温度、底物浓度、反应时间和缓冲液pH值、反应温度和缓冲液pH值交互作用对酶活测定影响均显著;图5D、5F中等高线图形趋于圆形,反应温度和底物浓度、底物浓度和缓冲液pH值交互作用不显著。
图5E(a)响应面随着pH值的增大酶活先增大后降低,变化幅度较小;随温度的增大酶活先增大后降低且变化幅度较大。这主要是由于较高或较低的pH值使蛋白质氢键断裂引起酶变性失活;适当提高酶活测定温度可提高酶催化活性,当温度高于酶活反应最佳温度时,测定温度越大酶易变性失活[13]。因此酶活测定时要选择合适的缓冲液pH值及测定温度。
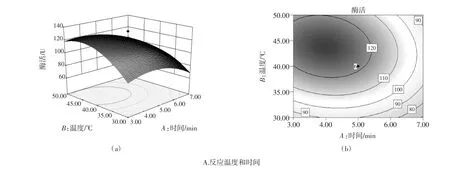
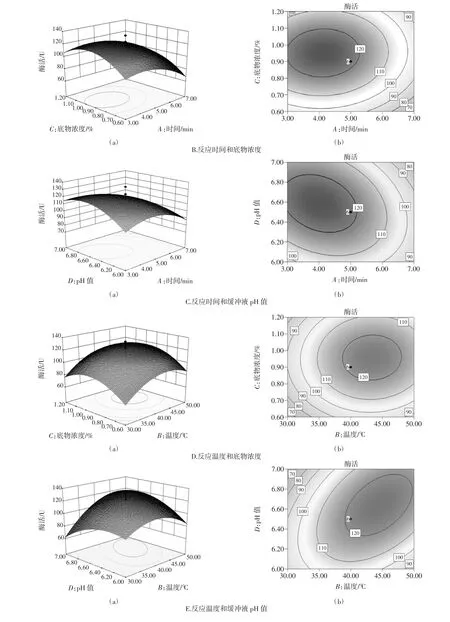
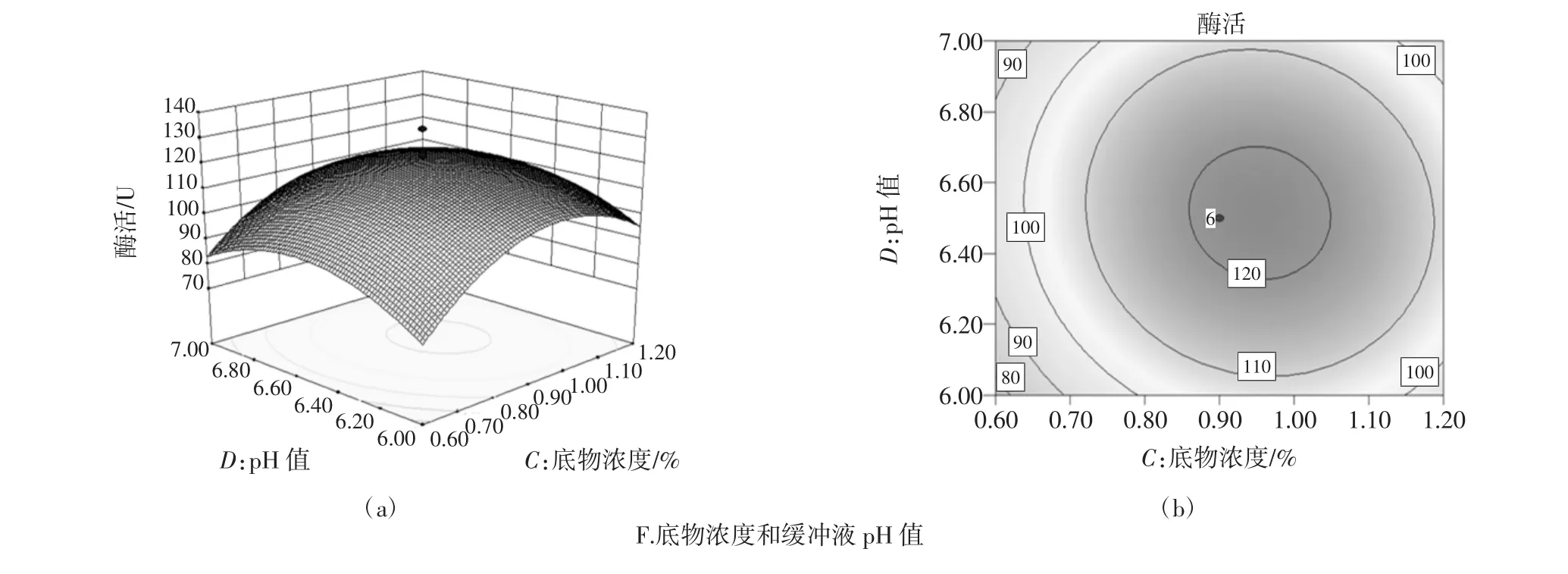
图5 两因素交互作用对生姜蛋白酶活测定的等高线和响应面Fig.5 Response surface and contour plots showing two factors effects on the activity of Ginger protease
由各响应面立体图可看出,响应值存在最大值。通过软件分析计算得出理论最佳提取工艺:反应时间3.6 min,反应温度46.45℃,底物浓度0.95%,缓冲液pH6.78,其预测值为130.46 U。为检验响应面优化结果的可靠性,采用上述条件测定酶活为133.15 U,表明该试验值与预测值吻合良好。
3 结论
采用Design-Expert 8.0.6软件的中心组合设计方法设计响应面试验,建立数学模型。方差分析结果表明反应温度和时间、反应温度和底物浓度、反应温度和缓冲液pH值、反应时间和底物浓度的交互作用对酶活测定影响均显著,反应时间和缓冲液pH、底物浓度和缓冲液pH交互作用不显著。通过软件分析得出生姜蛋白酶活性测定最佳条件:反应时间3.6 min,反应温度46.44℃,底物浓度0.95%,缓冲液pH6.78,此条件下生姜蛋白酶活130.46 U,验证试验测得生姜蛋白酶活性为133.15 U,与预测值吻合。
[1]王镜岩.生物化学[M].北京:高等教育出版社,2002:320-344
[2]FAN Li,YANG Liyuan,LV Xue,et al.Purification and characterization of a novel extracellular alkaline protease from Cellulomonas bogoriensis[J].Protein Expression and Purification,2016,121:125-132
[3]Martijn Verdoes,Steven H L Verhelst.Detection of protease activity in cells and animals[J].Biochimica et Biophysica Acta(BBA)-Proteins and Proteomic,2016,1864(1):130-142
[4]马俊阳,诸葛斌,方慧英,等.米曲霉蛋白酶的分离纯化及酶学性质研究[J].微生物学通报,2014,41(1):83-89
[5]王伟涛,张海德,蒋志国,等.离子液体双水相提取木瓜蛋白酶及条件优化[J].现代食品科技,2014,30(9):210-216
[6]Letícia Celia de Lencastre Novaes,Angela Faustino Jozala,André Moreni Lopes,Valéria de Carvalho Santos-Ebinuma,et al.Stability,purification,and applications of bromelain:A review[J].Biotechnology Progress,2016,32(1):5-13
[7]Rubab Mahmood.Purification of anti-bromelain antibodies by affinity precipitation using pNIPAm-linked bromelain[J].Preparative Biochemistry and Biotechnology;2016,46(2):161-164
[8]唐梅,劳斌基,林远敢,等.响应面法优化超滤提取菠萝蛋白酶工艺条件[J].食品研究与开发,2016,37(7):56-61
[9]Sarah Haesaerts,John Alexander Rodriguez Buitrago,Remy Loris,et al.Crystallization and preliminary X-ray analysis of four cysteine proteasesfromFicuscaricalatex[J].ActaCrystallographicaSectionF,2015,71(4):459-465
[10]刘艳,段振华,罗伟,等.无花果蛋白酶酶解牡蛎肉的工艺优化及其抗氧化活性研究[J].食品工业科技,2015,36(18):182-185,192
[11]杨裕方,沈冬君,隆异娟,等.无花果蛋白酶的类过氧化物酶活性及分析应用研究[A]//中国化学会.中国化学会第30届学术年会摘要集-第四分会:生物分析和生物传感[C].中国化学会,2016,1
[12]Porlin Rungsaeng,Polkit Sangvanich,Aphichart Karnchanatat.Zingipain,a Ginger Protease with Acetylcholinesterase Inhibitory Activity[J].Applied Biochemistry and Biotechnology,2013,170(4):934-950
[13]宋琦,许赣荣.生姜蛋白酶酶活测定方法的研究[J].食品科技,2010,35(1):277-281
[14]黄春喜,廖春芳,黄宜辉,等.准确快速测定木瓜蛋白酶活性的方法研究[J].轻工科技,2012(12):5-6
[15]周慧,鲁治斌,齐杰,等.蛋白水解酶活力测定新方法[J].生物化学杂志,1994(5):630-632
[16]于洁,肖超妮,王世祥,等.测定生姜蛋白酶活性的新方法[J].热带作物学报,2011(8):1475-1478
[17]Faria Neto,Antonio,Fernando Branco Costa,et al.Optimization of Pultrusion Process Parameters via Design of Experiments and Response Surface[J].Quality and Reliability Engineering International,2016,32(3):1265-1274
[18]M R Hadjmohammadi,Z Mousavi Kiasari,S S S J Nazari.Separation of some phenolic acids in micellar liquid chromatography using design of experiment-response surface methodology[J].Journal of Analytical Chemistry;2016,71(6):610-616
[19]Rasoul Khayyam Nekouei,Reza Akhaghi,Arsalan Ravanbakhsh,et al.A Study of the Effect of Two-Stage Tempering on Mechanical Properties of Steel 30CrMnSi Using Analysis on Response Surface in Design of Experiment[J].Metal Science and Heat Treatment,2016,57(11/12):6 94-701
[20]Shixiang Xia,Rui Lin,Xin Cui,et al.The application of orthogonal test method in the parameters optimization of PEMFC under steady working condition[J].International Journal of Hydrogen Energy,2016,41(26):11380-11390
[21]Jie Gao,Jun Yin,Feifei Zhu,et al.Orthogonal test design to optimize the operating parameters of CO2desorption from a hybrid solvent MEA-Methanol in a packing stripper[J].Journal of the Taiwan Institute of Chemical Engineers,2016,64:196-202
[22]Mohammed Adam Yahya Abdualrahman,Haile Ma,Abu ElGasim Ahmed Yagoub,et al.Optimization of Ultrasound Pretreatments and Hydrolysis Conditions for Production of Angiotensin-I Converting Enzyme(ACE)Inhibitory Peptides from Sodium Caseinate Protein Using Response Surface Methodology[J].American Journal of Food Technology,2016,11(6):240-252
[23]Fernanda Munhoz dos Anjos Leal,Veridiana Gomes Virginio,Carolina Lumertz Martello,et al.Mycoplasma hyopneumoniae and Mycoplasma flocculare differential domains from orthologous surface proteins induce distinct cellular immune responses in mice[J].Veterinary Microbiology,2016,190:50-57
[24]高晓东.多种生姜有效成分的联合提取及生姜蛋白酶的膜分离技术[D].泰安:山东农业大学,2013
[25]张林祥,杜广华,葛秀元,等.检验食品中蛋白质含量标准测定方法的改进[J].宝鸡文理学院学报(自然科学版),2016(1):36-39
[26]Amedeo Pietri,Paola Fortunati,Annalisa Mulazzi,et al.Terenzio Bertuzzi.Enzyme-assisted extraction for the HPLC determination of aflatoxin M1 in cheese[J].Food Chemistry,2016,192:235-241
